Похожие презентации:
Кислоты в свете ТЭД
1.
2.
Цели урока:Дать определение кислотам.
Рассмотреть состав кислот.
Классифицировать кислоты.
Ознакомиться с формулами и
названиями основных неорганических
кислот.
Рассмотреть свойства кислот в свете
теории электролитической
диссоциации.
3.
Кислоты - этосложные вещества, состоящие из
атомов водорода и кислотного остатка
Кислоты - это
сложные вещества, образующие при
диссоциации катионы водорода и
анионы кислотного остатка
4.
5. Дать название кислотам:
HCIH2SO4
H3PO4
HNO3
H2S
НNO2
H2SO3
H2CO3
Н2SiO3
6. «Третий лишний»
Удалите «лишнего» в каждом ряду:• HCl, HNO2, HBr
• H2CO3, HNO3, H2SO3
H2SO4, H2SO3, H2CO3
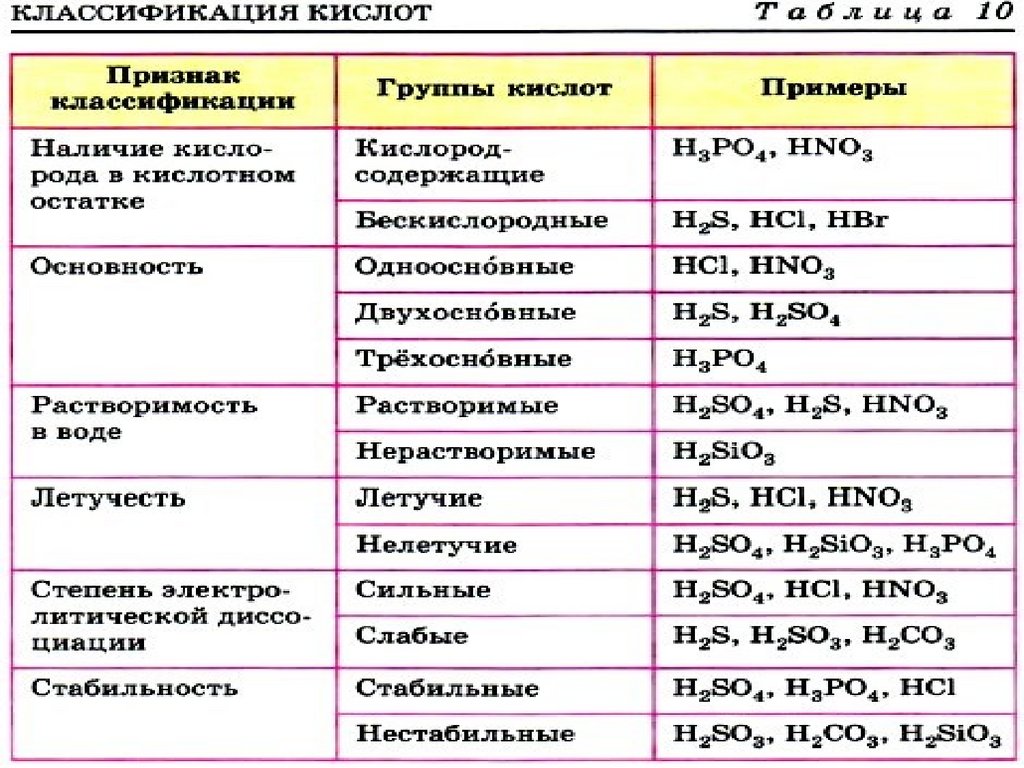
7. По какому признаку кислоты разделены на группы?
??
HF
HCl
HBr
HI
HNO3
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
?
H3PO4
H3BO3
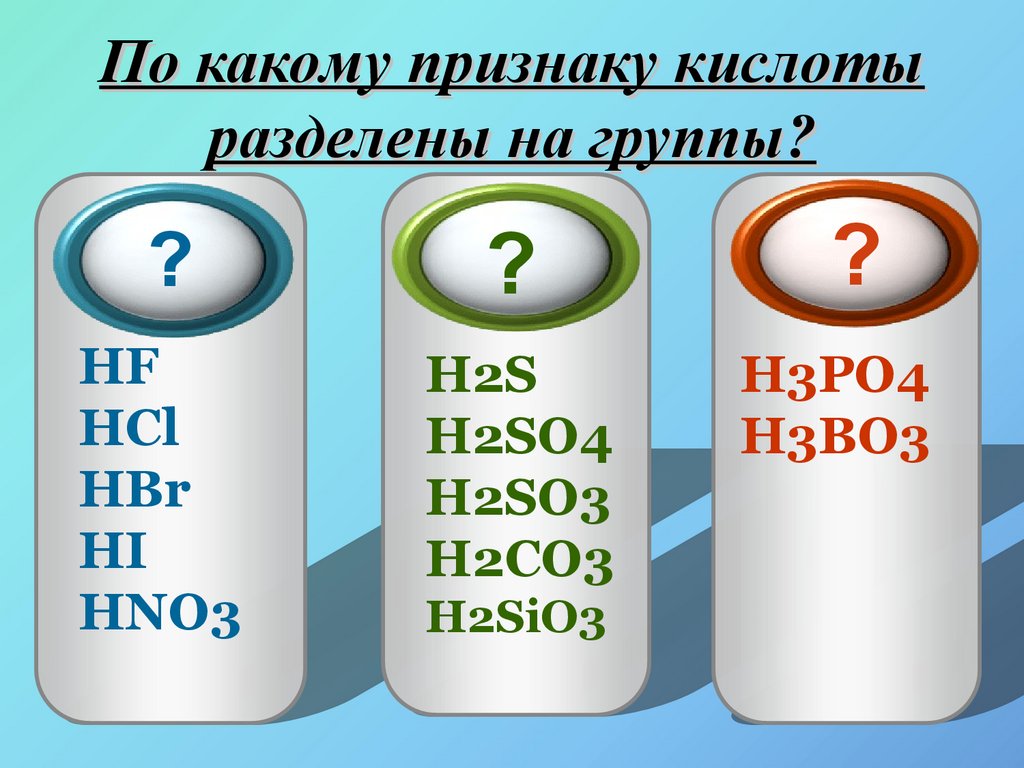
8. По какому признаку кислоты разделены на группы?
Одно-Двух-
Трех-
основные
основные
основные
HF
HCl
HBr
HI
HNO3
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
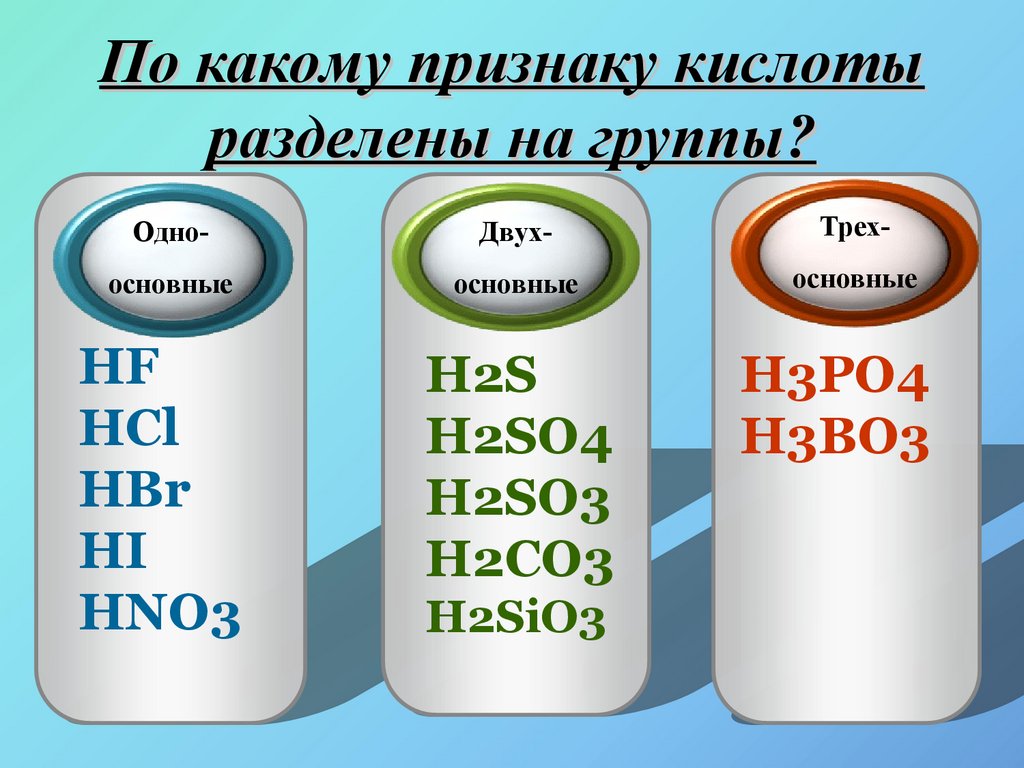
9. По какому признаку кислоты разделены на группы?
HClHNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
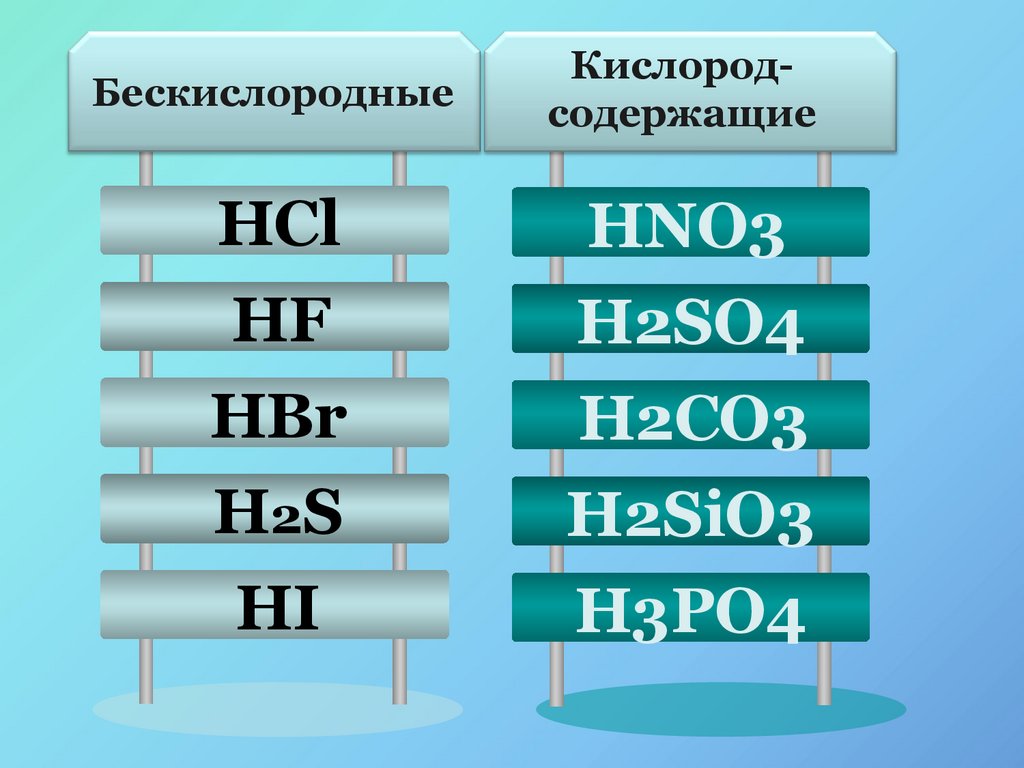
10.
БескислородныеКислородсодержащие
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
11. Определите оксиды, соответствующие кислотам. Дайте им названия.
• Н2SО4 →SO3
• Н2SО3 →
SO2 - оксид серы (IV)
• НNО3
→
N2O5 - оксид азота (V)
• НNО2
→
N2O3 - оксид азота (III)
- оксид серы (VI)
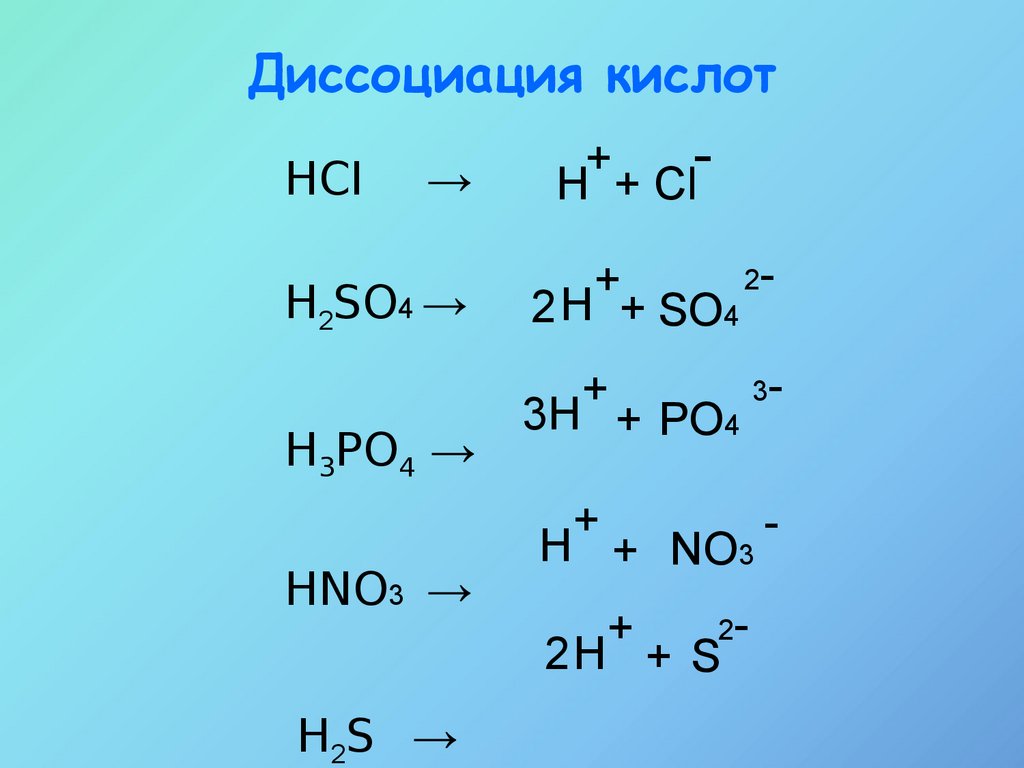
12.
Диссоциация кислотHCI
→
H2SO4 →
+
H + Cl
2+
2 H + SO4
+
H3PO4 →
3H + PO4
+
HNO3 →
H + NO3
+
2-
2H + S
H2S →
3-
-
13.
Химические свойства кислот1. Кислота + металл = соль +
водород
Ag + HCl = реакция не идет
Zn + H2SO4 = ZnSO4 + H2
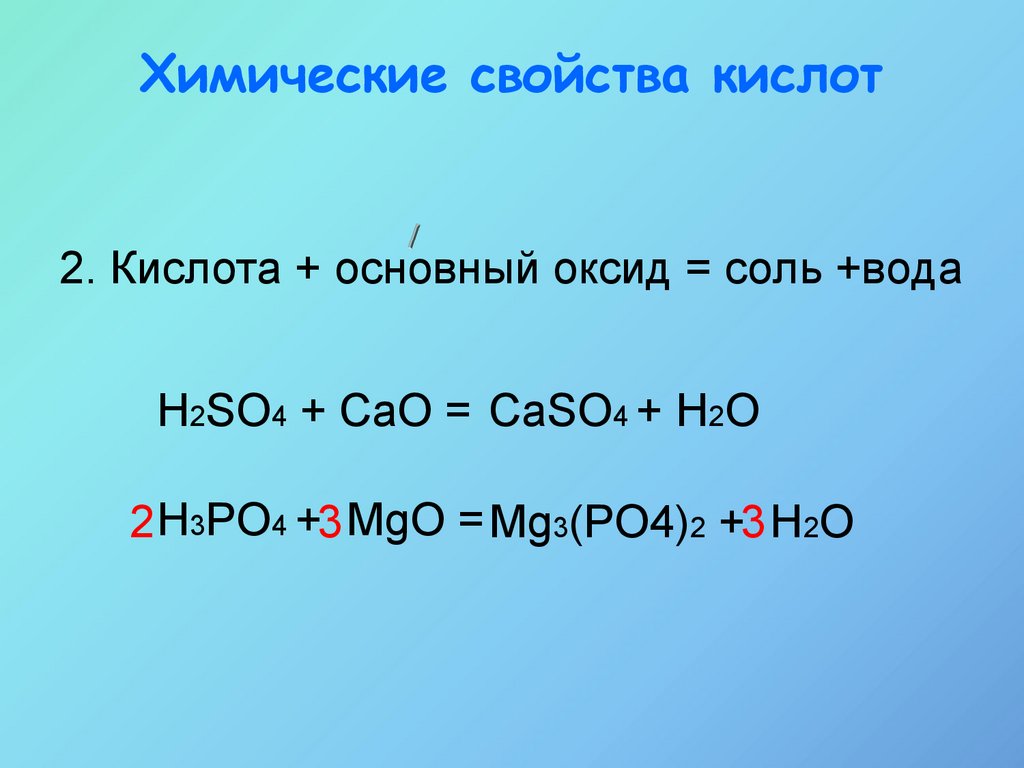
14.
Химические свойства кислот2. Кислота + основный оксид = соль +вода
H2SO4 + CaO = CaSO4 + H2O
2 H3PO4 +3 MgO = Mg3(PO4)2 +3 H2O
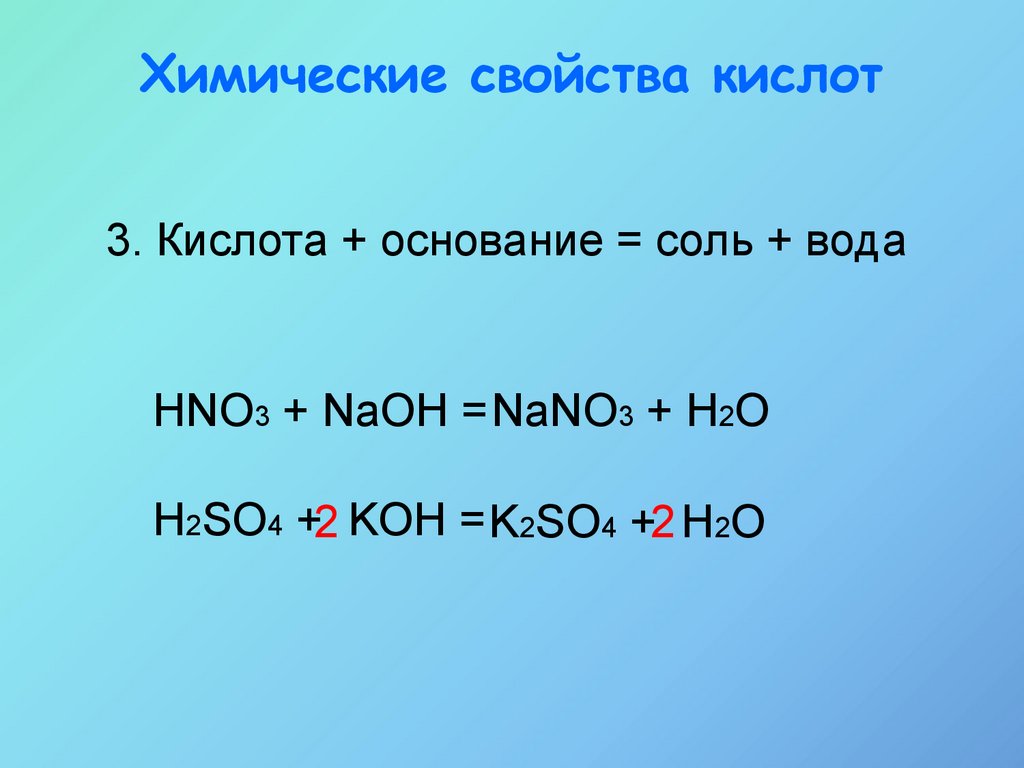
15.
Химические свойства кислот3. Кислота + основание = соль + вода
HNO3 + NaOH = NaNO3 + H2O
H2SO4 +2 KOH = K2SO4 +2 H2O
16.
Химические свойства кислот4. Кислота + соль = другая кислота + другая соль
HCl + AgNO3 = AgCl + HNO3
H2SO4 + NaCl = реакция не идет
17.
Домашнее задание:§39; упр.3, задача 5.









 Химия
Химия








