Похожие презентации:
Acidi carbossilici sono caratterizzati dalla presenza del carbossile
1. Diapositiva 1
Acidi carbossilicisono caratterizzati dalla presenza del carbossile
O
HO
il nome deriva dalla “crasi” tra carbonile e ossidrile
C
R
O
schematicamente anche RCOOH e RCO2H
HC
HC
OH
Sono stati tra i primi composti organici
studiati e la nomenclatura ne risente,
la maggior parte è più nota con i nomi d’uso
che con la nomenclatura IUPAC
C
C
CH
C
CH
2-hydroxybenzoic acid
acido salicilico
OH
2. Diapositiva 2
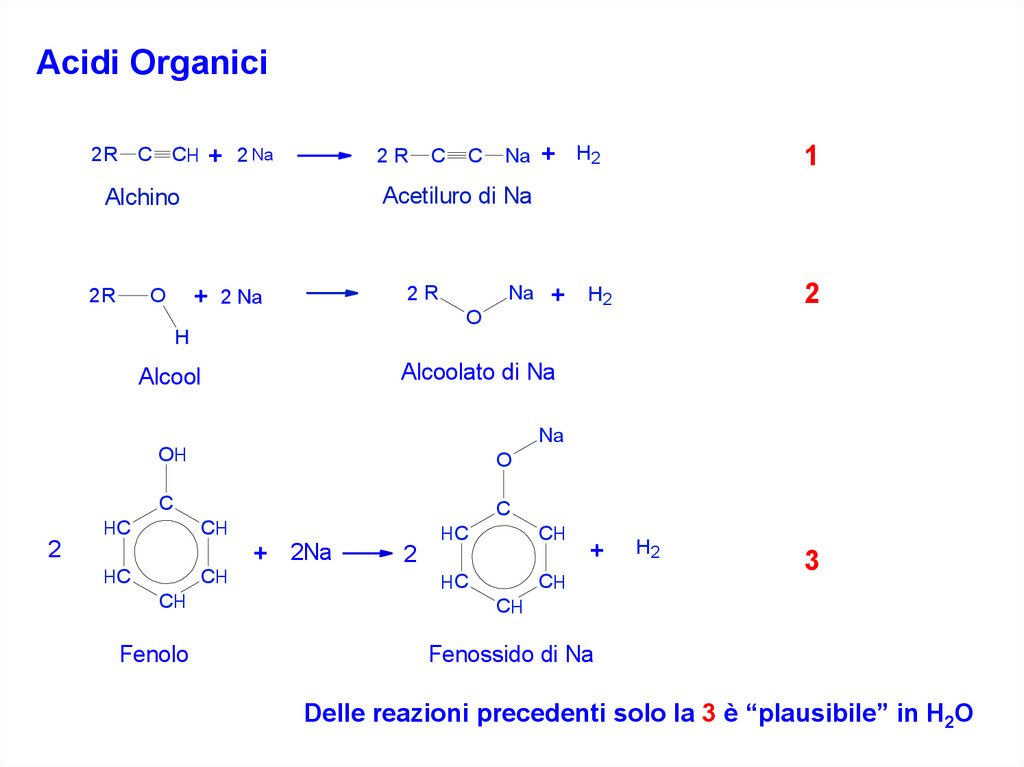
Acidi OrganiciNa + H2
2 R C CH + 2 Na
2R
Alchino
Acetiluro di Na
2R
C
2R
+ 2 Na
O
C
Na
+
1
2
H2
O
H
Alcoolato di Na
Alcool
Na
OH
O
C
HC
C
CH
2
+ 2Na
HC
CH
CH
Fenolo
HC
CH
HC
CH
2
+
H2
3
CH
Fenossido di Na
Delle reazioni precedenti solo la 3 è “plausibile” in H2O
3. Diapositiva 3
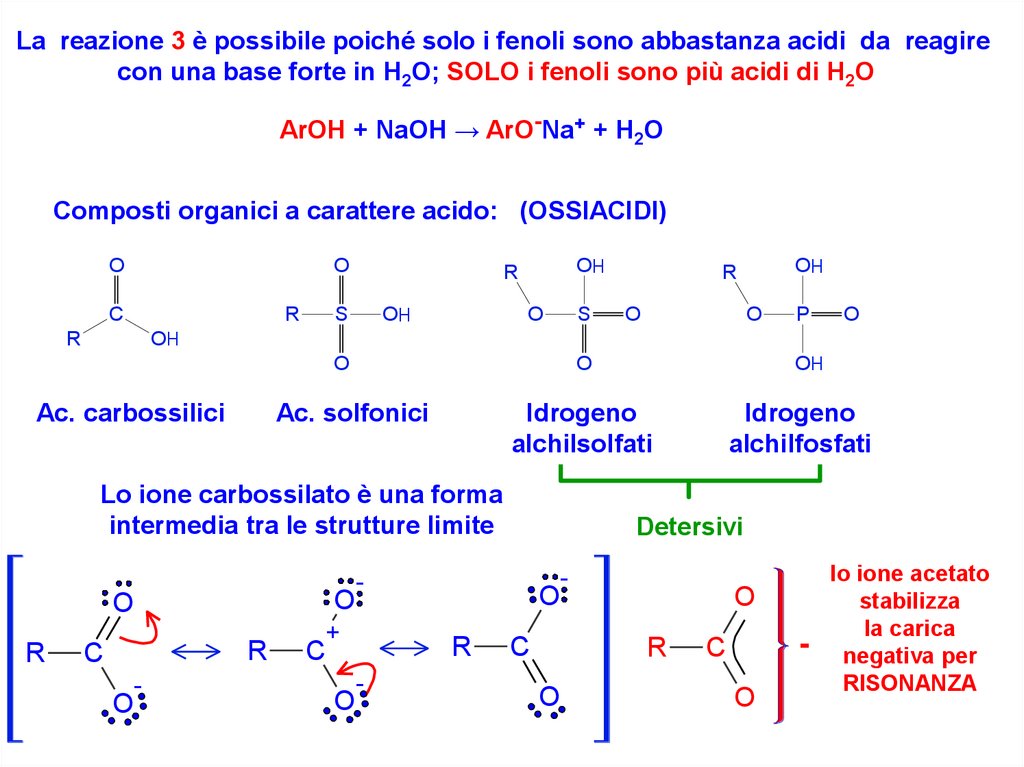
La reazione 3 è possibile poiché solo i fenoli sono abbastanza acidi da reagirecon una base forte in H2O; SOLO i fenoli sono più acidi di H2O
ArOH + NaOH → ArO-Na+ + H2O
Composti organici a carattere acido: (OSSIACIDI)
O
O
C
R
R
OH
R
S
OH
O
S
O
O
P
O
OH
Ac. carbossilici
O
O
OH
Ac. solfonici
Idrogeno
alchilsolfati
Idrogeno
alchilfosfati
Lo ione carbossilato è una forma
intermedia tra le strutture limite
-
O
-
O
O
R
C
Detersivi
-
O
R
OH
R
+
R
C
-
O
C
O
R
O
-
C
O
lo ione acetato
stabilizza
la carica
negativa per
RISONANZA
4. Diapositiva 4
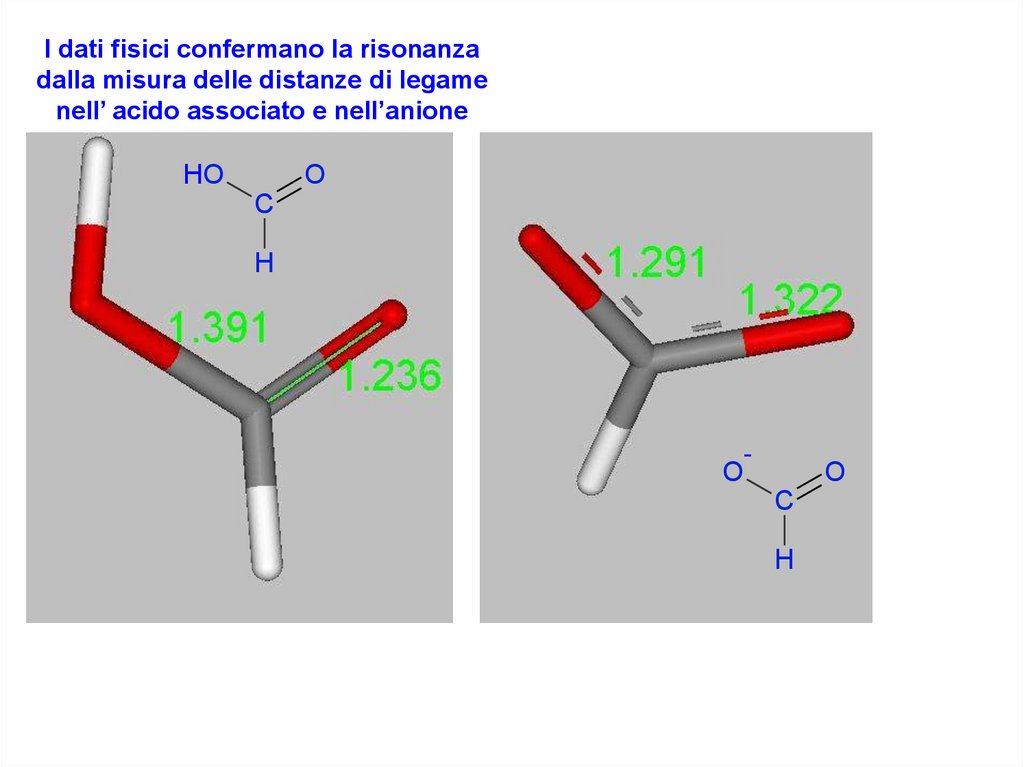
I dati fisici confermano la risonanzadalla misura delle distanze di legame
nell’ acido associato e nell’anione
HO
O
C
H
O
-
O
C
H
5. Diapositiva 5
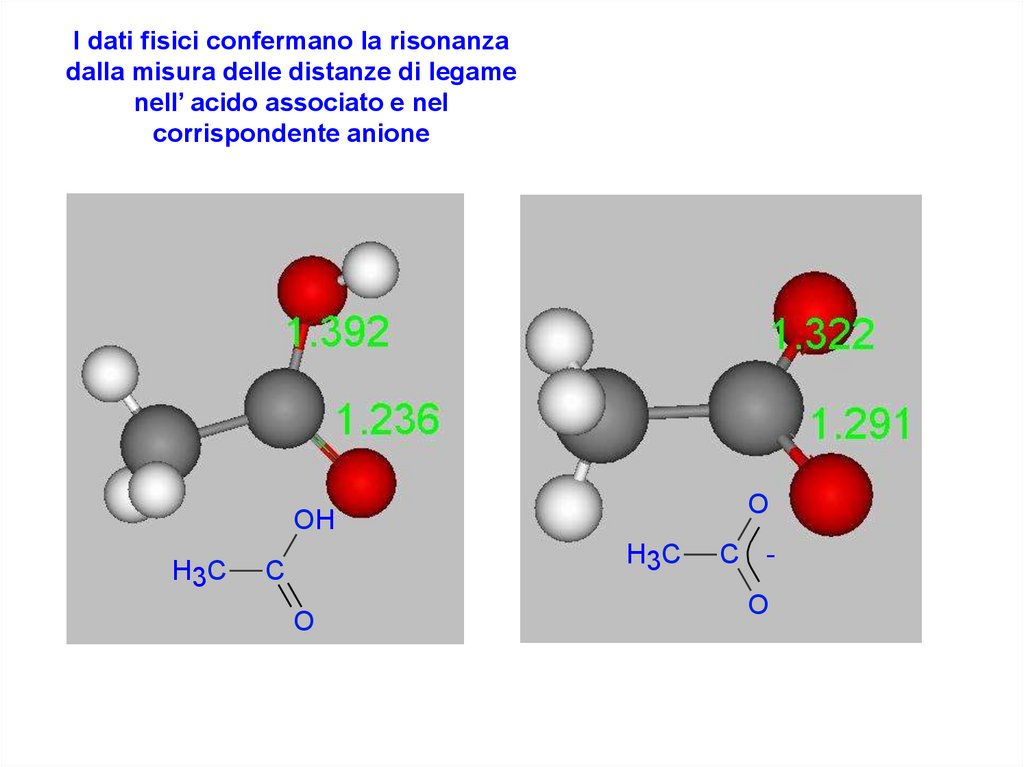
I dati fisici confermano la risonanzadalla misura delle distanze di legame
nell’ acido associato e nel
corrispondente anione
O
OH
H3C
H3C
C
O
C O
6. Diapositiva 6
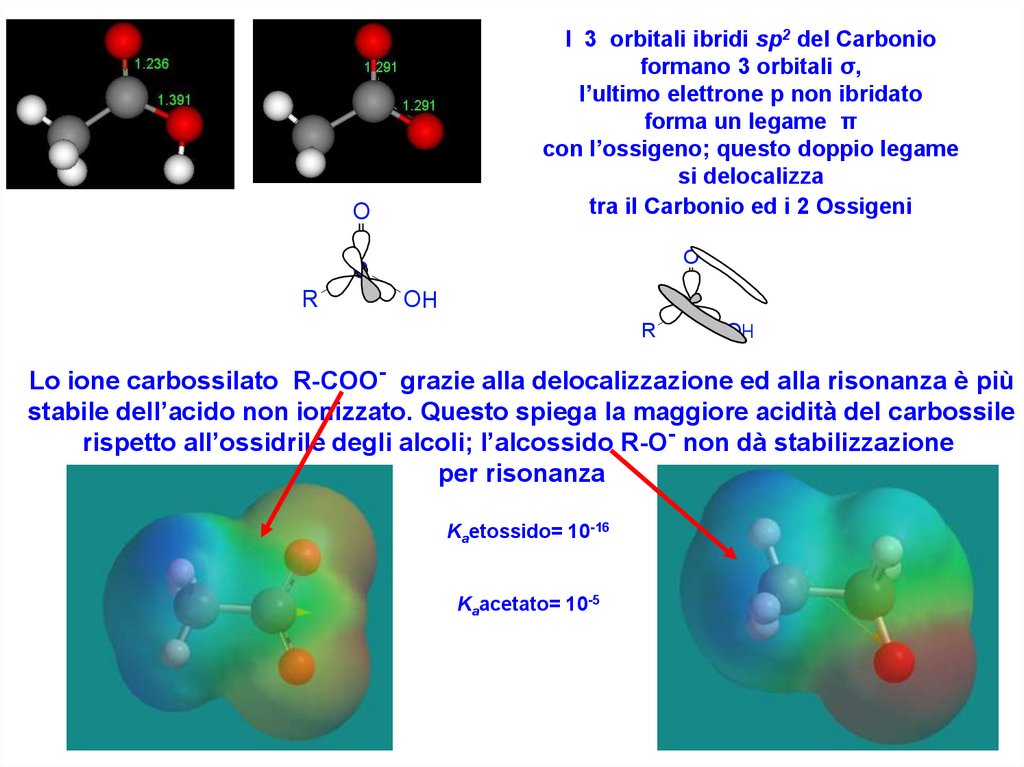
I 3 orbitali ibridi sp2 del Carbonioformano 3 orbitali σ,
l’ultimo elettrone p non ibridato
forma un legame π
con l’ossigeno; questo doppio legame
si delocalizza
tra il Carbonio ed i 2 Ossigeni
O
O
C
R
OH
C
R
OH
Lo ione carbossilato R-COO- grazie alla delocalizzazione ed alla risonanza è più
stabile dell’acido non ionizzato. Questo spiega la maggiore acidità del carbossile
rispetto all’ossidrile degli alcoli; l’alcossido R-O- non dà stabilizzazione
per risonanza
Kaetossido= 10-16
Kaacetato= 10-5
7. Diapositiva 7
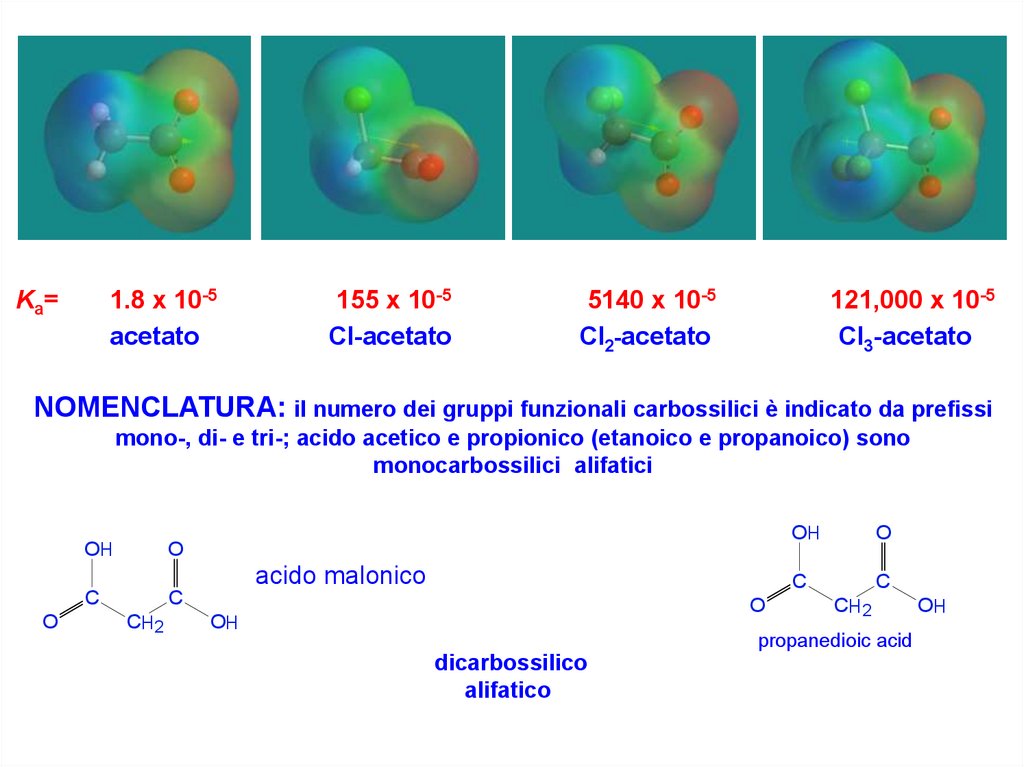
1.8 x 10-5acetato
Ka=
155 x 10-5
Cl-acetato
5140 x 10-5
Cl2-acetato
121,000 x 10-5
Cl3-acetato
NOMENCLATURA: il numero dei gruppi funzionali carbossilici è indicato da prefissi
mono-, di- e tri-; acido acetico e propionico (etanoico e propanoico) sono
monocarbossilici alifatici
OH
O
acido malonico
C
O
C
CH2
O
OH
OH
O
C
C
CH2
propanedioic acid
dicarbossilico
alifatico
OH
8. Diapositiva 8
HOHO
O
C
O
C
Acido p-ftalico
C
HC
C
HC
CH
HC
HC
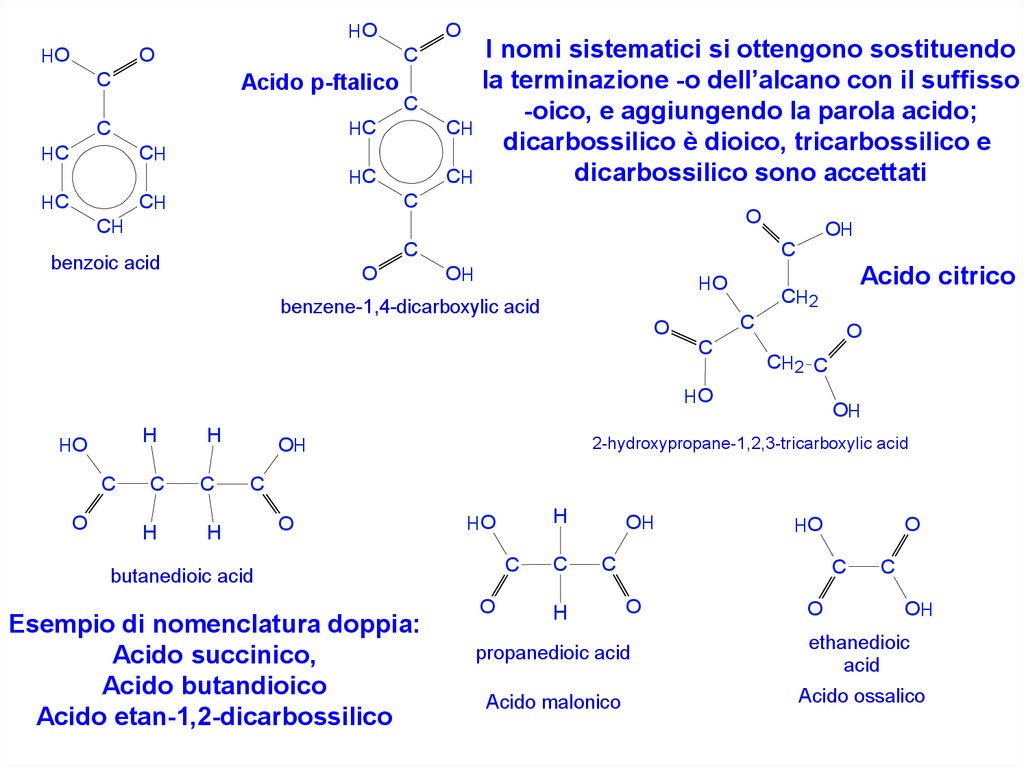
I nomi sistematici si ottengono sostituendo
la terminazione -o dell’alcano con il suffisso
-oico, e aggiungendo la parola acido;
CH
dicarbossilico è dioico, tricarbossilico e
dicarbossilico sono accettati
CH
C
CH
O
CH
C
C
benzoic acid
O
OH
OH
HO
benzene-1,4-dicarboxylic acid
C
O
C
O
CH2 C
HO
HO
C
O
H
H
C
C
H
H
Acido citrico
CH2
OH
2-hydroxypropane-1,2,3-tricarboxylic acid
OH
C
O
C
butanedioic acid
Esempio di nomenclatura doppia:
Acido succinico,
Acido butandioico
Acido etan-1,2-dicarbossilico
H
HO
O
C
OH
HO
C
H
O
C
O
O
C
OH
propanedioic acid
ethanedioic
acid
Acido malonico
Acido ossalico
9. Diapositiva 9
La bollitura dei grassi animali in presenza di NaOH - aggiunta di acidi- forma deiprecipitati di acidi grassi monocarbossilici da 6 a 22 atomi di carbonio
Se i carboni sono legati ad altri atomi di carbonio da LEGAMI SINGOLI si dicono
SATURI; INSATURI sono quelli contenenti uno o più di un DOPPIO legame
carbonio-carbonio
Alcune ossidazioni producono acidi grassi:
1) Idrocarburi insaturi che si spezzano formando 2 catene con acidi carbossilici
2)Alcool → Aldeide → Acido
3) Idrocarburi aromatici con catene laterali
Le proprietà fisiche di quelli a catena breve sono ben note e caratterizzate
da odore pungente o disgustoso (…butirrico e capronico).
Sono ben solubili in ambiente basico e liquidi (fino a C10) o solidi (>C10)
a T ambiente; li caratterizza l’elevato numero di legami H e quindi i punti di
ebollizione sono elevati e hanno buona solubilità
La presenza dell’ossidrile stabilizza il carbonile rispetto a quello dei chetoni;
in pratica il carbonile, –C=O, è meno polare e meno reattivo,
in confronto alle aldeidi ed ai chetoni
10. Diapositiva 10
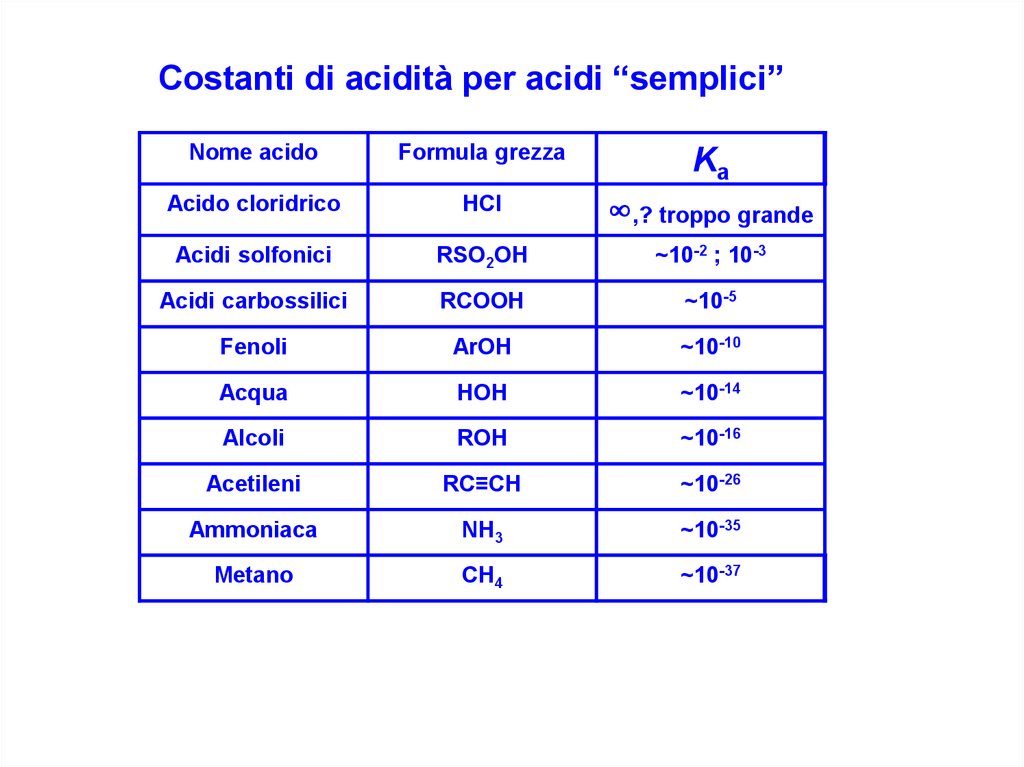
Costanti di acidità per acidi “semplici”Nome acido
Formula grezza
Ka
Acido cloridrico
HCl
∞,? troppo grande
Acidi solfonici
RSO2OH
~10-2 ; 10-3
Acidi carbossilici
RCOOH
~10-5
Fenoli
ArOH
~10-10
Acqua
HOH
~10-14
Alcoli
ROH
~10-16
Acetileni
RC≡CH
~10-26
Ammoniaca
NH3
~10-35
Metano
CH4
~10-37
11. Diapositiva 11
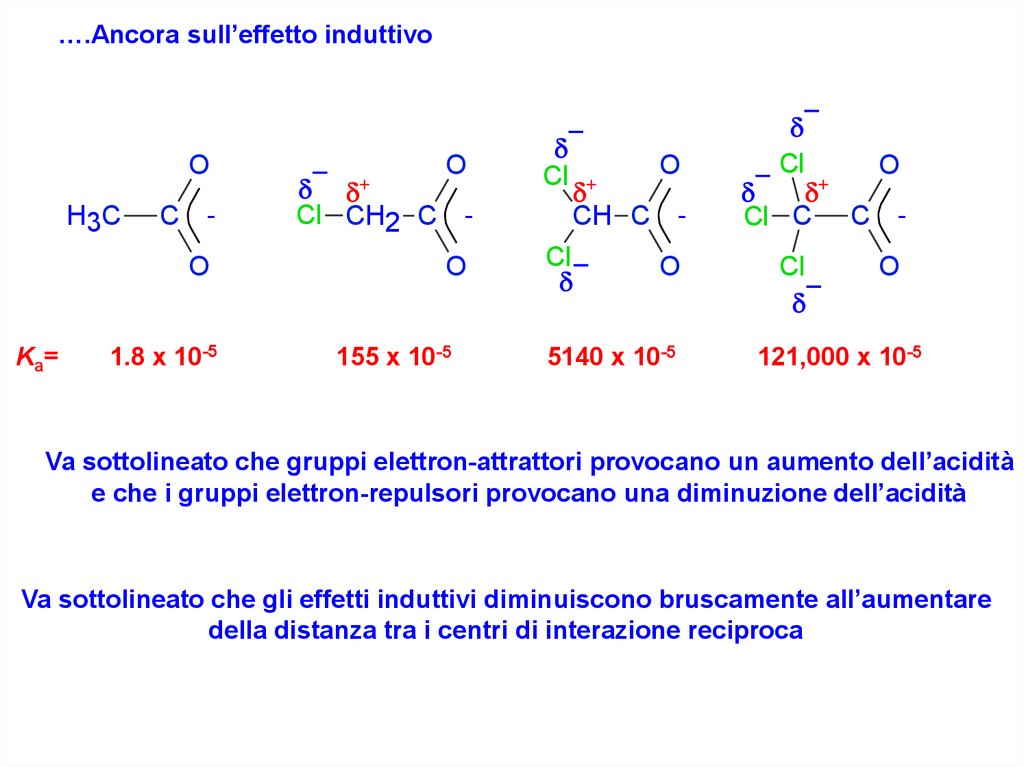
….Ancora sull’effetto induttivoC -
O
Cl CH2 C -
O
O
1.8 x 10-5
155 x 10-5
O
H3C
Ka=
O
Cl
CH C Cl
O
5140 x 10-5
O
Cl
Cl C C -
Cl
O
121,000 x 10-5
Va sottolineato che gruppi elettron-attrattori provocano un aumento dell’acidità
e che i gruppi elettron-repulsori provocano una diminuzione dell’acidità
Va sottolineato che gli effetti induttivi diminuiscono bruscamente all’aumentare
della distanza tra i centri di interazione reciproca
12. Diapositiva 12
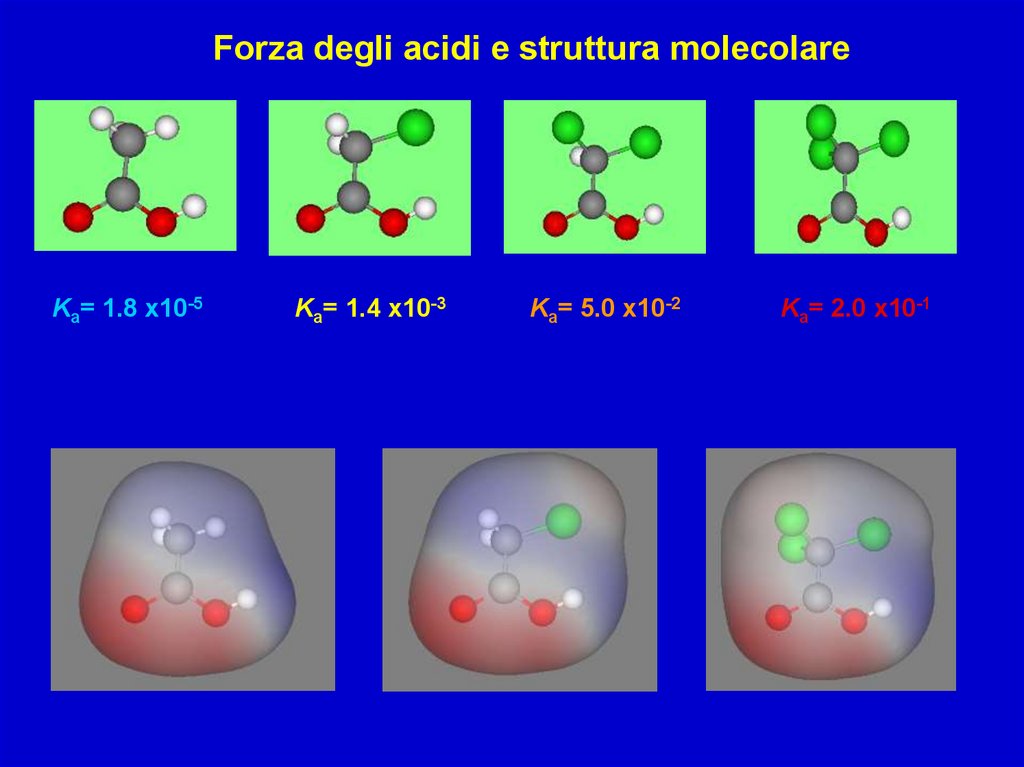
Forza degli acidi e struttura molecolareKa= 1.8 x10-5
Ka= 1.4 x10-3
Ka= 5.0 x10-2
Ka= 2.0 x10-1
13. Diapositiva 13
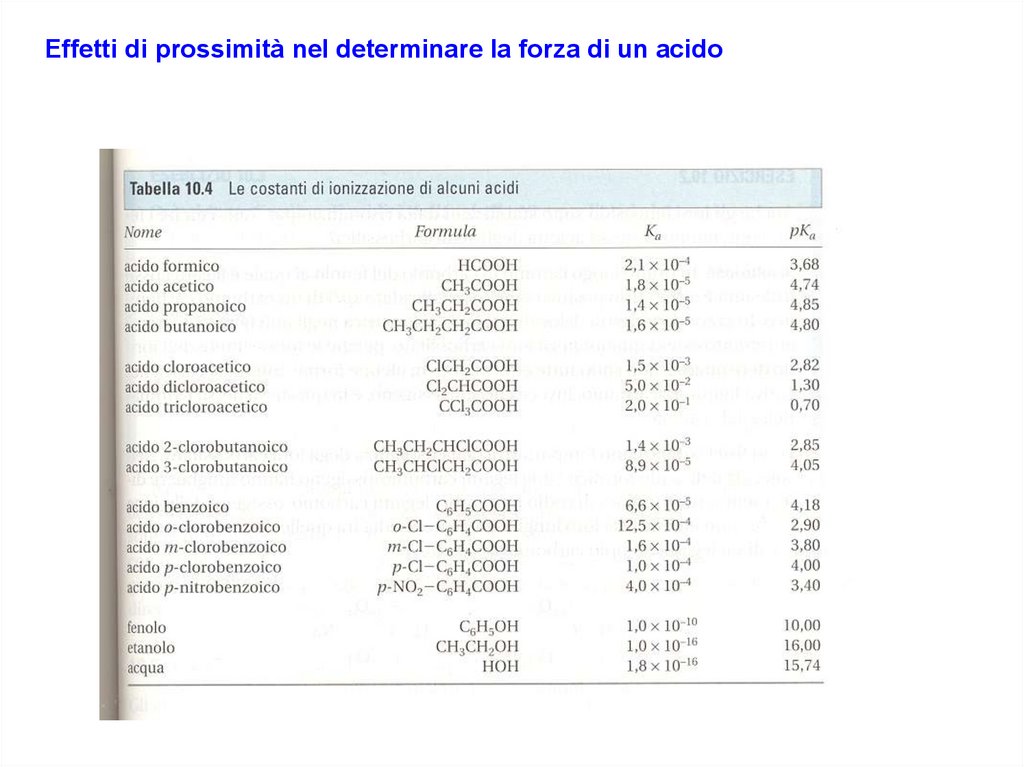
Effetti di prossimità nel determinare la forza di un acido14. Diapositiva 14
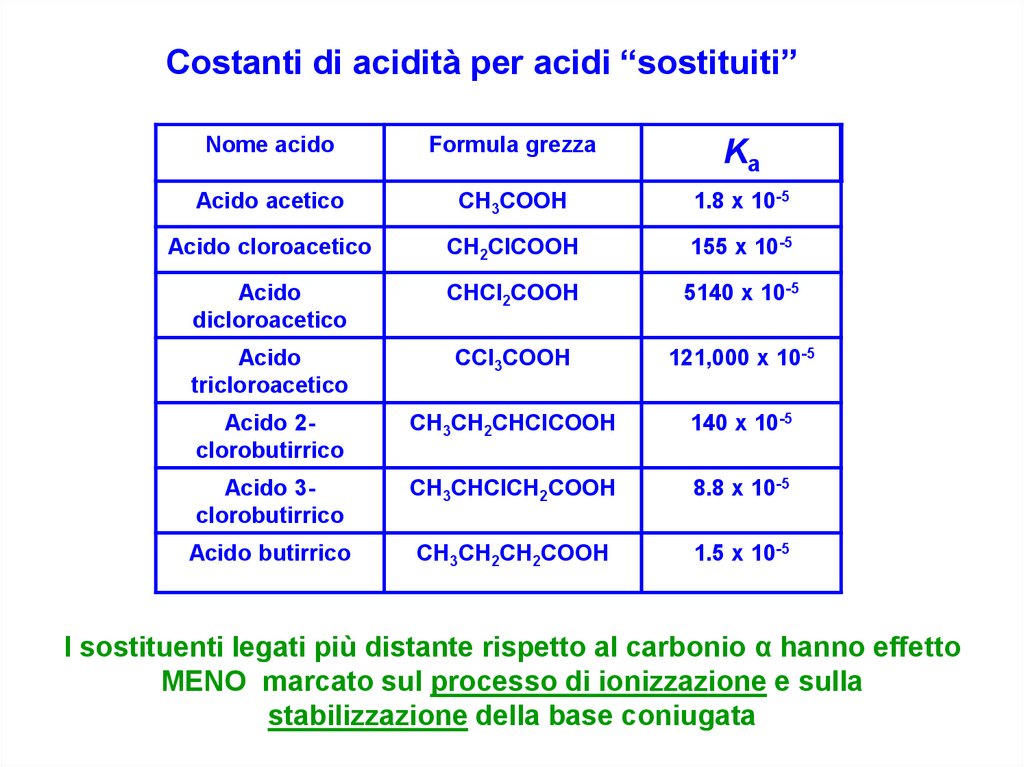
Costanti di acidità per acidi “sostituiti”Nome acido
Formula grezza
Ka
Acido acetico
CH3COOH
1.8 x 10-5
Acido cloroacetico
CH2ClCOOH
155 x 10-5
Acido
dicloroacetico
CHCl2COOH
5140 x 10-5
Acido
tricloroacetico
CCl3COOH
121,000 x 10-5
Acido 2clorobutirrico
CH3CH2CHClCOOH
140 x 10-5
Acido 3clorobutirrico
CH3CHClCH2COOH
8.8 x 10-5
Acido butirrico
CH3CH2CH2COOH
1.5 x 10-5
I sostituenti legati più distante rispetto al carbonio α hanno effetto
MENO marcato sul processo di ionizzazione e sulla
stabilizzazione della base coniugata
15. Diapositiva 15
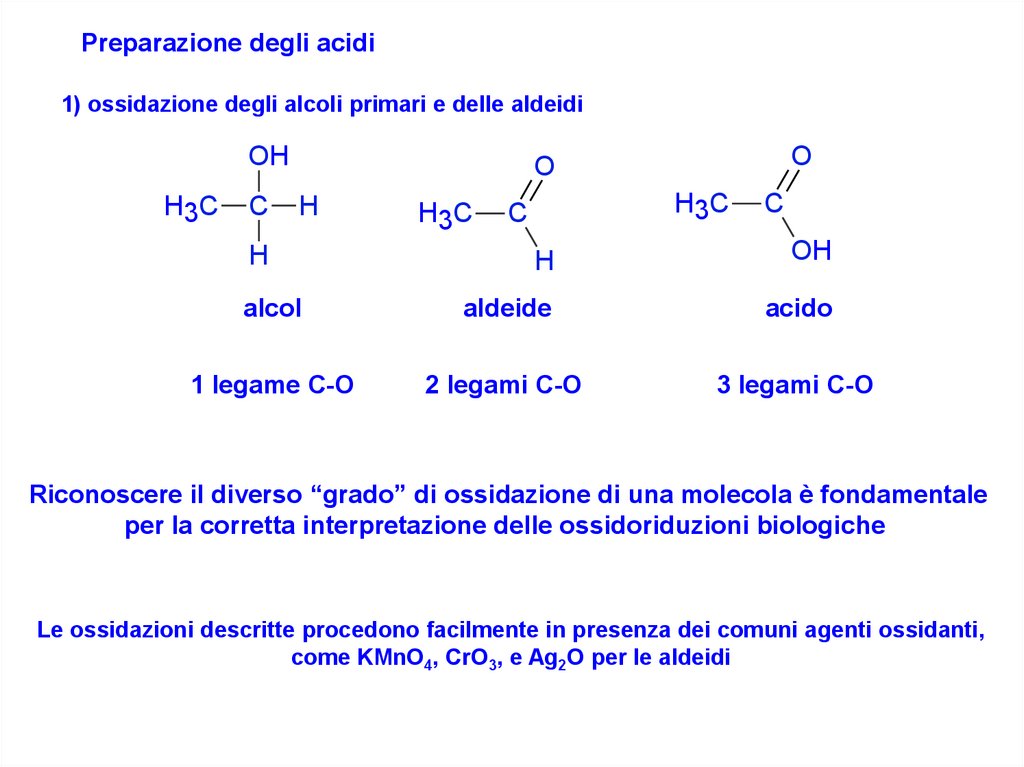
Preparazione degli acidi1) ossidazione degli alcoli primari e delle aldeidi
OH
H3C
C
O
O
H
H3C
H3C
C
C
H
OH
alcol
aldeide
acido
1 legame C-O
2 legami C-O
3 legami C-O
H
Riconoscere il diverso “grado” di ossidazione di una molecola è fondamentale
per la corretta interpretazione delle ossidoriduzioni biologiche
Le ossidazioni descritte procedono facilmente in presenza dei comuni agenti ossidanti,
come KMnO4, CrO3, e Ag2O per le aldeidi
16. Diapositiva 16
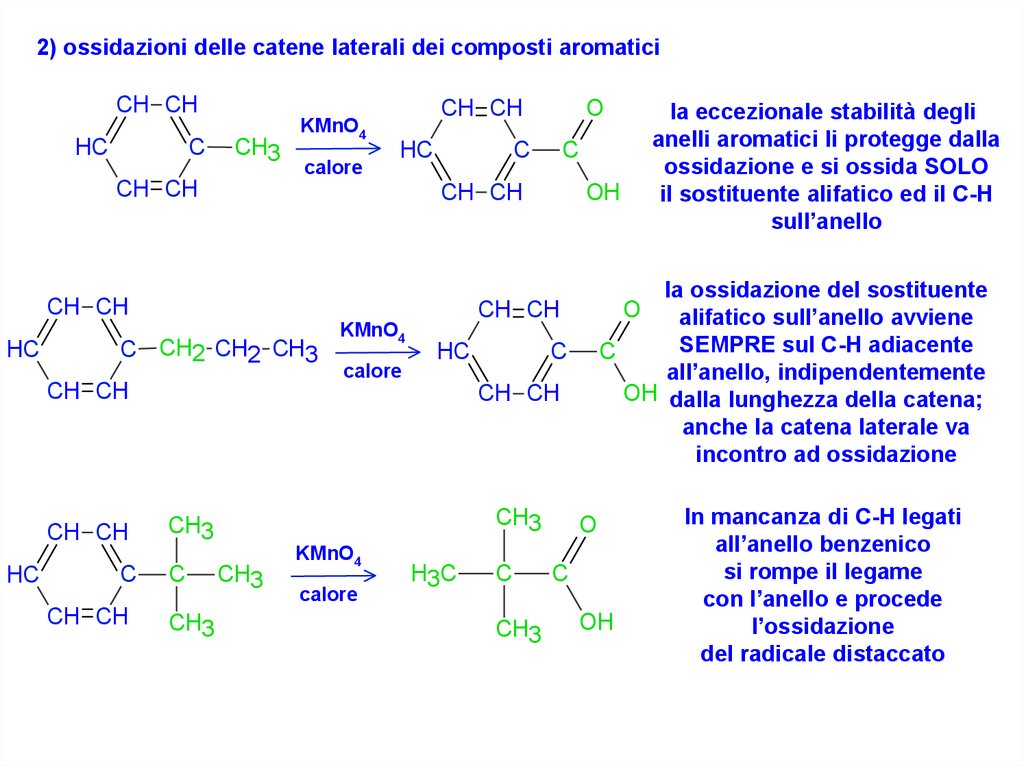
2) ossidazioni delle catene laterali dei composti aromaticiCH CH
HC
C
CH3
KMnO4
calore
CH CH
HC
CH CH
C
HC
KMnO4
calore
HC
CH CH
HC
C
CH CH
OH
la ossidazione del sostituente
alifatico sull’anello avviene
SEMPRE sul C-H adiacente
C
all’anello, indipendentemente
OH dalla lunghezza della catena;
anche la catena laterale va
incontro ad ossidazione
CH CH
C CH2 CH2 CH3
CH CH
C
CH CH
CH CH
O
C
CH CH
CH3
CH3
C
CH3
CH3
KMnO4
calore
H3C
C
CH3
la eccezionale stabilità degli
anelli aromatici li protegge dalla
ossidazione e si ossida SOLO
il sostituente alifatico ed il C-H
sull’anello
O
O
C
OH
In mancanza di C-H legati
all’anello benzenico
si rompe il legame
con l’anello e procede
l’ossidazione
del radicale distaccato
17. Diapositiva 17
3) reazione dei reattivi di Grignard con anidride carbonicaO
O
R-MgX + O C O
R C OMgH
X
HX
R C
+ MgX2
OH
I reattivi di Grignard si addizionano ai carbonili delle aldeidi e dei chetoni per dare alcoli
analogamente si addizionano alla CO2 per dare dopo protonazione dell’intermedio
carbossilato un acido carbossilico; la catena si allunga di un atomo di C rispetto a R
4) Idrolisi dei cianuri (nitrili)
Il triplo legame tra -C ≡ N dei cianuri organici può idrolizzarsi a –COOH in presenza di H+
o di OH-
O
R C
N + 2H2O
cianuro, nitrile
HCl
R C + NH4+ + Cl
OH
in ambiente acido
18. Diapositiva 18
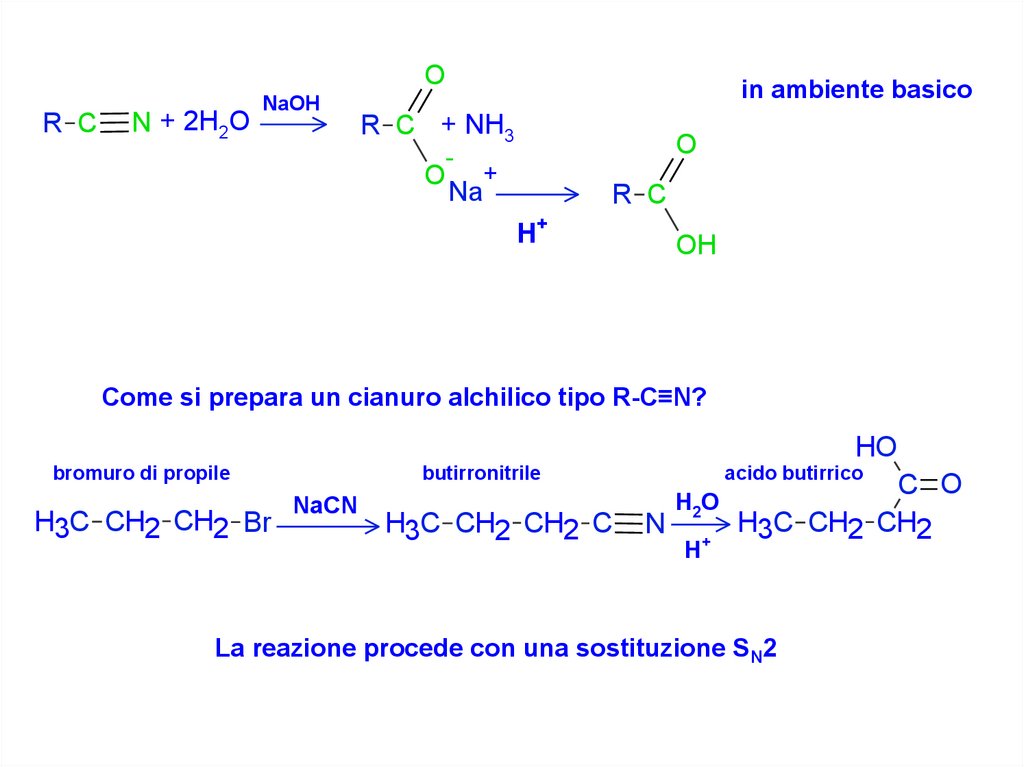
OR C
N + 2H2O
NaOH
in ambiente basico
R C + NH3
-
O
O
+
Na
R C
H+
OH
Come si prepara un cianuro alchilico tipo R-C≡N?
HO
bromuro di propile
H3C CH2 CH2 Br
butirronitrile
NaCN
H3C CH2 CH2 C
acido butirrico
N
H2O
H+
C O
H3C CH2 CH2
La reazione procede con una sostituzione SN2
19. Diapositiva 19
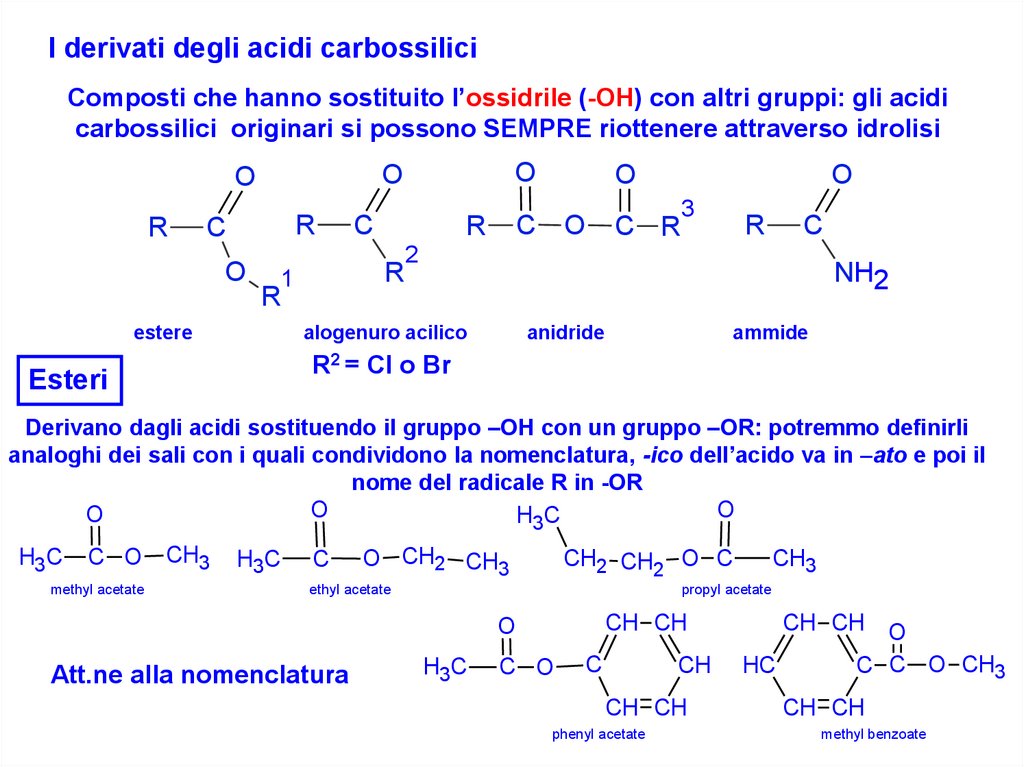
I derivati degli acidi carbossiliciComposti che hanno sostituito l’ossidrile (-OH) con altri gruppi: gli acidi
carbossilici originari si possono SEMPRE riottenere attraverso idrolisi
R
R
C
O
O
O
O
R
estere
C
1
C
R
R
O
O
O
3
C R
R
C
2
NH2
alogenuro acilico
ammide
anidride
R2 = Cl o Br
Esteri
Derivano dagli acidi sostituendo il gruppo –OH con un gruppo –OR: potremmo definirli
analoghi dei sali con i quali condividono la nomenclatura, -ico dell’acido va in –ato e poi il
nome del radicale R in -OR
O
O
O
H3C
H3C
C O
methyl acetate
CH3
H3C
C
O CH2 CH3
CH2 CH2 O C
ethyl acetate
propyl acetate
CH CH
O
Att.ne alla nomenclatura
CH3
H3C
C O
C
CH
CH CH
phenyl acetate
CH CH
HC
O
C C O CH3
CH CH
methyl benzoate
20. Diapositiva 20
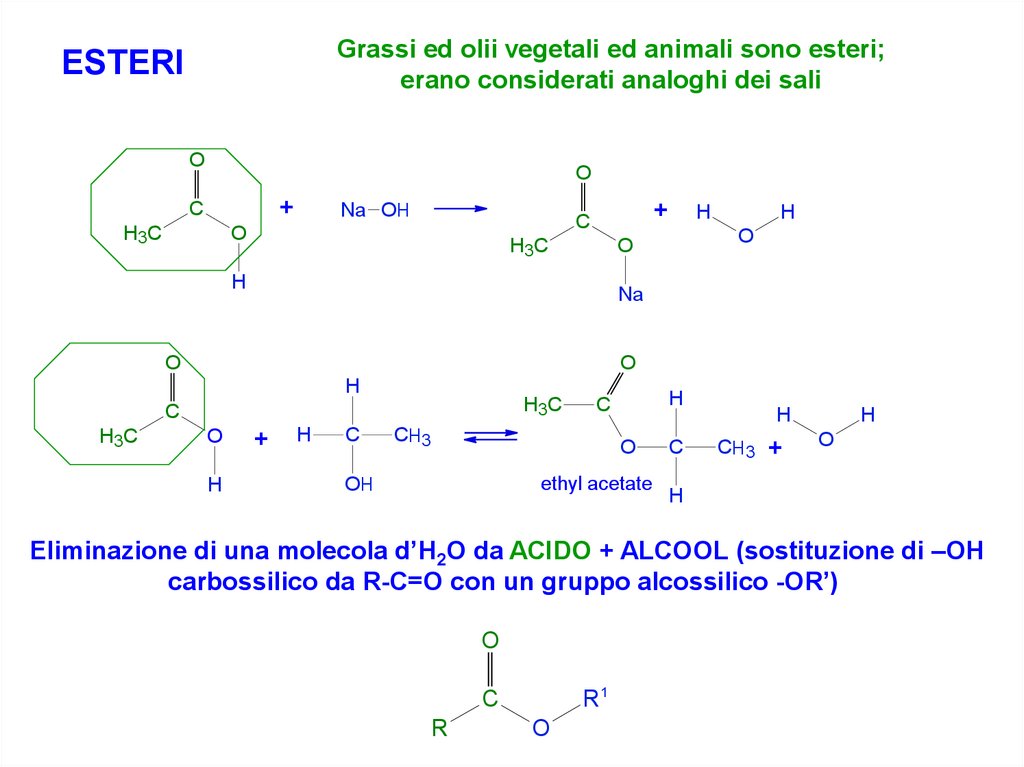
Grassi ed olii vegetali ed animali sono esteri;erano considerati analoghi dei sali
ESTERI
O
O
+
C
H3C
Na OH
+
C
O
H3C
H
O
O
H
Na
O
O
H
H3C
C
H3C
H
O
H
+
H
C
H
C
CH3
O
ethyl acetate
OH
C
H
CH3 +
H
O
H
Eliminazione di una molecola d’H2O da ACIDO + ALCOOL (sostituzione di –OH
carbossilico da R-C=O con un gruppo alcossilico -OR’)
O
R1
C
R
O
21. Diapositiva 21
OO
C
H3C
C
CH3
H3C
O
CH2
O
CH3
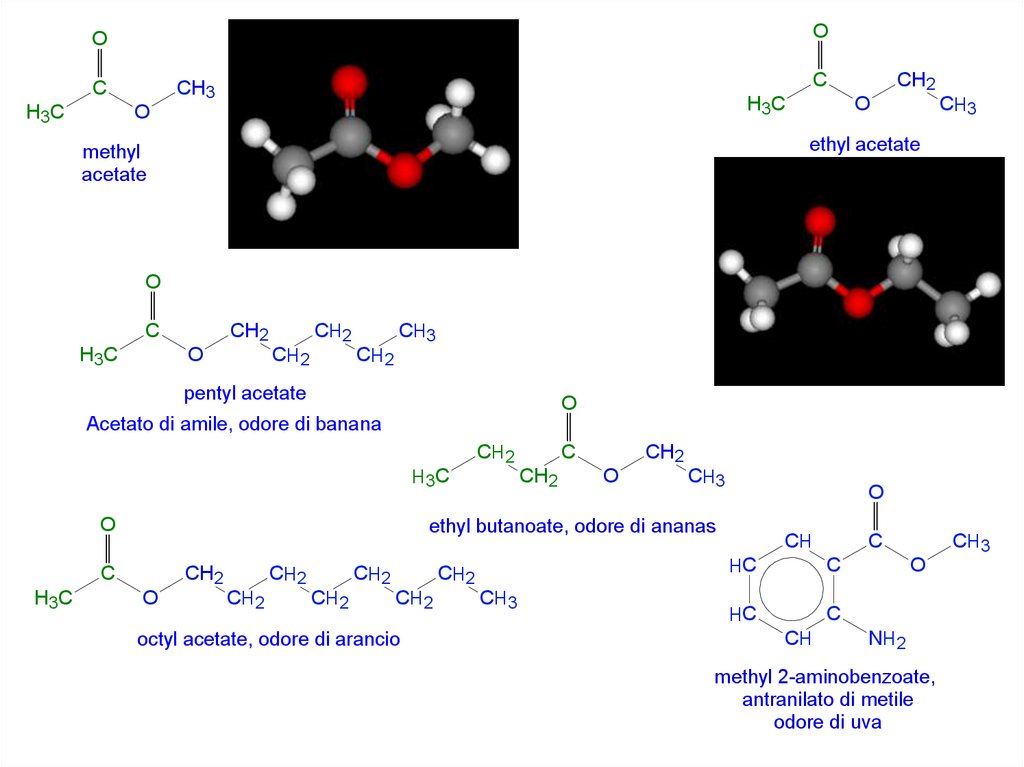
ethyl acetate
methyl
acetate
O
C
H3C
CH2
O
CH2
CH2
CH3
CH2
pentyl acetate
O
Acetato di amile, odore di banana
CH2
H3C
O
CH2
CH2
O
CH3
O
ethyl butanoate, odore di ananas
C
H3C
C
CH2
O
CH2
CH2
CH2
CH2
CH2
CH2
octyl acetate, odore di arancio
CH3
CH
C
HC
C
HC
C
CH
CH3
O
NH2
methyl 2-aminobenzoate,
antranilato di metile
odore di uva
22. Diapositiva 22
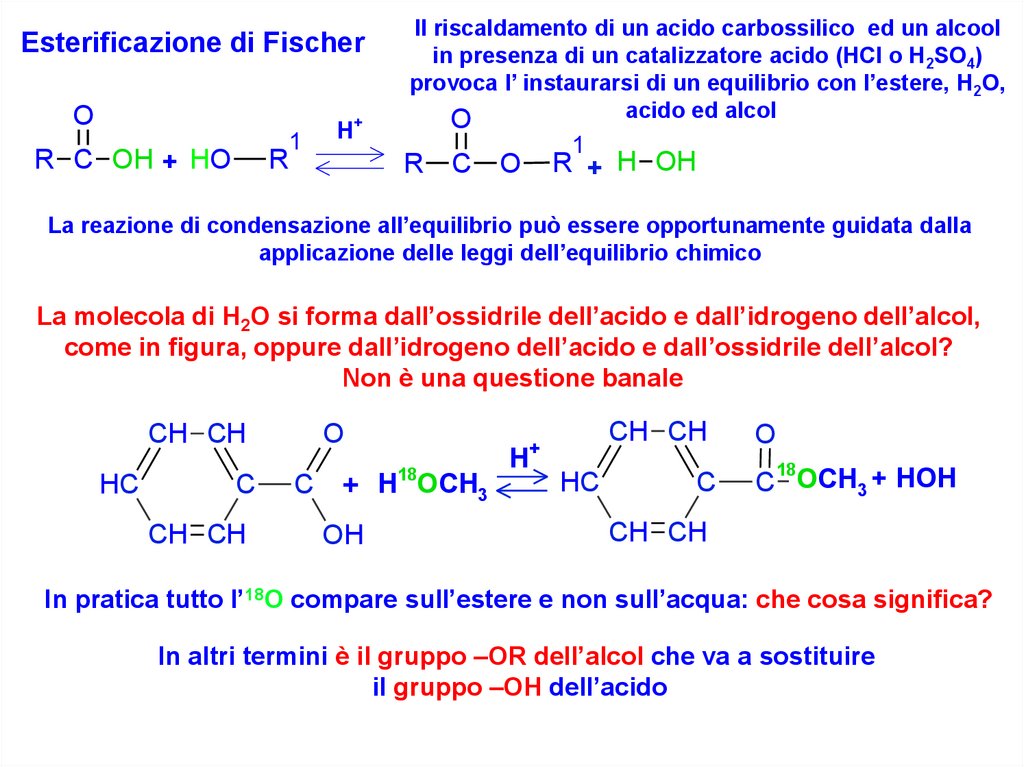
Esterificazione di FischerO
1
R C OH + HO
H+
R
Il riscaldamento di un acido carbossilico ed un alcool
in presenza di un catalizzatore acido (HCl o H2SO4)
provoca l’ instaurarsi di un equilibrio con l’estere, H2O,
acido ed alcol
O
R
C
1
R + H OH
O
La reazione di condensazione all’equilibrio può essere opportunamente guidata dalla
applicazione delle leggi dell’equilibrio chimico
La molecola di H2O si forma dall’ossidrile dell’acido e dall’idrogeno dell’alcol,
come in figura, oppure dall’idrogeno dell’acido e dall’ossidrile dell’alcol?
Non è una questione banale
CH CH
HC
C
CH CH
O
C
18
+ H OCH3
OH
CH CH
+
H
HC
C
O
18
OCH3 + HOH
C OH
CH CH
In pratica tutto l’18O compare sull’estere e non sull’acqua: che cosa significa?
In altri termini è il gruppo –OR dell’alcol che va a sostituire
il gruppo –OH dell’acido
23. Diapositiva 23
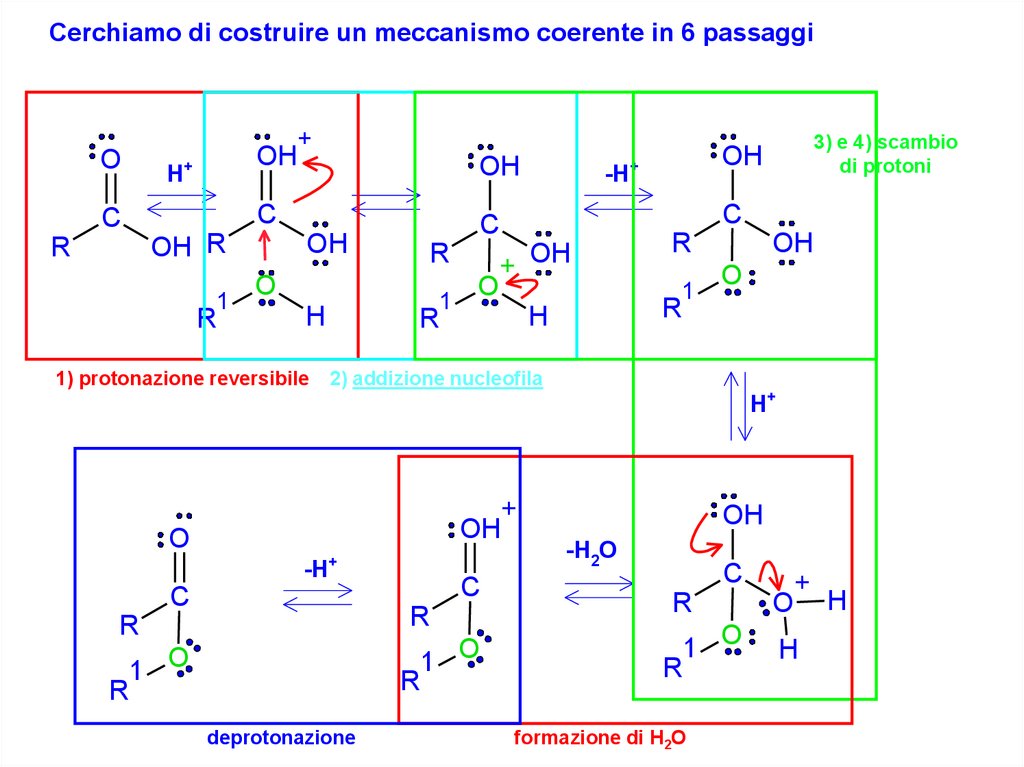
Cerchiamo di costruire un meccanismo coerente in 6 passaggi+
O
H+
C
OH
OH
C
C
OH R
R
R
1
OH
O
H
3) e 4) scambio
di protoni
OH
-H+
C
R
+ OH
O
1
H
R
R
R
1
OH
O
1) protonazione reversibile 2) addizione nucleofila
H+
+
OH
O
-H+
C
R
R
1 O
-H2O
C
R
R
+
O H
1 O
R
1 O
H
C
R
deprotonazione
OH
formazione di H2O
24. Diapositiva 24
+O
C
R
OH
H+
C
OH R
OH
+
OH
OH
C
C
R
R
OH
1
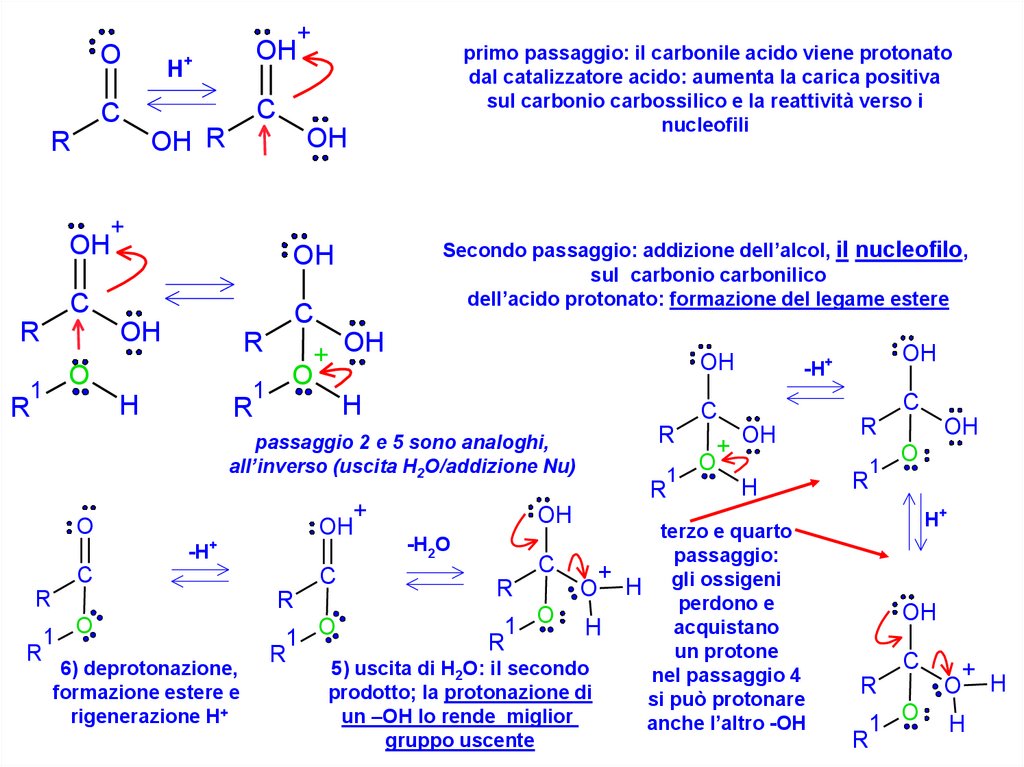
primo passaggio: il carbonile acido viene protonato
dal catalizzatore acido: aumenta la carica positiva
sul carbonio carbossilico e la reattività verso i
nucleofili
Secondo passaggio: addizione dell’alcol, il nucleofilo,
sul carbonio carbonilico
dell’acido protonato: formazione del legame estere
R
+ OH
O
1
H
R
O
H
OH
C
passaggio 2 e 5 sono analoghi,
all’inverso (uscita H2O/addizione Nu)
+
OH
O
-H
+
C
R
R
1 O
6) deprotonazione,
formazione estere e
rigenerazione H+
OH
-H+
R
+ OH
O
1
H
R
C
R
R
1
OH
O
OH
terzo e quarto
passaggio:
C
+
C
R
O H gli ossigeni
R
perdono e
O
acquistano
1
H
1 O
R
un protone
R
5) uscita di H2O: il secondo
nel passaggio 4
prodotto; la protonazione di
si può protonare
un –OH lo rende miglior
anche l’altro -OH
gruppo uscente
H+
-H2O
OH
C
R
+
O H
1 O
H
R
25. Diapositiva 25
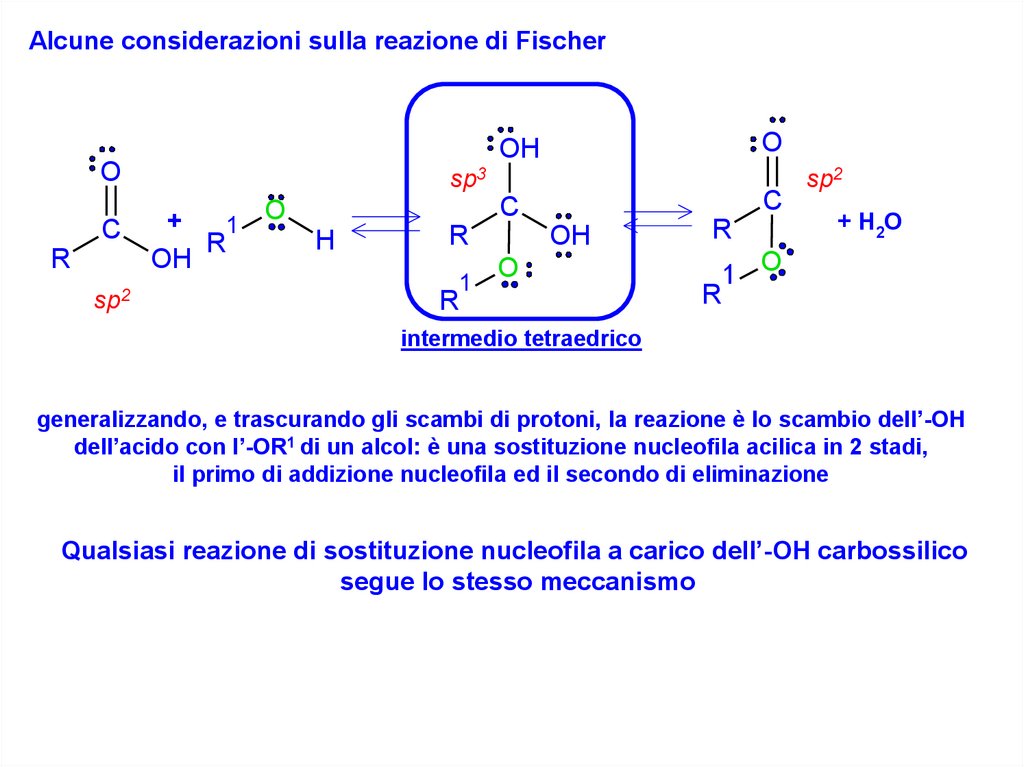
Alcune considerazioni sulla reazione di FischerO
C
R
sp2
O
OH
sp3
O
+
1
R
OH
C
C
H
R
R
1
OH
R
O
R
sp2
+ H2O
1 O
intermedio tetraedrico
generalizzando, e trascurando gli scambi di protoni, la reazione è lo scambio dell’-OH
dell’acido con l’-OR1 di un alcol: è una sostituzione nucleofila acilica in 2 stadi,
il primo di addizione nucleofila ed il secondo di eliminazione
Qualsiasi reazione di sostituzione nucleofila a carico dell’-OH carbossilico
segue lo stesso meccanismo
26. Diapositiva 26
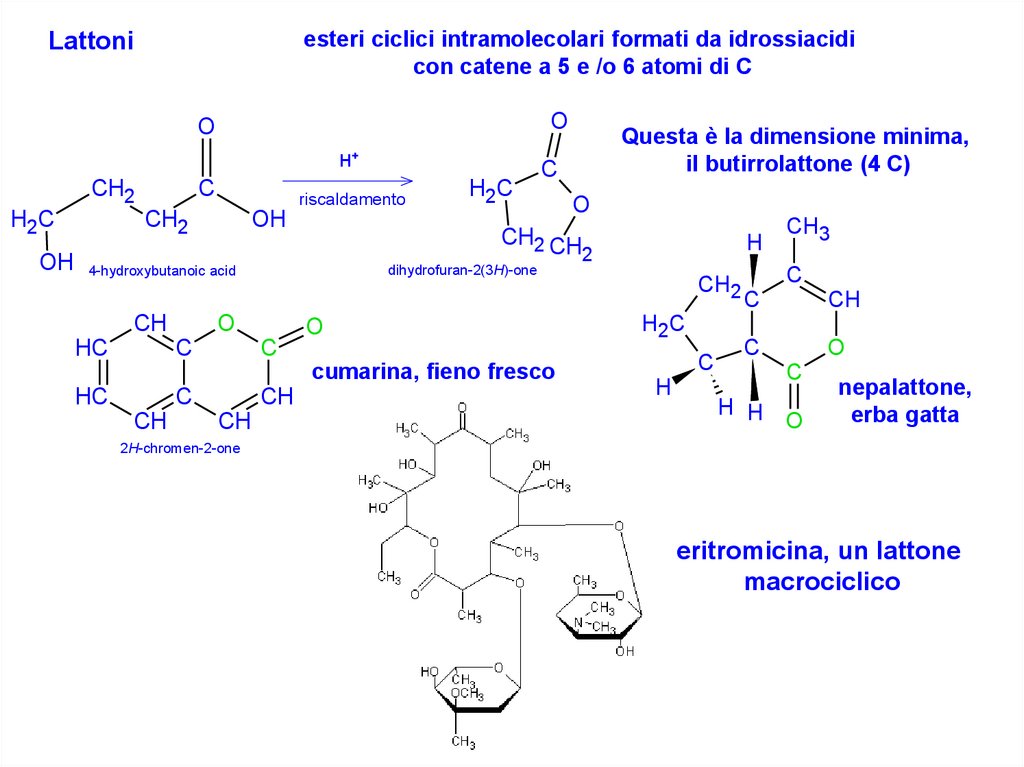
esteri ciclici intramolecolari formati da idrossiacidicon catene a 5 e /o 6 atomi di C
Lattoni
O
O
+
H
CH2
H2C
C
riscaldamento
CH2
OH
HC
dihydrofuran-2(3H)-one
O
C
C
C
O
cumarina, fieno fresco
HC
C
CH
CH
CH
O
CH2 CH
OH 4-hydroxybutanoic acid
CH
H2C
Questa è la dimensione minima,
il butirrolattone (4 C)
H
2
CH2
H2C
C
H
CH3
C
C
CH
C
O
C
H H
O
nepalattone,
erba gatta
2H-chromen-2-one
eritromicina, un lattone
macrociclico
27. Diapositiva 27
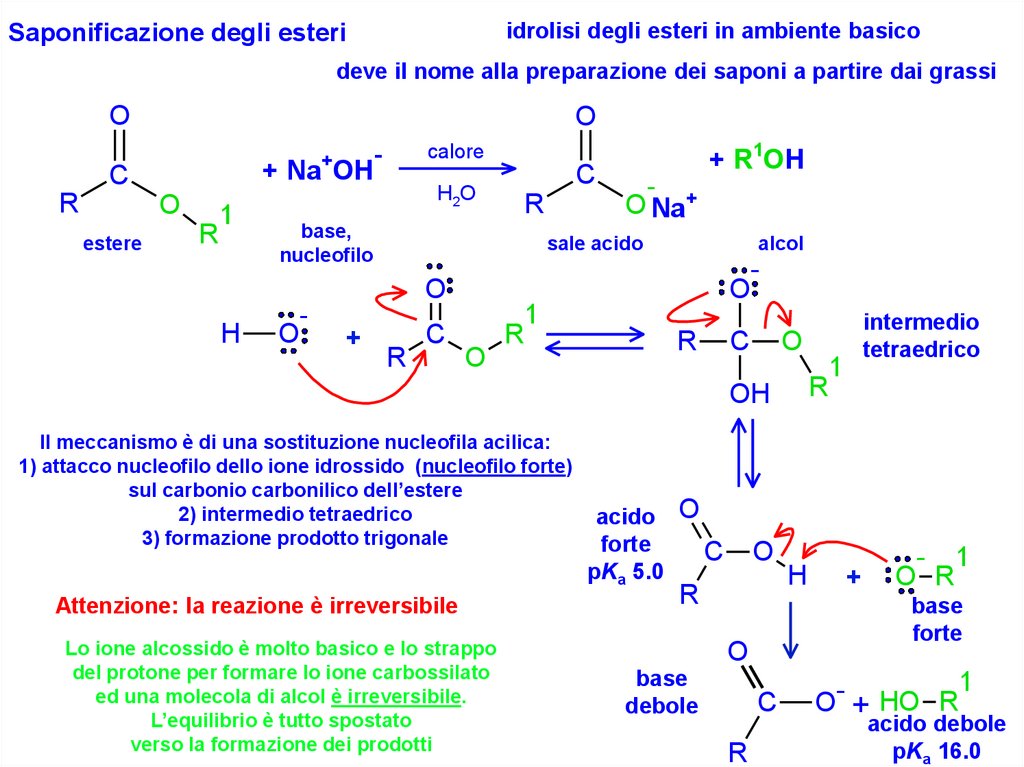
idrolisi degli esteri in ambiente basicoSaponificazione degli esteri
deve il nome alla preparazione dei saponi a partire dai grassi
O
O
+ Na OH
C
R
O
estere
1
R
C
H2O
base,
nucleofilo
-
O
+
-
O Na+
R
sale acido
O
H
+ R1OH
calore
-
+
R
C
O
R
alcol
O
1
R
C
O
R
OH
Il meccanismo è di una sostituzione nucleofila acilica:
1) attacco nucleofilo dello ione idrossido (nucleofilo forte)
sul carbonio carbonilico dell’estere
2) intermedio tetraedrico
3) formazione prodotto trigonale
Attenzione: la reazione è irreversibile
Lo ione alcossido è molto basico e lo strappo
del protone per formare lo ione carbossilato
ed una molecola di alcol è irreversibile.
L’equilibrio è tutto spostato
verso la formazione dei prodotti
acido O
forte
C
pKa 5.0
O
R
C
R
+
- 1
O R
base
forte
O
base
debole
H
1
intermedio
tetraedrico
1
O- + HO R
acido debole
pKa 16.0
28. Diapositiva 28
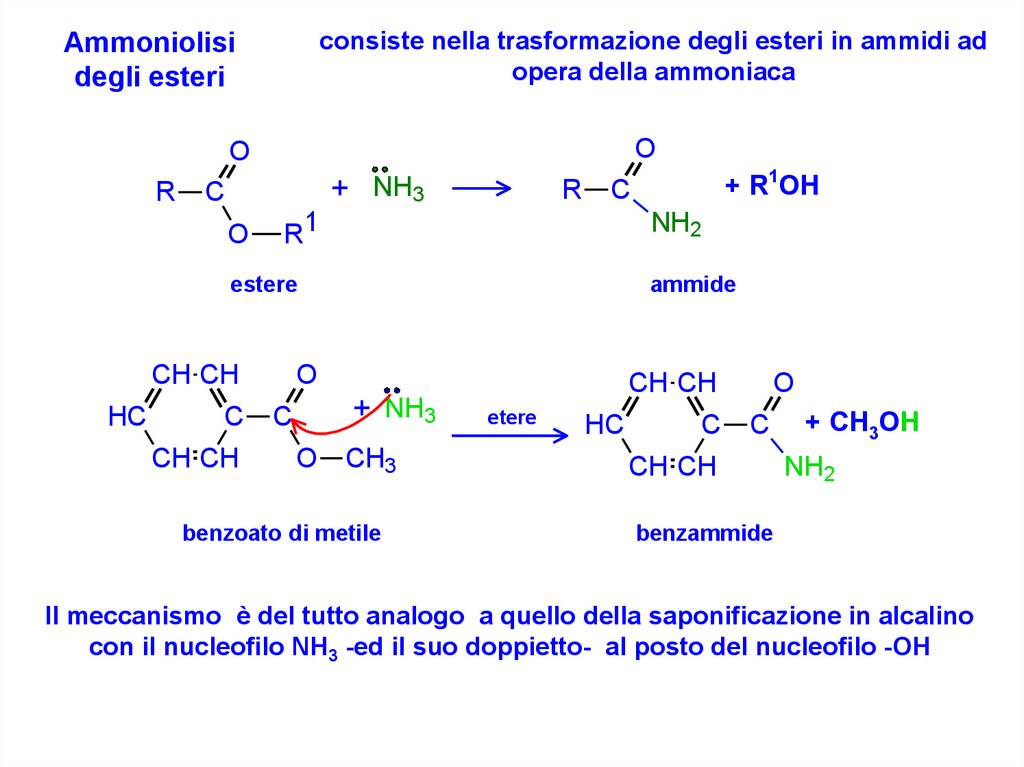
consiste nella trasformazione degli esteri in ammidi adopera della ammoniaca
Ammoniolisi
degli esteri
O
O
R
+ NH3
C
O
R
R1
NH2
estere
CH CH
HC
C
CH CH
ammide
O
+ NH3
C
O
+ R1OH
C
CH3
benzoato di metile
CH CH
etere
HC
C
O
C
CH CH
+ CH3OH
NH2
benzammide
Il meccanismo è del tutto analogo a quello della saponificazione in alcalino
con il nucleofilo NH3 -ed il suo doppietto- al posto del nucleofilo -OH
29. Diapositiva 29
Esteri e reattivi di GrignardBr Mg
O
R
estere
reazione
+ 2 R2MgBr
C
O
O
complessiva
R1
R
R
C
O
R1
1
R2
R2
+
R
C
R2
R2 alcol terziario
La reazione procede tra 1 estere e 2 eq di
reattivo di Grignard fornendo
2
1 alcol terziario
R MgBr
attacco
nucleofilo
O
H
C
R2
R2MgBr
Br Mg
H2O
OH
O
-R OMgBr
R
C
L’attacco nucleofilo del reattivo sul
carbonio del carbonile estereo termina
con la formazione di un chetone
R2
chetone
Il chetone reagisce come di regola per dare
l’alcol terziario
30. Diapositiva 30
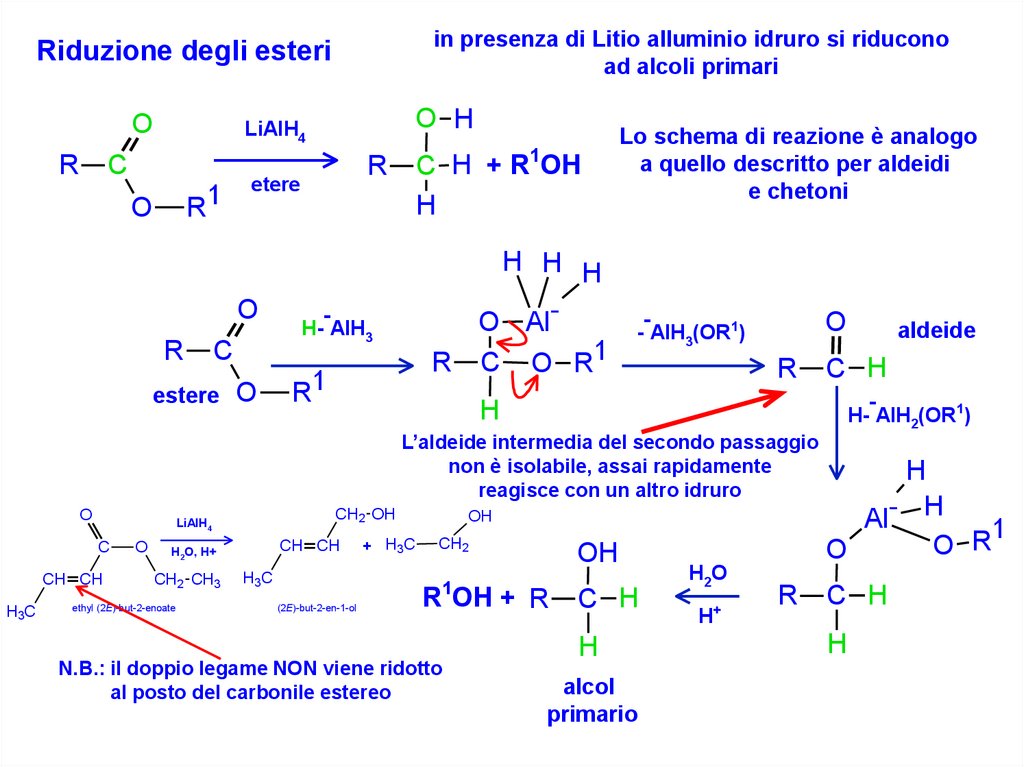
in presenza di Litio alluminio idruro si riduconoad alcoli primari
Riduzione degli esteri
O
R
O H
LiAlH4
C
R1
O
R
C
estere
O
C H + R OH
H
R
etere
O
1
H H H
O Al-
H- AlH3
R
R1
C
O R1
Lo schema di reazione è analogo
a quello descritto per aldeidi
e chetoni
- AlH3(OR1)
O
R
O
C
CH CH
H3C
CH2 OH
LiAlH4
O
CH CH
H2O, H+
CH2 CH3
ethyl (2E)-but-2-enoate
C H
H- AlH2(OR1)
H
L’aldeide intermedia del secondo passaggio
non è isolabile, assai rapidamente
reagisce con un altro idruro
H3C
+ H3C
OH
CH2
1
(2E)-but-2-en-1-ol
OH
R OH + R
N.B.: il doppio legame NON viene ridotto
al posto del carbonile estereo
C H
H
alcol
primario
H2O
H+
R
aldeide
H
Al- H
1
R
O
O
C H
H
31. Diapositiva 31
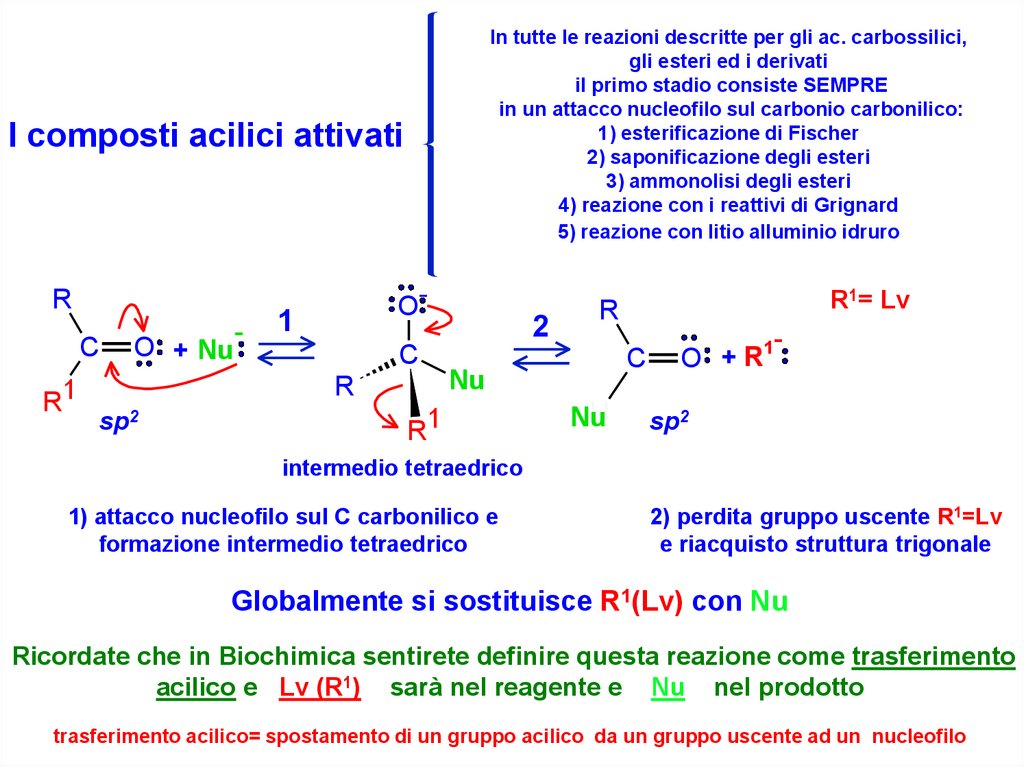
In tutte le reazioni descritte per gli ac. carbossilici,gli esteri ed i derivati
il primo stadio consiste SEMPRE
in un attacco nucleofilo sul carbonio carbonilico:
1) esterificazione di Fischer
2) saponificazione degli esteri
3) ammonolisi degli esteri
4) reazione con i reattivi di Grignard
5) reazione con litio alluminio idruro
I composti acilici attivati
R
C
R1
O + Nu
O-
1
C
R
sp2
2
C
H
Nu
R1
R1= Lv
R
H
Nu
O + R1
sp2
intermedio tetraedrico
1) attacco nucleofilo sul C carbonilico e
formazione intermedio tetraedrico
2) perdita gruppo uscente R1=Lv
e riacquisto struttura trigonale
Globalmente si sostituisce R1(Lv) con Nu
Ricordate che in Biochimica sentirete definire questa reazione come trasferimento
acilico e Lv (R1) sarà nel reagente e Nu nel prodotto
trasferimento acilico= spostamento di un gruppo acilico da un gruppo uscente ad un nucleofilo
32. Diapositiva 32
RC
R1
O + Nu
O-
1
C
R
R1
2
R
C
H
Nu
1-
O +R
R1= Lv
H
Nu
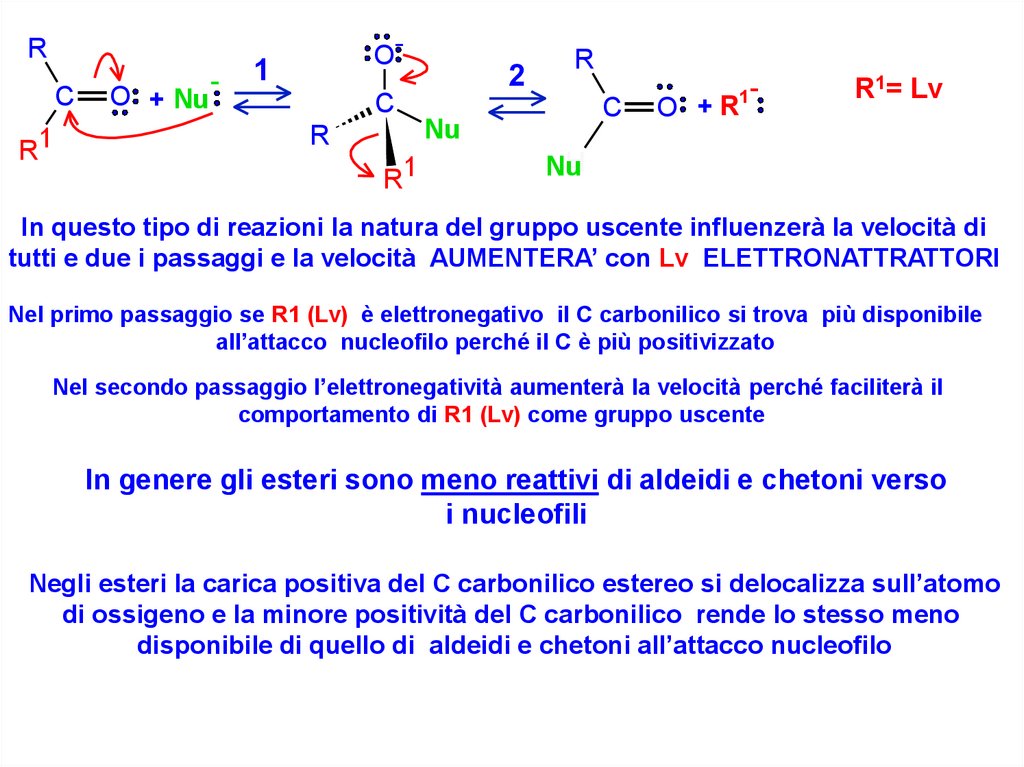
In questo tipo di reazioni la natura del gruppo uscente influenzerà la velocità di
tutti e due i passaggi e la velocità AUMENTERA’ con Lv ELETTRONATTRATTORI
Nel primo passaggio se R1 (Lv) è elettronegativo il C carbonilico si trova più disponibile
all’attacco nucleofilo perché il C è più positivizzato
Nel secondo passaggio l’elettronegatività aumenterà la velocità perché faciliterà il
comportamento di R1 (Lv) come gruppo uscente
In genere gli esteri sono meno reattivi di aldeidi e chetoni verso
i nucleofili
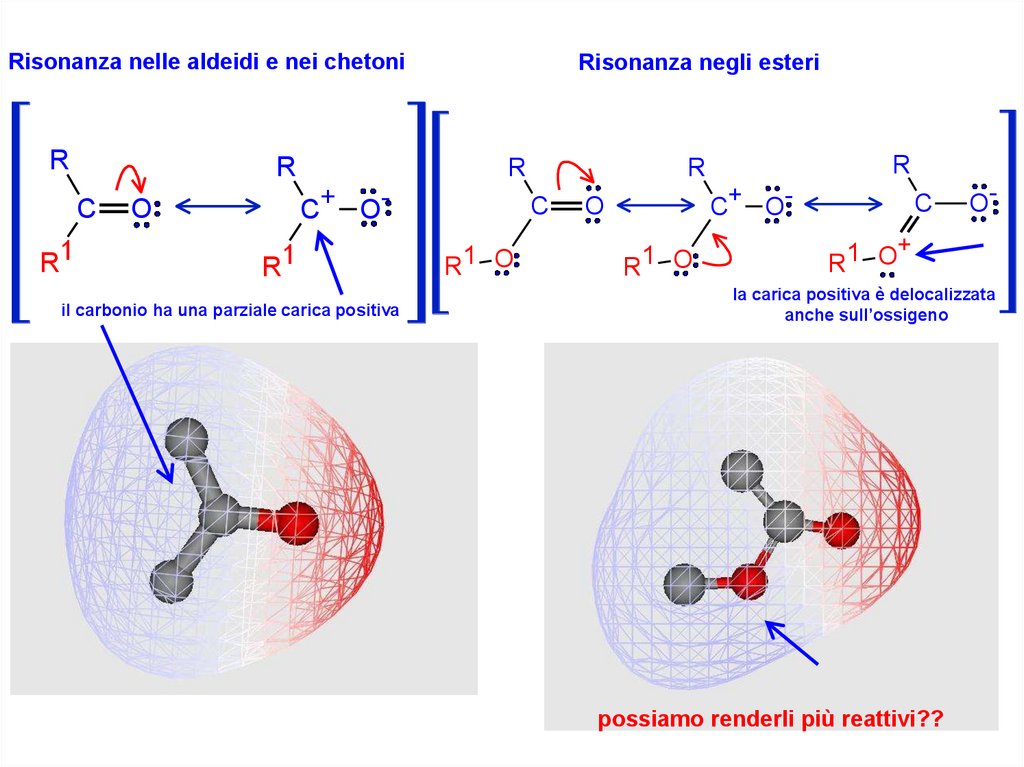
Negli esteri la carica positiva del C carbonilico estereo si delocalizza sull’atomo
di ossigeno e la minore positività del C carbonilico rende lo stesso meno
disponibile di quello di aldeidi e chetoni all’attacco nucleofilo
33. Diapositiva 33
Risonanza nelle aldeidi e nei chetoniR
R
C
R1
Risonanza negli esteri
R
C+ O-
O
R1
il carbonio ha una parziale carica positiva
C
R1 O
R
R
C+ O-
O
R1 O
C
O-
+
1
O
R
la carica positiva è delocalizzata
anche sull’ossigeno
possiamo renderli più reattivi??
34. Diapositiva 34
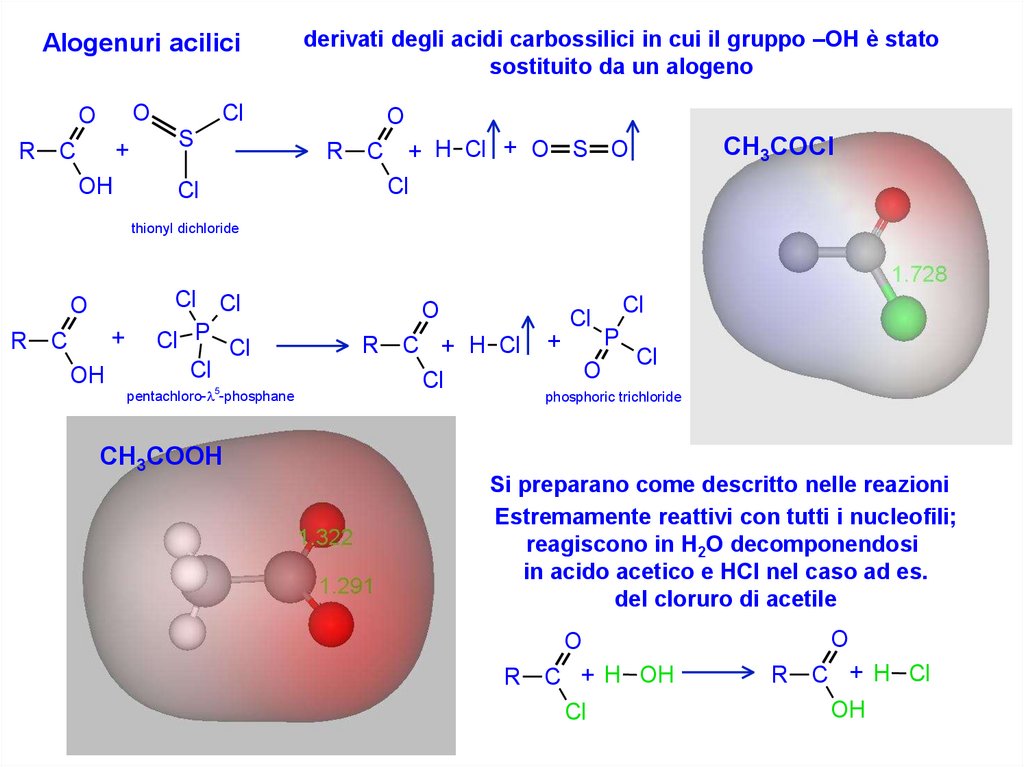
Alogenuri aciliciO
O
R
+
C
OH
derivati degli acidi carbossilici in cui il gruppo –OH è stato
sostituito da un alogeno
Cl
S
O
R
C
CH3COCl
+ H Cl + O S O
Cl
Cl
thionyl dichloride
O
R
+
C
OH
Cl Cl
Cl P Cl
Cl
pentachloro- 5-phosphane
O
R
Cl
C + H Cl
Cl
+
O
Cl
P
Cl
phosphoric trichloride
CH3COOH
Si preparano come descritto nelle reazioni
Estremamente reattivi con tutti i nucleofili;
reagiscono in H2O decomponendosi
in acido acetico e HCl nel caso ad es.
del cloruro di acetile
O
O
R
C + H OH
Cl
R
C + H Cl
OH
35. Diapositiva 35
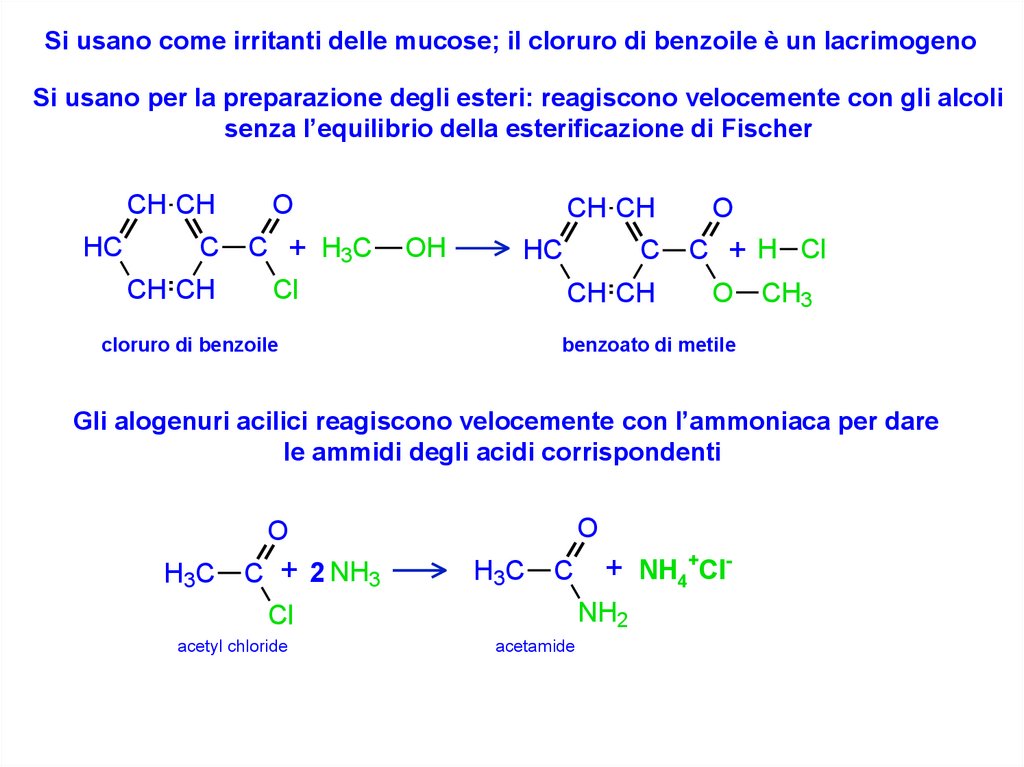
Si usano come irritanti delle mucose; il cloruro di benzoile è un lacrimogenoSi usano per la preparazione degli esteri: reagiscono velocemente con gli alcoli
senza l’equilibrio della esterificazione di Fischer
CH CH
HC
C
CH CH
O
C + H3C
Cl
CH CH
OH
HC
C
CH CH
cloruro di benzoile
O
C + H Cl
O CH3
benzoato di metile
Gli alogenuri acilici reagiscono velocemente con l’ammoniaca per dare
le ammidi degli acidi corrispondenti
O
O
H3C
C + 2 NH3
H3C
C
NH2
Cl
acetyl chloride
+ NH4+Cl-
acetamide
36. Diapositiva 36
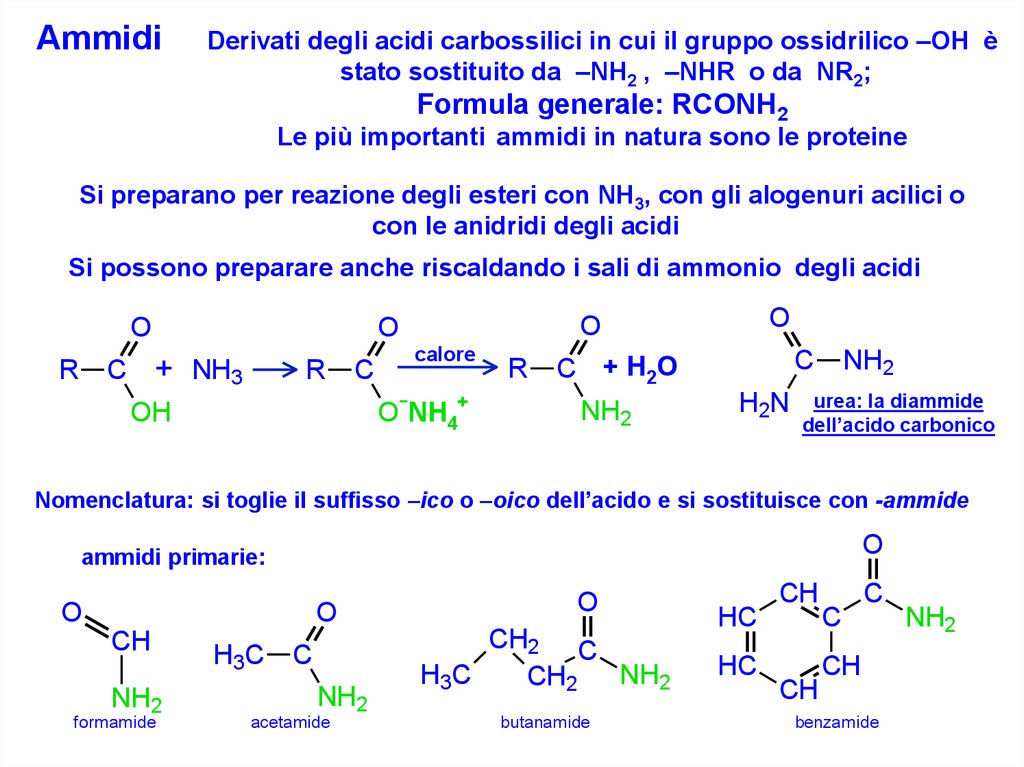
AmmidiDerivati degli acidi carbossilici in cui il gruppo ossidrilico –OH è
stato sostituito da –NH2 , –NHR o da NR2;
Formula generale: RCONH2
Le più importanti ammidi in natura sono le proteine
Si preparano per reazione degli esteri con NH3, con gli alogenuri acilici o
con le anidridi degli acidi
Si possono preparare anche riscaldando i sali di ammonio degli acidi
O
R
+ NH3
C
R
C
calore
O-NH4+
OH
O
O
O
R
C
C + H2O
NH2
H2N
NH2
urea: la diammide
dell’acido carbonico
Nomenclatura: si toglie il suffisso –ico o –oico dell’acido e si sostituisce con -ammide
O
ammidi primarie:
O
O
CH
NH2
formamide
H3C
C
NH2
acetamide
O
CH2 C
H3C
NH2
CH2
butanamide
HC
HC
CH
CH
C
C
CH
benzamide
NH2
37. Diapositiva 37
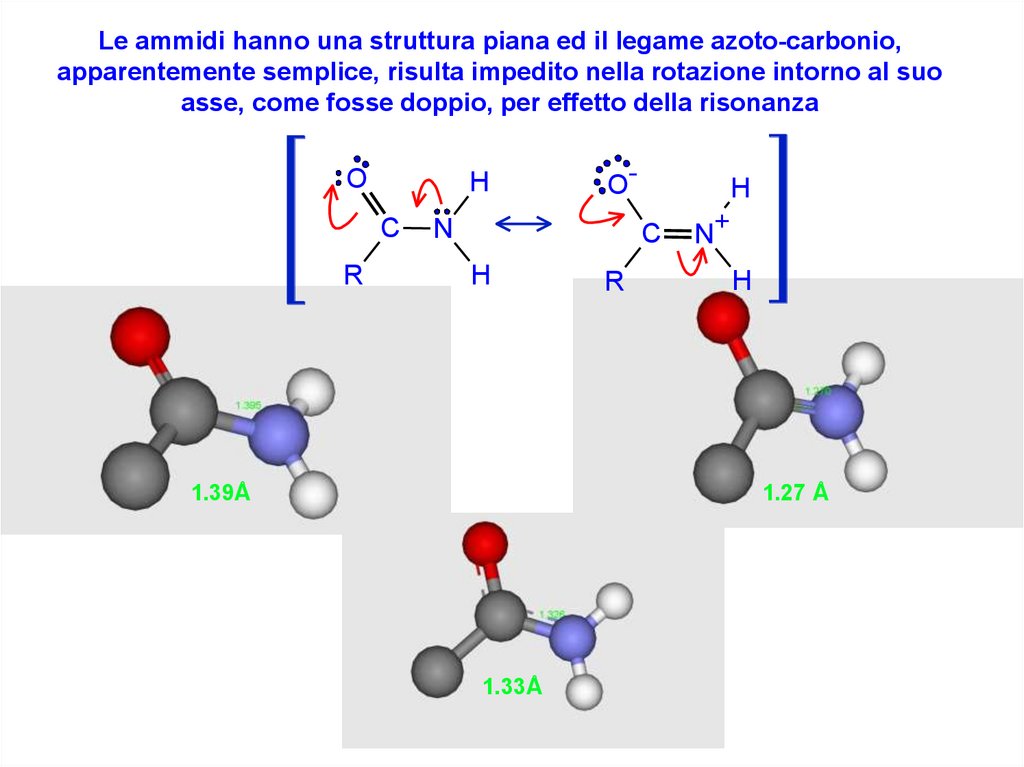
Le ammidi hanno una struttura piana ed il legame azoto-carbonio,apparentemente semplice, risulta impedito nella rotazione intorno al suo
asse, come fosse doppio, per effetto della risonanza
O
H
C
R
O-
N
H
C
H
R
N+
H
1.27 Å
1.39Å
1.33Å
38. Diapositiva 38
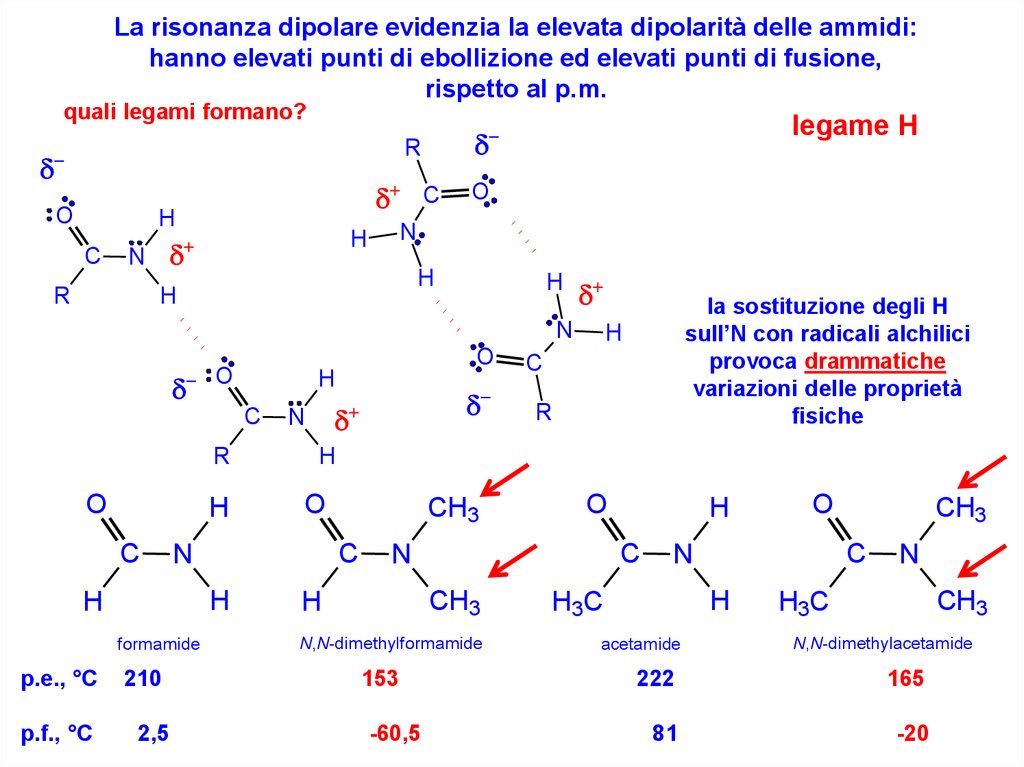
La risonanza dipolare evidenzia la elevata dipolarità delle ammidi:hanno elevati punti di ebollizione ed elevati punti di fusione,
rispetto al p.m.
quali legami formano?
O
H
C
N
R
C
O
N
H
H
H
R
legame H
H
N
O
H
C
O
C
N
R
H
H
O
H
formamide
C
R
CH3
C
N
H
O
H
O
H
C
N
CH3
H
la sostituzione degli H
sull’N con radicali alchilici
provoca drammatiche
variazioni delle proprietà
fisiche
N,N-dimethylformamide
O
C
N
H
H3C
acetamide
CH3
N
CH3
H3C
N,N-dimethylacetamide
p.e., °C
210
153
222
165
p.f., °C
2,5
-60,5
81
-20
39. Diapositiva 39
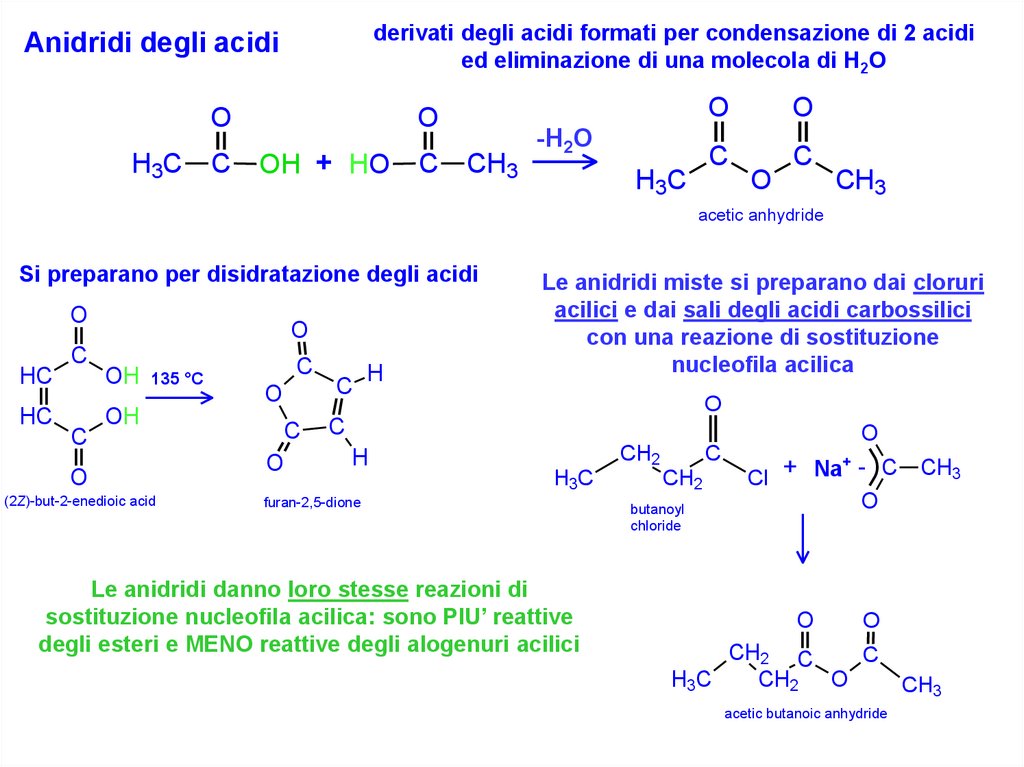
derivati degli acidi formati per condensazione di 2 acidied eliminazione di una molecola di H2O
Anidridi degli acidi
O
H3C
C
O
OH + HO
C
CH3
-H2O
H3C
O
O
C
C
O
CH3
acetic anhydride
Si preparano per disidratazione degli acidi
O
HC
HC
C
C
O
OH 135 °C
C
O
OH
O
(2Z)-but-2-enedioic acid
C
O
C
H
Le anidridi miste si preparano dai cloruri
acilici e dai sali degli acidi carbossilici
con una reazione di sostituzione
nucleofila acilica
O
C
H
CH2
H3C
furan-2,5-dione
Le anidridi danno loro stesse reazioni di
sostituzione nucleofila acilica: sono PIU’ reattive
degli esteri e MENO reattive degli alogenuri acilici
C
CH2
butanoyl
chloride
O
+
Cl + Na - C
O
O
CH3
O
CH2 C
C
H3C
CH2 O
acetic butanoic anhydride
CH3
40. Diapositiva 40
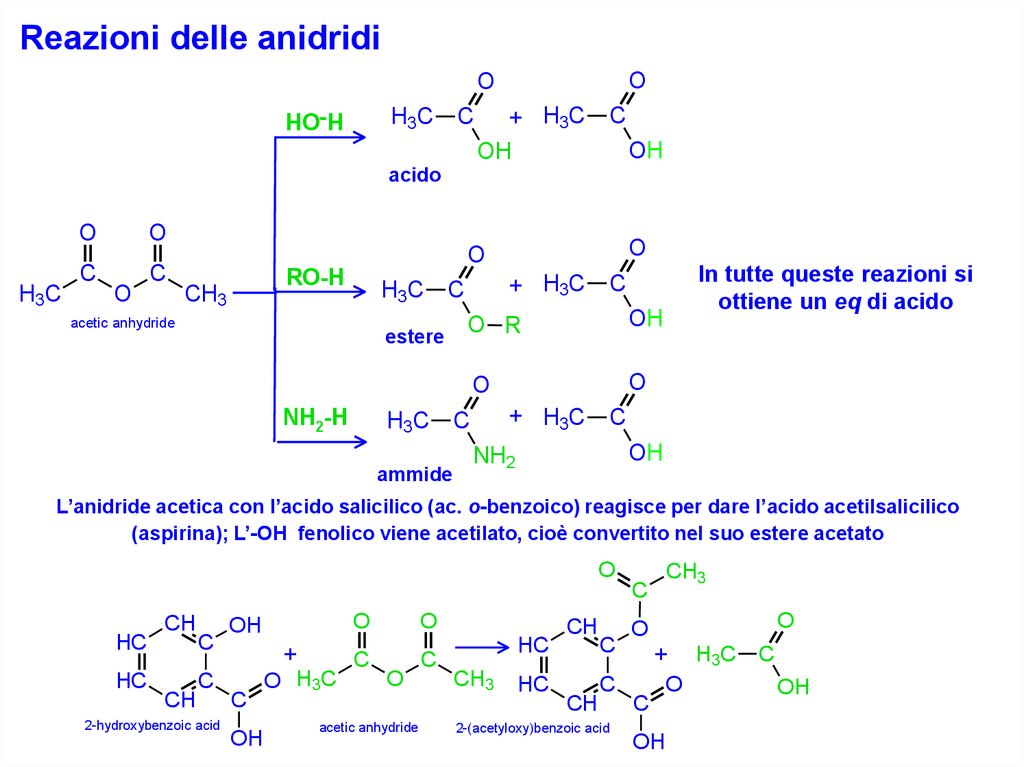
Reazioni delle anidridiO
O
H3C
+ H3C C
C
OH
OH
O
O
H-OH
acido
O
H3C
C
O
O
C
RO-H
CH3
H3C
acetic anhydride
estere
NH2-H
H3C
ammide
In tutte queste reazioni si
ottiene un eq di acido
+ H3C C
C
O R
OH
O
O
+ H3C C
C
OH
NH2
L’anidride acetica con l’acido salicilico (ac. o-benzoico) reagisce per dare l’acido acetilsalicilico
(aspirina); L’-OH fenolico viene acetilato, cioè convertito nel suo estere acetato
O
HC
HC
CH
CH
C
C
2-hydroxybenzoic acid
OH
+
C
OH
O H3C
O
O
C
C
O
acetic anhydride
HC
CH3
HC
CH
CH
C
C
2-(acetyloxy)benzoic acid
CH3
C
O
O
+
C
OH
O
H3C
C
OH
41. Diapositiva 41
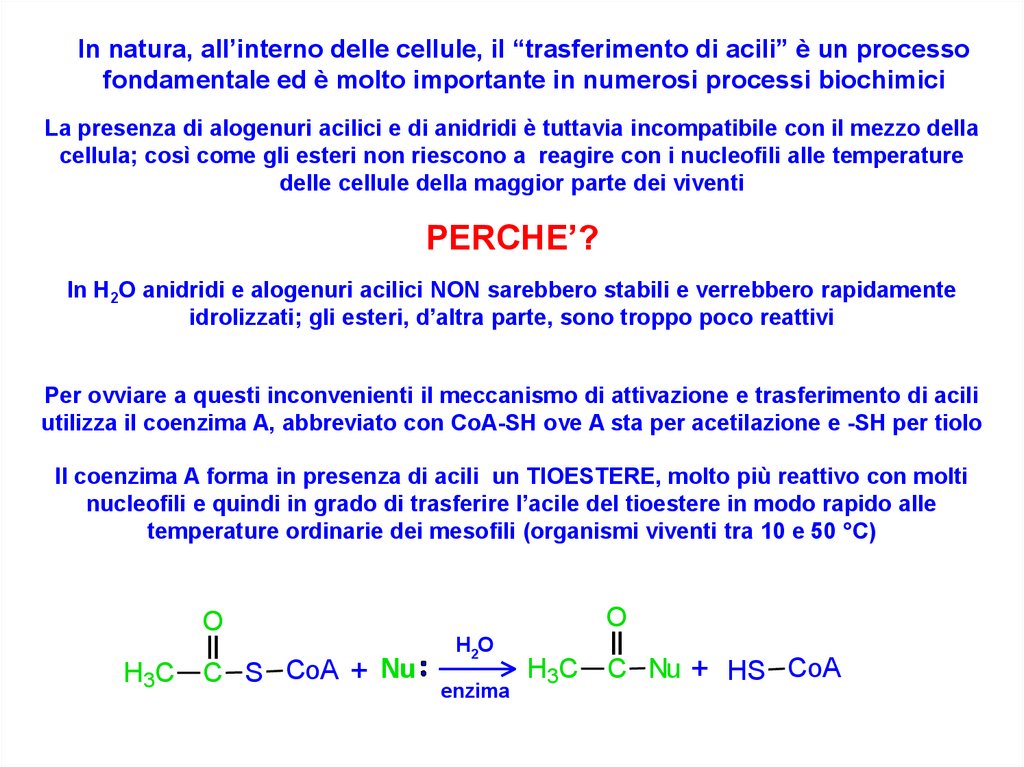
In natura, all’interno delle cellule, il “trasferimento di acili” è un processofondamentale ed è molto importante in numerosi processi biochimici
La presenza di alogenuri acilici e di anidridi è tuttavia incompatibile con il mezzo della
cellula; così come gli esteri non riescono a reagire con i nucleofili alle temperature
delle cellule della maggior parte dei viventi
PERCHE’?
In H2O anidridi e alogenuri acilici NON sarebbero stabili e verrebbero rapidamente
idrolizzati; gli esteri, d’altra parte, sono troppo poco reattivi
Per ovviare a questi inconvenienti il meccanismo di attivazione e trasferimento di acili
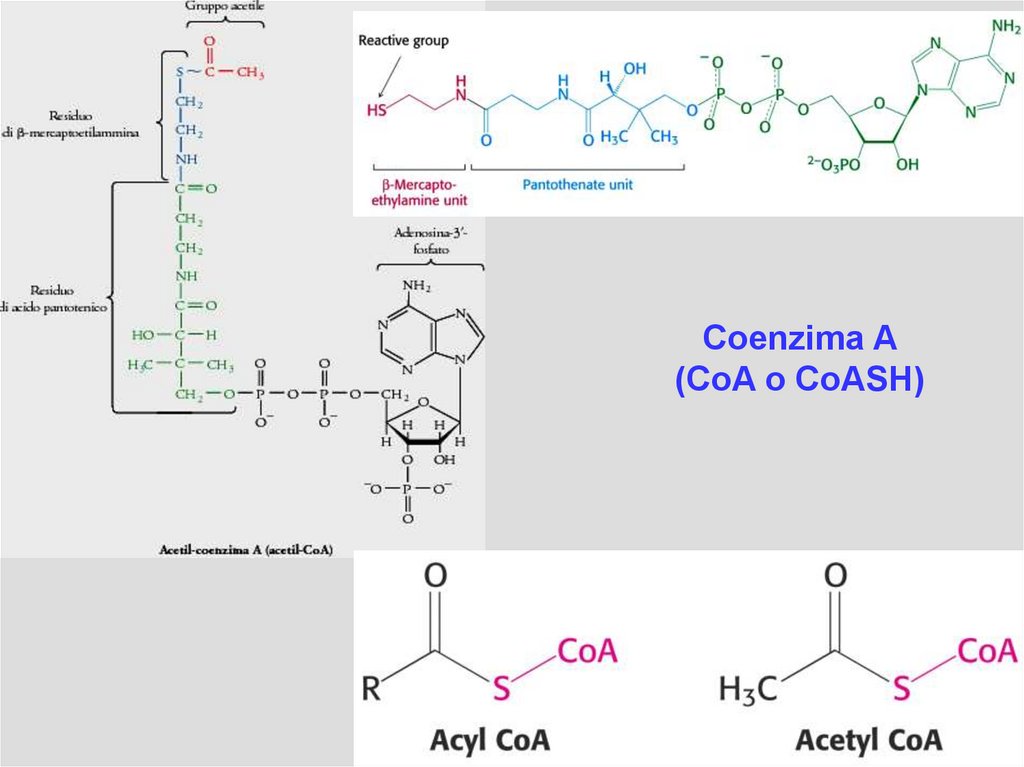
utilizza il coenzima A, abbreviato con CoA-SH ove A sta per acetilazione e -SH per tiolo
Il coenzima A forma in presenza di acili un TIOESTERE, molto più reattivo con molti
nucleofili e quindi in grado di trasferire l’acile del tioestere in modo rapido alle
temperature ordinarie dei mesofili (organismi viventi tra 10 e 50 °C)
O
O
H3C
C S CoA + Nu
H2O
enzima
H3C
C Nu + HS CoA
42. Diapositiva 42
Coenzima A(CoA o CoASH)
43. Diapositiva 43
Perché il tioestere è più reattivo degli esteri “normali” nel trasferire acili?Le basi coniugate RS- sono basi ben più
deboli di quelle degli alcoli ROI tioli sono più acidi degli alcoli
Il gruppo uscente -SR del tioestere, nella
sostituzione nucleofila, sarà molto
migliore di quello dei comuni alcoli -OR
presenti in tutti gli esteri
Il tioestere, nelle normali condizioni di
reattività cellulare, non sarà comunque
suscettibile di idrolisi spontanea pur
essendo assai più reattivo di qualsiasi
altro estere comune
44. Diapositiva 44
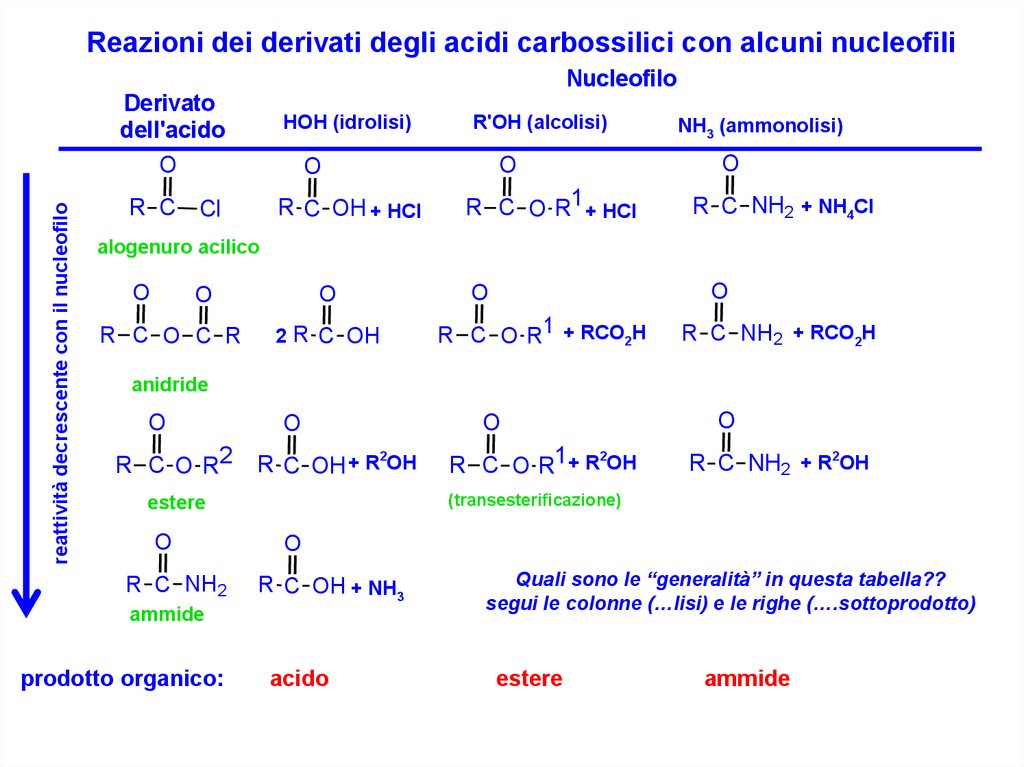
Reazioni dei derivati degli acidi carbossilici con alcuni nucleofiliNucleofilo
Derivato
dell'acido
HOH (idrolisi)
reattività decrescente con il nucleofilo
O
R C
R'OH (alcolisi)
O
O
R C OH + HCl
Cl
R C O R1 + HCl
NH3 (ammonolisi)
O
R C NH2 + NH4Cl
alogenuro acilico
O
R C O C R
O
O
O
O
2 R C OH
R C O R1 + RCO2H
R C NH2 + RCO2H
anidride
O
R C O R2
O
O
2
R C OH + R OH
R C NH2
O
R C OH + NH3
Quali sono le “generalità” in questa tabella??
segui le colonne (…lisi) e le righe (….sottoprodotto)
acido
estere
ammide
prodotto organico:
R C NH2 + R2OH
(transesterificazione)
estere
O
2
R C O R1+ R OH
O
ammide
45. Diapositiva 45
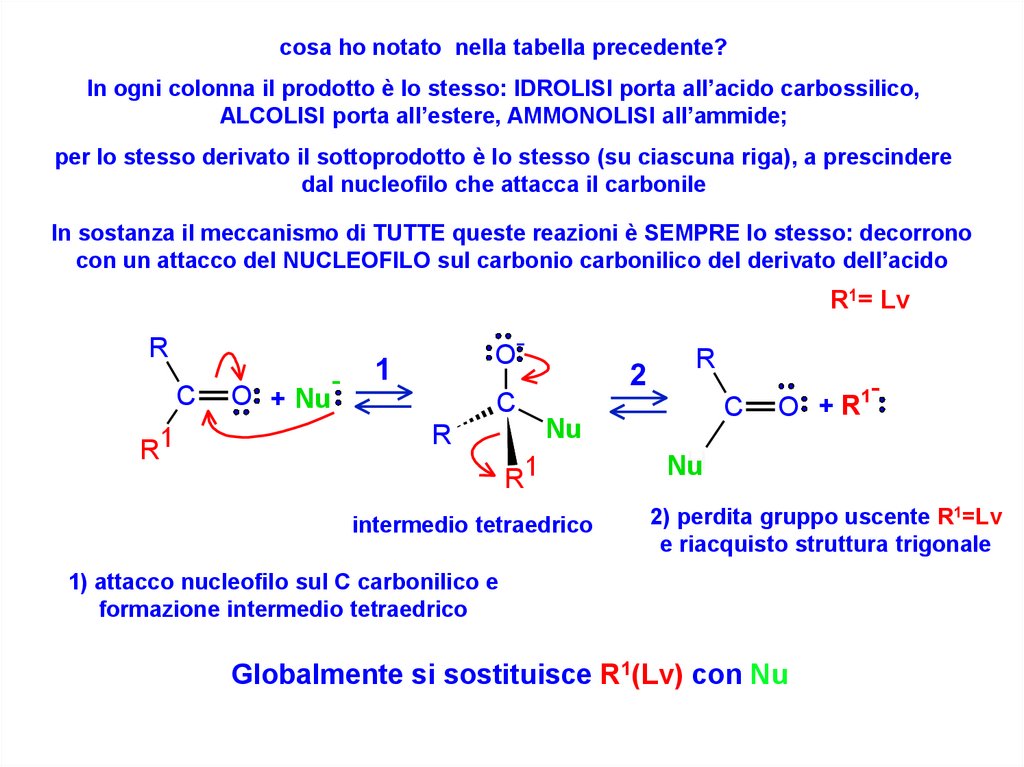
cosa ho notato nella tabella precedente?In ogni colonna il prodotto è lo stesso: IDROLISI porta all’acido carbossilico,
ALCOLISI porta all’estere, AMMONOLISI all’ammide;
per lo stesso derivato il sottoprodotto è lo stesso (su ciascuna riga), a prescindere
dal nucleofilo che attacca il carbonile
In sostanza il meccanismo di TUTTE queste reazioni è SEMPRE lo stesso: decorrono
con un attacco del NUCLEOFILO sul carbonio carbonilico del derivato dell’acido
R1= Lv
R
C
R1
O + Nu
O-
1
C
R
2
R
C
H
Nu
R1
intermedio tetraedrico
1+
R
O
H
Nu
2) perdita gruppo uscente R1=Lv
e riacquisto struttura trigonale
1) attacco nucleofilo sul C carbonilico e
formazione intermedio tetraedrico
Globalmente si sostituisce R1(Lv) con Nu
46. Diapositiva 46
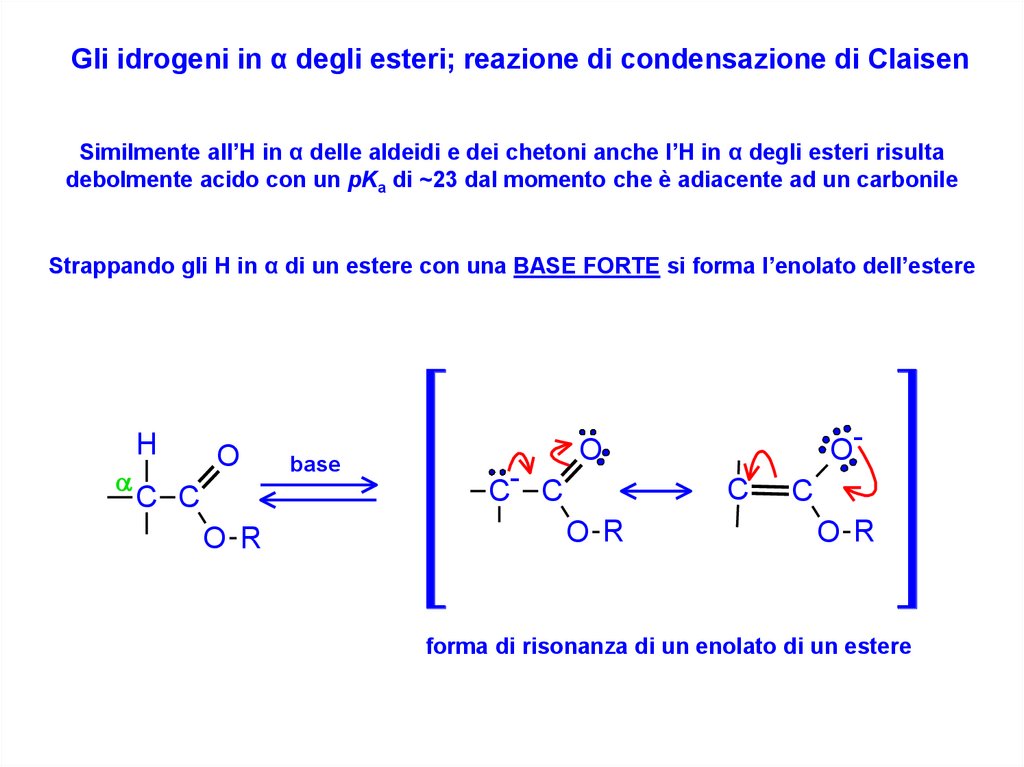
Gli idrogeni in α degli esteri; reazione di condensazione di ClaisenSimilmente all’H in α delle aldeidi e dei chetoni anche l’H in α degli esteri risulta
debolmente acido con un pKa di ~23 dal momento che è adiacente ad un carbonile
Strappando gli H in α di un estere con una BASE FORTE si forma l’enolato dell’estere
H
H
O
C C
H
O R
base
O
H C- C
H
O R
H
C
H
OC
O R
forma di risonanza di un enolato di un estere
47. Diapositiva 47
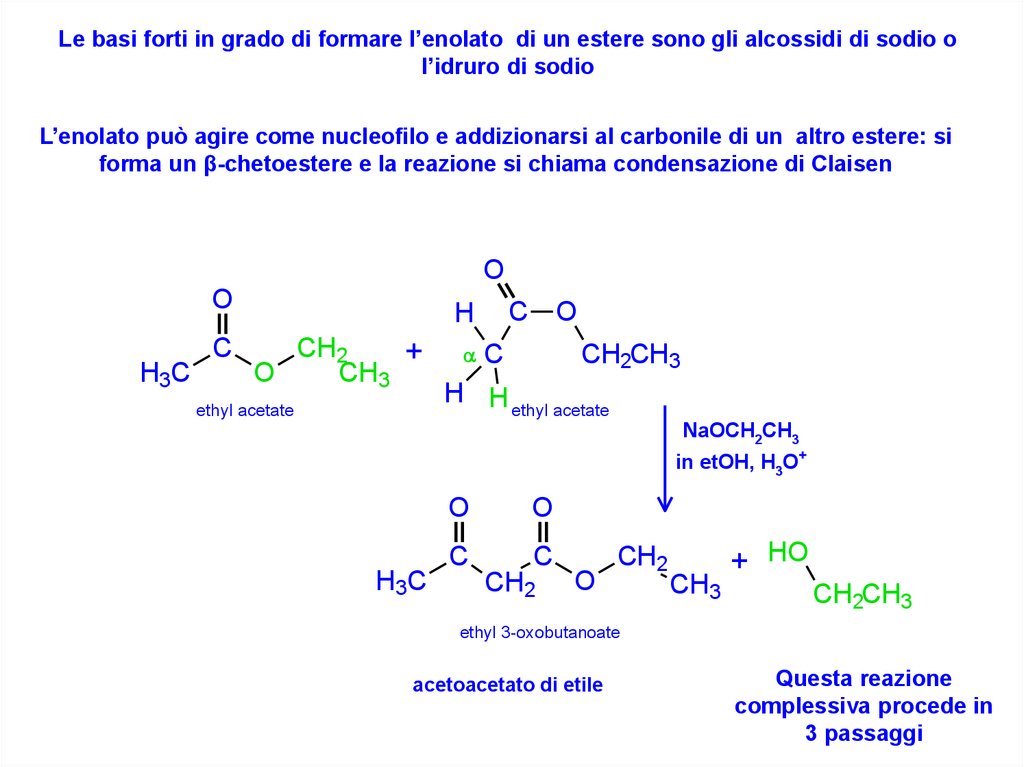
Le basi forti in grado di formare l’enolato di un estere sono gli alcossidi di sodio ol’idruro di sodio
L’enolato può agire come nucleofilo e addizionarsi al carbonile di un altro estere: si
forma un β-chetoestere e la reazione si chiama condensazione di Claisen
O
O
H3C
C
C
H
CH2
+
O
CH3
ethyl acetate
O
C
CH2CH3
H H ethyl acetate
NaOCH2CH3
in etOH, H3O+
H3C
O
O
C
C
CH2
O
CH2
CH3
+ HO
CH2CH3
ethyl 3-oxobutanoate
acetoacetato di etile
Questa reazione
complessiva procede in
3 passaggi
48. Diapositiva 48
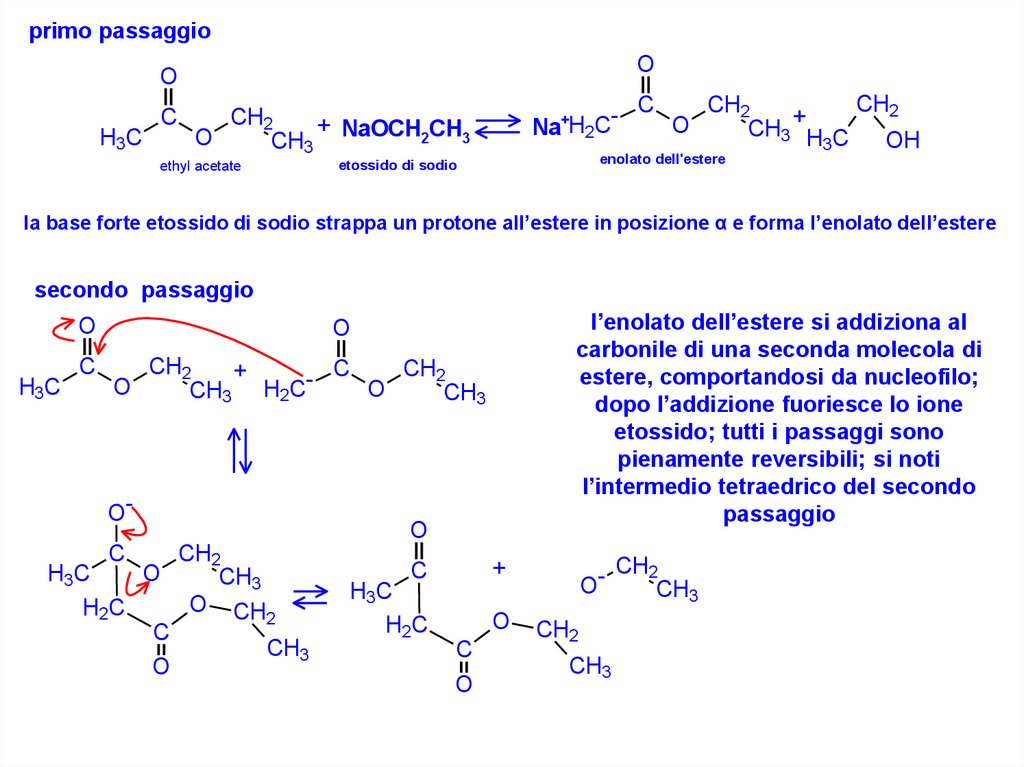
primo passaggioO
O
H3C
C
CH2
C
CH2
+
O
Na H2C
CH3 H C
OH
CH2
+ NaOCH2CH3
O
CH3
ethyl acetate
+
enolato dell'estere
etossido di sodio
3
la base forte etossido di sodio strappa un protone all’estere in posizione α e forma l’enolato dell’estere
secondo passaggio
O
H3C
C
l’enolato dell’estere si addiziona al
carbonile di una seconda molecola di
estere, comportandosi da nucleofilo;
dopo l’addizione fuoriesce lo ione
etossido; tutti i passaggi sono
pienamente reversibili; si noti
l’intermedio tetraedrico del secondo
passaggio
O
CH2
+
- C O CH2
O
H
C
CH3
CH3
2
OC
CH2
H3C
O
CH3
O CH
H2C
2
C
CH3
O
O
CH2
O
CH3
+
C
H3C
H2C
O
C
O
CH2
CH3
49. Diapositiva 49
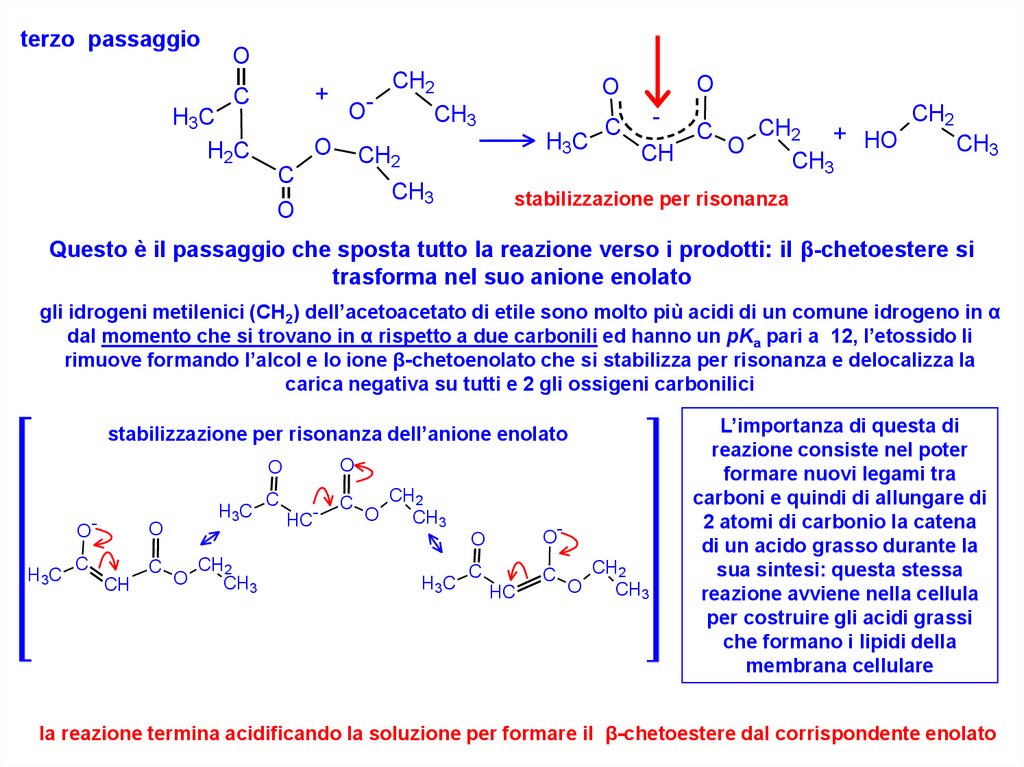
terzo passaggioO
+
C
H3C
H2C
CH2
OCH3
O
H3C
CH2
C
CH3
O
O
O
-
C
CH
C
CH2 +
HO
O
CH3
CH2
CH3
stabilizzazione per risonanza
Questo è il passaggio che sposta tutto la reazione verso i prodotti: il β-chetoestere si
trasforma nel suo anione enolato
gli idrogeni metilenici (CH2) dell’acetoacetato di etile sono molto più acidi di un comune idrogeno in α
dal momento che si trovano in α rispetto a due carbonili ed hanno un pKa pari a 12, l’etossido li
rimuove formando l’alcol e lo ione β-chetoenolato che si stabilizza per risonanza e delocalizza la
carica negativa su tutti e 2 gli ossigeni carbonilici
stabilizzazione per risonanza dell’anione enolato
O
O
OH3C
H3C
O
C
C
CH
O
CH2
CH3
C
HC-
C
O
CH2
CH3
H3C
O
O-
C
C
HC
CH2
O
CH3
L’importanza di questa di
reazione consiste nel poter
formare nuovi legami tra
carboni e quindi di allungare di
2 atomi di carbonio la catena
di un acido grasso durante la
sua sintesi: questa stessa
reazione avviene nella cellula
per costruire gli acidi grassi
che formano i lipidi della
membrana cellulare
la reazione termina acidificando la soluzione per formare il β-chetoestere dal corrispondente enolato





 Химия
Химия


