Похожие презентации:
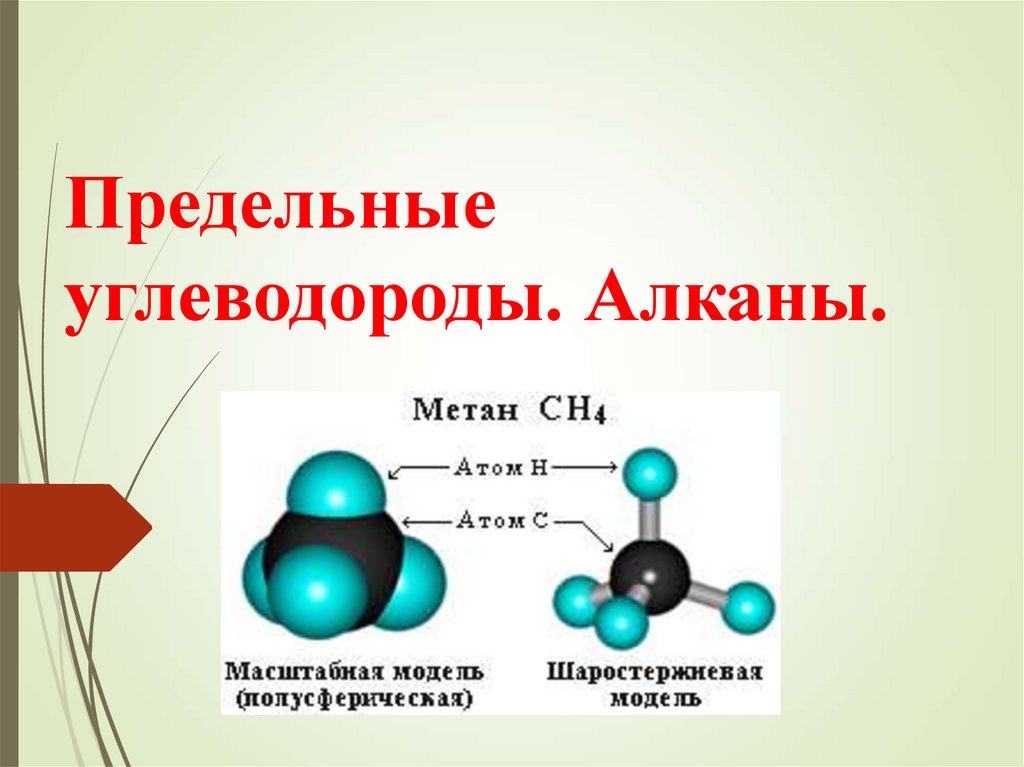
Предельные углеводороды. Алканы
1. Предельные углеводороды. Алканы.
2. Алканы
Алканы – предельные углеводороды, в молекулахкоторых все атомы связаны одинарными связями.
CnH2n+2
Насыщенные потому что каждый атом
углерода С образовывает четыре ковалентных
связи, что является максимальным пределом
для углерода(углерод насыщен, больше не
имеет возможности образовать связи)
3.
Физические свойства алканов4.
5.
6.
7.
8.
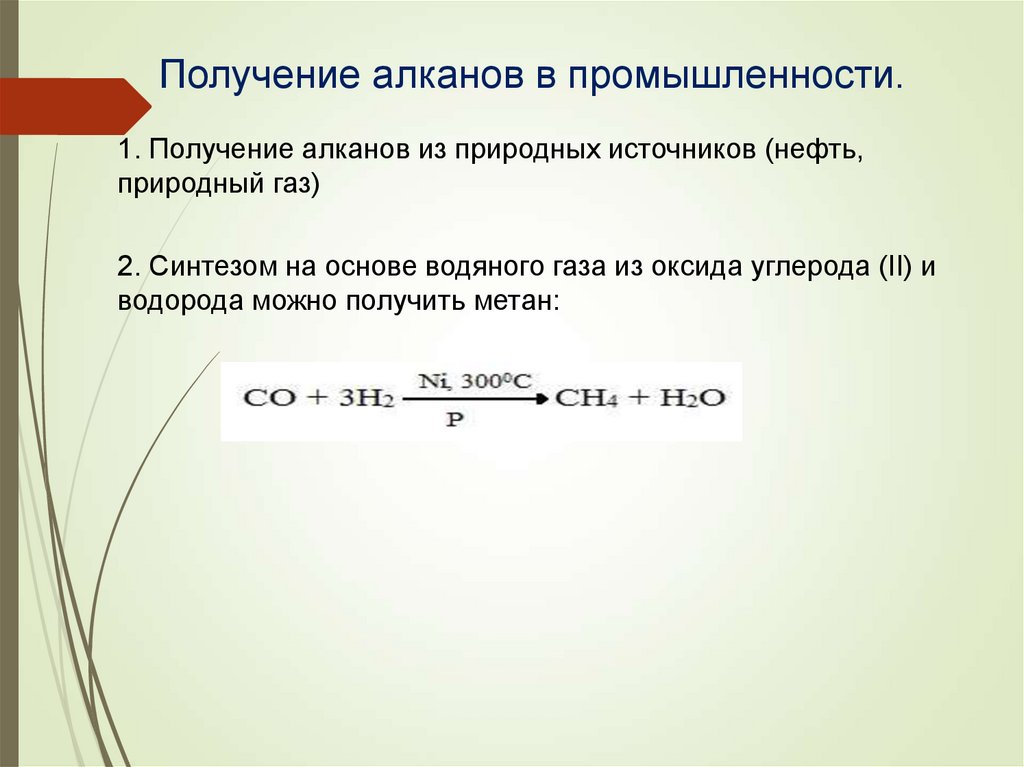
Получение алканов в промышленности.1. Получение алканов из природных источников (нефть,
природный газ)
2. Синтезом на основе водяного газа из оксида углерода (II) и
водорода можно получить метан:
9.
Получение алканов в лаборатории1. В лабораторных условиях алканы получают
гидрированием ненасыщенных углеводородовв присутствии
катализаторов Ni, Pt, Pd:
CH2 = CH2 + H2 → H3C – CH3
2. На галогенопроизводные алканов действуют металлическим
натрием – по реакции Вюрца получают алканы:
CH3Cl + 2 Na+ClCH3 → CH3 – CH3 + 2NaCl
3. Алканы можно получить гидрированием угля.
Реакция протекает при температуре 500°С и присутствии
катализатора (оксида железа):
C + 2H2 → CH4
4. В лаборатории получают метан путем плавления ацетата
натрия (соль уксусной кислоты) с гидроксидом натрия:
t
СН3СООNа + NаОН → СН4 + Nа2СО3
10.
Химические свойства алкановАлканы вступают в реакцию замещения, разложения и
окисления.
Реакции замещения
1. Реакция галогенирования:
11.
Химические свойства алканов2.Реакция разложения
(Пиролиз)
При нагревании алканы подвергаются термическому
разложению. При сильном нагревании метана (до 1000ºC) без
доступа воздуха он разлагается на простые вещества:
t
СН4 → С + 2Н2
3. Реакция окисления.
Реакции горения
При поджигании на воздухе алканы воспламеняются и горят.
При достаточном количестве кислорода они горят с
образованием окиси углерода(IV) и воды и выделением тепла:
СН4 + 2О2 → СО2 + 2Н2О
12.
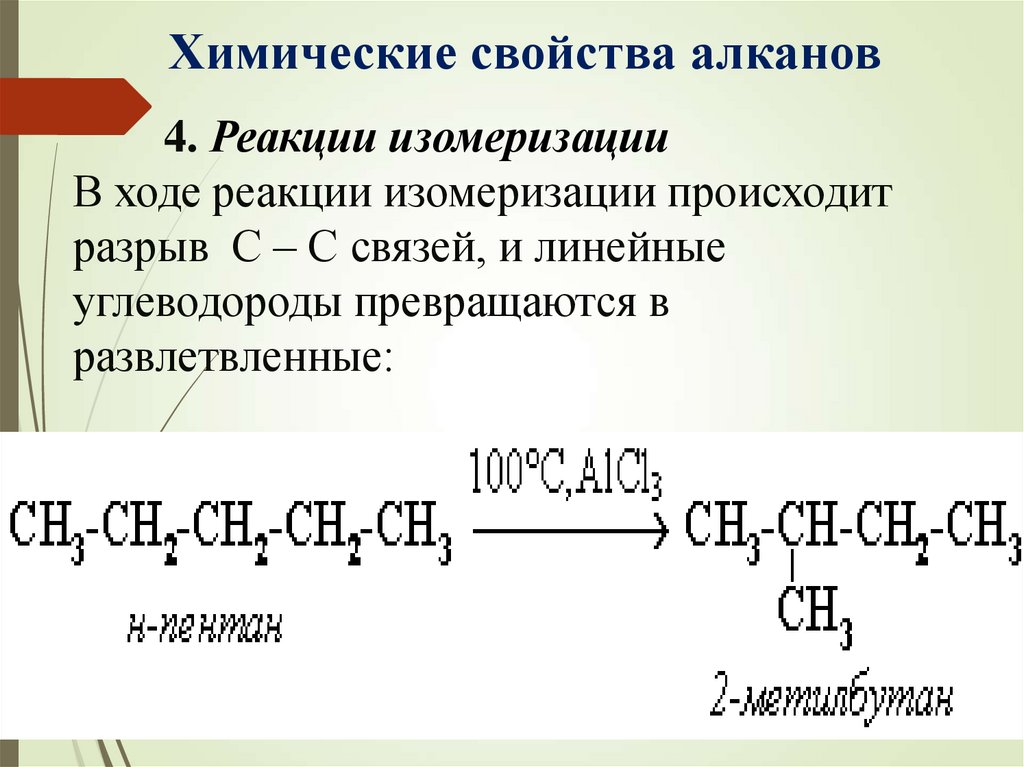
Химические свойства алканов4. Реакции изомеризации
В ходе реакции изомеризации происходит
разрыв С – С связей, и линейные
углеводороды превращаются в
развлетвленные:









 Химия
Химия








