Похожие презентации:
Кремний и его соединения. Строение атома
1.
«Кремний и его соединения»2.
3. Строение атома
1) Перечислите элементы IV группы.2) Охарактеризуйте кремний по положению в
ПСХЭ Д.И. Менделеева.
3) Составьте электронные формулу и схему
строения атома кремния.
4) Назовите возможные степени окисления
кремния.
4.
5) Напишите формулу высшего оксида игидроксида кремния, укажите их
характер.
6) Напишите формулу летучего
водородного соединения кремния.
7) У какого элемента сильнее выражены
неметаллические свойства:
а) углерод, кремний;
б) фосфор, кремний, алюминий?
5.
Строение атома кремния6. Строение атома
Положение в ПСХЭ Д.И. Менделеева: 3 IV АЗаряд ядра: +14
Относительная атомная масса: Ar (Si) = 28
Строение атома: p =14, e =14, n = 28 - 14 =14
Электронная формула: Si 1s2 2s2 2p6 3s2 3p2
Si +14 2e, 8e, 4e
Неметалл.
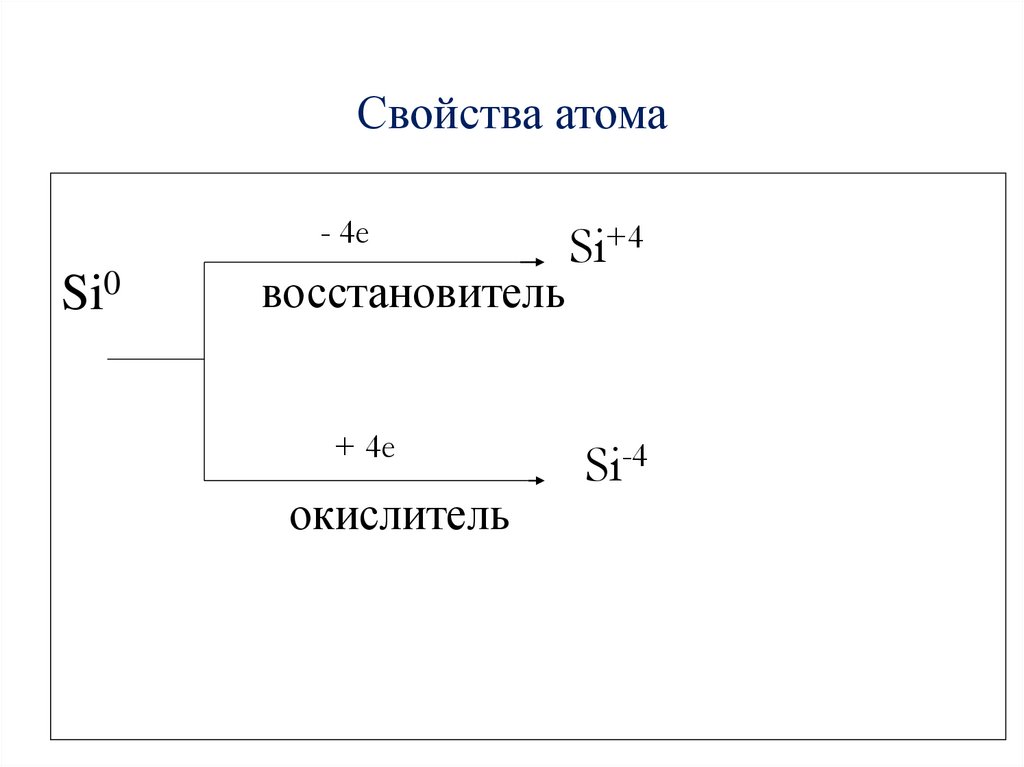
7. Свойства атома
- 4еSi0
восстановитель
+ 4е
окислитель
Si+4
Si-4
8. Кремний – простое вещество
Аллотропные модификации•Кристаллический – темно-серое со
стальным блеском вещество, хрупок,
полупроводник.
•Аморфный – порошок бурого цвета,
реакционно способнее
кристаллического.
9. Кремний в природе
Кремний в свободномвиде в природе не
встречается.
Кремний – второй по
распространенности
элемент ПСХЭ.
В природе встречается в
виде кремнезема (SiO2),
силикатов и
алюмосиликатов.
10. Кремень
Кремень, именно этот невзрачный и очень прочныйкамень, положил начало каменному веку – веку
кремневых орудий труда.
Причин две:
- распространенность и доступность кремния;
- способность образовывать при сколе острые режущие
края;
11. Разновидности минералов на основе оксида кремния
АгатКошачий
глаз
Горный
хрусталь
Аметист
Кварц
Цитрин
Яшма
Опал
Сердолик
12.
Интересные фактыЕщё древние греки связывали с яшмой возможность
противодействовать ядам и исцеляться от всех недугов. Так,
Византийский император Мануил подарил монастырю на
Афонской горе чашу из яшмы, которая, по преданию,
противодействовала ядам и исцеляла от всех болезней.
Талисман из яшмы дарует мудрость, силу предвидения и
твёрдость духа; способствует выравниванию отношений на
работе, с начальством.
Символическое значение: храбрость.
Лечебные эффекты (литотерапия): яшма оранжевых оттенков дневные, высокоэнергетичные камни, камни-лекари с широким
спектром деятельности. Кровавая яшма обладает огромным
кровоочистительным потенциалом, останавливает кровь при
кровотечениях, заживляет раны.
Яшма укрепляет сердце, зрение, желудок.
13. Знаете ли вы, что…
В чистом виде кремний был выделенв 1811 году французскими учеными:
Жозеф Луи Гей-Люссак
Луи Жаком Тенор
14. Знаете ли вы, что..
Кремний вэлементарном состоянии
был впервые получен в
1825 году шведским
химиком Йенсом
Якобсом Берцелиусом
15. Знаете ли вы, что…
Русское название «кремний»введено в 1834 г.
российским химиком
Германом Ивановичем
Гессом.
16. Знаете ли вы, что..
Способ получения кремнияв чистом виде разработан
Николаем Николаевичем
Бекетовым.
Кремний в России производится
на заводах:
г. Каменск - Уральский (Свердловская область)
г. Шелех (Иркутская область).
17. Получение кремния
Впромышленности кремний получают
восстанавливая расплав SiO2 коксом при
t = 18000C в дуговых печах. Чистота полученного таким образом
кремния составляет 99,9 %.
18. Получение кремния
Лабораторный способ получения:SiO2 + 2 Mg 2MgO + Si
19.
ХС схожи со свойствами углерода:реагирует с металлами Mg + Si → Mg2Si
горит в кислороде Si + О2 → SiО2
прямо не реагирует с водородом
(получаютсилан косвенно):
• Mg2Si + H2O → Mg(OH)2 + SiH4↑
• Mg2Si + HCl → MgCl2 + SiH4↑
•4) взаимодействует с растворами щелочей
•Si + NaOH + H2O → Na2SiO3 + H2↑
20.
Химически кремний малоактивен.При комнатной температуре реагирует
только c фтором, с другими галогенами
при нагревании:
Si + 2F2→ SiF4
Si + 2Cl2→ SiCl4
21.
При нагревании до 400 – 5000кремний реагирует с кислородом с
образованием диоксида кремния:
Si + O2 → SiO2
22.
При взаимодействии с металлами кремнийпроявляет себя как окислитель,
образуются силициды.
2Са + Si → Ca2Si
Кремний легко растворяется в щелочах.
NaOH (изб.) + Si + H2О → Na2SiO3 + H2
23.
С водородом кремний непосредственно нереагирует.
Водородное соединение силан, получают
косвенным способом, в реакции
силицидов с кислотами
Ca2Si + 4HCl → 2CaCl2 + SiH4↑
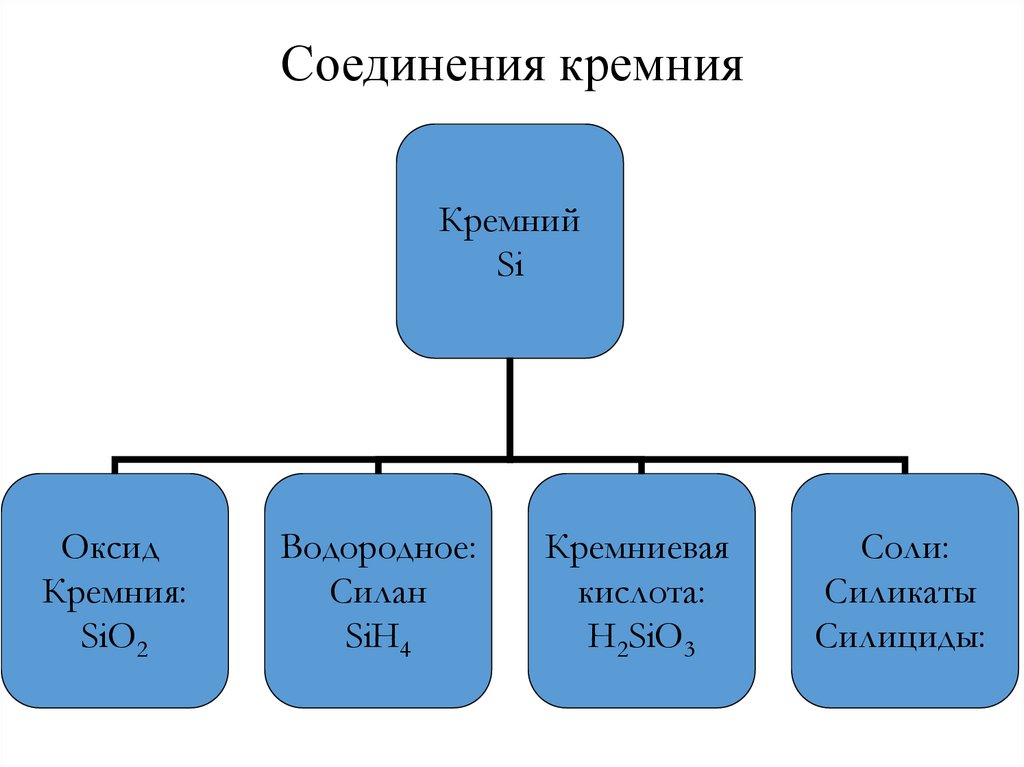
24. Соединения кремния
КремнийSi
Оксид
Кремния:
SiO2
Водородное:
Силан
SiH4
Кремниевая
кислота:
H2SiO3
Соли:
Силикаты
Силициды:
25.
СО2SiO2
Кислотный оксид
Молекулярная
Атомная
кристаллическая решетка кристаллическая решетка
Бесцветный газ.
Кристаллическое, твердое
вещество, тугоплавкое.
Химические свойства
H2O + CO2 = H2CO3
Не взаимодействует
CO2 + CaO = CaCO3
SiO2 + CaO = CaSiO3
CO2 + Ca(OH)2 = CaCO3 + SiO2 + 2NaOH = Na2SiO3 +
H2O
H2O
CO2 + 2Mg = 2MgO + C
SiO2 + 2Mg = 2MgO + Si
C + CO2 = 2CO
SiO2 + 2C = Si + 2CO
26.
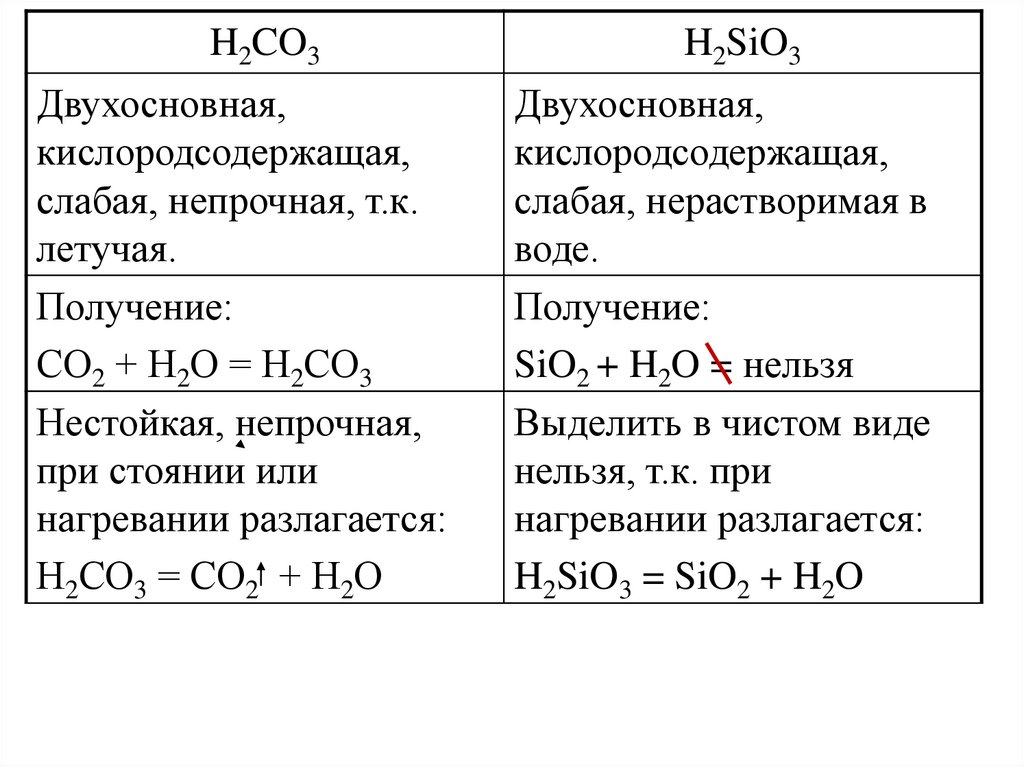
H2CO3H2SiO3
Двухосновная,
кислородсодержащая,
слабая, непрочная, т.к.
летучая.
Получение:
СО2 + Н2О = Н2СО3
Нестойкая, непрочная,
при стоянии или
нагревании разлагается:
Н2СО3 = СО2 + Н2О
Двухосновная,
кислородсодержащая,
слабая, нерастворимая в
воде.
Получение:
SiO2 + H2O = нельзя
Выделить в чистом виде
нельзя, т.к. при
нагревании разлагается:
H2SiO3 = SiO2 + H2O
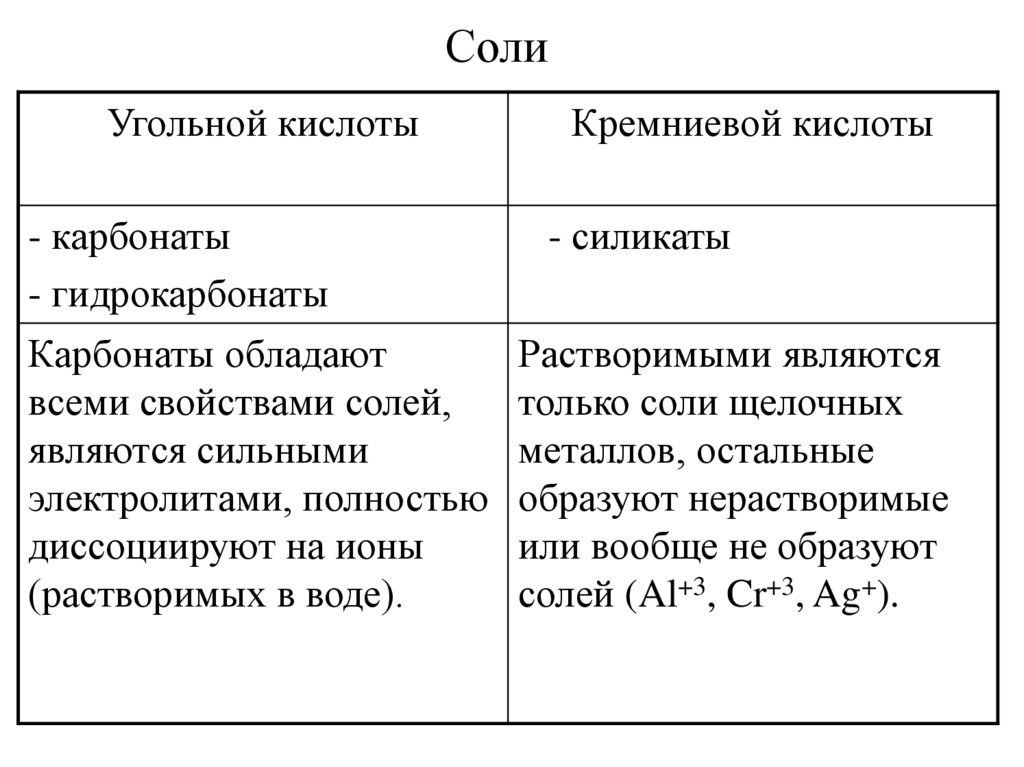
27. Соли
Угольной кислоты- карбонаты
- гидрокарбонаты
Карбонаты обладают
всеми свойствами солей,
являются сильными
электролитами, полностью
диссоциируют на ионы
(растворимых в воде).
Кремниевой кислоты
- силикаты
Растворимыми являются
только соли щелочных
металлов, остальные
образуют нерастворимые
или вообще не образуют
солей (Al+3, Cr+3, Ag+).
28. Применение кремния и его соединений
СтеклоЦемент
Кирпич
Фарфор
Керамика
Фаянс
Клей
Асбест
Силикон
Гранит
29. Применение кремния в технике
30. Применение кремния в медицине
31. Биологическая роль
Важнейшее соединение кремния – SiO2 необходимдля жизни растений и животных.
Благодаря ему тростники, камыши и хвощи стоят
крепко, как тыки. Oстрые листья осоки режут,
как ножи, стерня на скошенном поле
колет, как иголки, а стебли злаков настолько
крепки, что не позволяют ниве на полях ложиться
от дождя и ветра.
32. Биологическая роль
Чешуя рыб, панцири насекомых, крыльябабочек, перья птиц и шерсть животных
прочны, так как содержат кремнезем.
33. Биологическая роль
Кремний придаёт гладкость и прочностькостям и кровеносным сосудам человека.
В организме человека кремния менее 0,01% по весу.
34.
Кремний - микроэлемент, постоянно содержащийся ворганизме человека. Наибольшее его количество
содержится в лимфоузлах, соединительной ткани аорты,
трахеи, в волосах и коже. Кремний необходим для
построения эпителиальных клеток.
Кремний играет важную роль в процессе минерализации
костной ткани; необходим для поддержания эластичности
стенки артерий, оказывает положительное влияние на
иммунитет и замедляет процессы старения в тканях
организма человека.
Среднее содержание кремния в крови составляет 8,25
мг/сутки. С возрастом его уровень в организме снижается,
поэтому у пожилых людей потребность в кремнии, как
правило, повышается. Улучшают усвоение кремния
организмом наличие кальция, магния, марганца и калия.
35. Биологическая роль
Кремний входит и в состав низших живыхорганизмов – диатомовых водорослей и
радиолярий, - нежнейших комочков живой
материи, которые создают свои
непревзойденные по красоте скелеты из
кремнезема.
Диатомовые водоросли
Радиолярии
36. Кремний в продуктах питания
37. Самоконтроль
1. Какое место занимает кремний впериодической системе
а) 2 IV B б) 3 III A в) 3 IV A
2. Кристаллическая решетка кремния
а) ионная
б) атомная в) молекулярная
3. По распространенности в природе кремний ….
элемент
а) первый
б) второй в) третий
38. Самоконтроль
4. Кремний вступает в реакцию с:а) металлами, водородом, галогенами;
б) металлами, галогенами, легко растворяется в
щелочах;
в) оксидами, кислотами, неметаллами.
5. Соли кремниевой кислоты:
а) силициды;
б) гидросиликаты;
в) силикаты;


































 Химия
Химия








