Похожие презентации:
Протолитические (кислотно-основные) равновесия и процессы. Теории кислот и оснований
1.
ЛекцияПротолитические (кислотноосновные) равновесия и
процессы.
Теории кислот и оснований
1
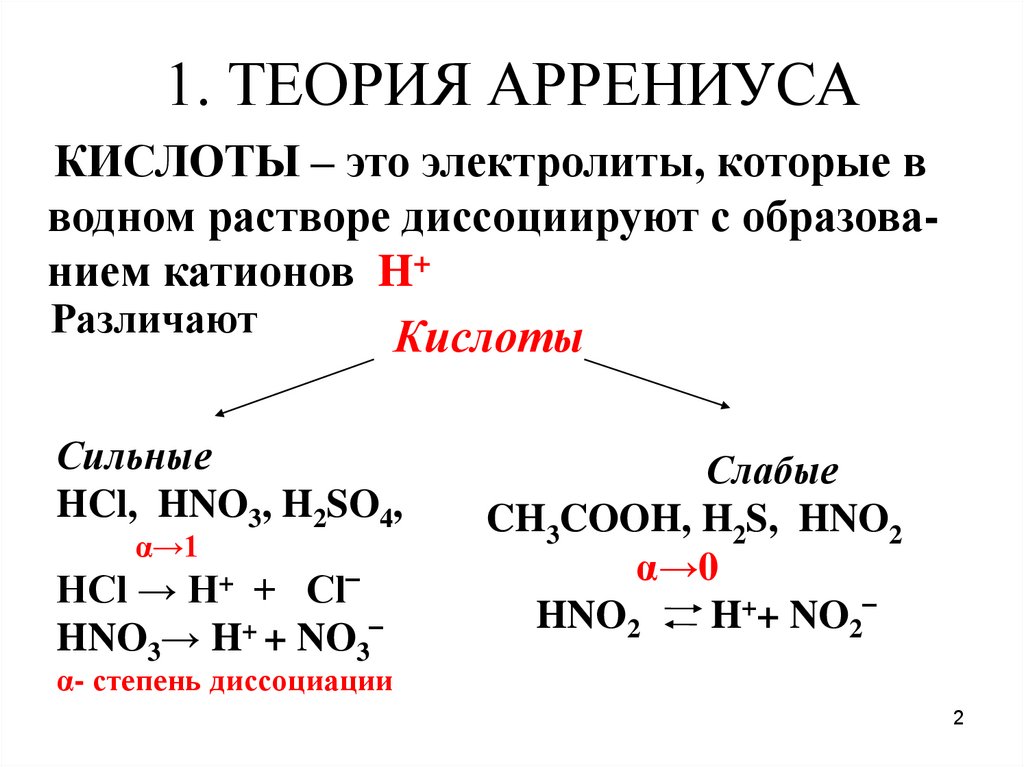
2. 1. ТЕОРИЯ АРРЕНИУСА
КИСЛОТЫ – это электролиты, которые вводном растворе диссоциируют с образованием катионов H+
Различают
Кислоты
Сильные
HCl, HNO3, H2SO4,
α→1
HCl → H+ + Cl‾
HNO3→ H+ + NO3‾
Слабые
CH3COOH, H2S, HNO2
α→0
HNO2
H++ NO2‾
α- степень диссоциации
2
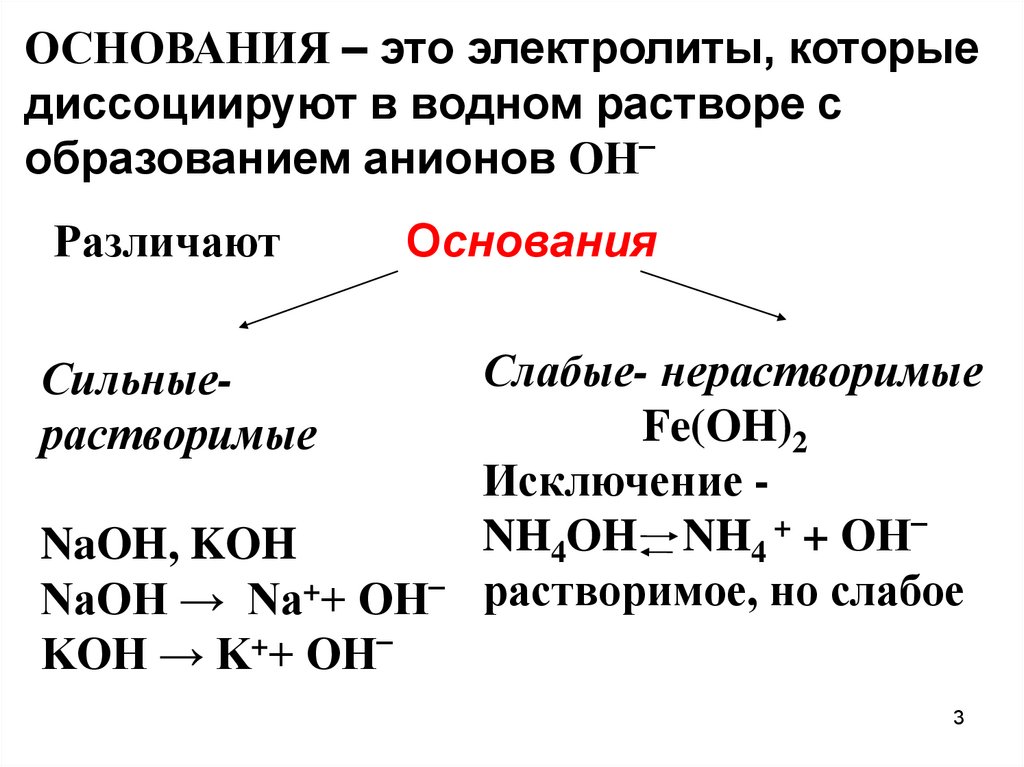
3.
ОСНОВАНИЯ – это электролиты, которыедиссоциируют в водном растворе с
образованием анионов OH‾
Различают
Основания
Слабые- нерастворимые
Fe(OH)2
Исключение + + OH‾
NH
OH
NH
NaOH, KOH
4
4
NaOH → Na++ OH‾ растворимое, но слабое
KOH → K++ OH‾
Сильныерастворимые
3
4.
2. Протолитическая теория Брендстеда и ЛоуриКислоты - доноры
протонов, отдают H+
Молек-е
H2S, H2O,
NH3,
C2H5OH
Ионные
1. анионные
HS‾, HSO4‾
2. катионные
H3O+ , NH4+
Основания - акцепторы
протонов, принимают H+
Молек-е
H2O:
:NH3
C2H5OH
Анионные
HS‾
S2‾
HSO4‾
Те соединения, которые встречаются
одновременно и в кислотах и в основаниях – это
амфолиты - вещества способные проявлять как
кислотные так и основные свойства. Наиболее
важные в организме амфолиты это аминокислоты.4
5.
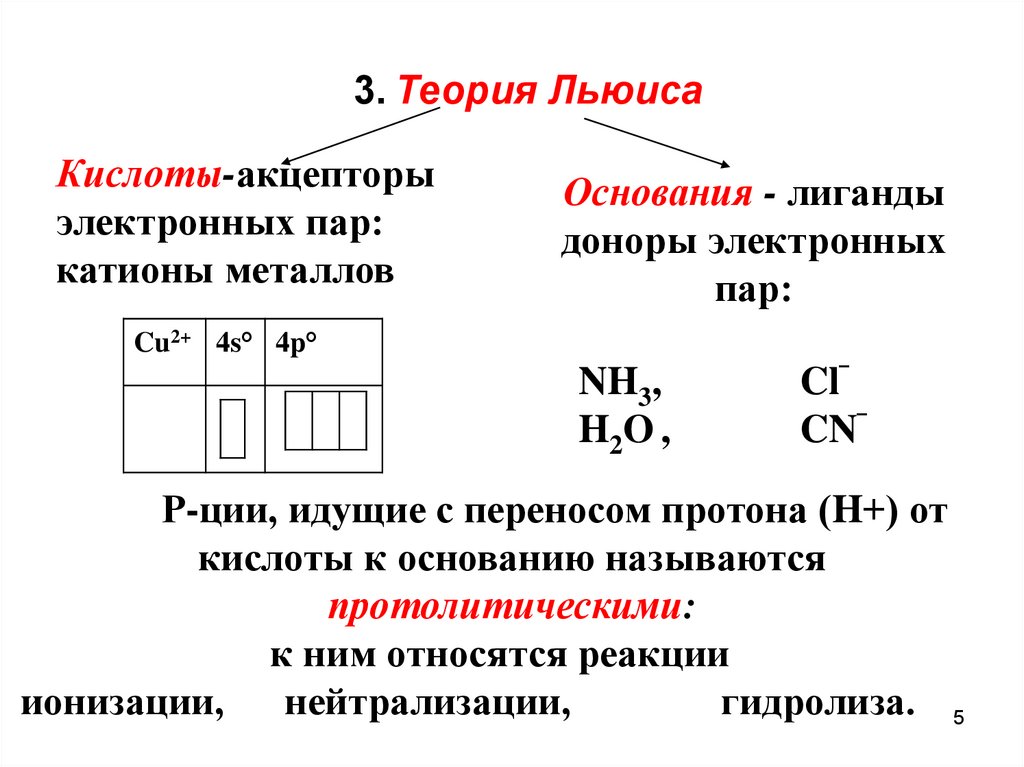
3. Теория ЛьюисаКислоты-акцепторы
электронных пар:
катионы металлов
Основания - лиганды
доноры электронных
пар:
Cu2+ 4s° 4p°
NH3,
H2O ,
Cl‾
CN‾
Р-ции, идущие с переносом протона (H+) от
кислоты к основанию называются
протолитическими:
к ним относятся реакции
ионизации,
нейтрализации,
гидролиза. 5
6.
Реакции ионизации1. Автопротолиз (самоионизация) воды возможен, так как вода
это амфолит.
H2 O + H2 O
OH‾ + H3O+
к-та
осн-е
осн-е
к-та
слабые
сильные сопряженные
Можно написать проще
H2 O
H+ + OH‾
Это обратимый процесс, значит его описывает константа
равновесия
[H ]·[OH ]
Кд
[ H 2 O]
тогда , перенесем её влево и получим новую постоянную
величину
Кр·[H2O] = [H+ ] · [ OH‾ ]
Кв = [H+ ]·[ OH‾ ] ионное произведение воды
6
7.
При 25°C Кв = 10-14, так как из10 млн молекул воды только одна распадается на ионы. В 1 л воды
[H+ ]=[ OH¯]=10-7 моль/л.
7
8.
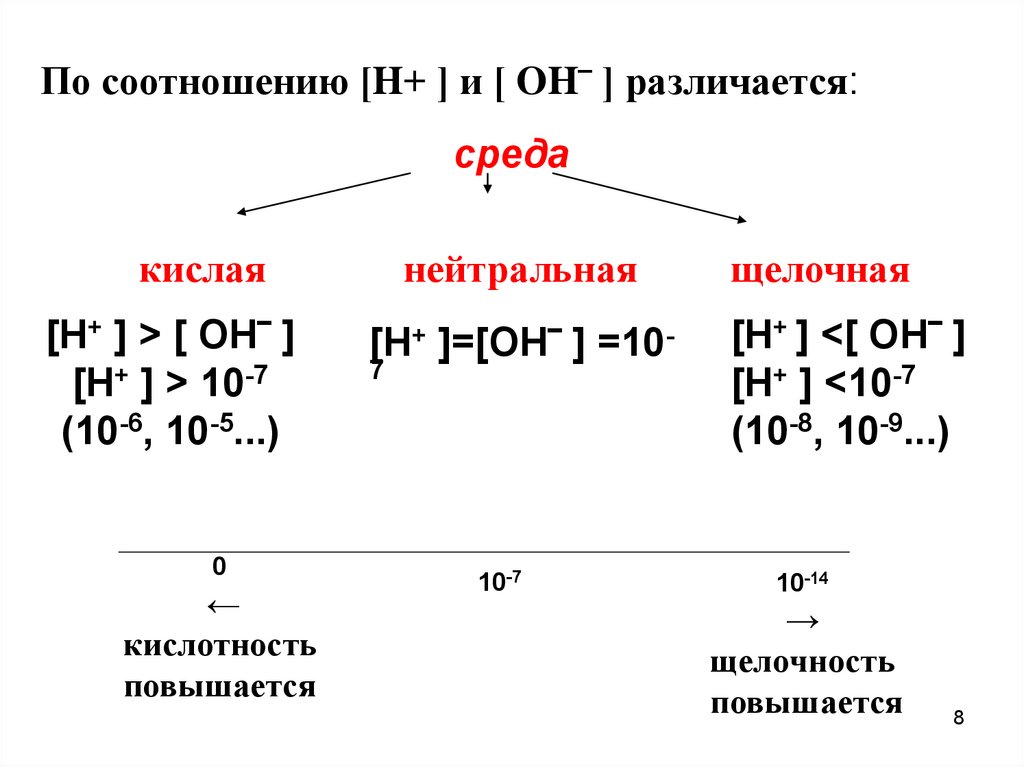
По соотношению [H+ ] и [ OH‾ ] различается:среда
кислая
[H+ ] > [ OH‾ ]
[H+ ] > 10-7
(10-6, 10-5...)
0
←
кислотность
повышается
нейтральная
[H+ ]=[OH‾ ] =107
10-7
щелочная
[H+ ] <[ OH‾ ]
[H+ ] <10-7
(10-8, 10-9...)
10-14
→
щелочность
повышается
8
9.
Кв, [H+ ] и [ OH-] - очень маленькие величины,поэтому чаще используют показатели этих чисел
pX= -lgX, а именно:
pH= - lg [H+] ,
pOH= - lg [OH‾],
pK= -lg10-14=14,
где p -это показатель концентрации ионов
/
0
7
14
кисл
HCI
нейтр.
H2O
щелоч.
NaOH
9
10.
Ионизация – это взаимод-е слабых элект-в смолекулами воды с образованием ионов, при этом
вода выполняет свойства кислоты или основания.
Ионизация слабой кислоты, например
уксусной, идет только в присутствии воды:
CH3COOH + H2O
..
к-та
осн-е
слабые
CH3COO‾ + H3O+
осн-е
к-та
сопряженные сильные
Это обратимый процесс, в котором устанавливается
подвижное равновесие в двух кислотно-основных
парах:
CH3COOH / CH3COO‾
H3O+ / H2O
К / О пара
К / О пара 10
11.
Равновесие в этих парах всегда смещено всторону образования слабых кислот и оснований.
Напишем процесс проще:
CH3COOH
CH3COO‾
+
H+
[H+] [ CH3COO‾ ]
Kд =
[CH3COOH]
Это константа диссоциации слабой кислоты.
11
12.
Уравнение ОствальдаОписывает связь между степенью диссоциации (α),
концентрацией C и константой диссоциации Kд :
C α2
K=
1- α
если электролит очень слабый, то α→0
и в знаменателе им
можно пренебречь, тогда получим
К = Cα2
α2 = К / С
α = √ К/С
Это т.н. закон разведения ОСТВАЛЬДА
12
13.
Ионизация слабых оснований также идет только вприсутствии растворителя - воды:
NH3
+ H2O
NH4+ + OH‾
осн-е
к-та
к-та
осн-е
слабые
сильные сопряженные
Между кислотно-основными парами
NH4+ / NH3
и
H2O / OH ‾
устанавливается подвижное равновесие,
характеризующееся
Kравновесия называемой здесь константой основности:
NH4+ +
NH4OH
OH‾
[NH4+] [ OH ‾ ]
Kp
=
[NH4OH]
13
14. Типичные случаи гидролиза солей
Гидролиз это взаимодействие ионов солис молекулами воды идущий с образованием
слабых электролитов и при этом часто
изменяется реакция среды (pH).
14
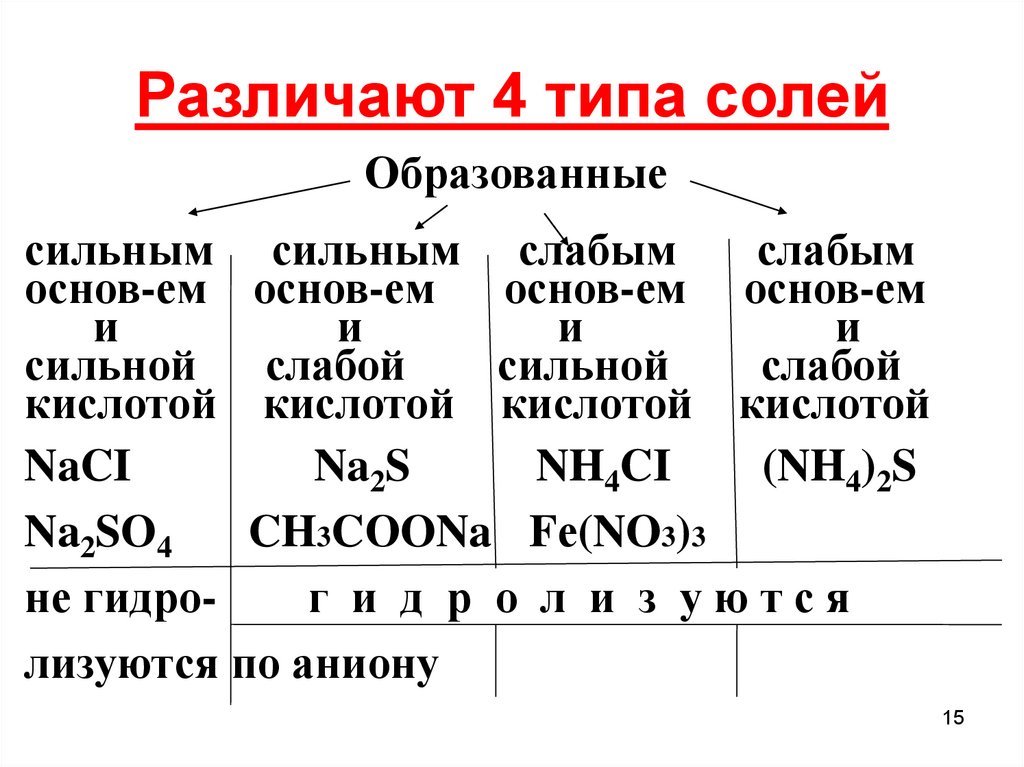
15. Различают 4 типа солей
Образованныесильным сильным слабым
слабым
основ-ем основ-ем основ-ем основ-ем
и
и
и
и
сильной слабой
сильной
слабой
кислотой кислотой кислотой кислотой
NaCI
Na2S
NH4CI
(NH4)2S
Na2SO4
CH3CОONa Fе(NO3)3
не гидрог и д р о л и з уются
лизуются по аниону
15
16.
1.Дана соль натрия карбонат: а) формула соли Na2CO3,б) тип соли: образованная сильным основанием (NaOH)
и слабой кислотой (H2CO3)
в) гидролиз записывается так:
в воде любая растворимая соль диссоциирует – т.к. это
сильный электролит
Na2CO3 → 2Na+ + CO32гидролиз идет по аниону
CO32- + HOH
HCO3¯ +OH¯
краткое ионное ур-е
2Na++CO32-+H2O
HCO3 ¯ + OH¯ + 2Na+
полное ионное ур-е
Na2CO3+H2O = NaHCO3+ NaOH
молекулярное ур-ние
В результате р-ции среда становится щелочной.
г) константа гидролиза вычисляется
Kг= Kв / KH2CO3 = 10-14 / табличная величина
д) pH раствора вычисляется по формуле
pH= 7+½ pKH2CO3 +½ lg [Na2CO3]
16
17.
2. Дана соль меди (II) нитрат:а) формула соли Cu(NO3)2
б) образованная слаб. основ-ем Cu(OH)2 и сильн. к-той
HNO3
в) гидролиз записывается так:
в воде любая растворимая соль диссоциирует
Cu(NO3)2 → Cu2+ +2NO3¯
гидролиз идет по катиону
Cu2+ + HOH
CuOH+ + H+
краткое ионное ур-е
CuOH++H++2NO3¯
2NO3¯ + Cu2+ + H2O полное ионное ур-е
Cu(NO3)2+ H2O = CuOHNO3+ HNO3
г) константа гидролиза
Kг = Kводы / KCu(OH)2 = 10-14
молекулярное ур-е
/ из таблиц
д) pH= 7-½ pKCu(OH)2 - ½ lg [Cu(NO3)2]
17
18.
3. Дана соль аммония сульфид: а) формула соли (NH4)2Sб) образованная слаб. основанием NH4OH и слабой
кислотой H2S
в) гидролиз записывается так: в воде любая
растворимая соль- сильный электролит - диссоциирует:
(NH4)2S → 2NH4+ + S2гидрализуется по обоим ионам
2 NH4+ + 2HOH + S2-→ 2NH4OH+ H2S полное ионное ур-е
(NH4)2S+2H2O → 2NH4OH+ Н2S
молекулярное ур-ние
г) константа гидролиза Kг = KH2O / K NH4OH · KH2S
д) pH= 7 + ½ pKH2S - ½ pKNH4OH
18
19.
Такие соли гидролизуются оченьсильно, до конца, с большой скоростью, в
то время как гидролиз предыдущих солей
заканчивался на 1й стадии, т.е.
+1 молекула H2O.
19
20.
Влияние температуры:Так как реакция нейтрализации экзотермична
(ΔHo = -56,5 кДж/моль), то противоположный ей процесс
гидролиза является эндотермическим. Энергия необходимая
для гидролиза образуется в результате гидратации при
растворении сухих солей и её достаточно только для
протекания первой стадии гидролиза.
В соответствии с принципом
ЛеШателье
с повышением температуры
степень гидролиза растет.
20
21.
Добавление кислот и щелочей.Если при обратимом гидролизе в растворе
накапливаются ионы Н+, то в соответствии с
принципом Ле Шателье процесс подавляется при
подкислении и усиливается при подщелачивании.
При накапливании ионов ОН¯ гидролиз
подавляется при подщелачивании и усиливается
при подкислении.
Разбавление раствора увеличивает степень
гидролиза
21
22.
Гидролиз будет необратимым, если какое-либоиз образующихся в процессе гидролиза веществ
выделяется в осадок или улетучивание в виде
газа. Это, приведет к полному разложению соли
водой:
Al 2S3 6H 2O 2Al(OH) 3 3H 2S
2AlCl 3 3Na 2CO3 3H 2O 2Al(OH) 3 3CO2 6 NaCl
или
2Al3 3CO32- 3H 2O 2Al(OH) 3 3CO2
22
23.
Роль гидролиза биоорганических соединенийв процессах жизнедеятельности
1. Каждый из ферментов активен при строго
определенных значениях рН:
пепсин желудочного сока активен при рН 1,5–2,0,
каталаза крови – при рН 7,0;
2. Ионы водорода катализируют гидролиз
сложных жиров, сахарозы.
23
24.
3. Без ферментативного гидролиза невозможноусвоение жиров, углеводов, белков, так как
всасываться в кишечнике способны только
относительно небольшие молекулы.
Усвоение полисахаридов и дисахаридов
становится возможным лишь после полного
их гидролиза ферментами до моносахаридов.
Белки гидролизуются до аминокислот
которые лишь потом могут усваиваться.
24
25.
4. Гидролиз АТФ - источник энергии в организмеЧеловек получает энергию как за счет многостадийного
процесса окисления пищи — белков, жиров и углеводов,
так и за счет гидролиза некоторых сложных эфиров,
амидов, пептидов и гликозидов.
Эта же энергия поддерживает
жизнь и в клетках нашего тела.
В них реакция окисления
протекает поэтапно. Кроме того,
сначала вместо тепловой и
кинетической энергии наши
клетки создают клеточное
«топливо» — АТФ.
25
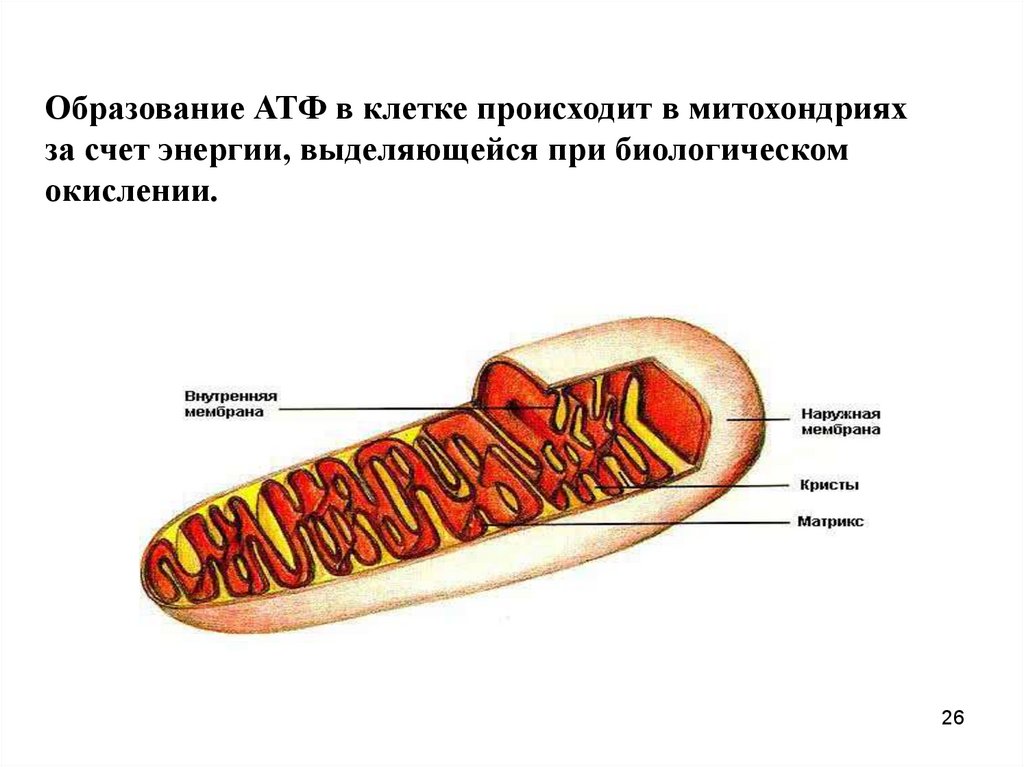
26. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
2627.
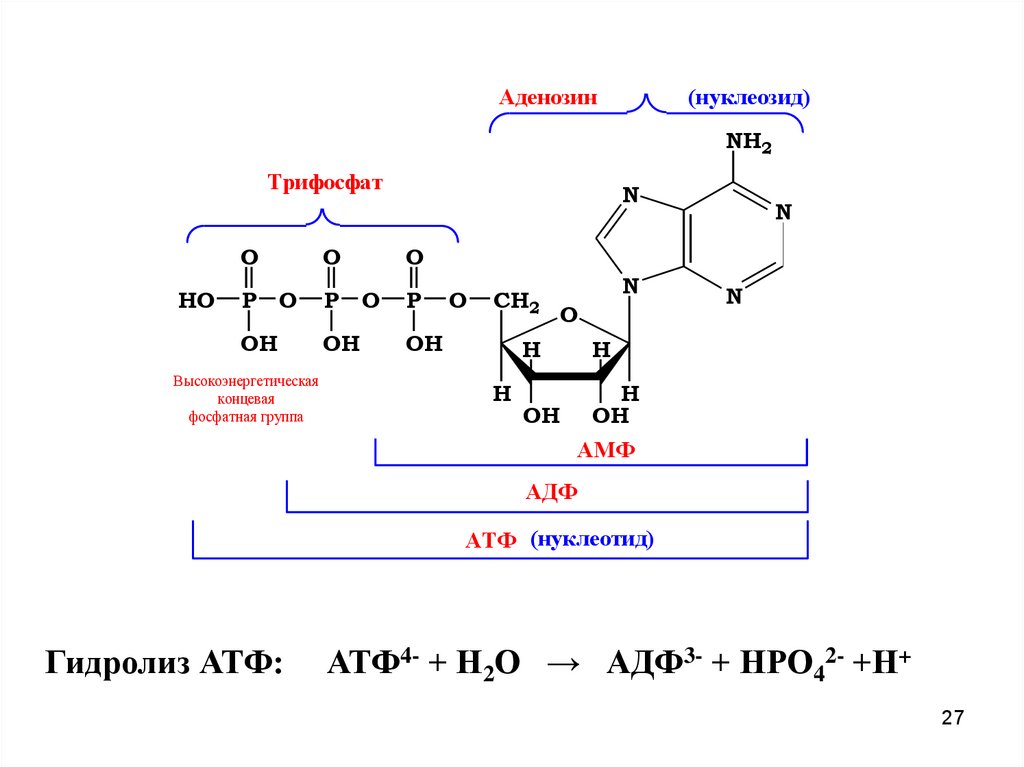
Аденозин(нуклеозид)
NH2
Трифосфат
HO
N
O
O
O
P O
P O
P
OH
OH
OH
Высокоэнергетическая
концевая
фосфатная группа
O
CH2
H
N
O
H
H
OH
H
OH
N
N
АМФ
АДФ
АТФ (нуклеотид)
Гидролиз АТФ:
АТФ4- + Н2О → АДФ3- + НРО42- +Н+
27
28.
5. Гидролиз –один из важнейших путей метаболизмалекарственных препаратов и пищевых продуктов
Процесс гидролиза может идти:
В плазме крови
На клеточных мембранах
В цитоплазме клеток
Во внутренних органеллах, в
частности в лизосомах
28
29.
Большинство лекарственных веществметаболизируются в печени, располагающей для
этого набором ферментных систем весьма большой
мощности.
Эти ферментные системы локализованы либо в
митохондриях, либо в микросомах, либо в
гиалоплазме.
29
30.
Гидролиз ацетилсалициловой кислоты (аспирина)O
C
H+
O
C
O
H2O
OH
OH + CH3
O
C
OH
COOH CH
3
30
31.
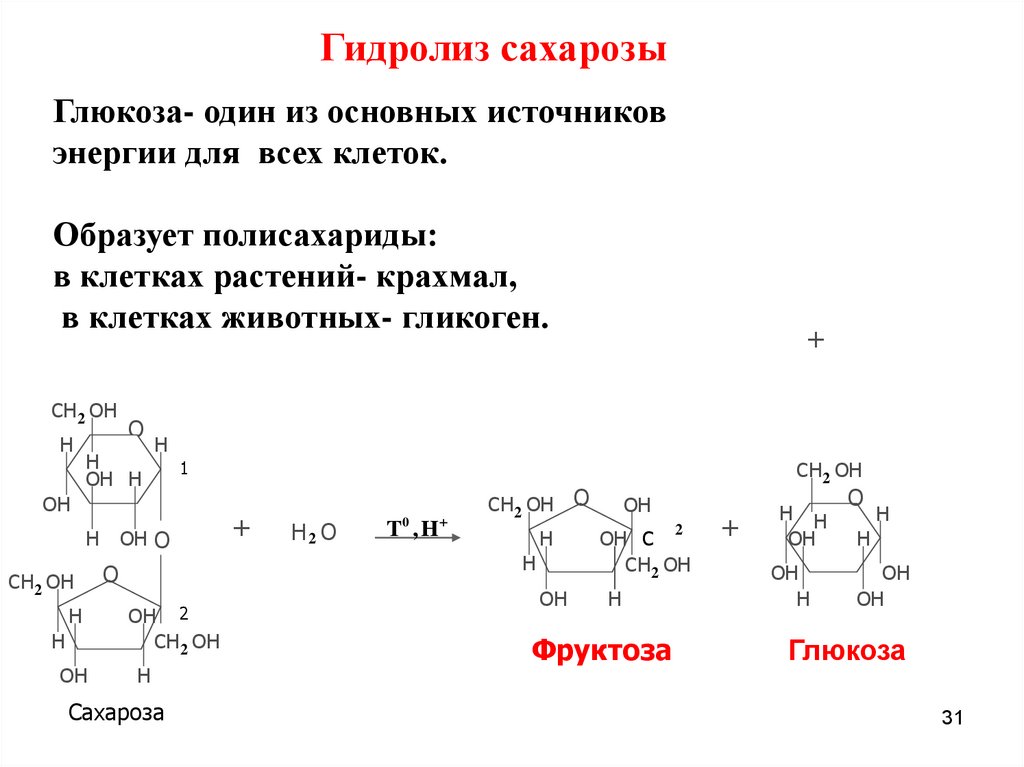
Гидролиз сахарозыГлюкоза- один из основных источников
энергии для всех клеток.
Образует полисахариды:
в клетках растений- крахмал,
в клетках животных- гликоген.
CH 2 OH
H
О
H
OH H
H
1
OH
H
CH 2 OH
H
+
OH О
О
H
OH 2
CH 2 OH
OH
H
Сахароза
+
H2 O
T0 , H
CH 2 OH
CH 2 OH О
H
H
OH
OH
2
OH С
CH 2 OH
H
Фруктоза
+
H H
OH
OH
H
О
H
H
OH
OH
Глюкоза
31























 Химия
Химия








