Похожие презентации:
Кинетика и регуляция действия ферментов
1. Кинетика и регуляция действия ферментов
2.
3.
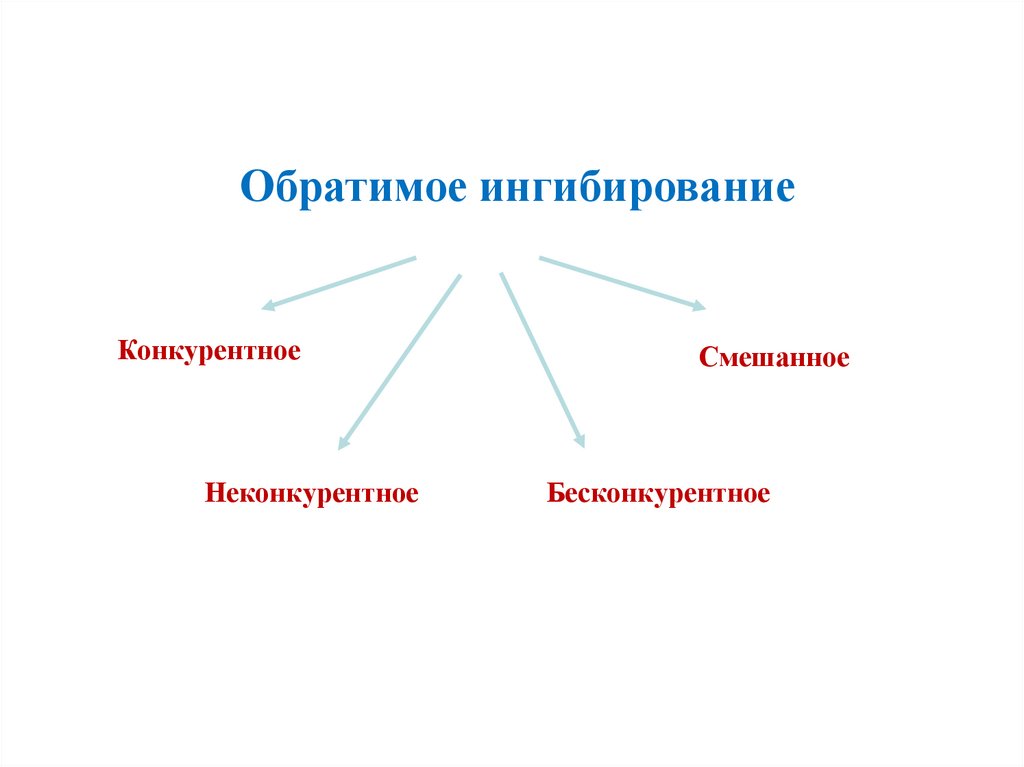
Обратимое ингибированиеКонкурентное
Неконкурентное
Смешанное
Бесконкурентное
4.
Конкурентное ингибированиеКонкурентный ингибитор сходен по строению с субстратом.
Конкурентный ингибитор взаимодействует с активным центром фермента и
препятствует взаимодействию активного центра с субстратом.
Действие конкурентного ингибитора зависит от его концентрации: чем
выше концентрация ингибитора, тем ниже скорость ферментативной
реакции.
5.
Влияние конкурентного ингибитора накинетические свойства фермента
Конкурентный ингибитор вызывает увеличение константы
Михаэлиса, но не влияет на максимальную скорость
реакции.
6.
Неконкурентное ингибирование• Неконкурентный ингибитор не сходен по строению с субстратом.
• Неконкурентный ингибитор может взаимодействовать, не с активным
центром фермента, а с другими участками в молекуле фермента.
• Действие неконкурентного ингибитора нельзя снять, увеличив
концентрацию субстрата.
7.
Влияние неконкурентного ингибитора накинетические свойства фермента
Ингибитор реагирует с функционально важной группой
фермента, не препятствуя связыванию субстрата. В этом
случае Км остается неизменной, но уменьшается
концентрация функционально активного фермента и,
следовательно, максимальная скорость реакции.
8.
Обратимое ингибированиеКонкурентное
Неконкурентное
Смешанное
Бесконкурентное
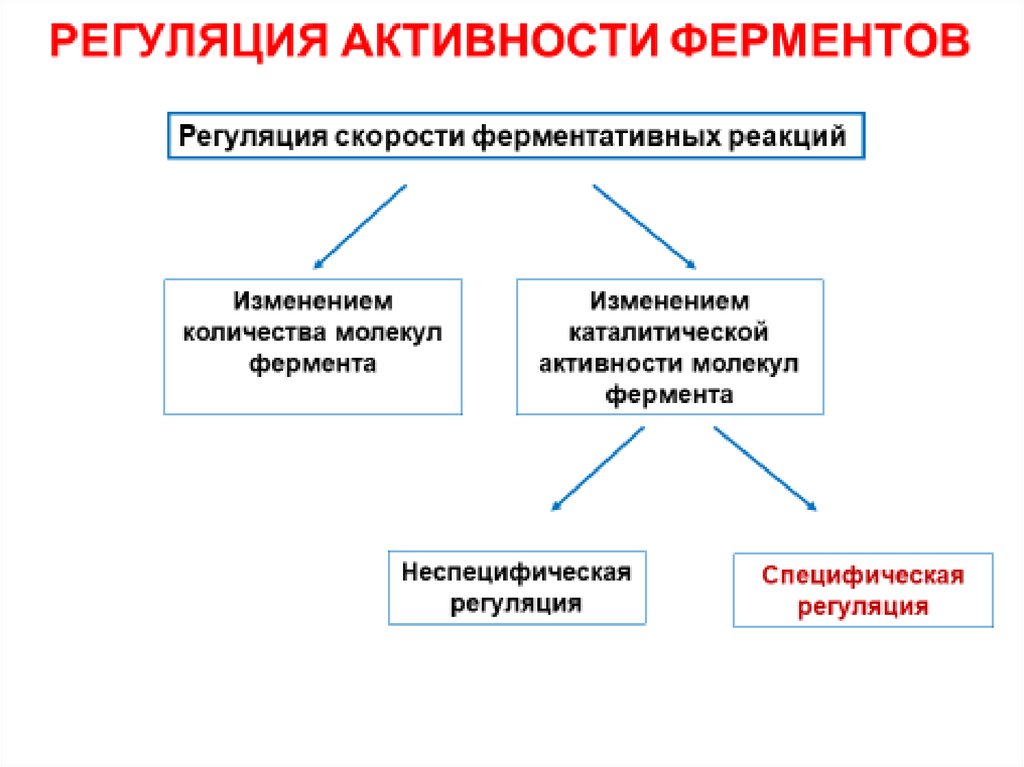
9. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Регуляция скорости ферментативных реакцийосуществляется на двух независимых уровнях:
I. Изменением количества молекул фермента;
II. Изменением каталитической активности
молекул фермента.
1) Неспецифическая регуляция.
2) Специфическая регуляция.
10.
11. Специфическая регуляция
Основные способы регуляции каталитическойактивности молекул ферментов:
1) аллостерическая регуляция;
2) ковалентная модификация.
12.
Аллостерическая регуляцияАллостерические ферменты имеют определенные
особенности строения:
- обычно являются
олигомерными белками,
состоящими из нескольких
субъединиц (протомеров);
Рисунок Аллостерический
фермент состоит из двух
субъединиц:
А - каталитической,
включающей активный центр, и
Б - регуляторной, в состав
которой входит
аллостерический центр.
- имеют аллостерический центр,
пространственно удаленный от
каталитического активного
центра;
- эффекторы присоединяются к
ферменту нековалентно в
аллостерических (регуляторных)
центрах.
13.
14.
15.
16.
Ковалентная модификация- заключается в обратимом присоединении или
отщеплении определенной группы, благодаря чему
изменяется активность фермента. Чаще всего такой
группой является фосфорная кислота.
Присоединение фосфорной кислоты к белку
осуществляют ферменты протеинкиназы, отщепление –
протеинфосфатазы
17. Тема №3 Метаболизм
18.
• Метаболизм – совокупность биохимическихпроцессов, протекающих в живом организме.
• Катаболизм – фаза метаболизма, которая
характеризуется распадом сложных молекул,
запасенных живым организмом, до
неорганических веществ.
• Анаболизм – синтез биологических
макромолекул из низкомолекулярных
предшественников.
19.
АТФ, трансмембранный потенциал и NAD(P)H вклетке выполняют роль связующего звена между
катаболическими и анаболическими процессами.
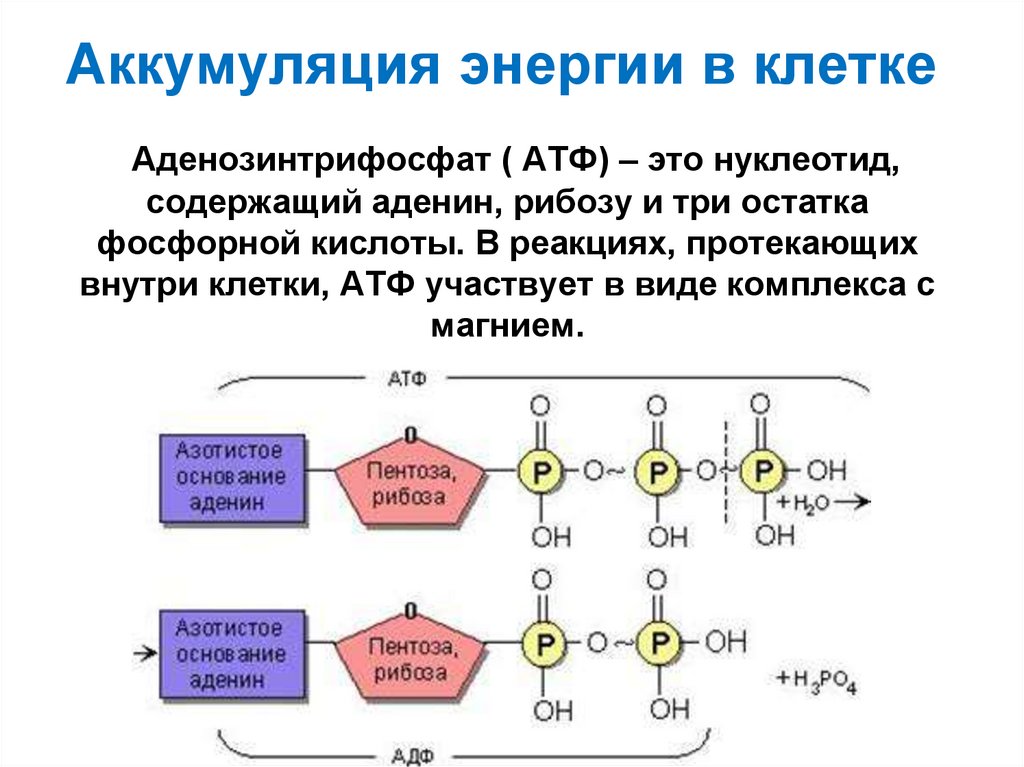
20. Аккумуляция энергии в клетке
Аденозинтрифосфат ( АТФ) – это нуклеотид,содержащий аденин, рибозу и три остатка
фосфорной кислоты. В реакциях, протекающих
внутри клетки, АТФ участвует в виде комплекса с
магнием.
21. Аккумуляция энергии в клетке
Молекула АТР содержит двемакроэргические связи. Макроэргическая
связь означает, что перенос группы,
которая присоединена этой связью на
подходящий акцептор, сопровождается
выделением большого количества
энергии.
22. Аккумуляция энергии в клетке
∆μ̃Н (Dμ̃Na) – трансмембранныйпотенциал (трансмембранная разность
электрохимических потенциалов)
23.
24. Аккумуляция энергии в клетке
ФАД25. Cхема катаболических процессов
26. Cхема катаболических процессов
ЖирыПолисахариды
Белки
27. Cхема катаболических процессов
ЖирыПолисахариды
Белки
Гидролиз
Жирные кислоты, глицерин Моносахариды
Аминокислоты
28. Cхема катаболических процессов
ЖирыПолисахариды
Белки
Гидролиз
Жирные кислоты, глицерин Моносахариды
Аминокислоты
Глюкоза
Гликолиз
ГА-3Ф
Пируват
Ацетил-СоА
ЦТК
NADH
FADH2
ЭТЦ
29. Cхема катаболических процессов
ЖирыПолисахариды
Белки
Гидролиз
Жирные кислоты, глицерин Моносахариды
Аминокислоты
Глюкоза
ГА-3Ф
Пируват
Ацетил-СоА
ЦТК
NADH
FADH2
ЭТЦ
30.
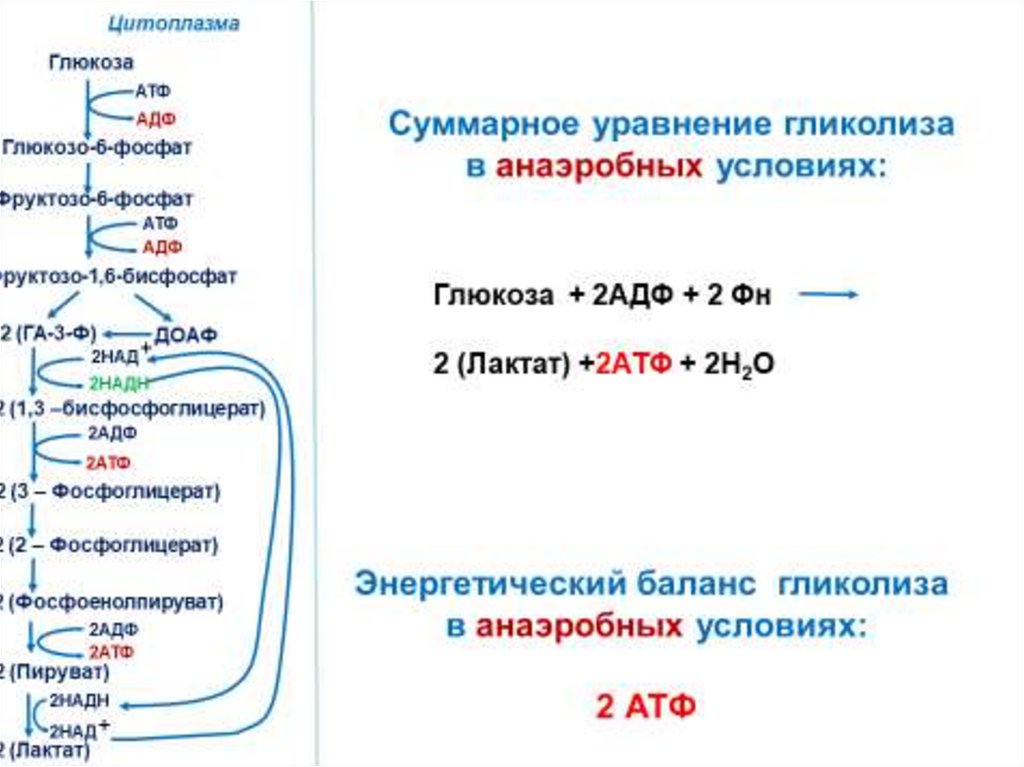
Катаболизм глюкозыГликолиз
– универсальный процесс окисления
глюкозы.
Известен почти у всех живых организмов.
У эукариот протекает в цитозоле.
Гликолиз обеспечивает окисление С6
глюкозы до двух С3 молекул.
31.
Регуляция гликолизаОсновное значение гликолиза - синтез АТФ,
поэтому его скорость коррелирует с
затратами энергии в организме.
Большинство реакций гликолиза обратимы,
за исключением трех, катализируемых
гексокиназой, фосфофруктокиназой,
пируваткиназой.
Регуляторные факторы, изменяющие скорость
гликолиза, направлены на необратимые
реакции.
32.
Регуляция гликолизаОсновное значение гликолиза - синтез АТФ,
поэтому его скорость коррелирует с
затратами энергии в организме.
Большинство реакций гликолиза обратимы,
за исключением трех, катализируемых
гексокиназой, фосфофруктокиназой,
пируваткиназой.
Регуляторные факторы, изменяющие скорость
гликолиза, направлены на необратимые
реакции.
Показателем потребления АТФ является
накопление АДФ и АМФ - продуктов распада АТФ.
Отношение уровня АТФ к АДФ и АМФ
характеризует энергетический статус клетки, а его
составляющие служат аллостерическими
регуляторами скорости гликолиза.
33.
ГликолизПроцесс включает два этапа:
Подготовительный этап
Окислительный этап
34.
Подготовительный этап гликолиза- Смысл подготовительного этапа состоит в
активации глюкозы за счет двойного
фосфорилирования (затрачивается 2
АТФ), перевода в фуранозную форму и
распада на две С3 молекулы:
глицеральдегид-3-фосфат и
диоксиацетонфосфат.
- Имеются 2 необратимые реакции
(регуляторные): гексокиназная и
фосфофруктокиназная.
35.
Подготовительный этап гликолизаГлюкоза
(АДФ
АТФ)
Гексокиназа (1)
Глюкозо-6-фосфат
Фосфоглюкоизомераза (2)
Фруктозо-6-фосфат
(АДФ
АТФ)
Фосфофруктокиназа (3)
Фруктозо-1,6-бисфосфат
Альдолаза (4)
Глицеральдегид-3- фосфат
Дигидроксиацетонфосфат
Триозофосфатизомераза (5)
36. 1 реакция - фосфорилирование глюкозы
Подготовительный этап гликолиза1 реакция - фосфорилирование глюкозы
CH2ОН
H
HО
O
H
ОH H
H
ОH
Глюкоза
АТФ
АДФ
H
ОH
H
Гексокиназа
HО
CH2О
Р
O
H
H
ОH H
H
ОH
ОH
Глюкозо-6-фосфат
37. 2 реакция - изомеризация глюкозо-6-фосфата
Подготовительный этап гликолиза2 реакция - изомеризация глюкозо6-фосфата
HО
CH2О
Р
CH2О
O
H
O
ОH
ОH
ОH
Глюкозо-6-фосфат
Фосфоглюкоизомераза
Р
CH2ОH
HО
ОH
HО
Фруктозо-6-фосфат
38. 3 реакция - фосфорилирование фруктозо-6-фосфата
Подготовительный этап гликолиза3 реакция - фосфорилирование фруктозо6-фосфата
CH2О
Р
CH2ОH
O
АТФ
АДФ
CH2О
HО
Фруктозо-6-фосфат
CH2 ОР
O
Mg
HО
ОH
Р
HО
Фосфофруктокиназа
ОH
HО
Фруктозо-1,6-бисфосфат
39.
40.
41.
Подготовительный этап гликолизаГлюкоза
(АДФ
АТФ)
Гексокиназа (1)
Глюкозо-6-фосфат
Фосфоглюкоизомераза (2)
Фруктозо-6-фосфат
(АДФ
АТФ)
Фосфофруктокиназа (3)
Фруктозо-1,6-бисфосфат
Альдолаза (4)
Глицеральдегид-3- фосфат
Дигидроксиацетонфосфат
Триозофосфатизомераза (5)
42.
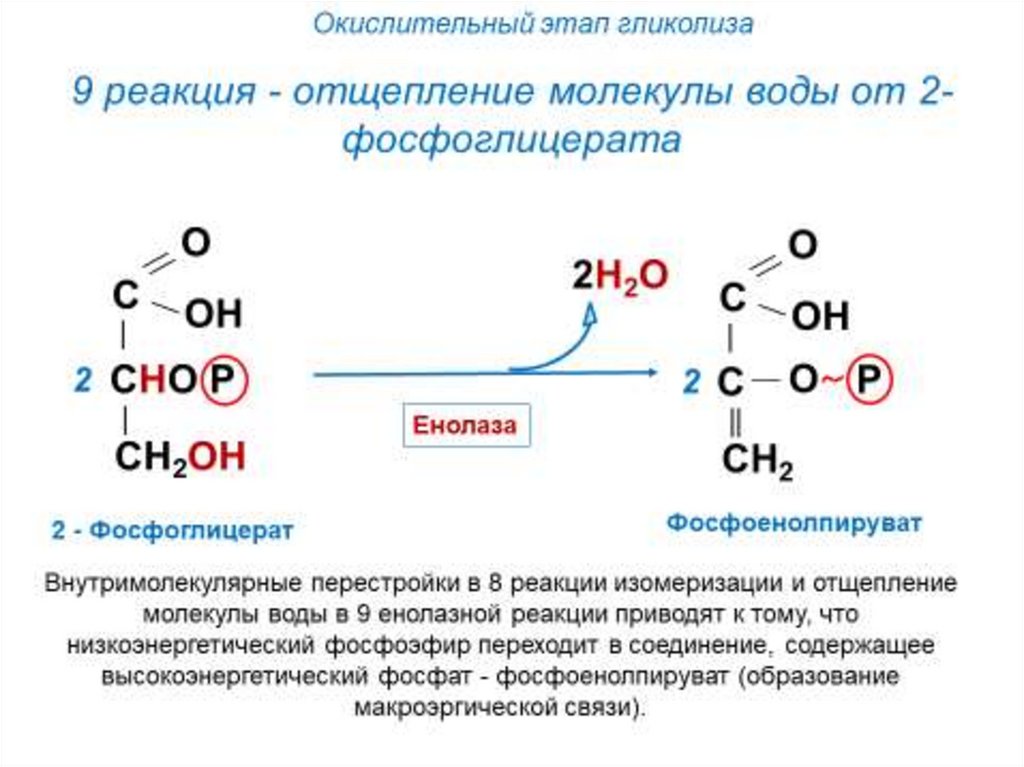
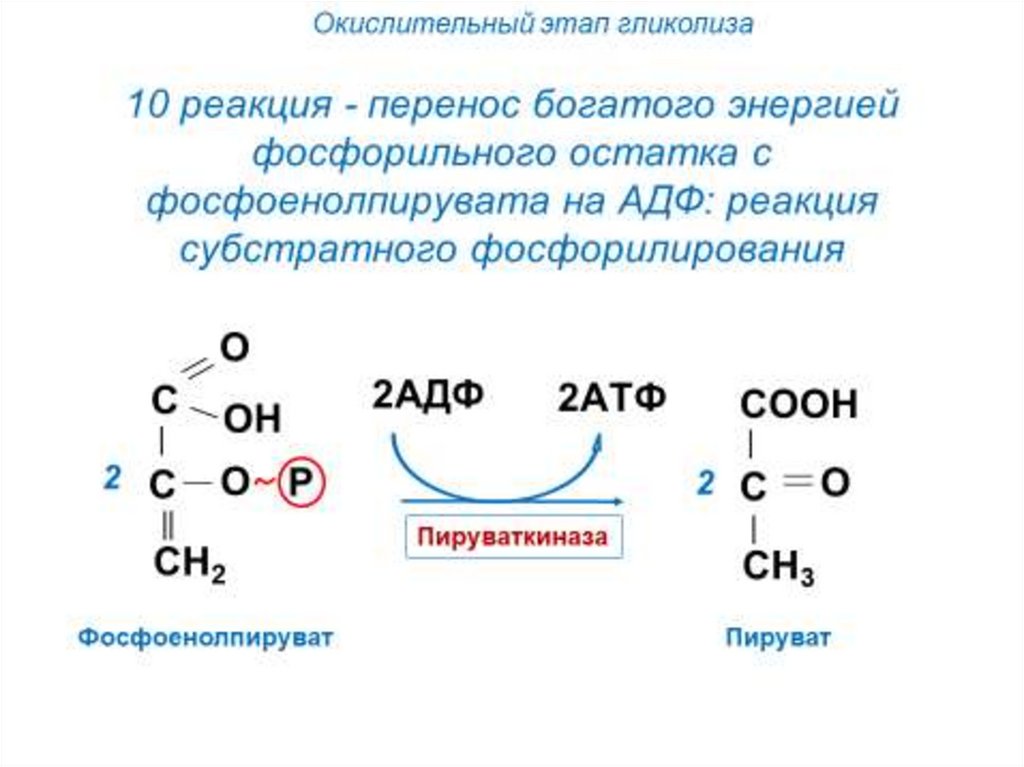
Окислительный этап гликолизаНа следующем этапе происходит
окисление глицеральдегид-3фосфата до пирувата (в аэробных
условиях) с образованием 4-х
молекул АТФ и 2-х молекул
НAДH.
Имеется 1 необратимая реакция
– пируваткиназная.
43.
44.
45.
46.
Субстратное фосфорилирование— реакция синтеза АТФ (ГТФ) путём
прямого переноса фосфата на АДФ
(ГДФ) с высокоэнергетического
промежуточного соединения.
47.
48.
49.
50.
51.
52.
53.
54.
55.
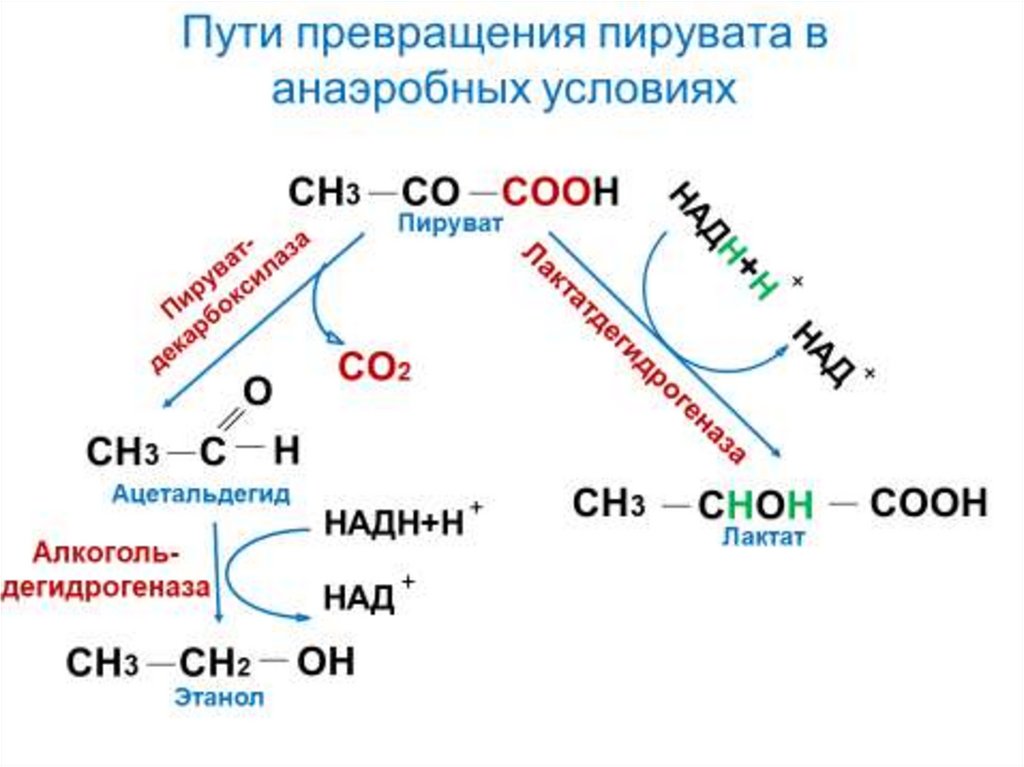
Молочнокислое и спиртовоеброжения – пути реокисления
НАДН
56.
57.
58.
Кофермент А (CОАSН)
59. Схема образования АТФ в клетке
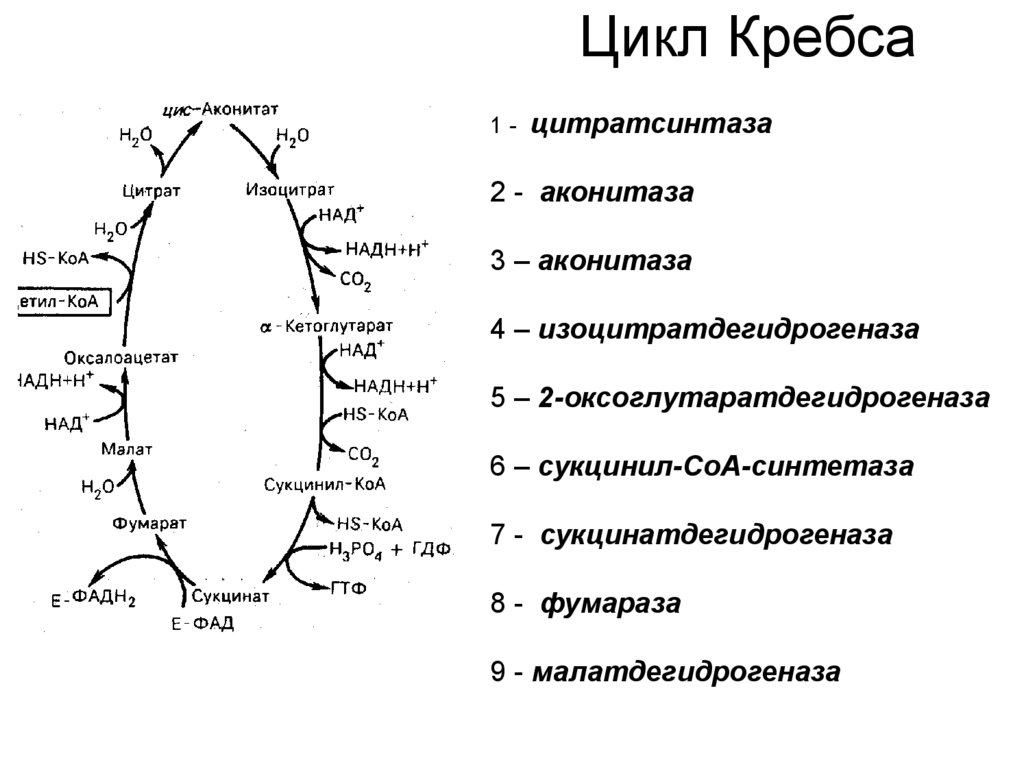
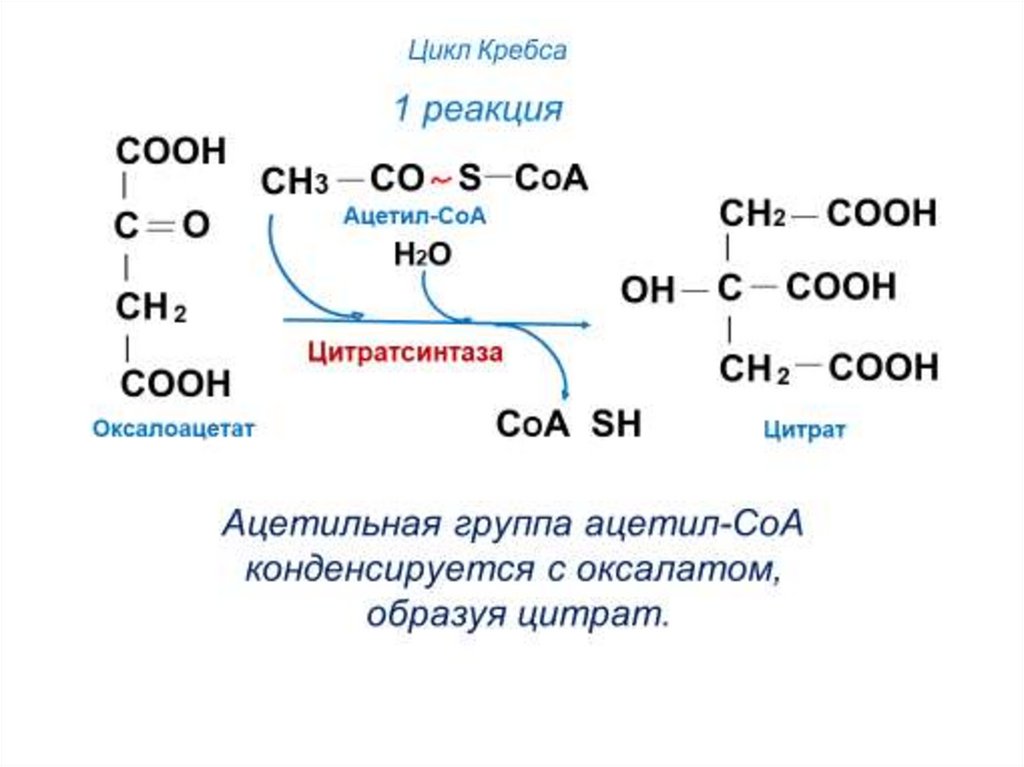
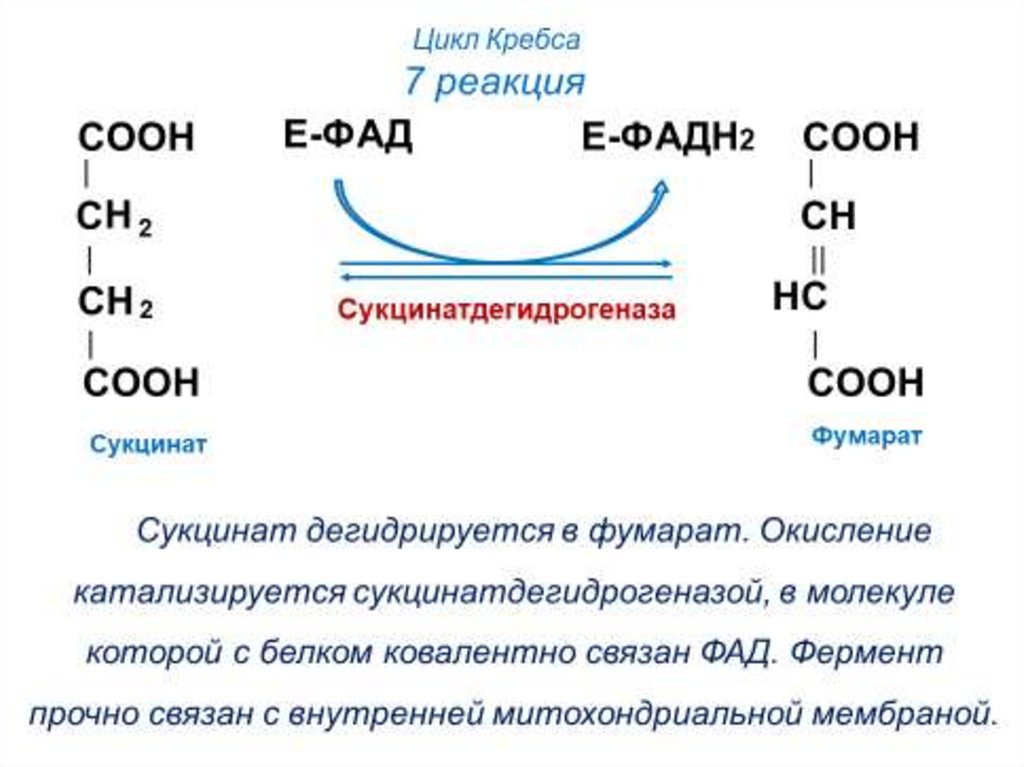
60. Цикл Кребса
1 - цитратсинтаза2 - аконитаза
3 – аконитаза
4 – изоцитратдегидрогеназа
5 – 2-оксоглутаратдегидрогеназа
6 – сукцинил-СоА-синтетаза
7 - сукцинатдегидрогеназа
8 - фумараза
9 - малатдегидрогеназа





























































 Биология
Биология








