Похожие презентации:
Как был открыт Великий закон
1.
Один день…или
Как был открыт
Великий закон.
Автор: Епанешникова
Елена
уч-ся 9 класса
МОУ СОШ № 4
п. Ноовоорск
Руководитель: Шурыгина
Галина Александровна
учитель химии
2.
Цели и задачи исследования- установить причины открытия закона;
- установить, что считал главным и основным
Д.И.Менделеев в своём труде;
- определить,какие открытия сделал Менделеев;
- доказать,что Менделеев первооткрыватель
закона;
- найти в литературе факты экспериментального
подтверждения периодического закона.
3.
Ожидаемые результаты:1. Выяснение конкретных причин
установления закона.
2.Установление открытий, сделанных
Менделеевым в ходе работы над законом.
3.Установление выводов, сделанных
Менделеевым о своём законе.
4.Доказательство первенства Менделеева в
открытии закона.
5.Установление фактов научного
доказательства и развития
периодического закона.
4.
5.
Цельприроде нет,
ни здесь, ни там , в
космических
глубинах :всё - от
песчинок малых до планет из элементов
состоит единых.
С.
Щипачёв.
(«Читая
исследования
:
Менделеева»)
история открытия Периодического закона
Д. И. Менделеева
6.
Что было известно до открытия закона1. Было известно 63 химических элемента.
Далеко не все свойства этих элементов были
достаточно изучены, даже атомные веса
некоторых оказались неправильно или
неточно определены.
2. Решением международного съезда химиков в
городе Карлсруэ в 1860 году утвердилось
атомно-молекулярное учение, приняты
определения понятий молекулы, атома,
атомного веса.
3. Предпринято около 50 попыток
классифицировать химические элементы.
7.
Первые попытки классификациихимических элементов:
• Всего в науке было предпринято около
50 попыток классифицировать
химические элементы.
• Среди учёных в химии называют в
основном имена трёх учёных,
сыгравших более существенную роль
при классификации. К ним относят:
8.
Работы Джона РейнаНьюлендса:
Английский химик Джон Александер Рейна
Ньюлендс в 1865 году предложил
«Закон октав»
9.
Джон Ньюлендс 1865г.Закон «Октав»
1
1октава H
1
2 октава F
Be
3
2
4
B
3
4
3
4
Na Mg Al
1
2
K
Ca
До
Ре
Ми
3 октава Cl
Ноты
Li
2
Cr
Фа
5
C
Si
5
Ti
5
Соль
6
7
N
O
6
7
P
S
6
Mn Fe
Ля
7
Си
10.
Работы Л. Мейера.В 1864 году немецкий исследователь Лотар Мейер предложил
таблицу для 27 элементов, разбитых на 6 групп, согласно их валентности
11.
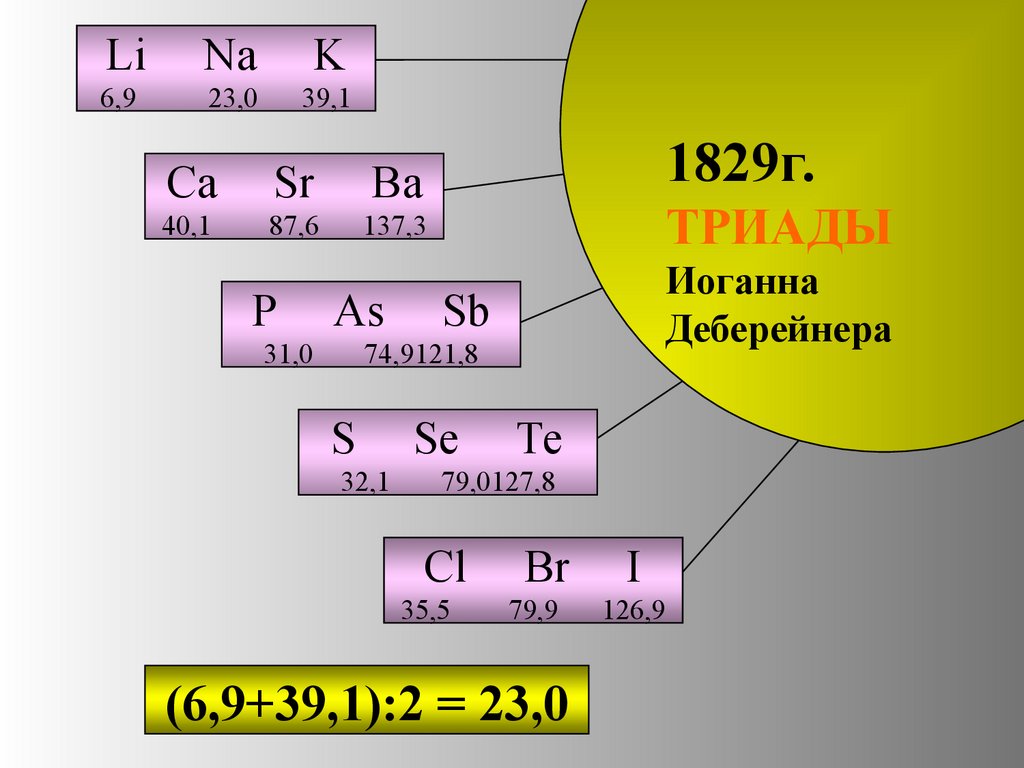
Работы И.В Деберейнера.Немецкий химик
Иоган-Вольфганг
Деберейнер разделил
элементы по три –
на ТРИАДЫ
12.
LiNa
K
6,9
23,0
39,1
1829г.
Ca
Sr
Ba
40,1
87,6
137,3
P
As
31,0
ТРИАДЫ
Иоганна
Деберейнера
Sb
74,9121,8
S
32,1
Se
Te
79,0127,8
Cl
35,5
Br
79,9
(6,9+39,1):2 = 23,0
I
126,9
13.
Дата рожденияпериодического закона:
Это произошло в пасмурный и не
по-зимнему сырой петербургский день
14 февраля 1869 года.
(1 Марта – по новому стилю)
14.
Рождениезакона
Случилось в Петербурге это.
Профессор университета
писал учебник для студентов...
Задумался невольно он:
«Как рассказать про элементы?
Нельзя ли тут найти закон?»
Искали многие' решенье,
но, проходя лишь полпути,
бросали. Мучило сомненье:
«А можно ли закон найти?»
Мир состоит из'Элементов.
(В то время знали шестьдесят.)
А сколько их всего? На это
нельзя ответить наугад.
Но не гадал, а верил он:
«Тут должен, должен быть закон!»
Упрямо он искал решенье.
Был Труд, Надежда и Терпенье,
и Вера в то, что он найдет!
Он так работал целый год.
15.
Тогда, усталостью сражен,лег на диван и видит сон...
То кружились,
то мелькали,
то водили хоровод,
то взрывались,
то пылали,
то шипели,
то сверкали,
то в покое пребывали:
Алюминий, Натрий, Калий,
Фтор, Бериллий, Водород...
Перепутались все свойства,
недалеко до беды. Вдруг команда:
— Стройся, войско! —
Стали строиться в ряды. Во втором ряду волненье:
все боятся окисленья. Третий ряд! Трубите сбор!
Натрий,
Магний,
Алюминий,
Кремний,
Фосфор,
Сера,
Хлор!
По порядку,
по закону
элементы встали в ряд
16.
и выходит, что в колонну все похожие стоят!C
O
B
Si
S
Al
Замечательный подбор!
Ряд пристраивая к ряду , а рядов – то десять к ряду:
Металлы под металлами, едкие под едкими,
Ковкие под ковкими идут своими клетками.
По порядку всё стоит, вот природы Алфавит!
«… я отобрал тела с наименьшим атомным весом и расположил их по порядку
величины их атомного веса. При этом оказалось, что существует как бы период
свойств простых тел, и даже по атомности элементы следуют друг за другом
в порядке арифметической последовательности величины их пая:
Li = 7; Be = 9,4;
B = 11;
C = 12; N = 14; O = 16;
F = 19;
Na =23; Mg = 24; Al = 27,4; Si = 28; P = 31; S = 32;
Cl = 35,5;
K =39; Ca = 40;
---------- ; Ti = 50; V = 51; ---------; ----------.
В разряде элементов, имеющих пай более 100, встречаем аналогичный
непрерывный ряд:
Ag = 108; Cd = 112; Ur = 116; Sn =118; Sb = 122; Te = 128; J = 127»
3, с.8 .
17.
Формулировка Периодического ЗаконаД.И. Менделеевым:
• «Свойства простых тел, а так же
формы и свойства их соединений,
находятся в периодической
зависимости от величины атомных
весов элементов».
18.
Таблица известных элементов кмоменту открытия закона.
Ag
Al
As
Au
B
Ba
Be
Bi
Br
C
Ca
Cd
Ce
Cl
Co
Cr
Cs
Cu
Di
Er
серебро
алюминий
мышьяк
золото
бор
барий
висмут
бром
углерод
кальций
кадмий
церий
хлор
кобальт
хром
цезий
медь
«дидимий»
«эрбий»
H
Hg
In
Ir
J
K
La
Li
Mg
Mn
Mo
N
Na
Nb
Ni
O
Os
P
Pb
Pd
водород
ртуть
индий
иридий
йод
калий
лантан
литий
магний
марганец
молибден
азот
натрий
ниобий
никель
кислород
осмий
фосфор
свинец
палладий
F
Fe
Фтор
железо
Pt
Rb
платина
рубидий
бериллий, глиций
Rh
Ru
S
Sb
Se
Si
Sn
Sr
Ta
Tb
Te
Th
Ti
Tl
U
V
W
Y
Zn
Zr
родий
рутений
сера
сурьма
селен
кремний, силиций
олово
стронций
тантал
«тербий»
теллур
торий
титан
таллий
уран
ванадий
вольфрам
иттрий
цинк
Цирконий, циркон
19.
А четвертый ряд нарушен!Был четвертый ряд нарушен.
Элемент не обнаружен.
Элемент не обнаружен —
тот, что в этом месте нужен.
Но напрасно беспокойство.
Существует где-то он!
«Я найду сначала свойства,
и поможет мне закон!»
Удельный вес назвал и цвет,
летуч на воздухе иль нет, как плавится, в
чем растворим...
Законом пользуясь своим,
три элемента предсказал,
как будто их в глаза видал!..
Быть может, раз в тысячелетье
свершить подобное дано.
20.
«Звёздность» системы и предсказаниесвойств элементов
Li
Be
B
Na
Mg
Al
K
Ca
Sc
21.
Д.И. Менделеев предсказал существование 11химических элементов.
• Это:
Ga Sc Ge Re Po Pa
Ra Ac Tc Fr At
На месте, где должны были стоять
не известные элементы, он оставил пустые
клеточки.
22.
23.
Элемент галлий открыл французскийучёный Буабодран:
…Довольный и счастливый
рассматривал металл,
но писем из России никак не ожидал.
Он взял письмо, прочел его. От русского ученого?!
— Ошибся я! Слыхали?! — Француз был удивлен.
— В глаза не видел Галлий, а свойства знает он!
Вес высчитал удельный точней, чем я, стократ
какой-то Менделеев еще пять лет назад!
— Глаза его сверкали, - топорщились усы.
Но вот металл свой Галлий он кинул на весы!.. Ответ в Россию мчится:
«Прекрасная Таблица!
Я Вами восхищен! Проверен мной практически
Закон периодический,
и я категорически приветствую Закон!»
24.
Сущность открытия МенделееваСущность открытия Менделеева заключалась в том, что
с ростом атомной массы химических элементов их
свойства меняются не монотонно, а периодически. После
определённого количества разных по свойствам
элементов, расположенных по возрастанию атомного
веса, свойства начинают повторяться. Например, натрий
похож на калий, фтор похож на хлор, а золото похоже на
серебро и медь. Разумеется, свойства не повторяются в
точности, к ним добавляются и изменения. Отличием
работы Менделеева от работ его предшественников
было то, что основ для классификации элементов у
Менделеева была не одна, а две — атомная масса и
химическое сходство. Для того, чтобы периодичность
полностью соблюдалась, Менделеевым были
предприняты очень смелые шаги: он исправил атомные
массы некоторых элементов, несколько элементов
разместил в своей системе вопреки принятым в то время
представлениям об их сходстве с другими
(например ,галлий, считавшийся щелочным металлом, он
поместил в третью группу согласно его фактической
максимальной валентности), оставил в таблице пустые
клетки, где должны были разместиться пока не открытые
элементы. В 1871 году на основе этих работ Менделеев
формулирует периодический закон.
25.
Подведение итогов исследованияПричины открытия закона
развитие науки
необходимость
классификации
научная деятельность
педагогическая
деятельность
подготовка «Основ
химии»
талант и
целеустремлённость
Открытия Д.И. Менделеева в
ходе работы над законом
• основа систематики атомный
вес и свойства
• сопоставление групп
несходных элементов
• правило: атомный вес
среднего члена группы равен
полу сумме атомных весов
крайних членов
• исправление атомных весов
элементов (In, La, Y, Er, Ce, Th,
U)
• существование неоткрытых
элементов и предсказание их
свойств
26.
Современная формулировкапериодического Закона:
• «Свойства простых тел, а так же
формы и свойства их соединений,
находятся в периодической
зависимости от величины заряда
атома».
27.
Чтобы создать ПериодическийЗакон химических элементов
Д. И. Менделееву понадобился
один день.
Один день - И ВСЯ ЖИЗНЬ…
28.
Ресурсы:• Манолов К. Великие химики - М., Мир, 1985
• Макареня А.А., Рысев Ю.В. Д.И. Менделеев –
М., Просвещение, 1988
• Петрянов И.В., Трифонов Д.Н. Великий закон
– М., Педагогика, 1976
• Макареня А.А., Трифонов Д.Н.
Периодический закон Д.И. Менделеева – М.,
Просвещение, 1969
• Фиалков Ю.Я. В клетке №… - М., Детская
литература, 1969
• http://www.alhimik.ru/


























 Химия
Химия








