Похожие презентации:
Строение атома. Электронные оболочки атома
1.
Строение атома. Электронныеоболочки атома.
2.
Атом- наименьшая электронейтральная частица химического элемента,
являющаяся носителем его свойств.
3.
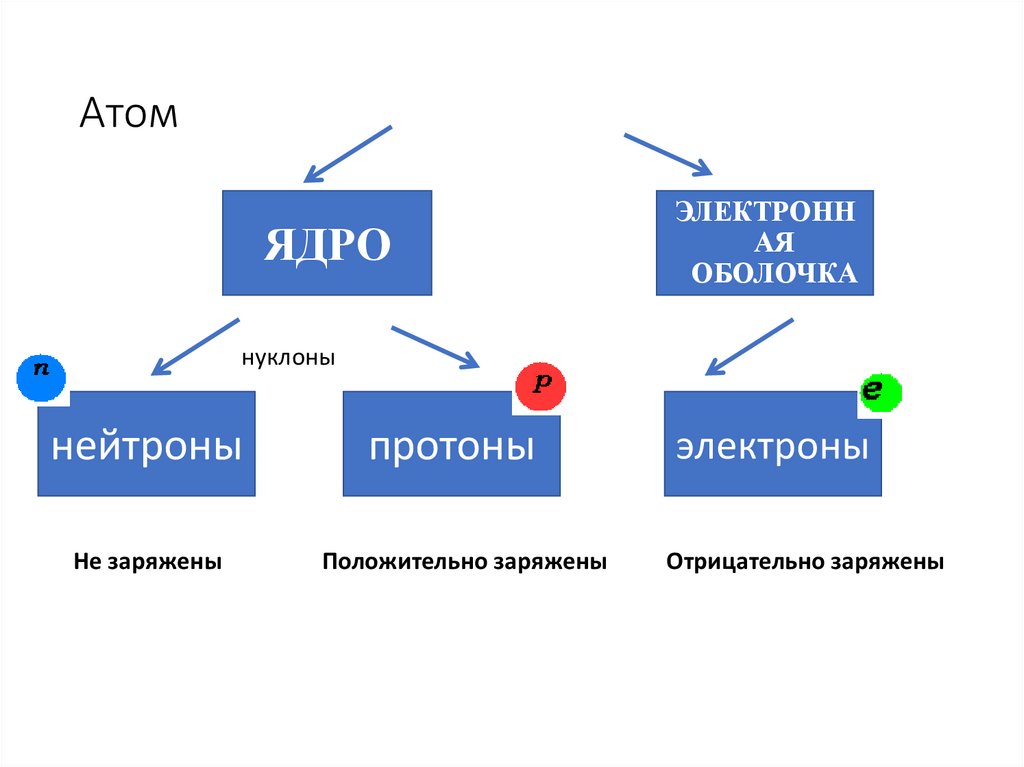
АтомЯДРО
ЭЛЕКТРОНН
АЯ
ОБОЛОЧКА
нуклоны
нейтроны
протоны
Не заряжены
Положительно заряжены
электроны
Отрицательно заряжены
4.
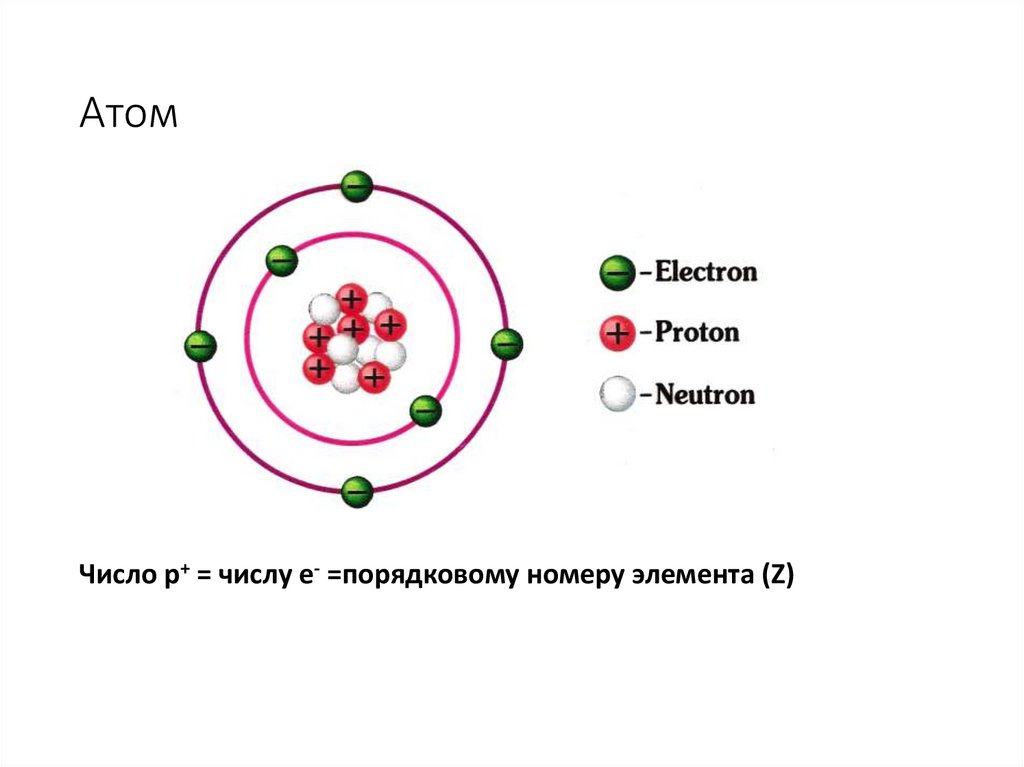
АтомЧисло p+ = числу e- =порядковому номеру элемента (Z)
5.
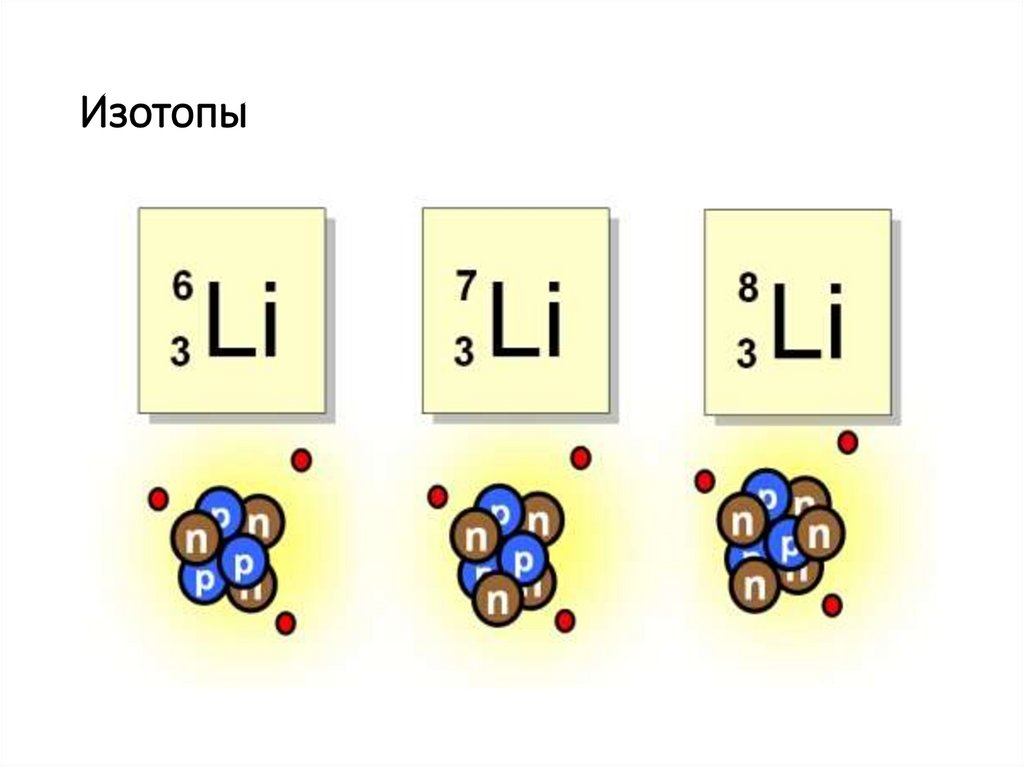
Изотопы6.
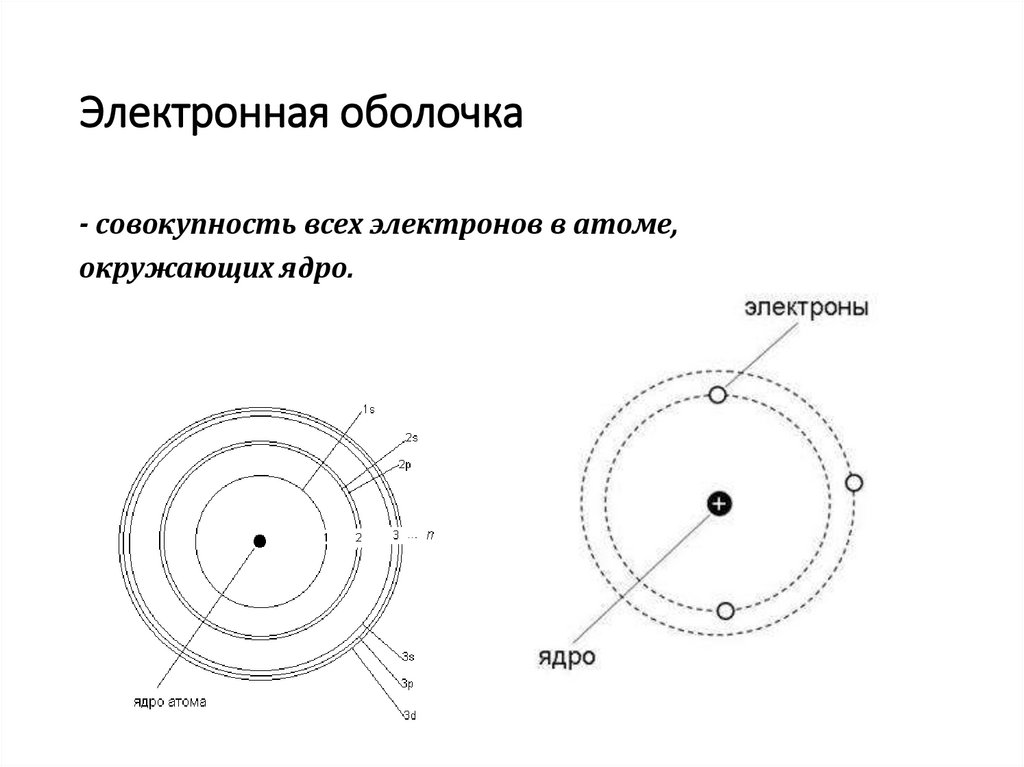
Электронная оболочка- cовокупность всех электронов в атоме,
окружающих ядро.
7.
Электронные уровниОрбиталь– это область наиболее вероятного
местонахождения электрона в пространстве.
Номер периода = числу эл. Уровней
Состояние электрона в атоме описывается 4 квантовыми числами:
1. Главное квантовое число n;
2. Побочное (орбитальное) квантовое число l;
3. Магнитное квантовое число ml;
4. Спиновое квантовое число ms.
8.
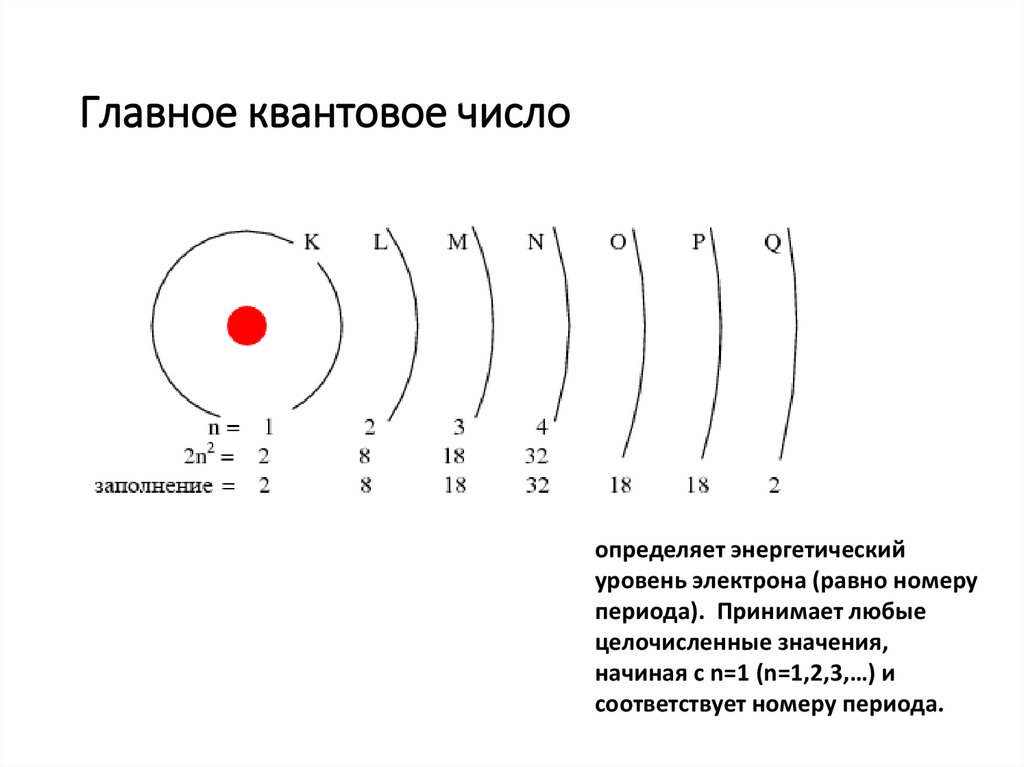
Главное квантовое числоопределяет энергетический
уровень электрона (равно номеру
периода). Принимает любые
целочисленные значения,
начиная с n=1 (n=1,2,3,…) и
соответствует номеру периода.
9.
Правило ХундаВ данном подуровне электроны стремятся занять энергетические
состояния таким образом, чтобы их суммарный спин был
максимальным, суммарный спин спаренных электронов равен
нулю.
10.
Электронная оболочка1s2
число электронов
2s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
11.
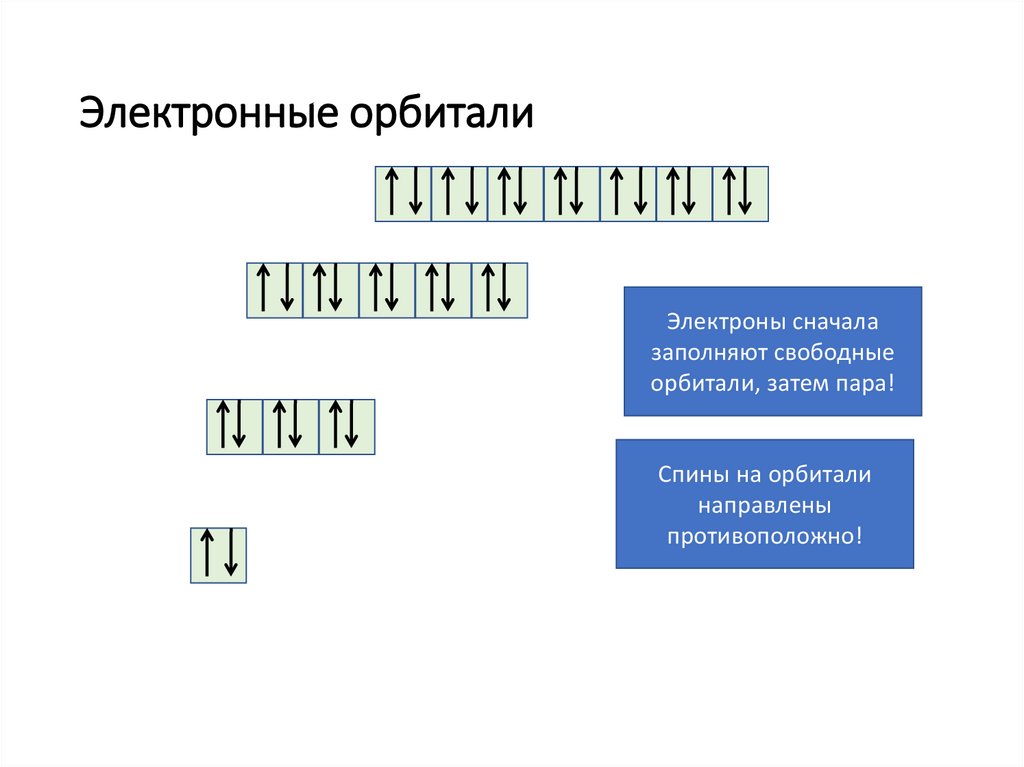
Электронные орбиталиЭлектроны сначала
заполняют свободные
орбитали, затем пара!
Спины на орбитали
направлены
противоположно!
12.
Электронная формула1.
2.
3.
Число e- = числу p+ =порядковому номеру
Число электронов на внешнем уровне = номеру группы
Число эл. уровней = номер периода






 Химия
Химия








