Похожие презентации:
Алканы: общая характеристика
1.
Алканы: общаяхарактеристика
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
РЕМОНТПлан характеристики
1. Определение
2. Общая формула
3. Гомологический ряд
4. Виды изомерии
5. Номенклатура
6. Физические и химические свойства
7. Получение и применение
3.
РЕМОНТАЛКАНЫ (предельные, насыщенные,
парафины)
– это углеводороды с общей формулой
CnH2n+2 , в молекулах которых все
связи одинарные.
4.
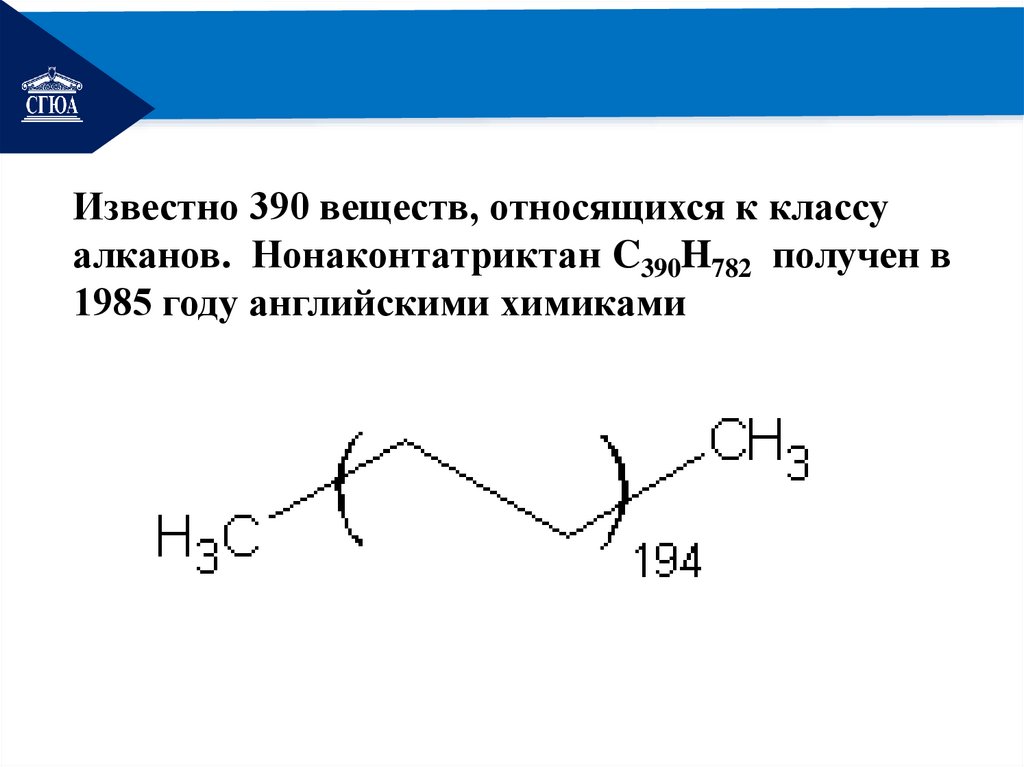
РЕМОНТИзвестно 390 веществ, относящихся к классу
алканов. Нонаконтатриктан C390H782 получен в
1985 году английскими химиками
5.
РЕМОНТГомологический ряд алканов
ГОМОЛОГИ – это вещества со
схожими строением и свойствами, но
различающиеся по составу на одну или
несколько групп CH2 (гомологическая
разность).
6.
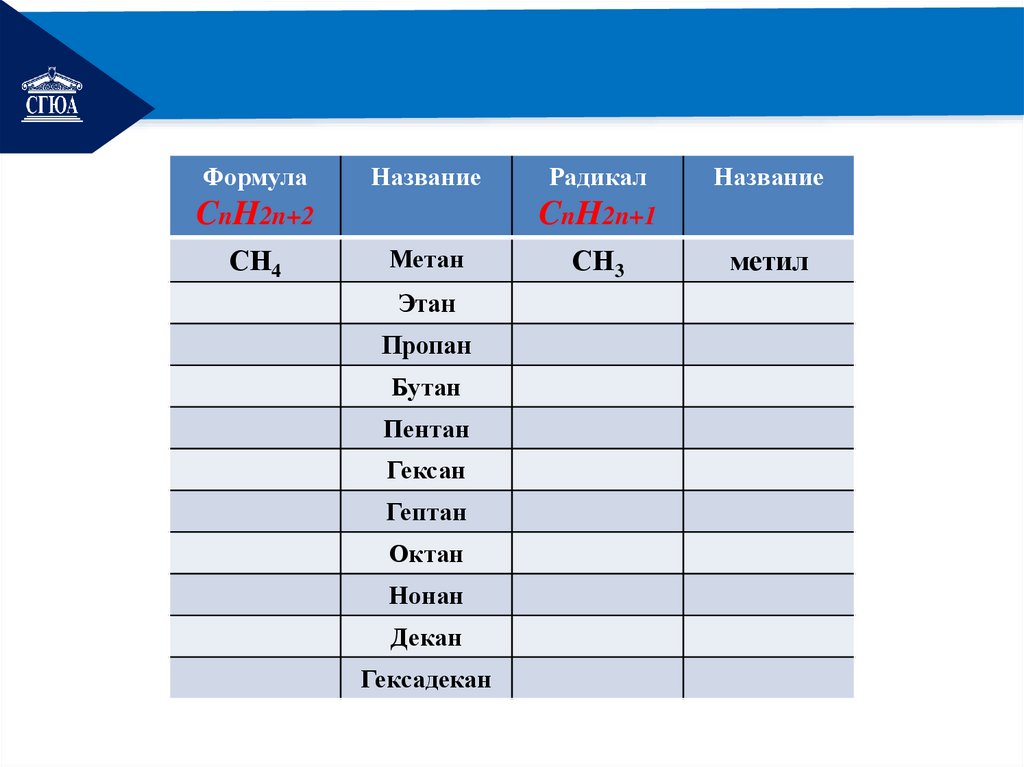
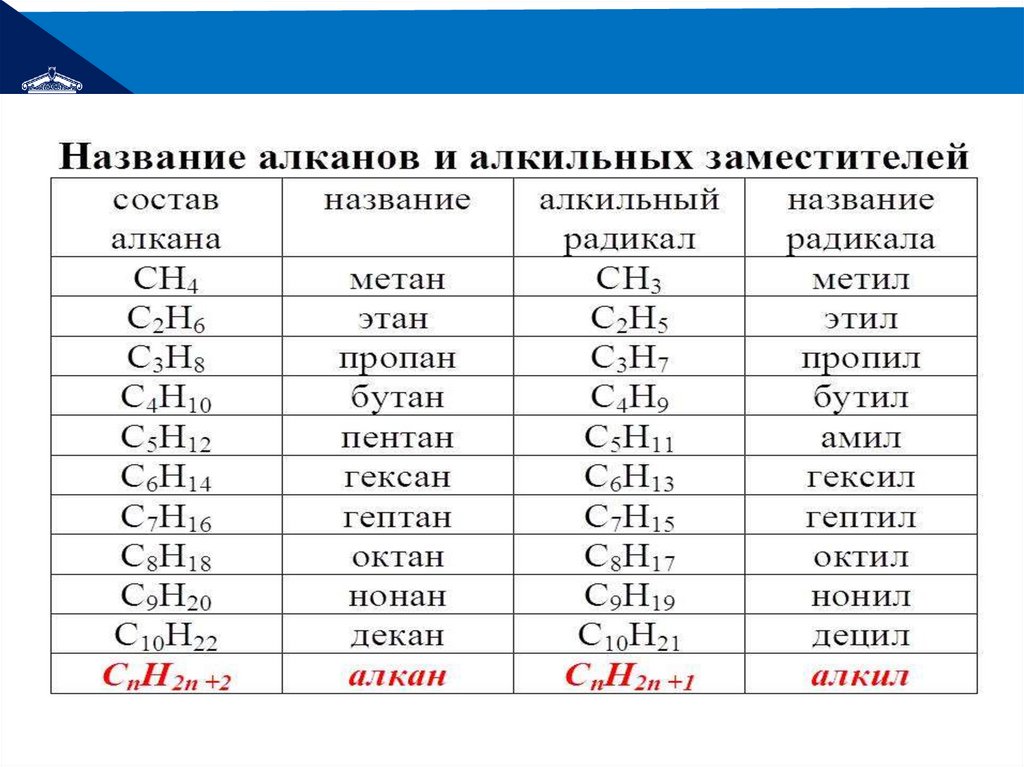
РЕМОНТФормула
Название
Радикал
Название
ГОМОЛОГИЧЕСКИЙ
РЯД АЛКАНОВ
CnH2n+2
СН4
CnH2n+1
Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан
Гексадекан
СН3
метил
7.
РЕМОНТРадикал – остаток углеводорода
без одного атома Н.
Активная частица,
определяющая свойства
вещества.
Радикалы алканов – алкилы имеют общую формулу CnH2n+1.
8.
РЕМОНТ9.
РЕМОНТТип изомерии
1.
Изомерия углеродного скелета
Количество изомеров возрастает с увеличением
числа атомов С в углеродной цепи.
Например, у бутана известно 2 изомера, у
пентана – 3, гептана – 9 и т.д.
10.
РЕМОНТНОМЕНКЛАТУРА АЛКАНОВ ИЮПАК
Международный союз теоретической и прикладной химии –
ИЮПАК разработал номенклатуру алканов, чтобы легко называть
каждое соединение, зная только его формулу.
1. Находим в структурной формуле наиболее
длинную цепь атомов С и нумеруем их, начиная с
того, к которому ближе разветвление.
1
2
3
4
5
СН3 - СН - СН2 - СН2 - СН3
I
СН3
радикал
Когда радикалов несколько и они равноудалены от концов главной цепи, то нумерацию
начинают с того края, к которому ближе расположен простейший радикал.
11.
РЕМОНТ2. Называем радикалы (начиная с
простейшего), указывая место их
присоединения.
1
2
3
4
5
СН3 - СН - СН2 - СН2 - СН3
I
СН3
2 – метил …
Если радикалы повторяются, то номер места повторяем, а перед названием
радикала приписываем приставку («ди»-2, «три»-3, «тетра»-4 и т.д.)
12.
РЕМОНТ3. Даем полное название алкана по
числу атомов углерода в
нумерованной цепи
1
2
3
4
5
СН3 - СН - СН2 - СН2 - СН3
I
СН3
2 – метилпентан
13.
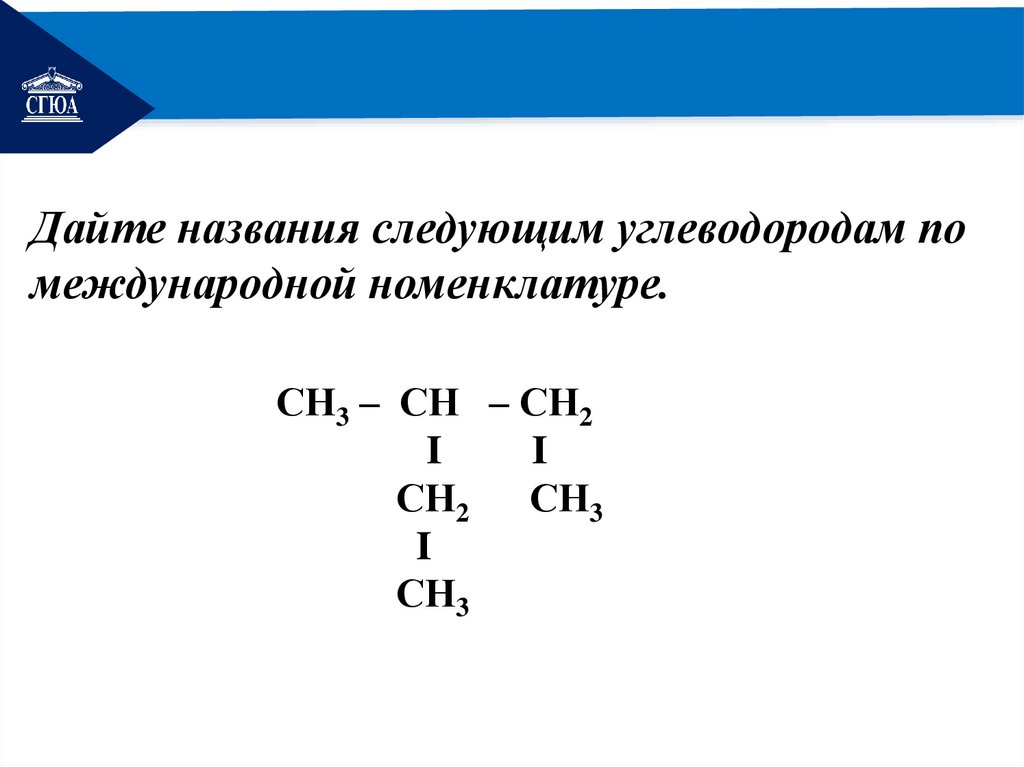
РЕМОНТДайте названия следующим углеводородам по
международной номенклатуре.
СН3
4
3
2I
1
СН3 – СН2 – С – СН3
I
СН3
2,2 - диметилбутан
14.
РЕМОНТДайте названия следующим углеводородам по
международной номенклатуре.
СН3 – СН – СН2
I
I
СН2
СН3
I
СН3
15.
РЕМОНТ3
2
СН3 – СН – СН2
I
I
4 СН 1СН
2
3
I
5 СН
3
3- метилпентан
16.
РЕМОНТ17.
РЕМОНТЗадание
Составить 4 формулы изомеров
гептана и назвать их
18.
РЕМОНТСоставление структурных формул по
названию
Написать структурную формулу
следующего углеводорода: 2,3,5 –
триметил,3-этилгексан
19.
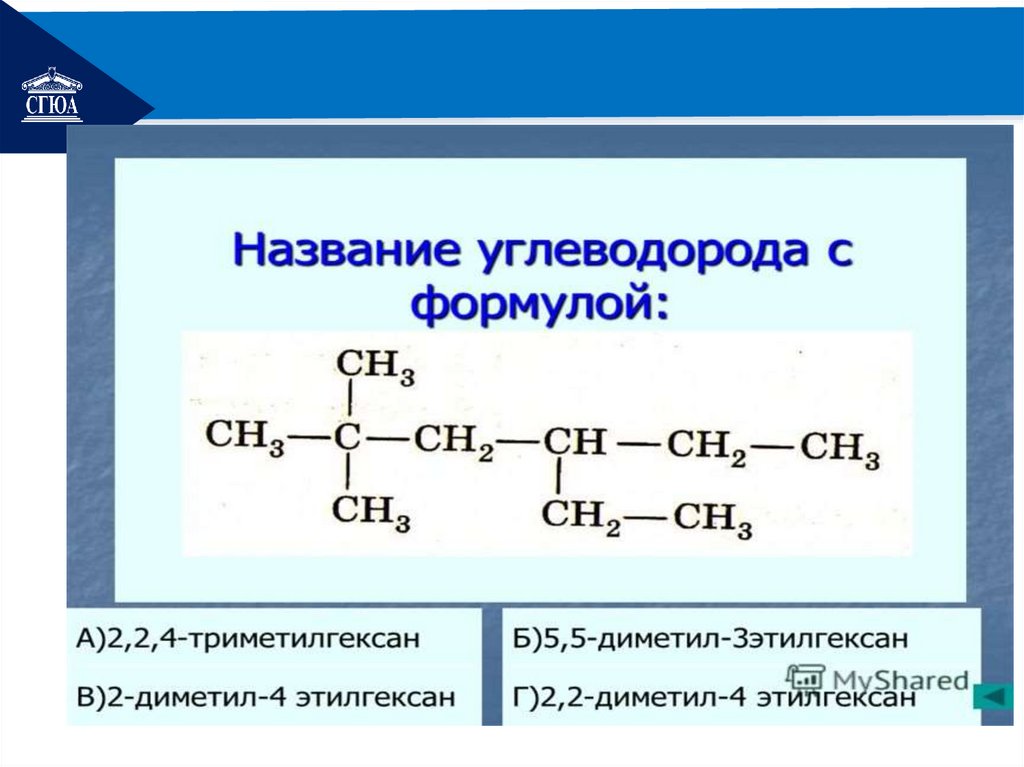
РЕМОНТ2,3,5 –триметил,3-этилгексан
I I
I
С–С–С–С–С–С
I
20.
РЕМОНТСН3 СН3 СН3
I
I
I
С–С– С–С–С–С
I
С2Н5
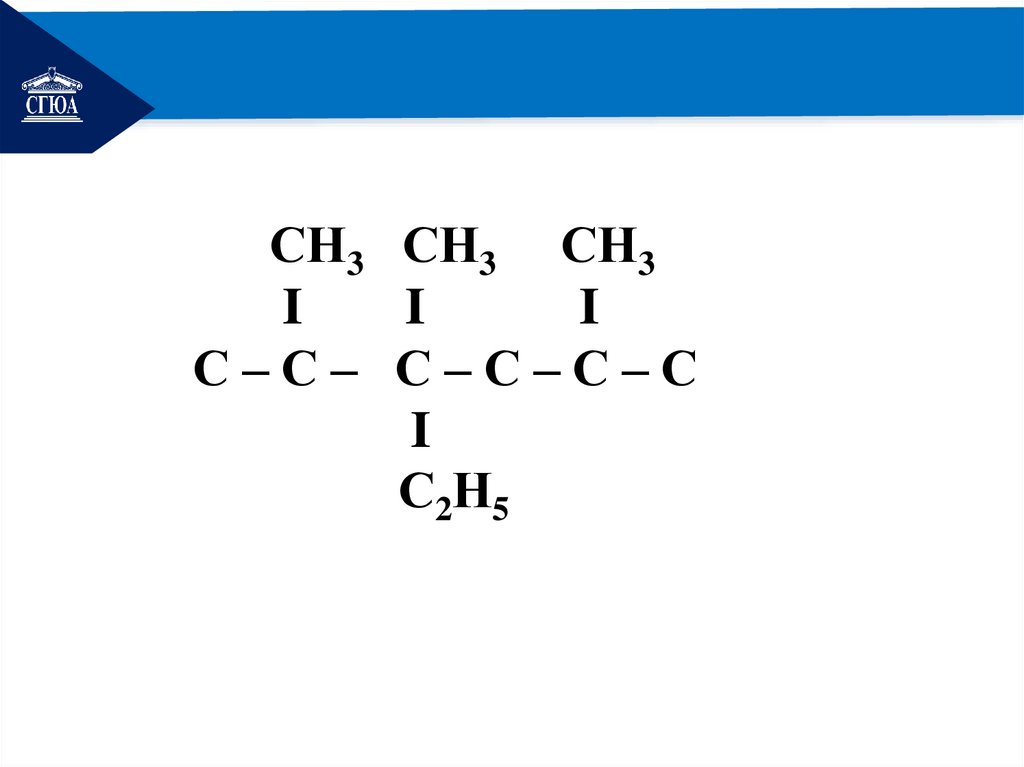
21.
РЕМОНТСН3 СН3
СН3
I
I
I
СН3 – СН – С – СН2 – СН – СН3
I
С2Н5
22.
РЕМОНТЗадание
Написать структурную формулу
следующего углеводорода: 2,2,3,4 –
тетраметил,3-этилпентан
23.
РЕМОНТФизические свойства алканов
С1- С4 – газы;
С5- С15 - жидкости с запахом бензина, начиная с
С 16 - твердые вещества (парафины).
Т кип. и плавл. увеличиваются с увеличением
атомов С в цепи. Разветвленные алканы имеют
более низкие Т кип., чем нормальные.
Алканы нерастворимы в воде, но хорошо
растворяются в органических растворителях.
24.
РЕМОНТХимические свойства алканов
Связи в молекулах алканов
прочные, насыщенные, поэтому
алканы пассивны, для них
характерны реакции замещения, а
не присоединения.
25.
РЕМОНТРеакции замещения
1. Галогенирование алканов (свет или температура)
2. Нитрование алканов (реакция Коновалова)
протекает при 140 °С:
26.
РЕМОНТРеакции расщепления:
А) дегидрирование – разрываются связи С-Н и
отщепляется водород (катализатор –платина,
температура):
CH3- CH3→ CH2= CH2 + Н2
Б) крекинг - процесс термического разложения
углеводородов. При температуре 450–700 oС
разрываются связи С – С и образуются молекулы
алканов и алкенов с меньшим числом углеродных
атомов:
C8H18 C4H8 + C4H10
алкен
алкан
27.
РЕМОНТОкисление алканов.
В различных условиях и при разных
катализаторах окисление алкана может привести к
образованию спирта, альдегида (кетона) и уксусной
кислоты.
В условиях полного окисления реакция протекает до
образования воды и углекислого газа:
C H4 + O2 C O2 + 2 H2O + Q
28.
РЕМОНТРеакции изомеризации
превращение алканов с нормальной цепью при
высоких температурах в присутствии катализатора
в их изомеры.
29.
РЕМОНТПолучение алканов.
1. Природные источники алканов: нефть, газ и
горный воск.
2. Гидрирование непредельных углеводородов
(катализатор, температура):
C4H8 + H2 C4H10
3. Смесь предельных углеводородов от С6 до С12
получают
из
синтез-газа
(катализаторы,
температура от 170 до 330 0):
6CO + 12H2 C6 H12 + 6H2O
4. Синтез Вюрца: нагревание
галогеналканов с
металлами:
2C2H5Br +2Na C4H10 + 2NaBr
30.
РЕМОНТПолучение метана
1. При нагревании углерода в атмосфере водорода
при температуре 400-500 градусов и повышенном
давлении в присутствии катализатора образуется
метан:
C + 2 H2 CH4
2.Гидролиз карбида алюминия
Al4C3 + 12 H2 O 4Al(OH) 3+3CH4
31.
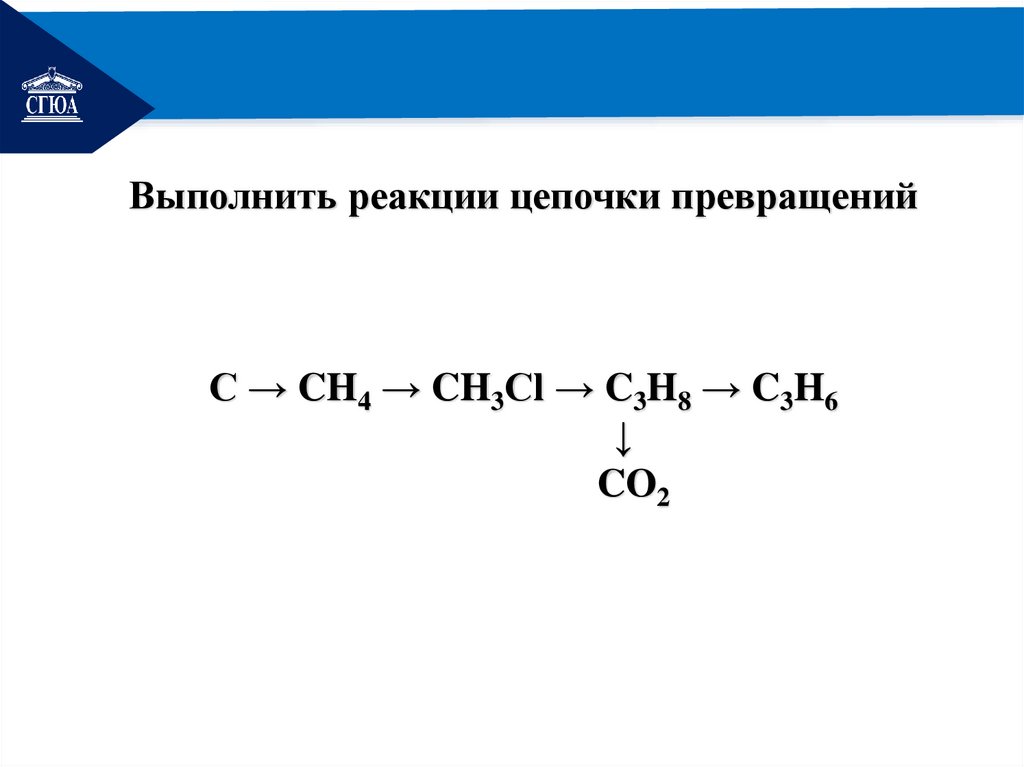
РЕМОНТВыполнить реакции цепочки превращений
C → CH4 → CH3Сl → C3H8 → C3H6
↓
CO2
32.
РЕМОНТПрименение
1. Топливо ( газ, бензин, дизельное топливо, авиационное
топливо).
2. Жидкие алканы – растворители.
3. Производство пластмасс, каучуков, синтетических
волокон, моющих средств и т.д.
4. Вазелиновое масло (смесь жидких углеводоpодов с числом
атомов С до 15) - в медицине, паpфюмеpии и косметике.
5. Вазелин (смесь жидких и твеpдых пpедельных
углеводоpодов с числом атомов С до 25) - в медицине.
6. Паpафин (смесь твеpдых углеводоpодов С19-С35) изготовление свечей, пpопитка спичек и упаковочной бумаги,
для тепловых пpоцедуp в медицине и т.д.
33.
СПАСИБО ЗАВНИМАНИЕ!


























 Химия
Химия