Похожие презентации:
Биохимия крови. Обмен хромопротеинов. Лекция
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел X
ЛЕКЦИЯ
БИОХИМИЯ КРОВИ. ОБМЕН ХРОМОПРОТЕИНОВ.
Профессор В.А. Дадали, доцент. М.Н. Соколова,
доцент Павлова Р.Н., доцент Антонова Ж.В.
2022/2023
2.
План лекции1.Хромопротеины (: определение понятия, примеры. 2 Строение
гемоглобина. 2.1. Строение белковой части гемоглобина. 2.2. Строение гема.
2.3. Функции гемоглобина.
2.4. Кривые насыщения гемоглобина и миоглобина кислородом. 2.5.
Газообмен в легких и тканях. Эффект Бора. Влияние факторов на насыщение
гемоглобина кислородом., 2.6.Регуляция сродства Нb к кислороду.
3. Виды гемоглобина. Нормальные и патологические производные Нb.
4. Обмен ХП. Синтез ГЕМа. 4.1.Регуляция синтеза гема и гемоглобина.
4.2. Порфирии.
4.3.Физико-химические свойства порфиринов.
5. Обмен железа.
6. Распад гемоглобина, катаболизм гема. Ткани РЭС.
6.1.Распад гемоглобина, катаболизм гема. Печень, кишечник.
7.Гипербилирубинемии, желтухи.
8. Рекомендованная литература.
2
3.
Условные обозначения1. Нb и Мb – гемоглобин и миоглобин.
2. ХП – хромопротеины
3. КПГ- III – синтаза – копропорфириноген III –синтаза
4. УПГ -I-синтаза –уропорфириноген-1-синтаза
5. УПГ- III- косинтаза- уропорфириноген-III-синтаза
3
4.
1. Хромопротеины (ХП)ХП – это сложные белки, небелковая часть которых
придает белкам окраску. К ним относятся:
• Флавопротеины – содержат ФАД, ФМН (желтая окраска)
• Гемопротеины – содержат простетическую группу ГЕМ
(красная окраска)
• «Голубые белки» - содержат ионы Cu+ например:
супероксиддисмутаза (содержит Cu+ и Zn++) ,
церулоплазмин
Примеры гемопротеинов:
• гемоглобин и миоглобин
• цитохромы ЦПЭ(митохондриальные): b, с1, с, аа3
• цитохромы детоксикации (микросомальные): Р450, b5
• NO- синтаза, гуанилатциклаза цитозольная и др.
4
5.
2. Строение гемоглобинаКаждая субъединица имеет ГЕМ
5
6.
2.1.Строение белковой части - глобинаГлобин состоит из четырех субъединиц (2α и 2β).
Каждый мономер содержит гем и способен
присоединять 1 мол О2.
Поверхность мономеров не ровная и формируется
центральная полость, образованная «+» заряженными
аминокислотами (ЛИЗ и ГИС).
Железо гема связано через 5-ю координационную
связь с азотом имидазольного кольца гистидина в
молекуле глобина (Рис.1).
Гидрофобные аминокислоты, окружающие гем,
образуют гидрофобные связи с гидрофобными
метильными (М) и винильными (В) радикалами
пиррольных колец гема, удерживая гем в углублении, в
«кармане», (наряду с 5-й координационной связью),
что препятствует окислению железа Fe2+.
6
7.
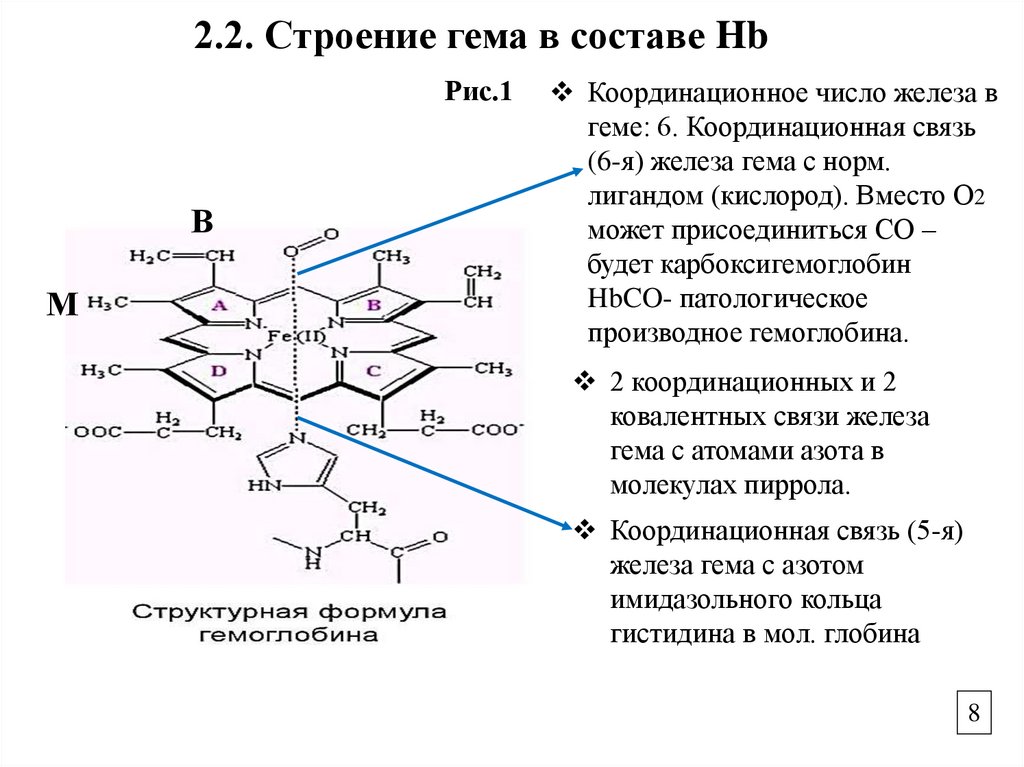
2.2. Строение гемаГЕМ – содержит порфириновое кольцо, которое
состоит из 4-х пиррольных колец, соединенных
метиленовыми мостиками, образует единую
сопряженную систему (Рис.1).
Fe2+ связано с пиррольными кольцами 2-мя
ковалентными и 2-мя координационными
связями, образуя хелатную форму. Гем
расположен в плоскости (Рис.1).
7
8.
2.2. Строение гема в составе HbРис.1
В
М
Координационное число железа в
геме: 6. Координационная связь
(6-я) железа гема с норм.
лигандом (кислород). Вместо О2
может присоединиться СО –
будет карбоксигемоглобин
HbCO- патологическое
производное гемоглобина.
2 координационных и 2
ковалентных связи железа
гема с атомами азота в
молекулах пиррола.
Координационная связь (5-я)
железа гема с азотом
имидазольного кольца
гистидина в мол. глобина
8
9.
2.3.Функции гемоглобина• Транспорт О2 из легких к тканям и СО2 и Н+ из
периферических тканей в легкие для выведения из
организма (Рис.2).
• Обеспечивает постоянство рН (гемоглобиновая
буферная система).
9
10.
2.4.Кривые насыщения гемоглобина и миоглобина кислородом10
11.
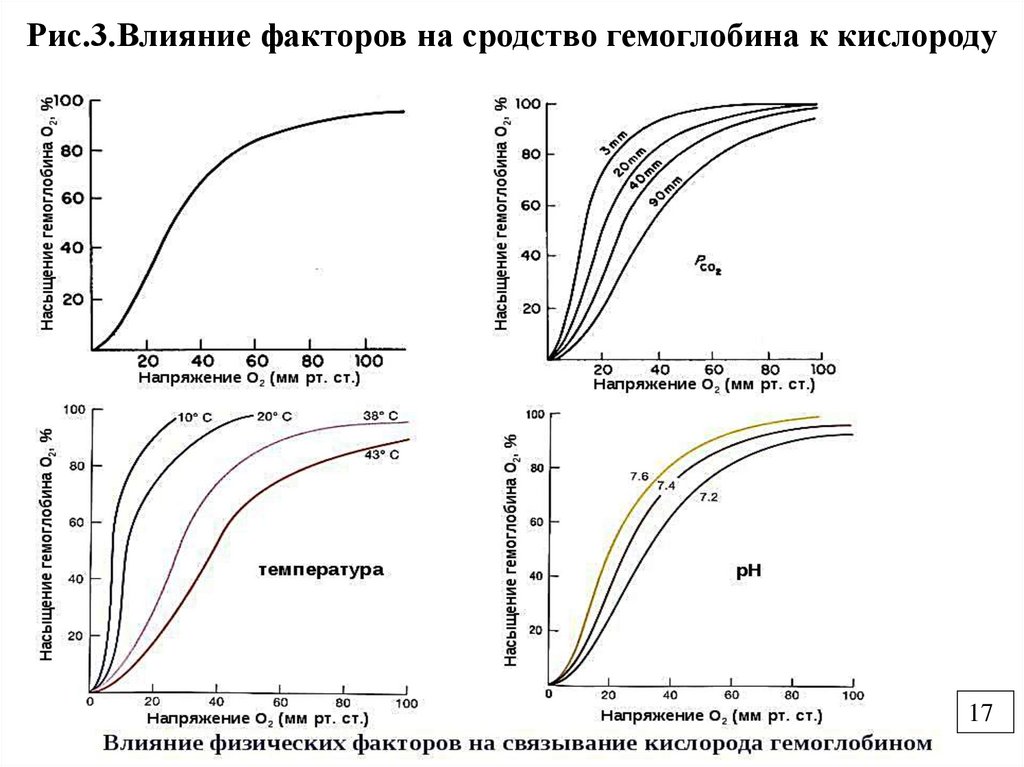
• Присоединение О2 к Нb осуществляется поэффекту кооперативности, т.е.
присоединение О2 к первой субъединице
вызывает конформационные изменения
других субъединиц и облегчает
присоединение следующей молекулы О2.
Четвертая молекула О2 присоединяется к
Нb в 300 раз легче, чем первая.
• Кооперавтивный эффект выражается в виде
кривой оксигенации (насыщения) О2 для
Нb и Мb (п.2.4)
11
12.
• Кривая оксигенации для Мb гипербола, Мbобладает третичной структурой имеет одну
белковую субъединицу и связывает одну
молекулу О2.
• Мb даже при низком парциальном давлении
1-2 мм.рт.ст. имеет высокое сродство к О2.
• Функция Мb депонировать О2 в клетке для
создания аэробных условий.
• Отдача О2 миоглобином происходит при
интенсивной физической работе.
12
13.
• Кривая оксигенации для Нb имеетсигмоидную форму.
• Нb имеет низкое сродство к О2 и
насыщение возникает при более высоком
парциальном давлении в легких, а в
капиллярах тканей Нb отдает О2 (снижается
сродство).
13
14.
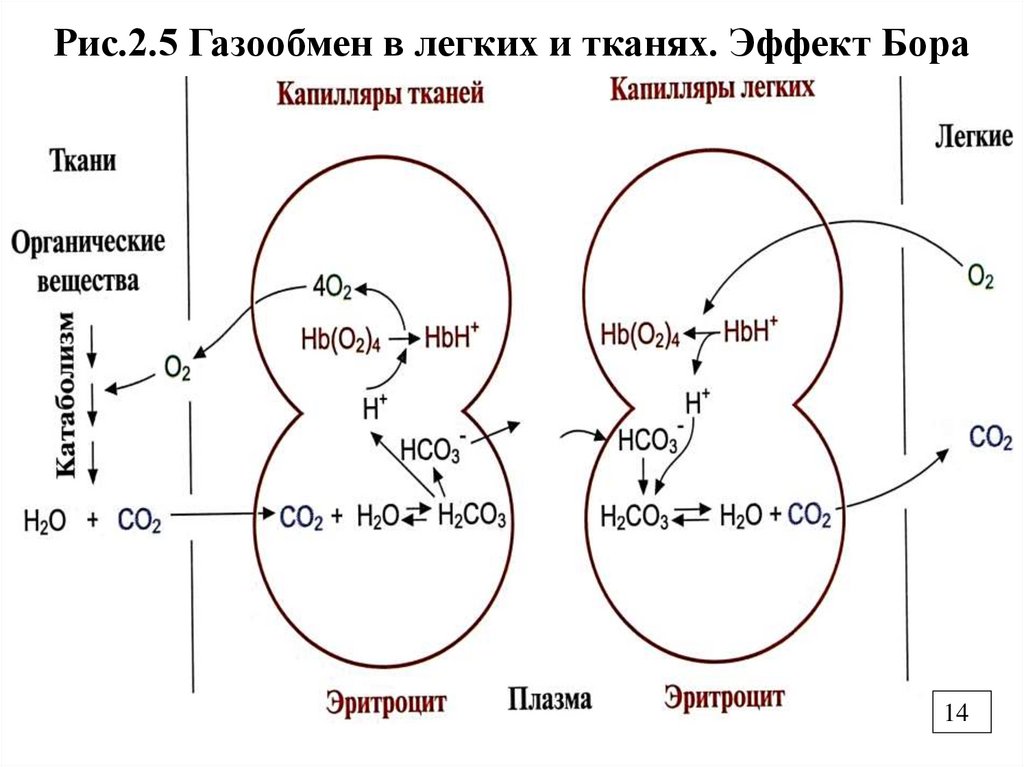
Рис.2.5 Газообмен в легких и тканях. Эффект Бора14
15.
Реакция оксигенации
НbН+ + О2 → НbО2 + Н+
В зависимости от условий происходит оксигенация или отдача
О2
В капиллярах легких высокое парциальное давление О2
приводит к оксигенации Нb и удалению 6 Н+ .
Образующийся СО2 выделяется в альвеолярное пространство и
удаляется с выдыхаемым воздухом.
Большая часть СО2 транспортируется кровью в виде НСО3-.
Небольшое количество СО2 (15-20%) переносится в легкие в
виде карбгемоглобина, когда СО2 присоединяется к концевым
--NH2 гр. глобина: R-NH2 + CO2 =R-NH-COO- + H+
15
16.
В органах и тканях накапливаются конечныепродукты обмена - СО2 и Н2О. Высокое
давление СО2 приводит к его поступлению
в эритроцит. В результате увеличивается
[Н+], рН, сродство Нb к О2 , что ведет к
высвобождению О2 и усилению
оксигенации тканей (эффект Бора). В
тканях низкое парциальное давлении О2 и
уменьшается сродство Нb к О2.
16
17.
Рис.3.Влияние факторов на сродство гемоглобина к кислороду17
18.
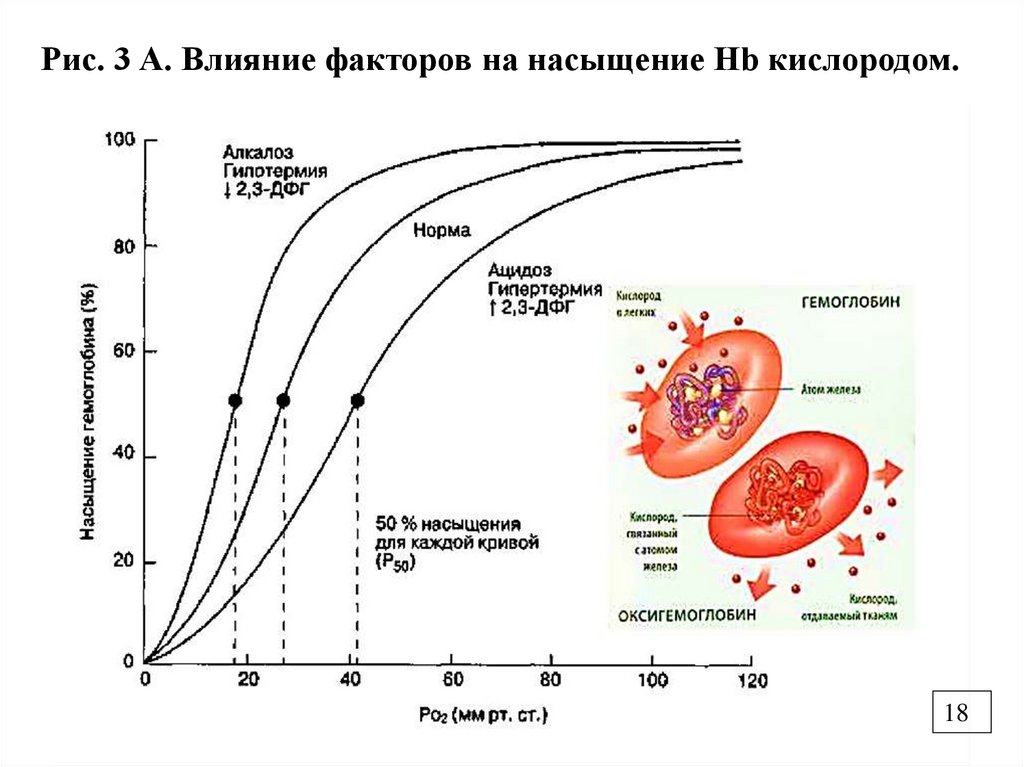
Рис. 3 А. Влияние факторов на насыщение Нb кислородом.18
19.
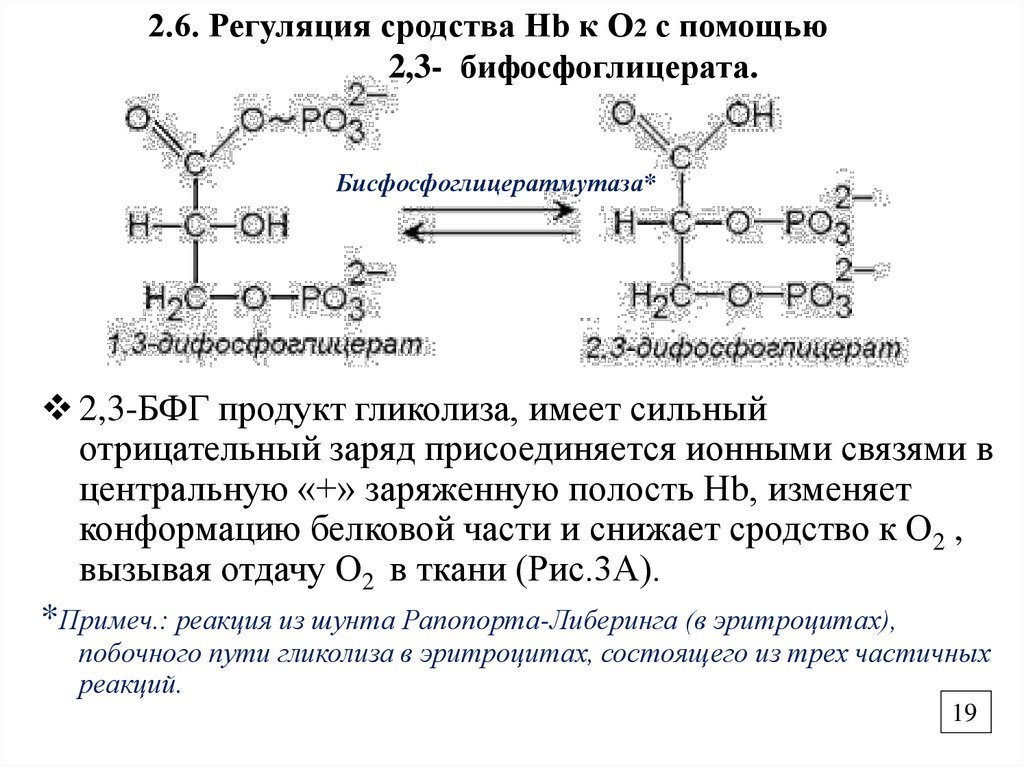
2.6. Регуляция сродства Нb к О2 с помощью2,3- бифосфоглицерата.
Бисфосфоглицератмутаза*
2,3-БФГ продукт гликолиза, имеет сильный
отрицательный заряд присоединяется ионными связями в
центральную «+» заряженную полость Нb, изменяет
конформацию белковой части и снижает сродство к О2 ,
вызывая отдачу О2 в ткани (Рис.3А).
*Примеч.: реакция из шунта Рапопорта-Либеринга (в эритроцитах),
побочного пути гликолиза в эритроцитах, состоящего из трех частичных
реакций.
19
20.
3. Виды гемоглобина. Нормальные и патологическиепроизводные Нb.
Виды гемоглобина
Нормальные производные гемоглобина
20
21.
Патологические производные гемоглобина22.
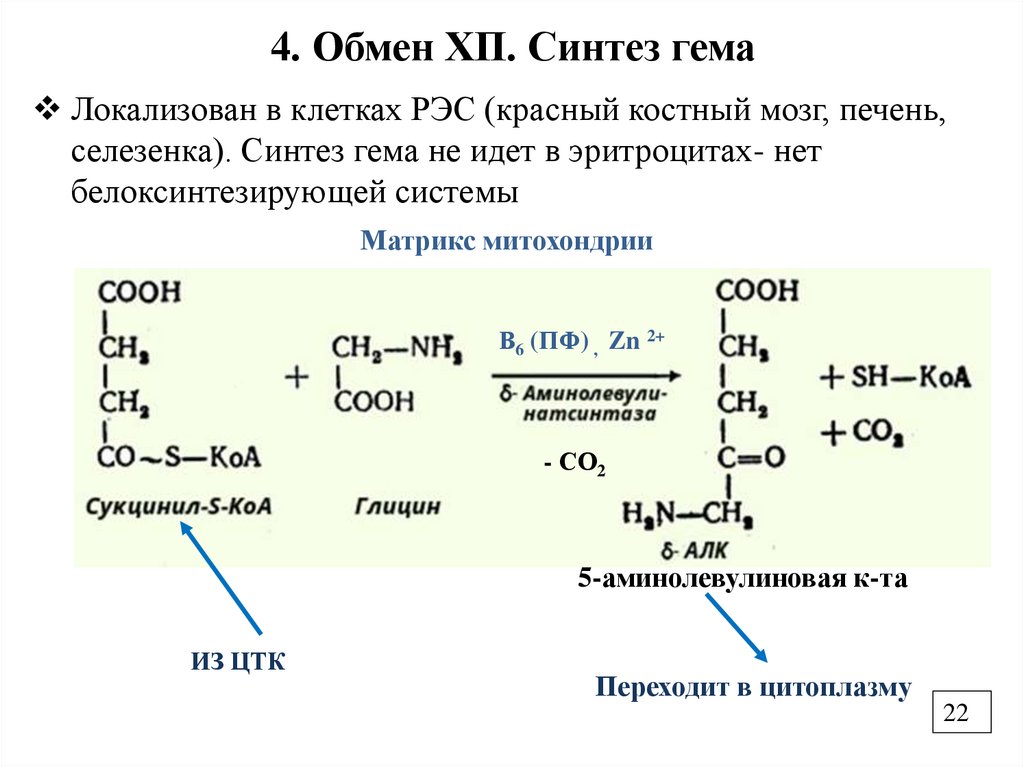
4. Обмен ХП. Синтез гемаЛокализован в клетках РЭС (красный костный мозг, печень,
селезенка). Синтез гема не идет в эритроцитах- нет
белоксинтезирующей системы
Матрикс митохондрии
В6 (ПФ) , Zn 2+
- СО2
5-аминолевулиновая к-та
ИЗ ЦТК
Переходит в цитоплазму
22
23.
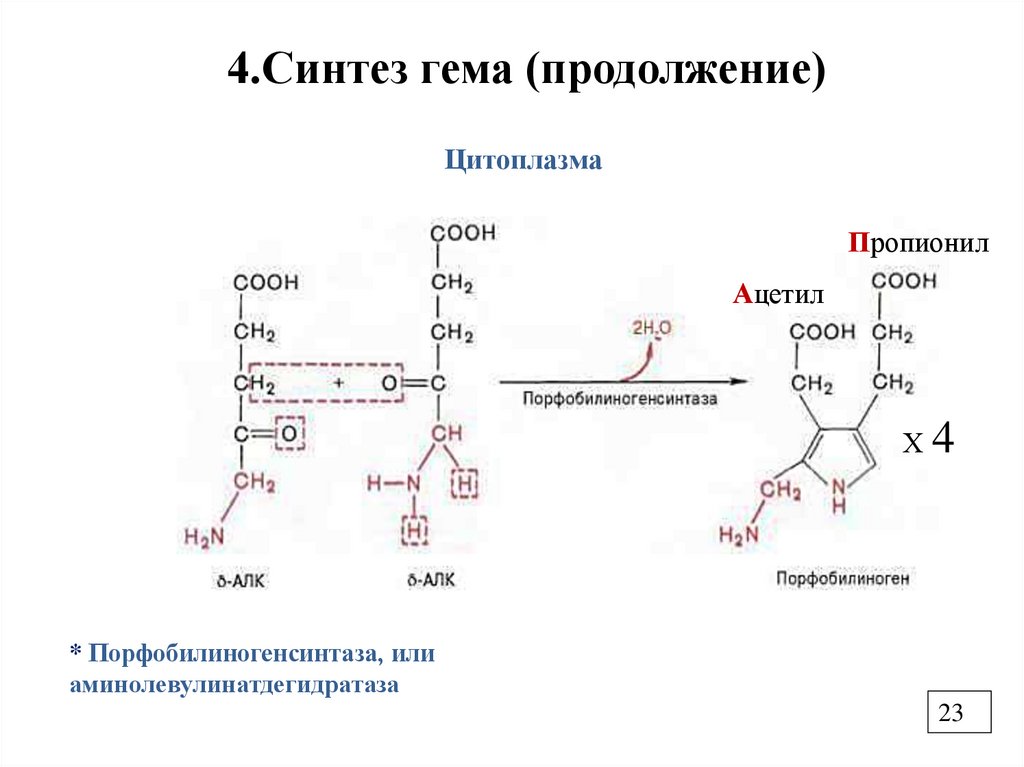
4.Синтез гема (продолжение)Цитоплазма
Пропионил
Ацетил
Х4
* Порфобилиногенсинтаза, или
аминолевулинатдегидратаза
23
24.
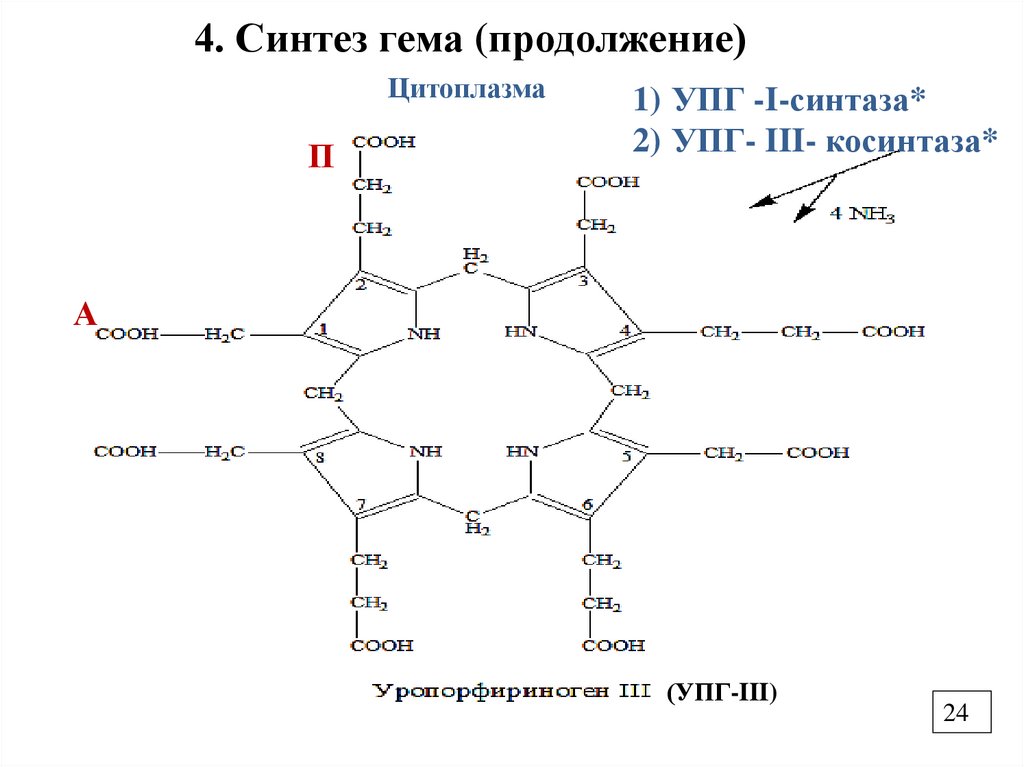
4. Синтез гема (продолжение)Цитоплазма
П
1) УПГ -I-синтаза*
2) УПГ- III- косинтаза*
А
(УПГ-III)
24
25.
*Уропорфириноген –I- синтаза(порфобилиногендезаминаза, или
гидроксиметилбилансинтаза (ЕС 2.5.1.61),
участвует в третьей стадии биосинтеза гема. Он
катализирует конденсацию четырех
молекул порфобилиногена от головы к хвосту в
линейный гидроксиметилбилан высвобождая при
этом четыре молекулы аммиака.
* УПГ- III- косинтаза превращает линейный
гидроксиметилбилан в уропорфириноген III
25
26.
4. Синтез гема (продолжение)Цитоплазма
КПГ- III-синтаза
(уропорфириногендекарбоксилаза)
М
М
М
М
IV
В результате
декарбоксилирования
УПГ- III в положениях
1,3,5,8 четыре
ацетильных остатка (А)
превращаются в
метильные группы (М).
Переходит в
митохондрию
III (КПГ-III)
26
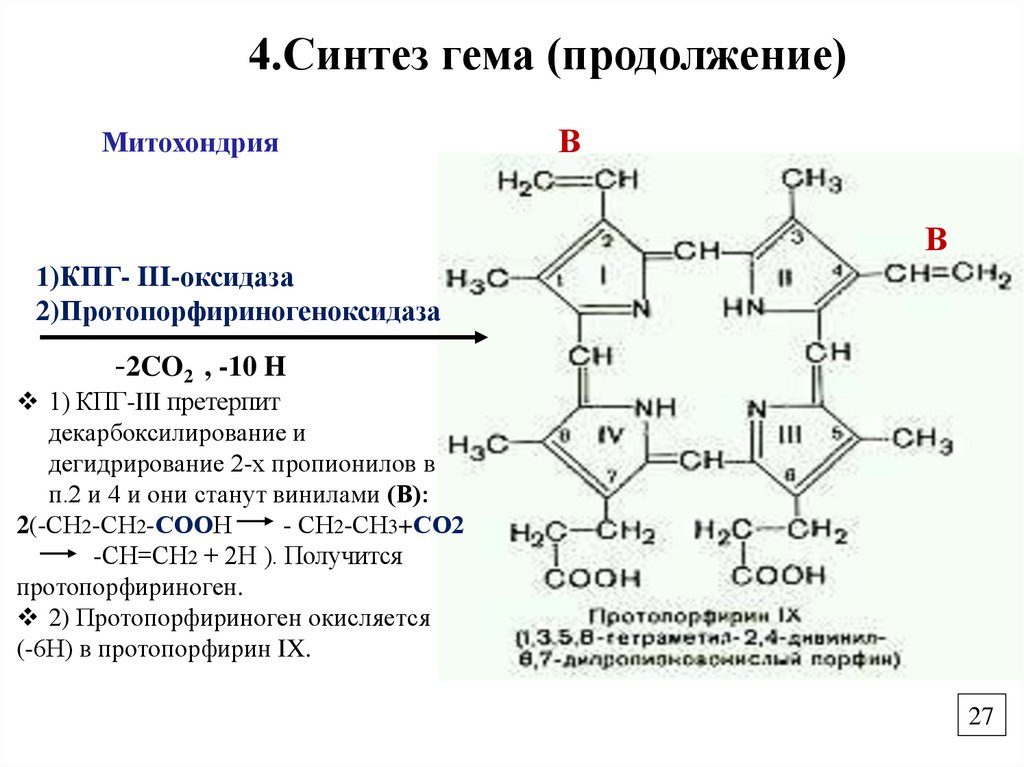
27.
4.Синтез гема (продолжение)Митохондрия
В
В
1)КПГ- III-оксидаза
2)Протопорфириногеноксидаза
-2CO2 , -10 H
1) КПГ-III претерпит
декарбоксилирование и
дегидрирование 2-х пропионилов в
п.2 и 4 и они станут винилами (В):
2(-СН2-СН2-СООН
- СН2-СН3+СО2
-СН=СН2 + 2Н ). Получится
протопорфириноген.
2) Протопорфириноген окисляется
(-6Н) в протопорфирин IX.
27
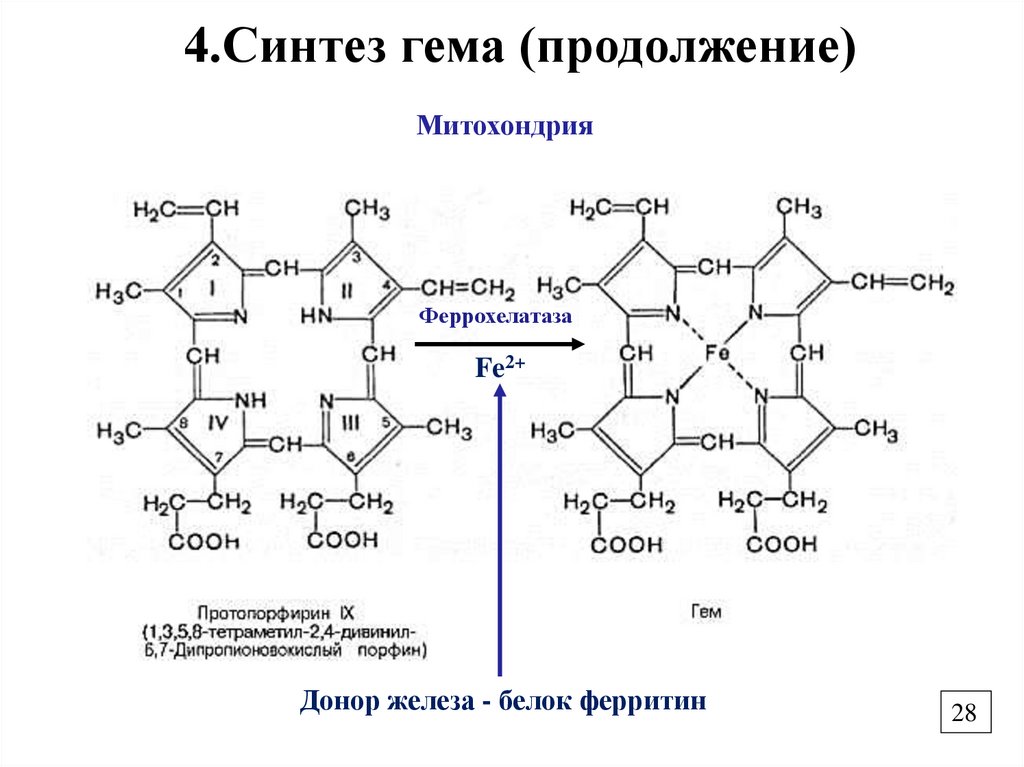
28.
4.Синтез гема (продолжение)Митохондрия
Феррохелатаза
Fe2+
Донор железа - белок ферритин
28
29.
Гем + белок = гемопротеин• Белки: гемоглобин, миоглобин, цитохромы ЦПЭ, цитохромы
микросомальные (Р450, В5)
• Ферменты: каталаза, пероксидаза,
NO-синтаза, гуанилатциклаза,
триптофанпирролаза.
Аномальные гемоглобины
Точечные мутации в одном из генов, кодирующих синтез α-, β ,γ-, δ- цепей, сопровождаются появлением аномальных
гемоглобинов (около 300).
• Например, HbS: (βГлу6 βВал6)-серповидно-клеточная
анемия (частичноприемлимая мутация).
• Hb M появляется при замене в β-цепях Гис-87, участвующего
в связывании глобина с железом гема на другие
аминокислоты, чаще Тир (неприемлимая мутация).
29
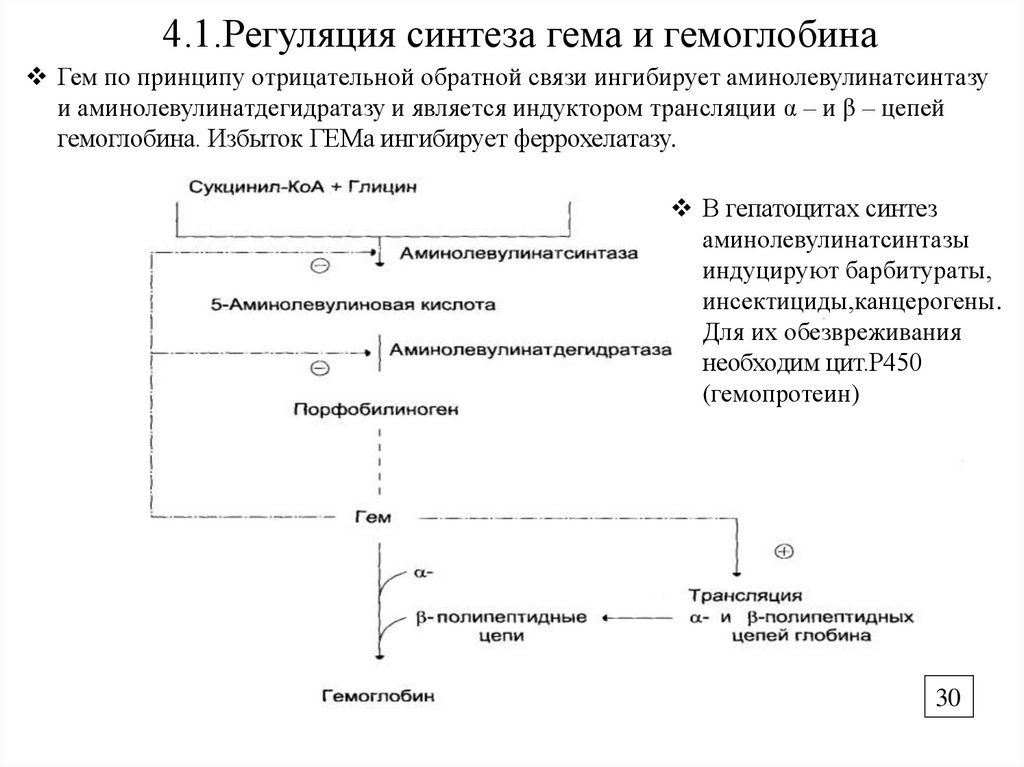
30.
4.1.Регуляция синтеза гема и гемоглобинаГем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является индуктором трансляции α – и β – цепей
гемоглобина. Избыток ГЕМа ингибирует феррохелатазу.
В гепатоцитах синтез
аминолевулинатсинтазы
индуцируют барбитураты,
инсектициды,канцерогены.
Для их обезвреживания
необходим цит.Р450
(гемопротеин)
30
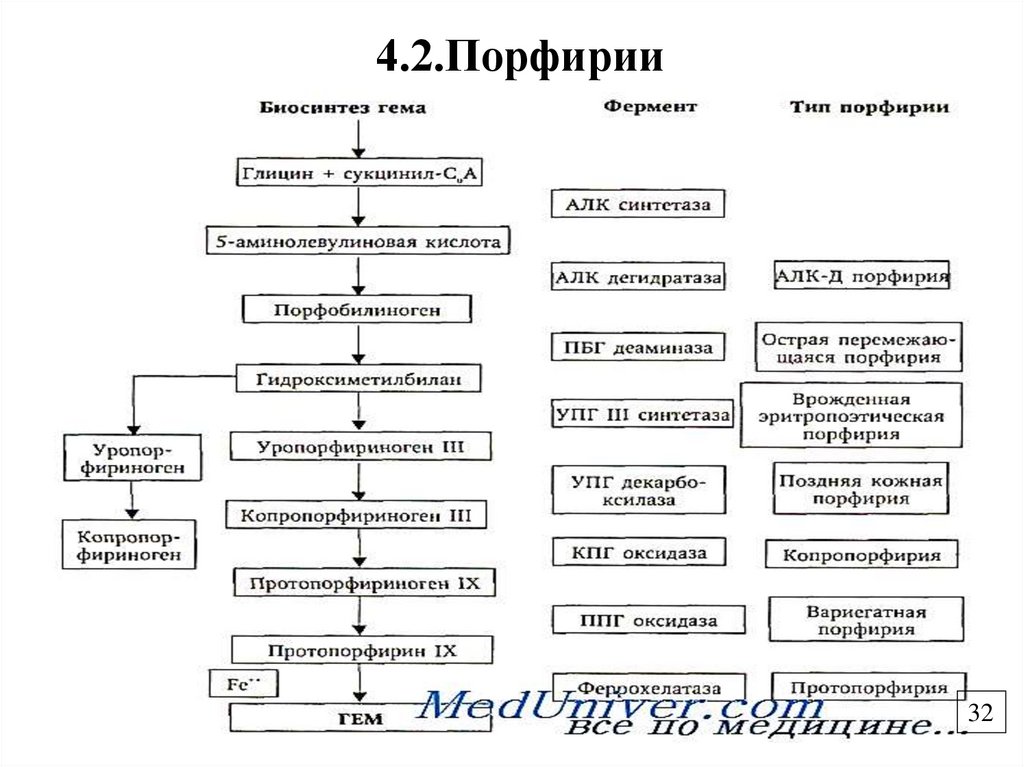
31.
4.2. ПорфирииГруппа заболеваний, связанных с нарушением работы ферментов
синтеза гема и сопровождающихся накоплением порфиринов и
их предшественников.
Отмечается порфиринемия, порфиринурия, отложение
порфиринов в тканях.
Бывают наследственные (генетические дефекты ферментов
синтеза гема) и приобретенные (при отравлении тяжелыми
металлами, диоксинами)
По локализации делятся на печеночные (копропорфирия, острая
перемежающаяся порфирия, урокопропорфирия),
эритропоэтические (уропорфирия, протопорфирия), смешанные.
Клинические проявления: повышенная светочувствительность
(светобоязнь, эритема, дерматит),расстройства работы ЖКТ,
нейропсихические расстройства.
31
32.
4.2.Порфирии32
33.
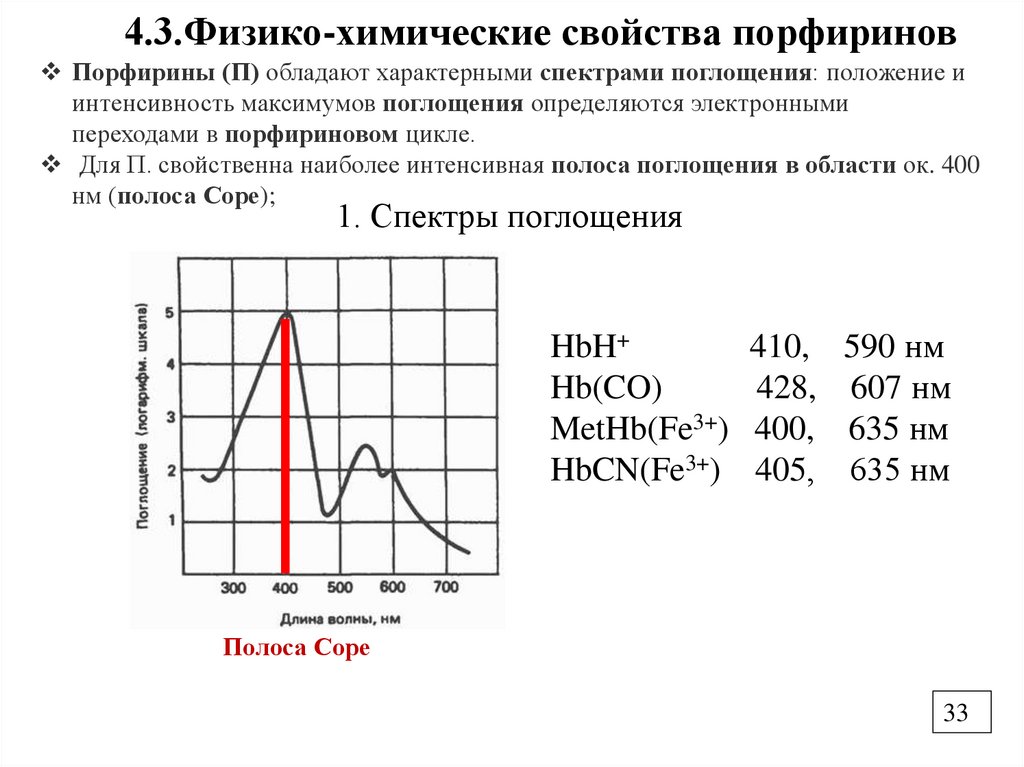
4.3.Физико-химические свойства порфириновПорфирины (П) обладают характерными спектрами поглощения: положение и
интенсивность максимумов поглощения определяются электронными
переходами в порфириновом цикле.
Для П. свойственна наиболее интенсивная полоса поглощения в области ок. 400
нм (полоса Соре);
1. Спектры поглощения
HbH+
410, 590 нм
Hb(CO)
428, 607 нм
MetHb(Fe3+) 400, 635 нм
HbCN(Fe3+) 405, 635 нм
Полоса Соре
33
34.
4.3.Физико-химические свойства порфиринов2. Красная флюоресценция (при облучении УФ в
сильнокислой рН) –
выявление скрытой крови
3. Переход в возбужденное состояние при действии
аргонового лазера (514,5 нм, 528,7 нм) –
фототерапия опухолей
фотодинамическая терапия (ФДТ)
при обработке кариозных полостей
4. Порфириногены бесцветны, но при окислении О2
окрашиваются (темнеют) –
диагностика порфирий
34
35.
5.Обмен железа(С пищей)Fe3+
Fe2+
HCl, Vit C
Мобилферрин (всасывание, поступление в энтероцит)
В тканях: Апоферритин + Fe2+
Ферритин (Fe3+ )
В крови: 1) Fe2+ окисляется феррооксидазой в Fe3+
2)Трансферрин (связывает 2 мол. Fe3+)
При внутрисосудостом гемолизе эритроцитов:
Гаптоглобин (связывает гемоглобин)
Гемопексин (связывает гем)
↑железа + ферритин
Гемосидерин
Гемохроматоз (избыточное отложение в органах и
тканях)
Железодефицитная анемия
35
36.
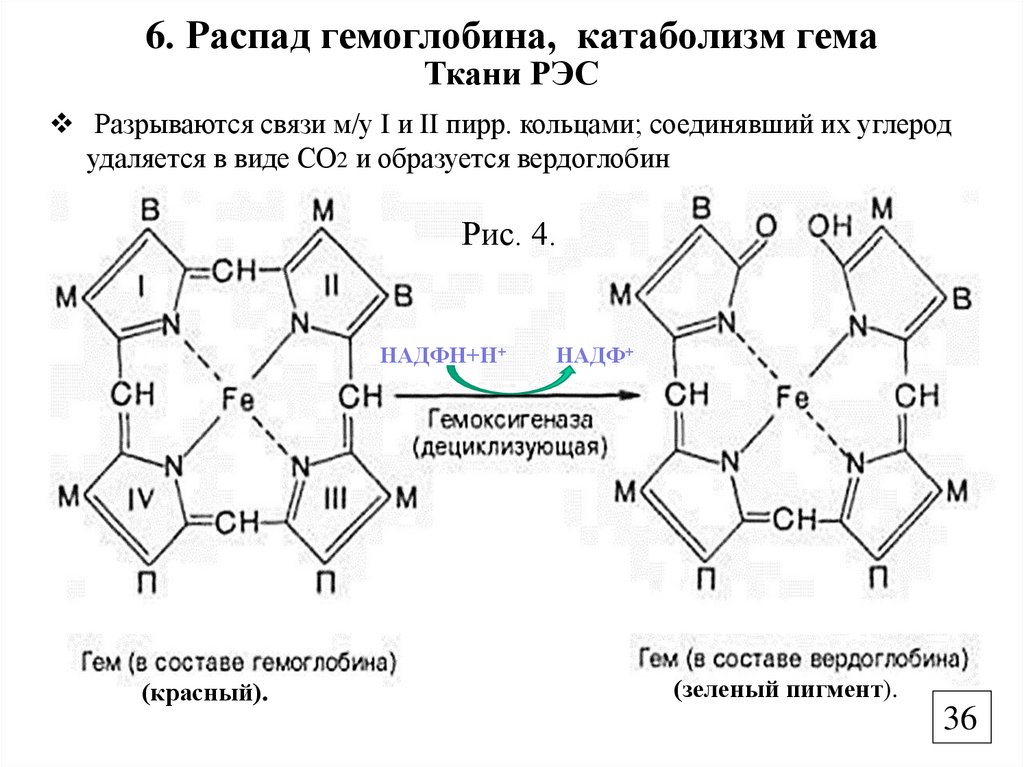
6. Распад гемоглобина, катаболизм гемаТкани РЭС
Разрываются связи м/у I и II пирр. кольцами; соединявший их углерод
удаляется в виде СО2 и образуется вердоглобин
Рис. 4.
НАДФН+Н+
(красный).
НАДФ+
(зеленый пигмент).
36
37.
6. Распад гемоглобина, катаболизм гема.Ткани РЭС
Гемоглобин (красный)
НАДФН+Н+ , О2 Гемоксигеназа ( Рис.4)
НАДФ+
Вердоглобин (зеленый)
Железо (Fe3+)
Глобин НАДФН+Н+
Биливердин
НАДФ +
(желто-оранжевый)
Билирубин
(желто-зеленый) ( Рис.5) Биливердинредуктаза (непрямой)
В крови билирубин непрямой + альбумины
37
38.
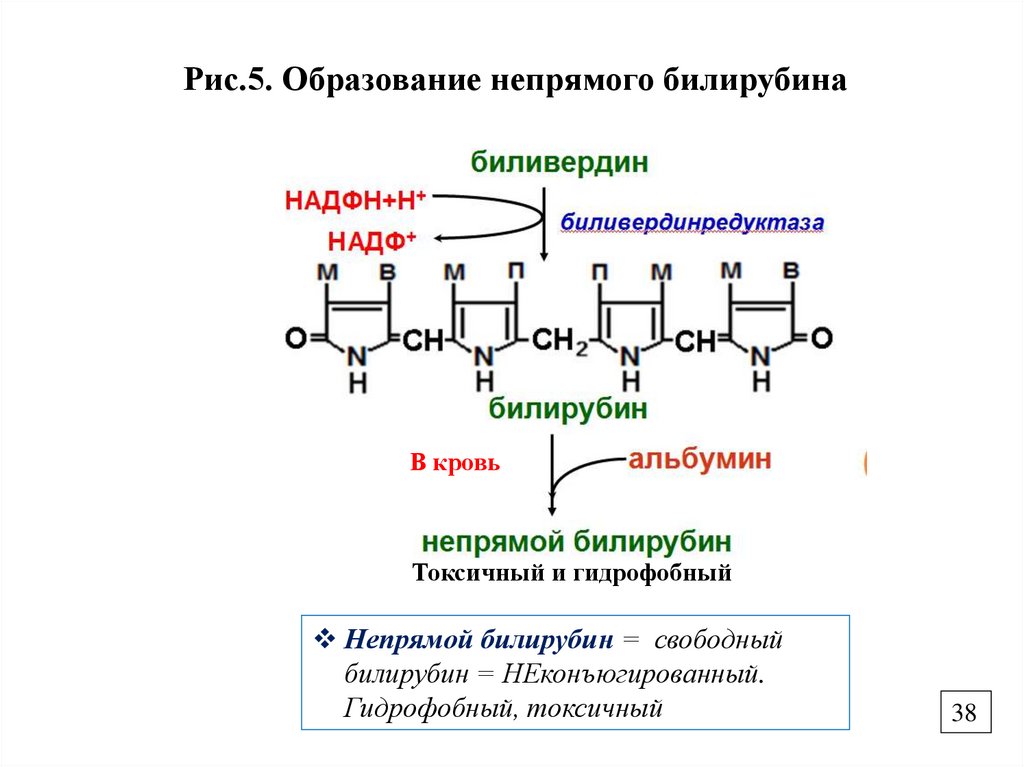
Рис.5. Образование непрямого билирубинаВ кровь
Токсичный и гидрофобный
Непрямой билирубин = свободный
билирубин = НЕконъюгированный.
Гидрофобный, токсичный
38
39.
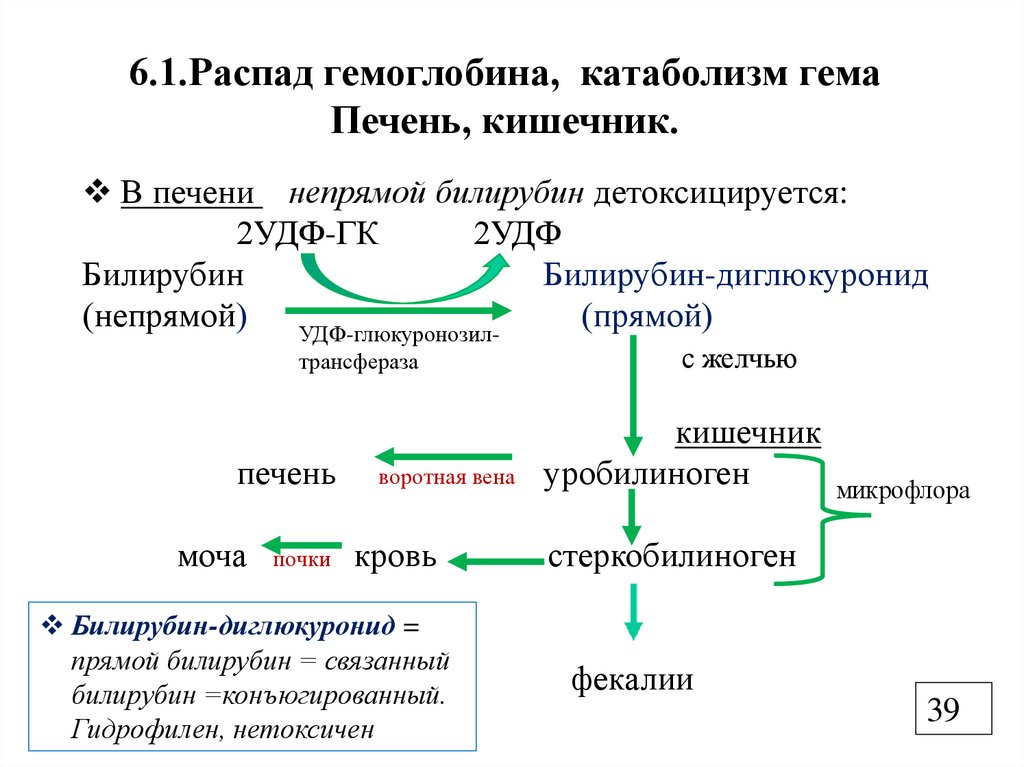
6.1.Распад гемоглобина, катаболизм гемаПечень, кишечник.
В печени непрямой билирубин детоксицируется:
2УДФ-ГК
2УДФ
Билирубин
Билирубин-диглюкуронид
(непрямой)
(прямой)
УДФ-глюкуронозилтрансфераза
печень
моча
почки
воротная вена
кровь
Билирубин-диглюкуронид =
прямой билирубин = связанный
билирубин =конъюгированный.
Гидрофилен, нетоксичен
с желчью
кишечник
уробилиноген
микрофлора
стеркобилиноген
фекалии
39
40.
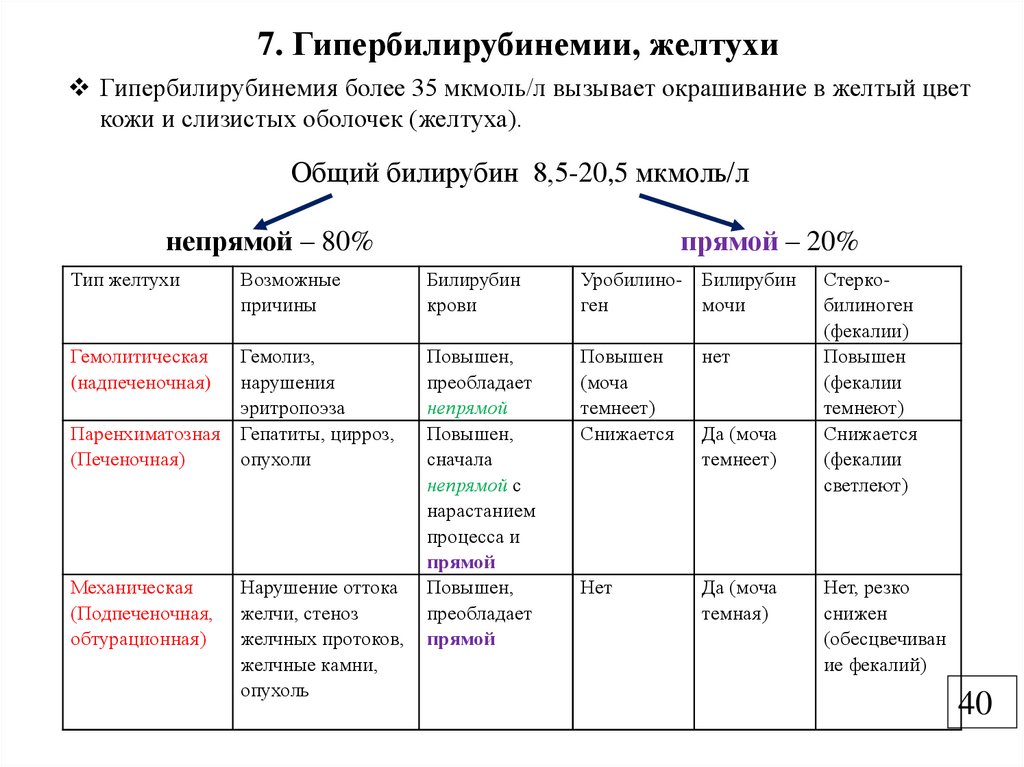
7. Гипербилирубинемии, желтухиГипербилирубинемия более 35 мкмоль/л вызывает окрашивание в желтый цвет
кожи и слизистых оболочек (желтуха).
Общий билирубин 8,5-20,5 мкмоль/л
непрямой – 80%
Тип желтухи
Возможные
причины
Гемолитическая
(надпеченочная)
Гемолиз,
нарушения
эритропоэза
Паренхиматозная Гепатиты, цирроз,
(Печеночная)
опухоли
Механическая
(Подпеченочная,
обтурационная)
Нарушение оттока
желчи, стеноз
желчных протоков,
желчные камни,
опухоль
прямой – 20%
Билирубин
крови
Уробилино- Билирубин
ген
мочи
Повышен,
преобладает
непрямой
Повышен,
сначала
непрямой с
нарастанием
процесса и
прямой
Повышен,
преобладает
прямой
Повышен
(моча
темнеет)
Снижается
нет
Нет
Да (моча
темная)
Да (моча
темнеет)
Стеркобилиноген
(фекалии)
Повышен
(фекалии
темнеют)
Снижается
(фекалии
светлеют)
Нет, резко
снижен
(обесцвечиван
ие фекалий)
40
41.
II. Рекомендуемая литература8. Рекомендуемая литература
Основная литература
Биохимия /Северин Е.С. М. «ГЭОТАР-Медиа». 2005 г. - с.45-55, 636664, 2011г. – с. 45-55, 623-673. (РАЗДЕЛ 13, 14).
Биохимия [Электронный ресурс] : учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп.
- М. : ГЭОТАР- Медиа, 2015. - http://www.studmedlib.ru / book / ISBN9785970433126.html
(РАЗДЕЛ 13, 14).
2. а) Биологическая химия. Биохимия полости рта: учебник / Т.П. Вавилова, А.Е. Медведев.
- М.: ГЭОТАР-Медиа, 2014. - С. 377-389, 496-515) ЧАСТЬ V, гл. 17; ЧАСТЬ VII, глава 25.
б) Биологическая химия. Биохимия полости рта [Электронный ресурс]: учебник / Т.П.
Вавилова, А.Е. Медведев - М. : ГЭОТАР- Медиа, 2014. - http://www.studmedlib.ru / book /
ISBN9785970430392.html (ЧАСТЬ V, глава 17; ЧАСТЬ VII, глава 25)
5. Сборник тестовых заданий по разделам биологической химии и биохимии полости рта:
учебно-методическое пособие для студентов стоматологического факультета / под ред. В.А.
Дадали, Ж.В. Антоновой, Р.Н. Павловой. - СПб. : Изд-во СЗГМУ им. И. И. Мечникова, 2017.
– С. 108-112.
Дополнительная литература
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М. Медицина, 1998.- с. 77-84,
590-593, 610-614, 628-637
41
42.
Благодарю за внимание !42

























 Химия
Химия








