Похожие презентации:
Хлор. Табиғатта таралуы
1.
Тақырыбы: ХлорОрындаған: Айтуар А.Е
Факультет: ТФП14-001-1
Тексерген: Кусаинова А.Қ
2.
Жоспар:1. Табиғатта таралуы
2. Атом құрылысы
3. Алынуы
4. Физикалық қасиеті
5. Химиялық қасиеті
3.
Хлор(лат. Clorum), Cl – элементтердің периодтық жүйесінің VІІтобындағы химиялық элемент, атомдық номері 17, атомдық
массасы 35,45; галогендер тобына жатады. Молекуласы екі
атомнан (Cl2) тұрады; өткір иісті сарғылт, жасыл түсті улы
газ; тығыздығы 0,3214 г/см3. Балқу t – 101°С; Табиғатта екі
тұрақты изотопы (35Cl мен 37Cl) бар. Жасанды радиоактивті
изотоптарының ішіндегі маңыздылары [34Сl(Т1/2 32,4 мин);
36Сl (Т1/2 3,08 105 жыл); 38Сl(Т1/2 37,29 мин)] химиялық
және биохимиялық процестерді зерттеуде пайдаланылады.
Хлорды алғаш швед химигі К. Шелле пиролюзитті тұз
қышқылымен әрекеттестіріп алған (1774). Жер қыртысындағы
салмақ мөлшері 4,5102%. Хлор өте активті элемент, бос күйінде
жанартау лавасында ғана, ал байланысқан түрінде тау
жыныстарында, теңіз, мұхит, өзен суларында, өсімдік және
жануарлар организмдерінде кездеседі. Байланыстағы хлор
көптеген минералдардың: галит, сильвин, сильвинит, карналлит,
т.б. құрам бөлігі. Қалыпты жағдайда хлор — сарғыш жасыл,
ерекше өткір иісті газ, тығыздығы 3,214 г/л, ауадан 2,5 есе
ауыр, қайнау t –33,6С, балқу t –100,98С.
4.
Суда жақсы ериді. Тотығу дәрежелері +1, +3, +4, +5, +7. Хлорхимиялық активті болғандықтан оның қосылыстары көптеген
металдармен, бейметалдармен тікелей әрекеттестіру арқылы,
ал оттек, азот, көміртек, инертті газдармен хлор
қосылыстары жанама жолмен алынады. Хлор кальций
гидрототығымен белгілі жағдайда әрекеттесіп, маңызды
техникалық өнімдер (хлорлы әк, гипохлорит, кальций хлораты,
т.б.) түзеді. Хлор көптеген органикалық қосылыстармен де
әрекеттеседі (қ. Хлорлау). Лабораторияда хлорды
4HCl+MnO2=MnCl2+Cl2+2H2O реакциясы арқылы, ал
өнеркәсіпте ас тұзының (NaCl) ерітіндісін электролиздеп
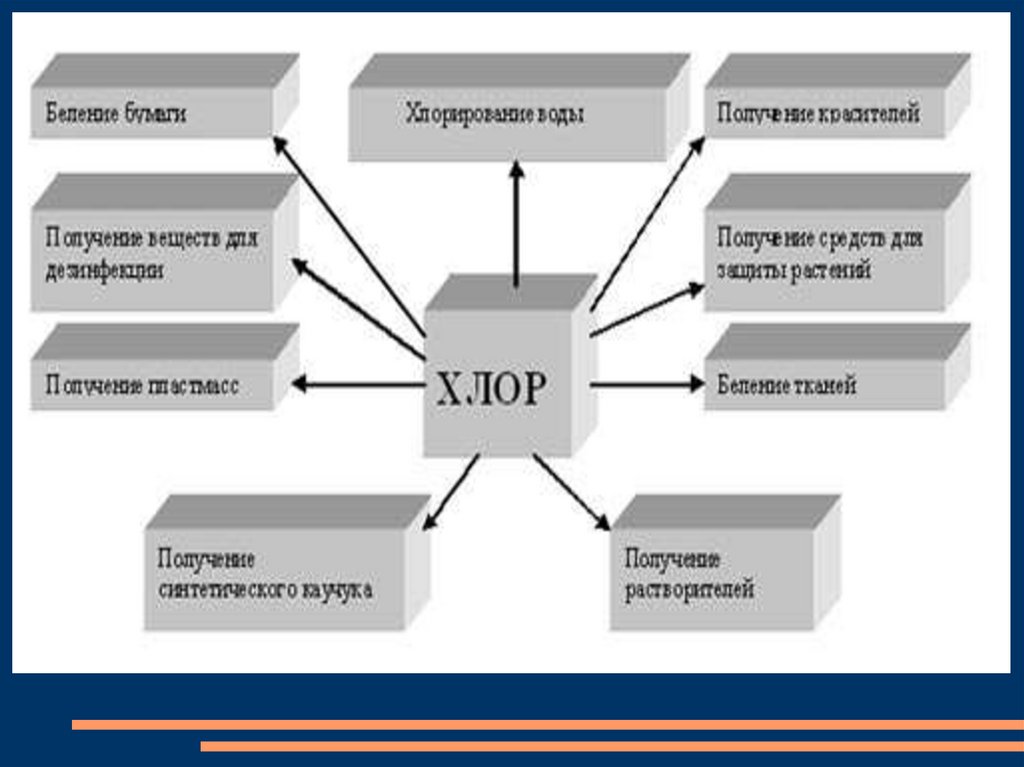
алады. Хлорды ауыз суды хлорлауға, мата, қағаз ағартуда, тұз
қышқылы мен органикалық синтезде, хлоры бар қосылыстар
даярлауда, т.б. қолданылады. Қазақстанда хлор Павлодар химия
зауытында өндіріледі.
5.
Табиғатта таралуыХлор табиғатта активті элемент болғандықтан тек
қосылыстар күйінде кездеседі. Негізінен сілтілік
және сілтілік-жер (II) металдарының хлоридтері
күйінде;
олар карналлит KC1*MgCl2*6Н2О,
сильвинит NaCl*KCl,
бишофит MgCl2*6Н2О,
галит тас тұзы NaCl
6.
карналлитбишофит
сильвинит
галит
7.
Ас тұзын тағамдық мақсаттан басқа салаларға да кең қолданады.Соның біріншісі- көкөністерді тұздау болса, екіншісі- тері илеу,
былғары жасау. Шикі теріге ашудас пен ас тұзының қоспасын жағып
илейді. Бояушылар бояуды матаға жақсы сіңіру үшін ас тұзын қосып,
басытқы дайындауды ерте кезден білген. Ас тұзы сода мен хлор
өндіруге , сілті алуға, шыны жасауға,медицинада дәрі-дәрмек өндіруге,
өндірісте жүннің майын кетіруге пайдаланылады.
Мұхит, теңіз, өзен суларында еріген натрий хлориді 0,8-3,5%
мөлшерде кездеседі. Теңіздің суы тартылып құрғаса,''таз тұзы'' деген
атпен белгілі, галит минералы пайда болады.
8.
Атом құрылысыХлор III периодтың, VII топтың негізгі топшасының элементі,
35,417С1 ядросындағы протон сандары 17, яғни ядро заряды +17,
электрондар саны 17, нейтрондар саны 18. Хлор атомының
электрондық формуласы: ls22s22p63s23p5, валенттілік
электрондары 3s23p53d0.
9.
АлынуыӨндірісте хлорды ас тұзының балқымасын электролиздеу арқылы
алатындығын айтқанбыз. Осы әдіспен жұмыс істейтін зауыт
Павлодарда орналасқан.
Зертханада концентірлі тұз қышкылына марганец диоксидін
(МnО2) қосып, тотықтыру арқылы алады.
+4
+2
MnO2+ 4HCl= Cl2+ MnCl2+ 2H2O
+4
+2
1
Mn+2e=Mn
2
0
2Cl-2e= Cl2
2
1
Осы әдіспен хлорды алғаш рет 1774 жылы швед оқымыстысы К. Шееле алғ
10.
+5-1
0
KClO3+ 6HCl= 3Cl2+ Kcl+3H2O
+5
-1
Cl+6e= Cl 2
1
-1
0
2Cl-2e=Cl2 6
3
+7
-1
0
+2
2KMnO4+16HCl=5Cl2+ 2MnCl2+ 2KCl+ 8H2O
+7 +2
Mn+5e= Mn 2
0
2Cl-2e= Cl2 5
11.
Физикалық қасиеттеріХлор - сарғыш-жасыл түсті тұншықтырғыш улы газ. Онымен
тек тартпа шкафтың ішінде жұмыс жасау керек. Хлор ауадан
2,5 еседей ауыр. (Daya = М(С12)/М(ауа) = 71/29 = 2,45),
сондықтан оны ауаны ығыстыру арқылы жинайды, ыдыстың
аузын жоғары қаратып ұстауға да болады. Суды ығыстыру
арқылы жинауға болмайды, себебі хлор сумен химиялық
әрекеттесіп, хлор «суын» түзеді.
12.
Химиялық қасиеттеріХлор бос күйінде едәуір белсенді зат, алайда оның белсенділігі
фторға қарағанда төмен. Хлор оттегі, азот және бекзат
газдардан басқа жай заттардың барлығымен дерлік
әрекеттеседі, ол үшін жылу немесе жарықтандыру қажет.
Н2 + С12 = 2HC1
Бұл реакцияны былай жүргізуге болады
Енді осы сынауықтарды су құйылған ыдысқа төңкерсек, сынауықтардың бойымен судың к
13.
14.
15.
Қолданылған әдебиеттер:www.google.kz
https://ru.wikipedia.org/
http://www.alhimikov.net/














 Химия
Химия








