Похожие презентации:
Определение качества питьевой воды (по жесткости и нитратам)
1. Определение качества питьевой воды (по жесткости и нитратам)
Исследовательский проектучениц 11 класса МОУ «Гатчинская СОШ №7»
Бусько Алены и Евдокимовой Олеси
Руководители: Васильева В.К.,
Сляпцова Т.Н., Яковлева И.А.
2. Актуальность темы
• Вода — это самое распространенное на Земле вещество. Почти3/4 поверхности земного шара покрыты водой.
• Человеческий организм на 60-70% состоит из воды. Вода
поставляет в клетки организма питательные вещества
(витамины, глюкозу, минеральные соли), участвует в процессе
терморегулирования и дыхания. Увы, времена, когда можно
было без опасений выпить воды из ручья, колодца, или просто
из под крана, давно канули в Лету. Та вода, которая течет в
наши квартиры по водопроводу – это скорее техническая вода,
нежели чем питьевая. По данным ЮНЕСКО 80% всех
заболеваний связано с качеством питьевой воды.
3. Цели проекта
Определить уровень жесткости питьевой воды.
Уровень pH питьевой воды.
Определить содержание нитратов в воде.
Сравнить полученные результаты с ПДК.
Сделать выводы о качестве питьевой воды.
4. Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+),
а также других щелочноземельных
металлов, обуславливающих
жесткость, присутствуют во всех
минерализованных водах. Их
источником являются природные
залежи известняков, гипса и
доломитов. Ионы кальция и магния
поступают в воду в результате
взаимодействия растворенного
диоксида углерода с минералами и
при других процессах растворения и
химического выветривания горных
пород. Источником этих ионов могут
служить также микробиологические
процессы, протекающие в почвах на
площади водосбора, в донных
отложениях, а также сточные воды
различных предприятий.
5.
• Жёсткая вода при умываниисушит кожу, в ней плохо
образуется пена при
использовании мыла.
Использование жёсткой воды
вызывает появление осадка
(накипи) на стенках котлов, в
трубах и т. п. Потребление
жёсткой воды обычно не
является опасным для
здоровья, хотя есть данные о
том, что высокая жёсткость
способствует образованию
камней в почках.
6. Виды жесткости
• Общая жесткость. Определяется суммарной концентрациейионов кальция и магния. Представляет собой сумму
карбонатной (временной) и некарбонатной (постоянной)
жесткости.
• Карбонатная жесткость. Обусловлена наличием в воде
гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния.
Данный тип жесткости почти полностью устраняется при
кипячении воды и поэтому называется временной жесткостью.
При нагреве воды гидрокарбонаты распадаются с
образованием угольной кислоты и выпадением в осадок
карбоната кальция и гидроксида магния.
• Некарбонатная жесткость. Обусловлена присутствием
кальциевых и магниевых солей сильных кислот (серной,
азотной, соляной) и при кипячении не устраняется (постоянная
жесткость).
7.
8. Источники воды, используемые человеком
• Различают подземные и поверхностные источники воды.Подземные - это скважины и колодцы различной глубины.
Как правило, вода, добываемая из подземных источников,
бывает прозрачной и бесцветной. В подземной воде обычно
содержится много растворенных минеральных веществ, часто
присутствуют повышенные концентрации железа (Fe) и
марганца (Mn). Количество минеральных веществ в воде из
разных скважин может сильно различаться, даже если эти
скважины расположены близко друг от друга.
9.
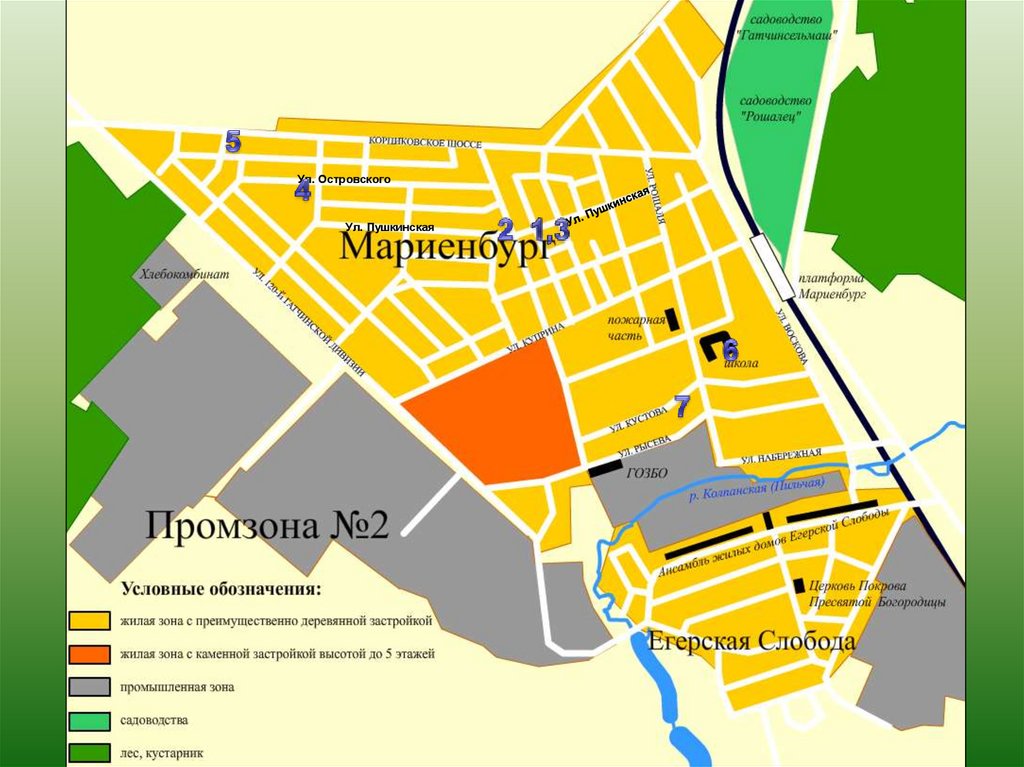
Ул. ОстровскогоУл. Пушкинская
10. Количественное определение общей жесткости в воде
Цель работы: изучение общей жесткостикак естественного параметра воды с
использованием метода количественного
определения.
Оборудование: из мини-экспресс
лаборатории «Пчелка У/хим»: склянка для
титрирования с пробкой, пипеткакапельница в футляре, колба, сливной
стакан.
Реактивы: раствор титранта, пробы воды
для анализа.
Ход работы:
1. Мерную склянку ополоснули несколько раз
анализируемой водой. В склянку налили 2,5
мл анализируемой воды.
2. Добавляли пипеткой-капельницей к пробе
раствор титранта по каплям до изменения
цвета раствора( от розового до сиреневосинего). Содержимое склянки
перемешивали встряхиванием.
3. Определили величину общей жесткости
воды в пробе в ммоль/л в зависимости от
количества капель раствора титранта.
11. Определение водородного показателя (pH) воды
Цель работы: изучение кислотности
воды как фактора,
характеризующего качество воды
водоисточника.
Информация: кислотность воды
характеризуют значением
водородного показателя (pH),
который для природных вод обычно
имеет значения от 6,5 до 8.5.
Изменение pH водоисточника часто
вызваны кислотными
загрязнителями, попадающими в
воду из воздуха, почвы. Изменение
pH воды сверх допустимых пределов
делает ее непригодной для
хозяйственно-питьевых нужд.
Оборудование: индикаторные
полоски для определения уровня pH,
контрольная шкала образцов
окраски полоски тест-системы для
определения уровня pH, пипеткакапельница, пробирка.
Реактивы: пробы воды для анализа.
12.
Ход работы:1. Пробирку сполоснули
несколько раз
анализируемой водой(5 мл);
2. Зажали кусочек
индикаторной полоски и
опустили его в пробирку с
водой;
3. Сравнили окраску кусочка
полоски с окраской
контрольной шкалы цветных
образцов, выбрав
ближайший по
интенсивности и характеру
окраски тестируемого
кусочка.
13. Определение количества нитратов в воде
• Цель работы: Оценкапитьевой воды на
содержание нитратов.
• Информация: В питьевой
воде допускается
присутствие нитратов до
45 мг/л. Потребление
питьевой воды составляет
1.5-2.0 л в день, т.е. 67-90
мг нитратов в день.
• Оборудование: из миниэспресс лаборатории
«Пчелка -У/хим» ножницы,
пинцет, чашка Петри.
• Реактивы: пробы воды
для анализа , тест-система
«Нитрат-тест».
14.
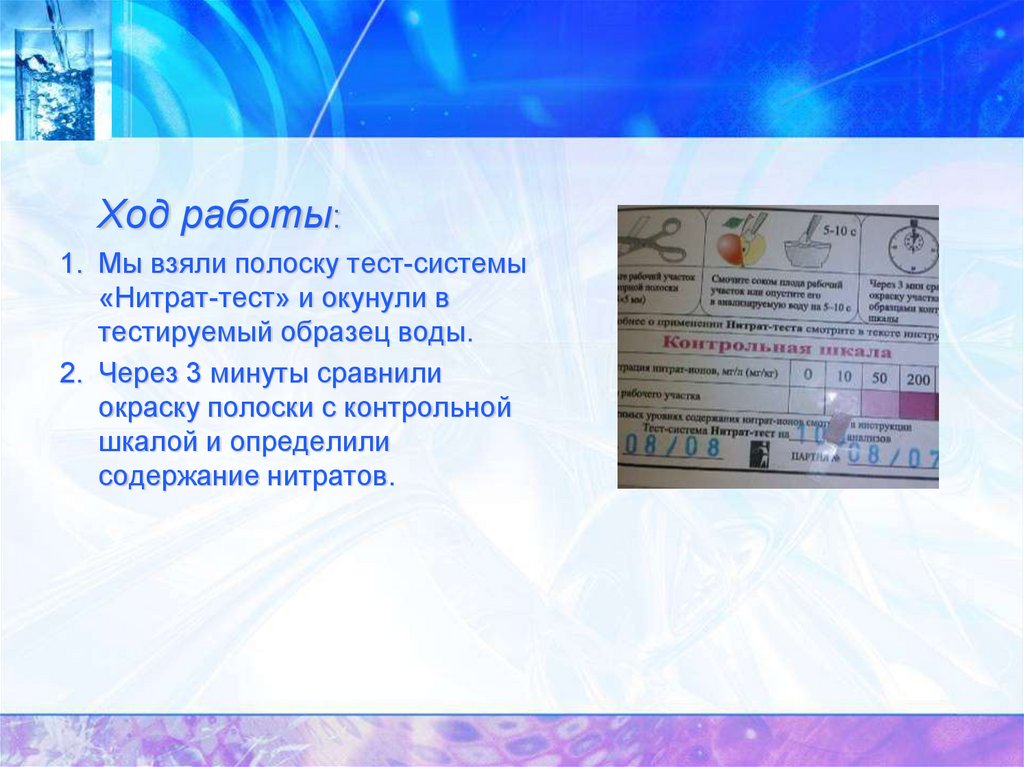
Ход работы:1. Мы взяли полоску тест-системы
«Нитрат-тест» и окунули в
тестируемый образец воды.
2. Через 3 минуты сравнили
окраску полоски с контрольной
шкалой и определили
содержание нитратов.
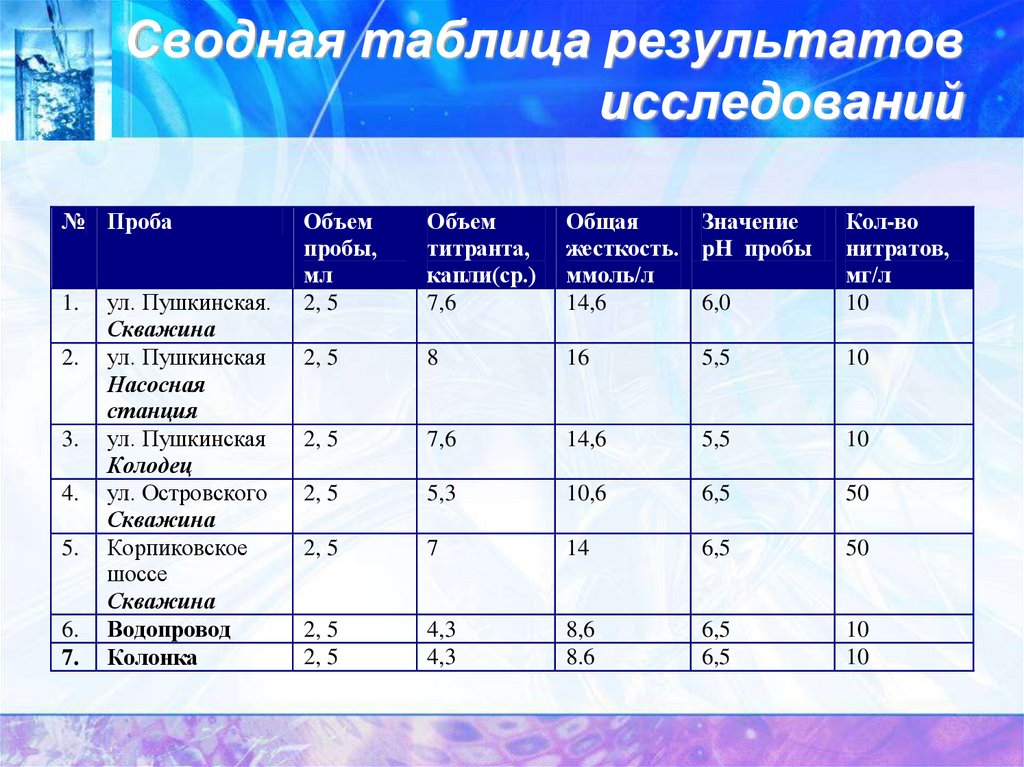
15. Сводная таблица результатов исследований
№ Проба1.
2.
3.
4.
5.
6.
7.
ул. Пушкинская.
Скважина
ул. Пушкинская
Насосная
станция
ул. Пушкинская
Колодец
ул. Островского
Скважина
Корпиковское
шоссе
Скважина
Водопровод
Колонка
Объем
пробы,
мл
2, 5
Объем
титранта,
капли(ср.)
7,6
Общая
Значение
жесткость. pH пробы
ммоль/л
14,6
6,0
Кол-во
нитратов,
мг/л
10
2, 5
8
16
5,5
10
2, 5
7,6
14,6
5,5
10
2, 5
5,3
10,6
6,5
50
2, 5
7
14
6,5
50
2, 5
2, 5
4,3
4,3
8,6
8.6
6,5
6,5
10
10
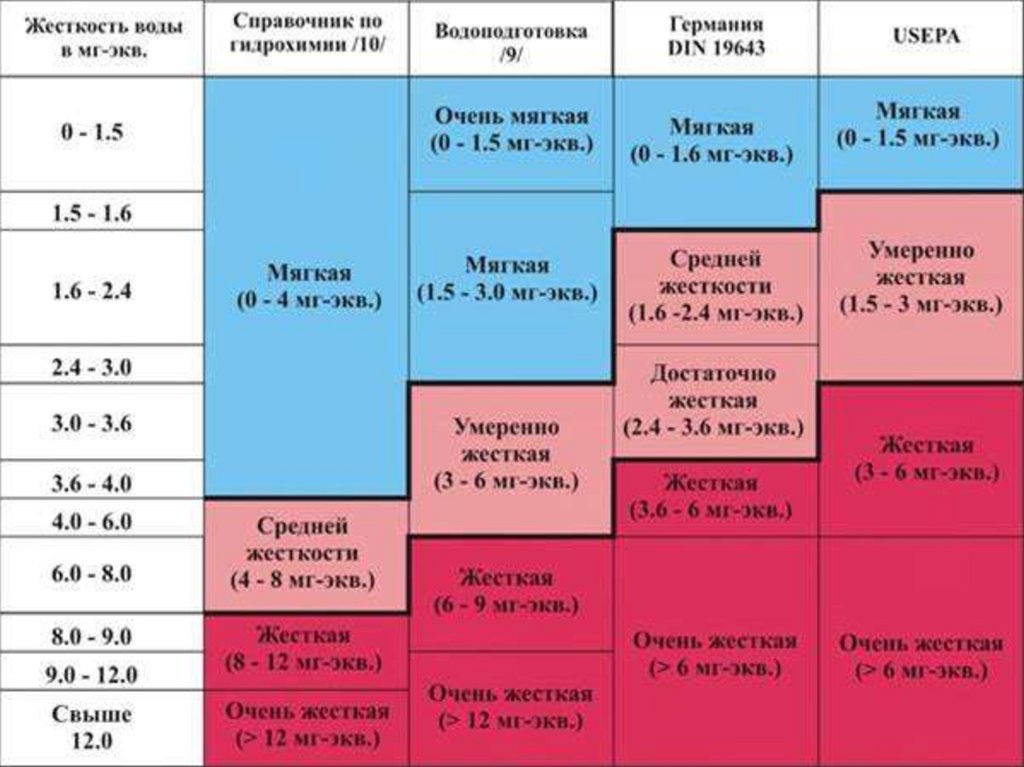
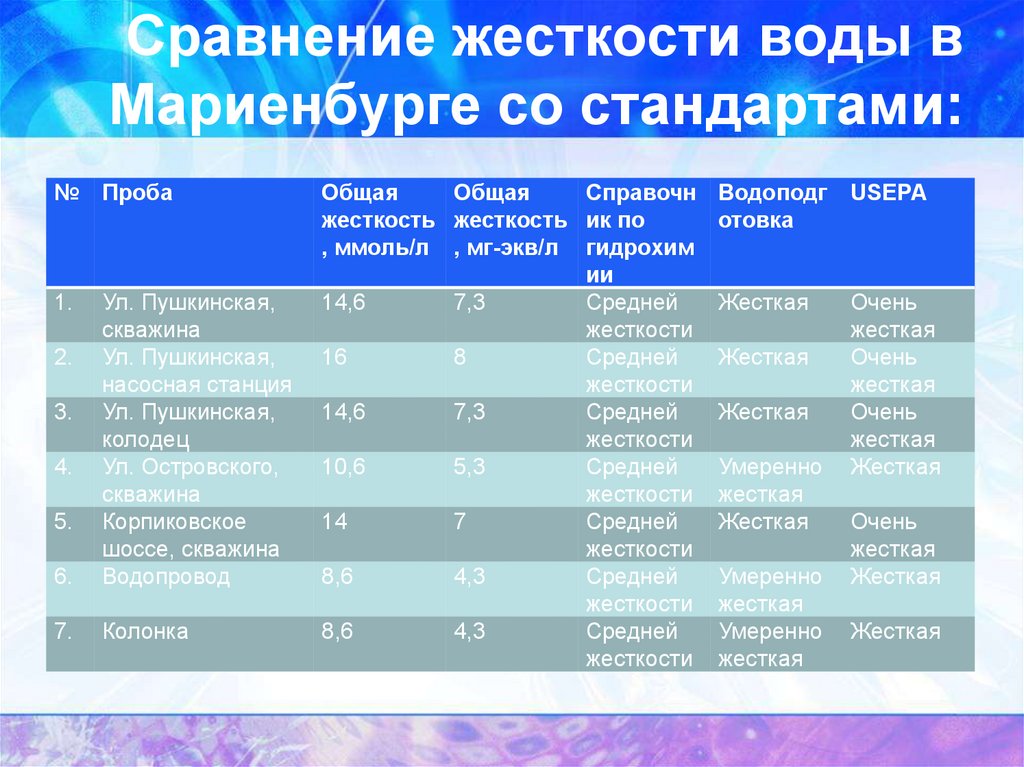
16. Сравнение жесткости воды в Мариенбурге со стандартами:
№ Проба6.
Ул. Пушкинская,
скважина
Ул. Пушкинская,
насосная станция
Ул. Пушкинская,
колодец
Ул. Островского,
скважина
Корпиковское
шоссе, скважина
Водопровод
7.
Колонка
1.
2.
3.
4.
5.
Общая
Общая
Справочн Водоподг
отовка
жесткость жесткость ик по
, ммоль/л , мг-экв/л гидрохим
ии
14,6
7,3
Жесткая
Средней
жесткости
16
8
Жесткая
Средней
жесткости
14,6
7,3
Жесткая
Средней
жесткости
10,6
5,3
Средней
Умеренно
жесткости жесткая
14
7
Жесткая
Средней
жесткости
8,6
4,3
Средней
Умеренно
жесткости жесткая
8,6
4,3
Средней
Умеренно
жесткости жесткая
USEPA
Очень
жесткая
Очень
жесткая
Очень
жесткая
Жесткая
Очень
жесткая
Жесткая
Жесткая
17. Умягчение воды
Способ умягчения водыОбщая
жесткость,
мг-экв/л
Исходный образец воды
10
Фильтр «гейзер»
2
Полифосфатный фильтр
10
Кипяченая вода
8
«Калгон»
7
Полифосфатный
фильтр
Фильтр
«Гейзер»
18. Выводы
В ходе работы был определен уровень жесткости питьевой воды в разных
источниках. Результаты исследования показали, что общая жесткость воды
превышает 6 мг-экв/л, что, согласно стандарту жесткости, соответствует
жесткой воде (в точках 1, 2, 3 и 5). Вода водопроводная и из колонки имеет
гораздо меньшую жесткость, но превышает нормативы СанПин.
Вода в точках 1,2,3 и 5 поступает из одного водоносного слоя, а водопроводная
вода имеет другое происхождение.
Водородный показатель pH, показывающий уровень кислотности среды,
оказался в пределах нормы во всех точках.
Содержание нитратов в пробах 4 и 5 равно 50 мг/л, что превышает ПДК на 5
мг/л (ПДК(H2O)=45 мг/л). В остальных пробах содержание нитратов не
превышает ПДК.
Питьевая вода в исследуемых точках безопасна, но жесткая вода может
явиться причиной заболеваний мочевыделительной системы, а повышенное
содержание нитратов может вызвать нарушение тканевого дыхания.
19. Рекомендации
1. Использовать в быту специальные фильтрыумягчители, которые снижают жёсткость воды,удаляя излишек солей жесткости (соединения
кальция, магния и других элементов).
2. В питьевой воде допускается присутствие нитратов
до 45 мг/л. Потребление питьевой воды (супы,
напитки и др.) составляет 1,5-2,0 в день, т.е. с водой
взрослый человек может употребить 67-70мг
нитратов в день.
20. Список источников
Муравьев А.Г. Руководство по определению показателей качества воды
полевыми методами. – СПб.: «Крисмас+», 1998. – 224 с.
Муравьев А.Г., Данилова В.В. Руководство по применению мини-экспресс
лаборатории «Пчелка-У» и ее модификаций при учебных при учебных
экологических исследованиях.- СПб.: «Крисмас+», 2006. – 136 с., ил.
http://ecoteka.ru/
http://www.water.ru/
http://www.vodoobmen.ru/
http://www.bestwater.ru/
http://www.ecoz.ru/
http://www.geliosco.ru/
21. Принцип действия ионообменного фильтра
• шарики смолы,способны
улавливать из воды
ионы различных
веществ и
''впитывать'' их в
себя, отдавая в
замен ''запасенные''
ранее ионы
22. Принцип действия полифосфатного фильтра
• При прохождениичерез кристаллы,
вода постепенно
растворяет их и
насыщается
определённым
количеством
полифосфата
натрия.

















 Экология
Экология








