Похожие презентации:
Количественное определение
1.
Количественное определение2.
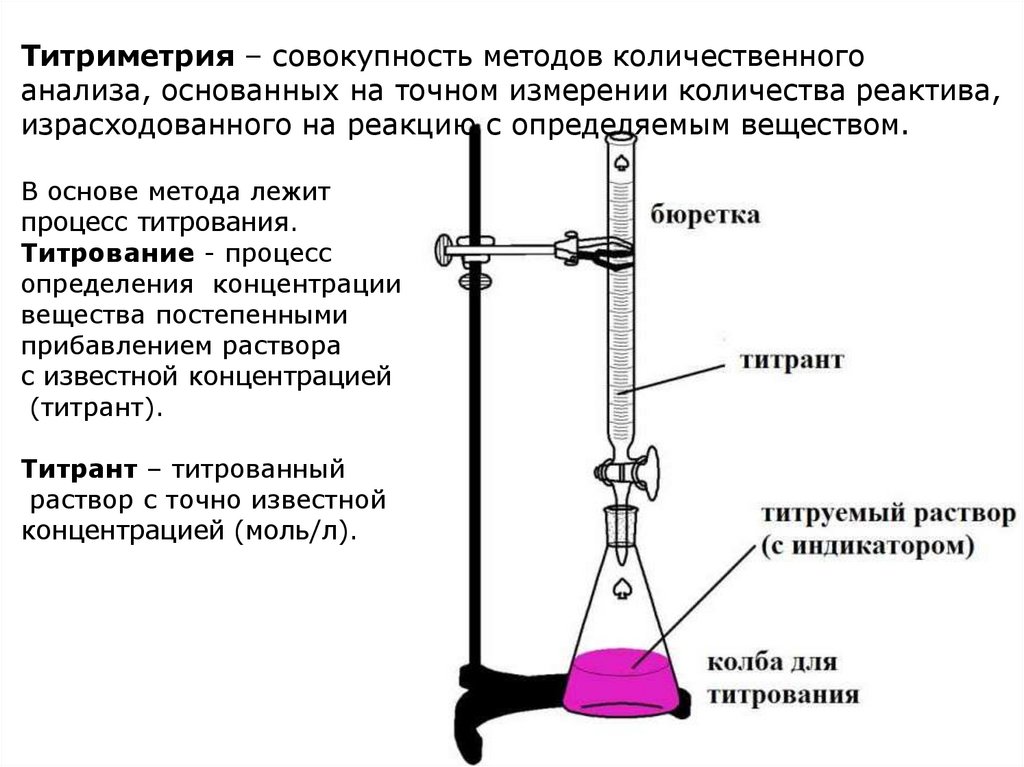
Титриметрия – совокупность методов количественногоанализа, основанных на точном измерении количества реактива,
израсходованного на реакцию с определяемым веществом.
В основе метода лежит
процесс титрования.
Титрование - процесс
определения концентрации
вещества постепенными
прибавлением раствора
с известной концентрацией
(титрант).
Титрант – титрованный
раствор с точно известной
концентрацией (моль/л).
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
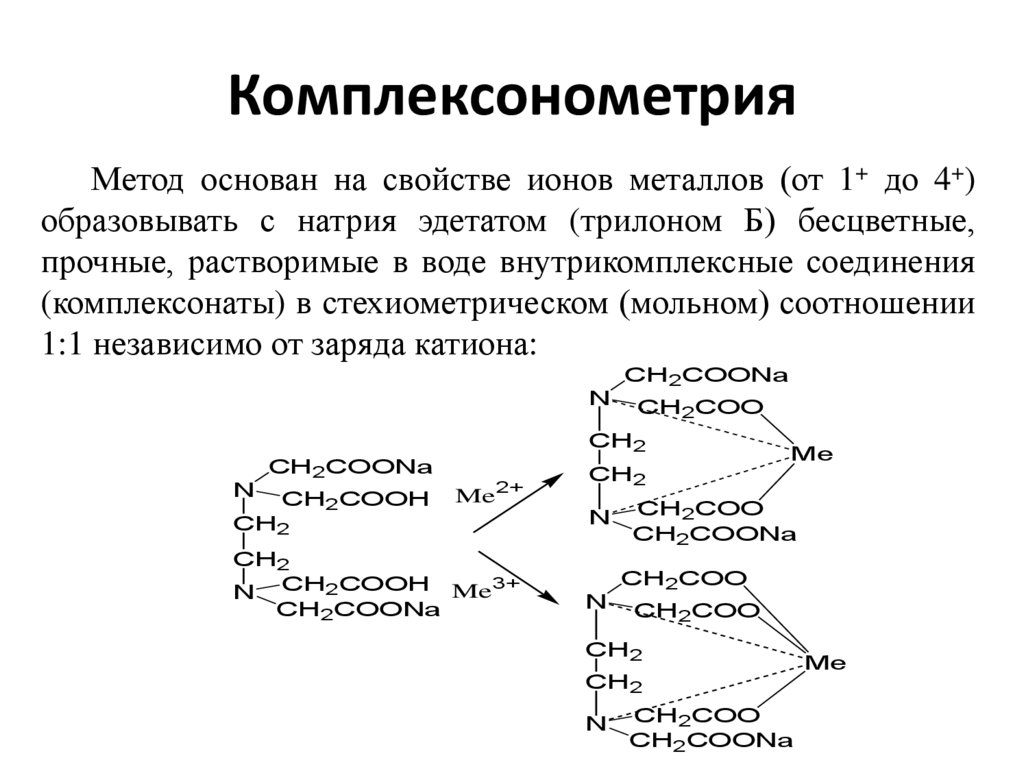
КомплексонометрияМетод основан на свойстве ионов металлов (от 1+ до 4+)
образовывать с натрия эдетатом (трилоном Б) бесцветные,
прочные, растворимые в воде внутрикомплексные соединения
(комплексонаты) в стехиометрическом (мольном) соотношении
1:1 независимо от заряда катиона:
CH2COONa
N
CH2COO
CH2
CH2COONa
N
CH2COOH
Me2+
CH2
CH2
3+
N CH2COOH Me
CH2COONa
Me
CH2
N
CH2COO
CH2COONa
CH2COO
N
CH2COO
CH2
CH2
N
CH2COO
CH2COONa
Me
19.
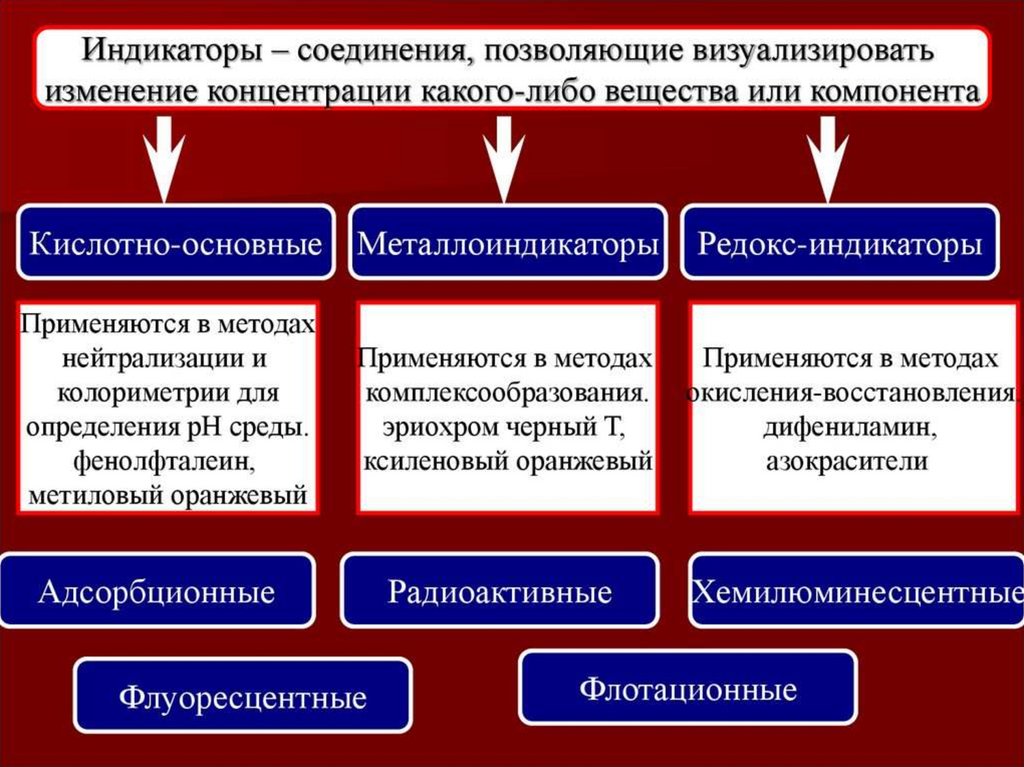
КомплексонометрияУсловия определения - создание рН среды для устойчивости
комплексов металла и индикатора с помощью буферных
растворов
Индикаторы –металлохромные органические красители:
- кислотный хром черный специальный (эриохром черный Т);
- хромовый темно-синий (кислотный хром темно синий);
- ксиленоловый оранжевый;
- хальконкарбоновая кислота;
- пирокатехиновый фиолетовый и др.
20.
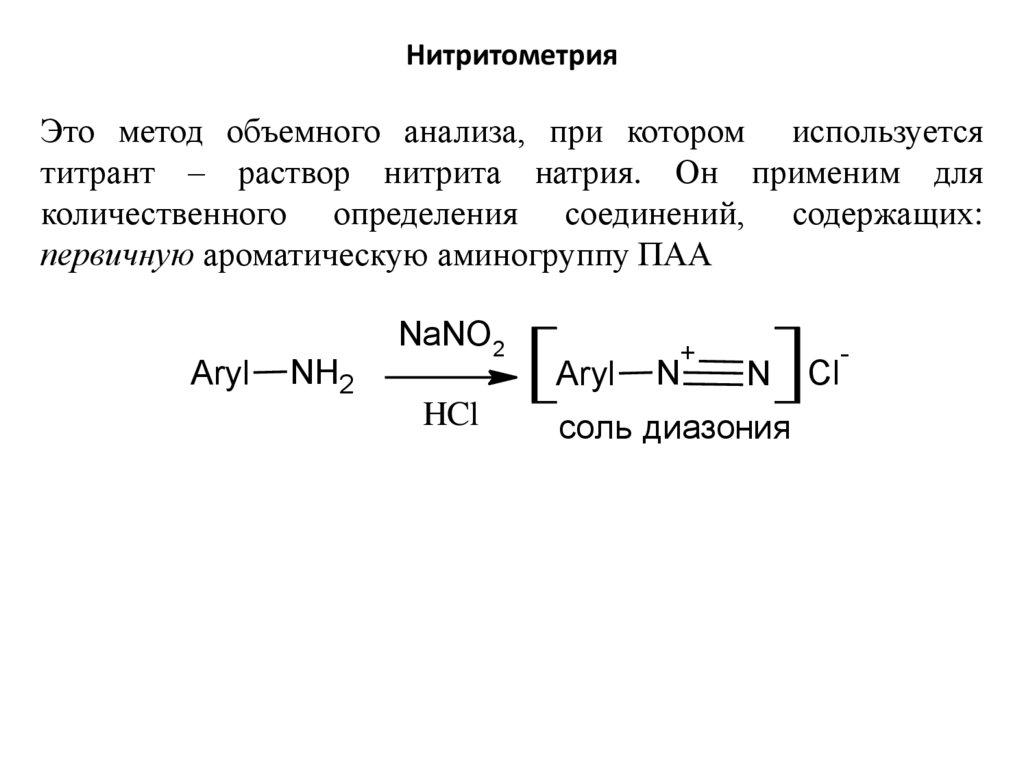
НитритометрияЭто метод объемного анализа, при котором используется
титрант – раствор нитрита натрия. Он применим для
количественного определения соединений, содержащих:
первичную ароматическую аминогруппу ПАА
Aryl
NH2
NaNO2
Aryl
HCl
+
N
N
соль диазония
Cl
-
21.
Основные условия титрованияСреда кислая разведенной хлороводородной кислоты, т.к. диазотирующим
агентом является азотистая кислота, т.е. реакция идет только в среде НСI.
процесс диазотирования катализируется, катализатор - КВг (он ускоряет реакцию
и стабилизирует соль диазония), добавляют 1,0 KBr.
Медленное титрование (т.к. соль диазония образуется не сразу, а через ряд
промежуточных стадий).
Температурный режим. Титрование проводят при пониженной температуре 1520оС, а в некоторых случаях при охлаждении до 0-5оС (ледяная баня), так как соли
диазония неустойчивы и легко разлагаются;
Точку эквивалентности устанавливают одним из следующих методов:
а) потенциометрическим
б) с помощью внутренних индикаторов:
A.тропеолин 00 (переход окраски из красного в желтый)
B.тропеолин 00 + метиленовый синий (красно-фиолетовый – голубой)
C.нейтральный красный (красно-фиолетовый – синий)
в) с помощью внешнего индикатора – йодкрахмальной бумаги
2KI + 2 NaNO2 + 4HCl → I2 + 2NO↑ + 2NaCl + 2KI + 2H2O
I2 + крахмал → синее окрашивание
22.
23.
24.
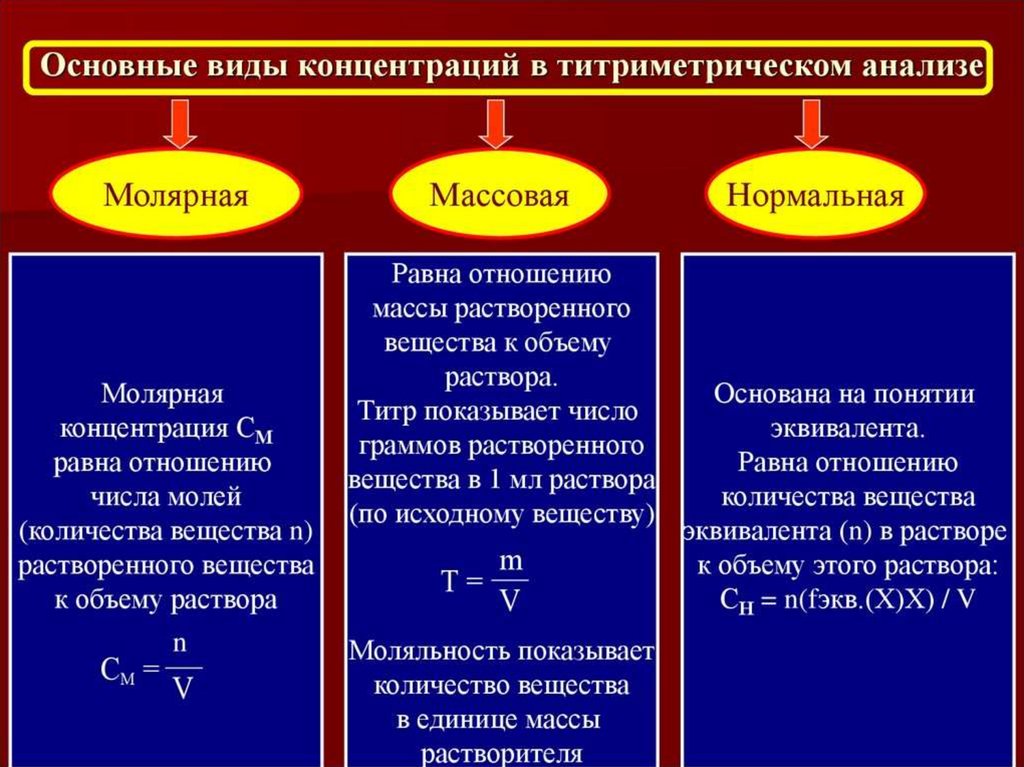
Расчет фактора эквивалентности, молярной массы эквивалента,титра титранта по определяемому веществу
Фактор эквивалентности (f) – число, показывающее, какая доля реальной
части вещества эквивалентна одному иону водорода или гидроксильных групп в
кислотно-основной реакции или одному электрону в окислительновосстановительной реакции.
Фактор эквивалентности рассчитывают на основании стехиометрии данной
реакции, которая должна быть обязательно указана.
Фактор эквивалентности величина безразмерная.
Молярная масса эквивалента вещества (Mf) – масса одного моля
эквивалента вещества, равная произведению фактора эквивалентности на
молярную массу (M) вещества:
Mf=М×f
Титр титранта по определяемому веществу – это выраженная в граммах
масса определяемого вещества, эквивалентная одному миллилитру данного
титранта. Титр по определяемому веществу вычисляют, исходя из молярности
или титра титранта с учетом стехиометрических коэффициентов уравнения
химической реакции, протекающей при титровании, и молярных масс,
реагирующих веществ (г/мл).
Ттитр.по опр.веществу = (Cтитранта×Mf)/1000, где
С титранта – концентрация титранта (моль/л).
25.
Пример 1. Рассчитайте молярную массу эквивалента и титр титрантапо кальцию хлориду при количественном определении методом
аргентометрии с использованием 0,05 моль/л раствора серебра нитрата.
Решение.
Записываем уравнение химической реакции, лежащей в основе
метода количественного определения, и уравниваем его.
СаСI2 + 2AgNO3 → 2AgCI↓ + Са(NO3)2
Из уравнения химической реакции находим стехиометрические
коэффициенты лекарственного вещества и титранта
КСаСI2 = 1, КAgNO3 = 2, следовательно f =1/2
Находим молярную массу лекарственного вещества расчетным
путем, по нормативной документации, учебнику, справочной
литературе.
М.м. (СаСI2·6Н2О) = 219,0 г/моль
Молярную массу эквивалента рассчитываем по формуле:
Мf(CaCl2)=(1×219,0)/2=109,5 г/моль
Титр титранта рассчитываем по формуле:
Т=(109×0,05)/1000=0,005475 г/мл
26.
Расчет концентрацииПри прямом и заместительном титровании для массовой доли
вещества (W) в процентах пользуются формулой:






















 Химия
Химия








