Похожие презентации:
Особенности работы с ферментами
1.
Особенностиработы с
ферментами.
2.
Ферменты, которые мы исследуем3.
Ферменты – специфические высокоэффективныебиологические катализаторы, синтезируемые
живыми клетками.
• любые химические превращения веществ в организме происходят
при участии ферментов
• все ферменты – белки
• практическое применение ферментов во всех областях деятельности,
где речь идёт о живых существах:
• хлебопечение,
• виноделие,
• сыроварение,
• чайное, кожевенное, меховое производство.
• β-галактозидаза
4.
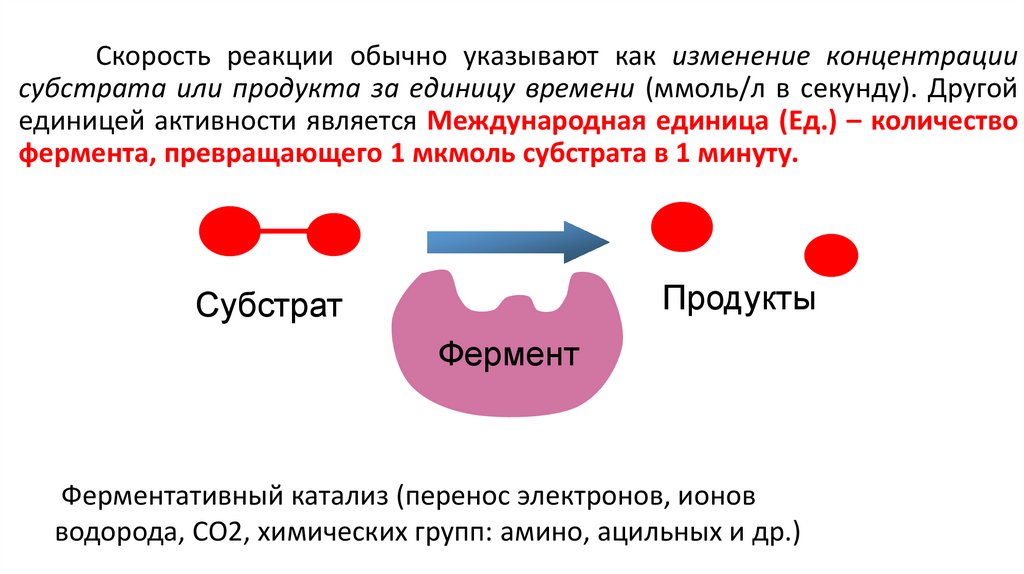
Скорость реакции обычно указывают как изменение концентрациисубстрата или продукта за единицу времени (ммоль/л в секунду). Другой
единицей активности является Международная единица (Ед.) – количество
фермента, превращающего 1 мкмоль субстрата в 1 минуту.
Продукты
Cубстрат
Фермент
Ферментативный катализ (перенос электронов, ионов
водорода, СО2, химических групп: амино, ацильных и др.)
5.
Активный центр фермента• Активный центр фермента – несколько аминокислотных
остатков, которые в ходе ферментативного катализа
взаимодействуют с субстратом.
• Для формирования активного центра имеют значение
третичная и четвертичная структуры фермента, так как в
активный центр входят аминокислоты, расположенные
далеко друг от друга.
• Наиболее часто в активный центр входят 3-5 аминокислот.
6.
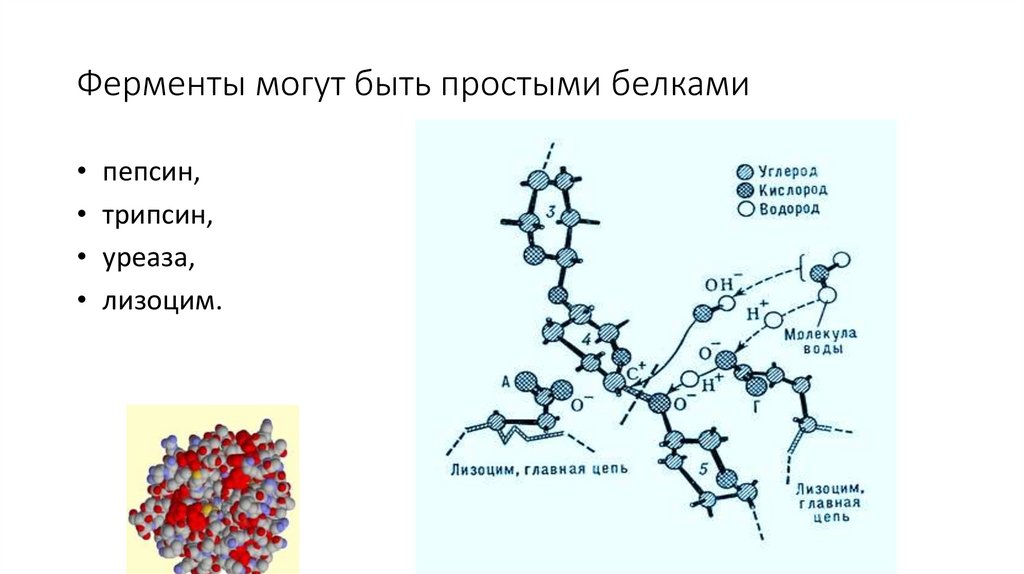
Ферменты могут быть простыми белками• пепсин,
• трипсин,
• уреаза,
• лизоцим.
7.
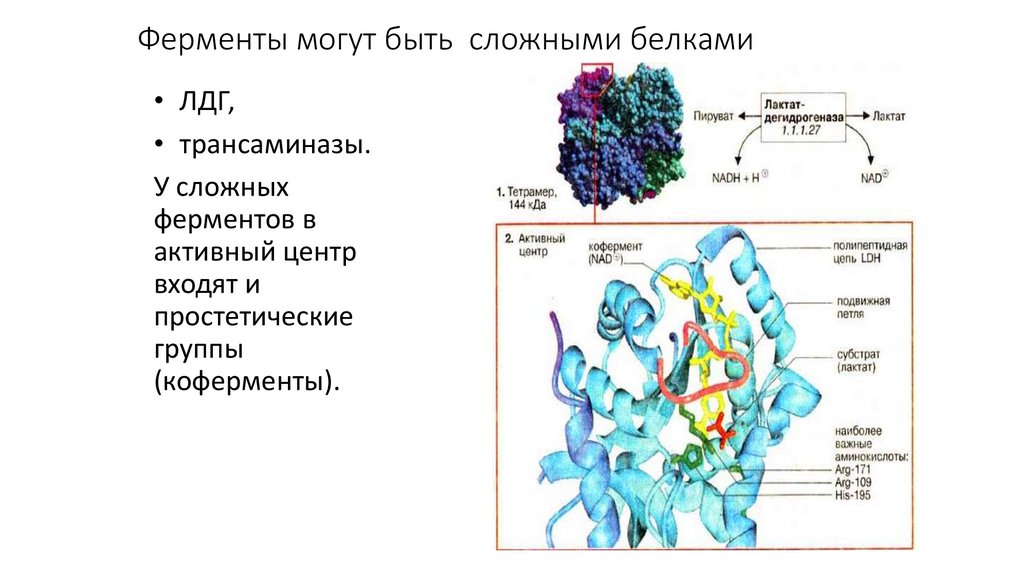
Ферменты могут быть сложными белками• ЛДГ,
• трансаминазы.
У сложных
ферментов в
активный центр
входят и
простетические
группы
(коферменты).
8.
Коферменты и кофакторы• Для проявления активности многих
ферментов необходимы небелковые
факторы.
• Если они представлены органическими
соединениями, то их называют
коферментами.
• Если они представлены неорганическими
веществами, то их именуют кофакторами.
• Это низкомолекулярные термостабильные
соединения.
• Коферменты располагаются в активном
центре фермента.
9.
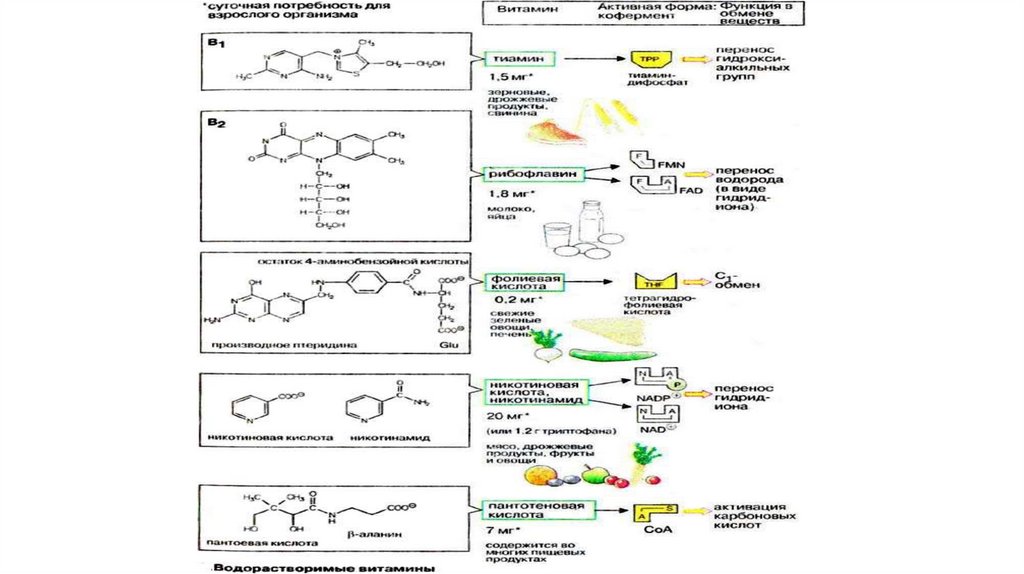
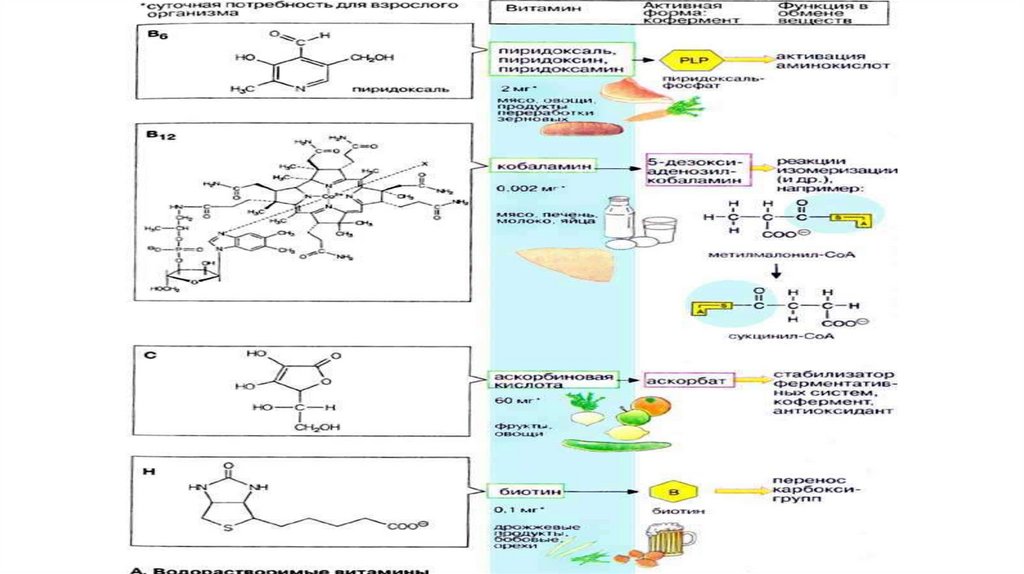
Химическое строение коферментов• производные водорастворимых витаминов,
• производные полипептидов,
• производные нуклеотидов и других соединений.
10.
11.
12.
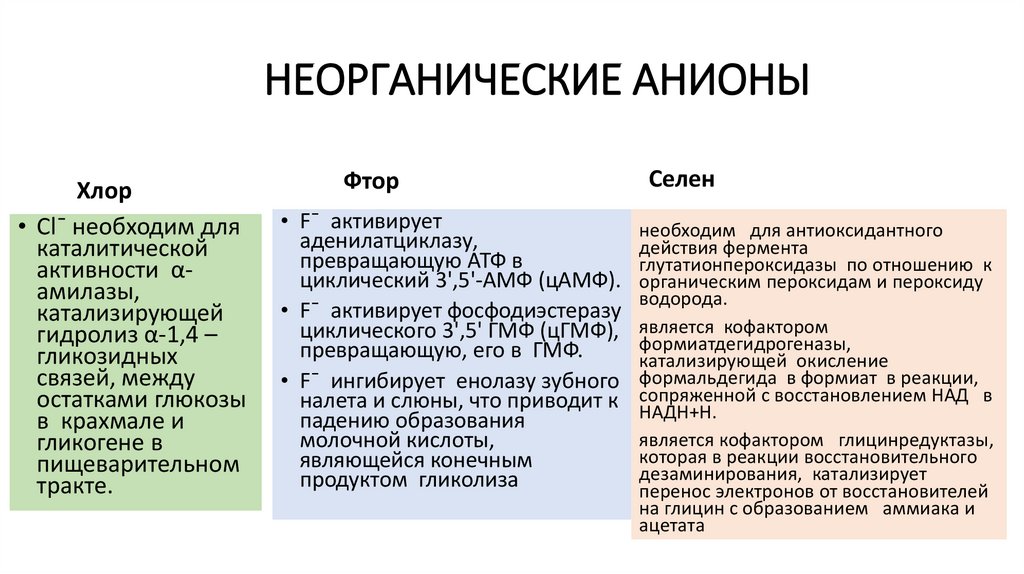
НЕОРГАНИЧЕСКИЕ АНИОНЫХлор
• Сl¯ необходим для
каталитической
активности αамилазы,
катализирующей
гидролиз α-1,4 –
гликозидных
связей, между
остатками глюкозы
в крахмале и
гликогене в
пищеварительном
тракте.
Фтор
• F¯ активирует
аденилатциклазу,
превращающую АТФ в
циклический 3',5'-АМФ (цАМФ).
• F¯ активирует фосфодиэстеразу
циклического 3',5' ГМФ (цГМФ),
превращающую, его в ГМФ.
• F¯ ингибирует енолазу зубного
налета и слюны, что приводит к
падению образования
молочной кислоты,
являющейся конечным
продуктом гликолиза
Селен
необходим для антиоксидантного
действия фермента
глутатионпероксидазы по отношению к
органическим пероксидам и пероксиду
водорода.
является кофактором
формиатдегидрогеназы,
катализирующей окисление
формальдегида в формиат в реакции,
сопряженной с восстановлением НАД в
НАДН+Н.
является кофактором глицинредуктазы,
которая в реакции восстановительного
дезаминирования, катализирует
перенос электронов от восстановителей
на глицин с образованием аммиака и
ацетата
13.
Активаторы ферментов – соединения, которыеприводят фермент в каталитически активное
состояние (Cu2+, Mg2+, Zn2+, Ca2+).
14.
Влияние температуры• Термолабильность – чувствительность ферментов к
температуре.
• При температуре 60º наступает денатурация.
• Миокиназа мышц выдерживает нагревание до 100º.
• Оптимум температуры 37-40º С.
• При температуре 50º снижается активность ферментов.
• Эффект температуры в отношении скорости реакции
объясняется её влиянием на кинетическую энергию
молекул.
15.
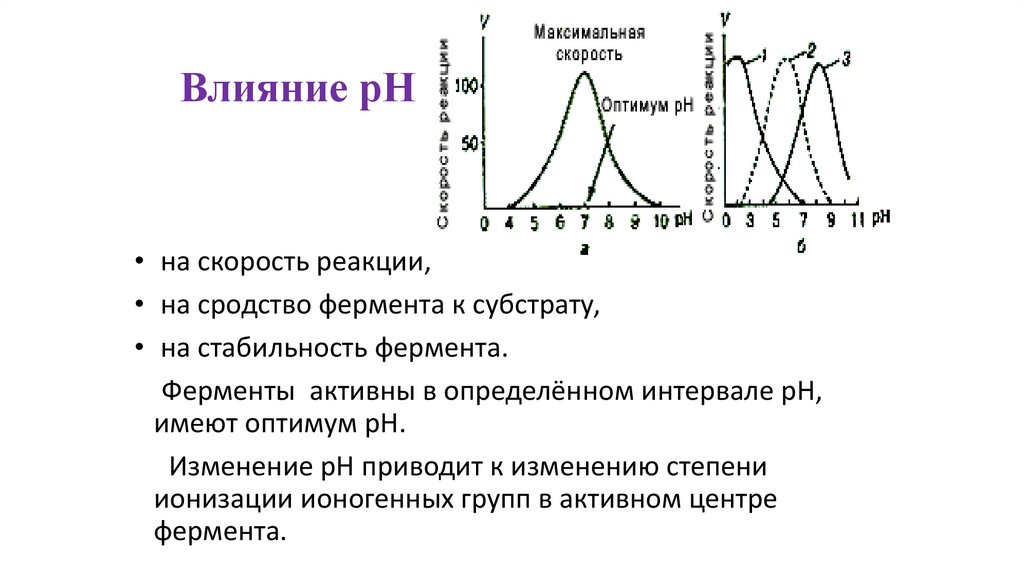
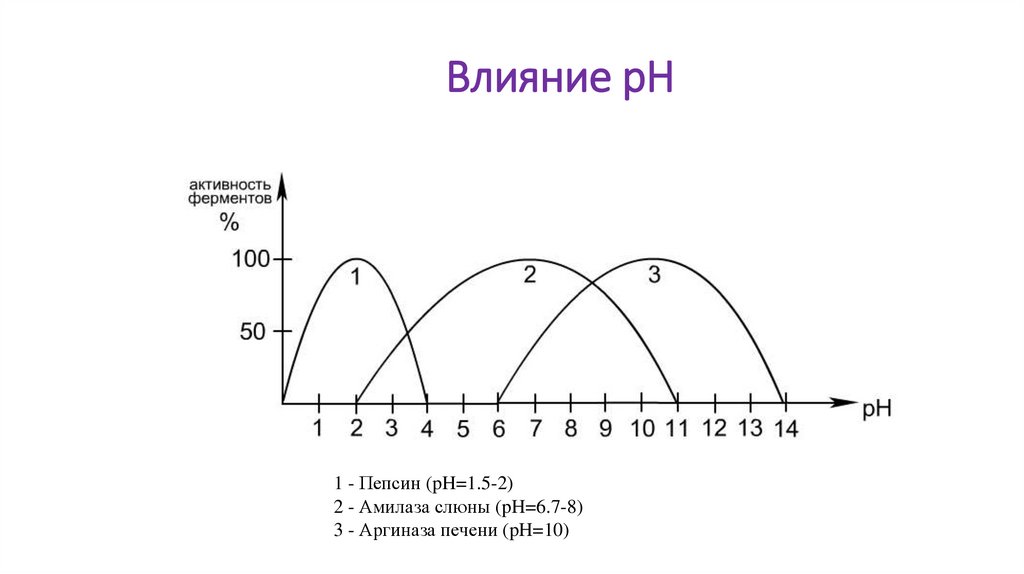
Влияние рН• на скорость реакции,
• на сродство фермента к субстрату,
• на стабильность фермента.
Ферменты активны в определённом интервале рН,
имеют оптимум рН.
Изменение рН приводит к изменению степени
ионизации ионогенных групп в активном центре
фермента.
16.
Влияние рН1 - Пепсин (pH=1.5-2)
2 - Амилаза слюны (pH=6.7-8)
3 - Аргиназа печени (pH=10)
17.
Специфичность действия ферментов• Каждый фермент действует строго на одно вещество
или очень небольшое число близкородственных
веществ.
• Если бы ферменты не обладали специфичностью, их
действие приводило бы к распаду клеточного
материала.
• Структура активного центра фермента
комплементарна структуре его субстрата.
18.
Классификация ферментовБольшинство определяемых ферментов содержатся внутри
клетки и появляются в крови только когда клетка разрушается!!!
Такие ферменты называют индикаторными (АСТ, АЛТ, ЛДГ, КФК)
Некоторые ферменты появляются в крови в результате
стимуляции их синтеза внутри клетки. Это – экскреторные
ферменты (ЩФ, ГГТ)
Существуют так же секреторные ферменты (синтезируются в
печени, выделяются в плазму крови (протромбиназа,
холинэстераза)).
Органы или ткани, имеющие наибольшую концентрацию какоголибо фермента, будут обуславливать значимое повышение его
активности в крови при повреждении клеток (справедливо для
индикаторных ферментов) или при активации синтеза
(справедливо для экскреторных ферментов).
19.
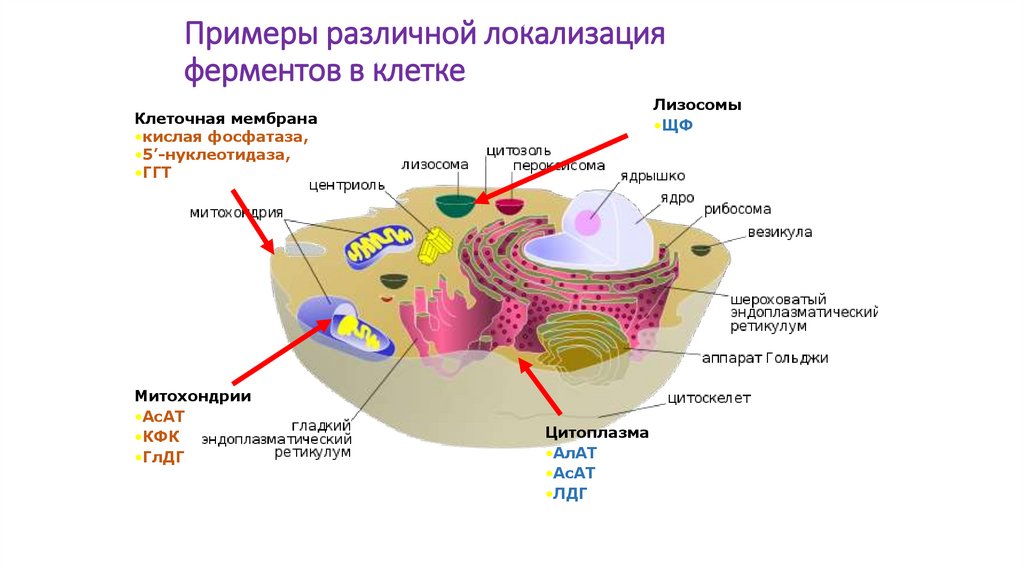
Примеры различной локализацияферментов в клетке
Лизосомы
•ЩФ
Клеточная мембрана
•кислая фосфатаза,
•5’-нуклеотидаза,
•ГГТ
Митохондрии
•АсАТ
•КФК
•ГлДГ
Цитоплазма
•АлАТ
•АсАТ
•ЛДГ
20.
Как относится к величинеферментемии?
Величина активности фермента отражает (но не
прямо пропорционально, как хотелось бы) объем
и глубину патологического воздействия
Прогнозировать развитие патологического
процесса возможно путем последовательных
измерений, учитывая так называемый
«полупериод жизни фермента».
21.
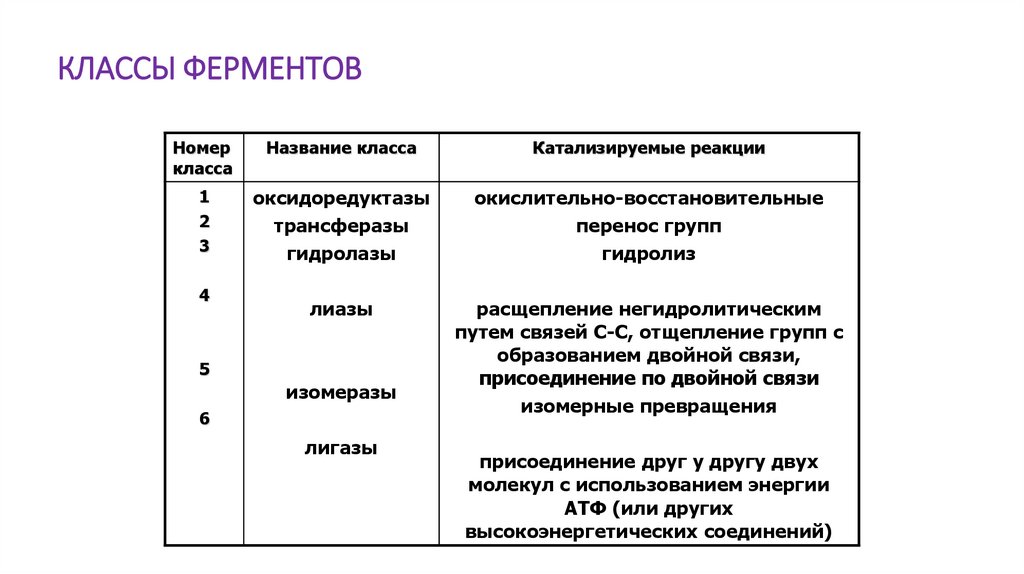
КЛАССЫ ФЕРМЕНТОВНомер
класса
Название класса
Катализируемые реакции
1
2
3
оксидоредуктазы
трансферазы
гидролазы
окислительно-восстановительные
перенос групп
гидролиз
лиазы
расщепление негидролитическим
путем связей С-С, отщепление групп с
образованием двойной связи,
присоединение по двойной связи
изомерные превращения
4
5
изомеразы
6
лигазы
присоединение друг у другу двух
молекул с использованием энергии
АТФ (или других
высокоэнергетических соединений)
22.
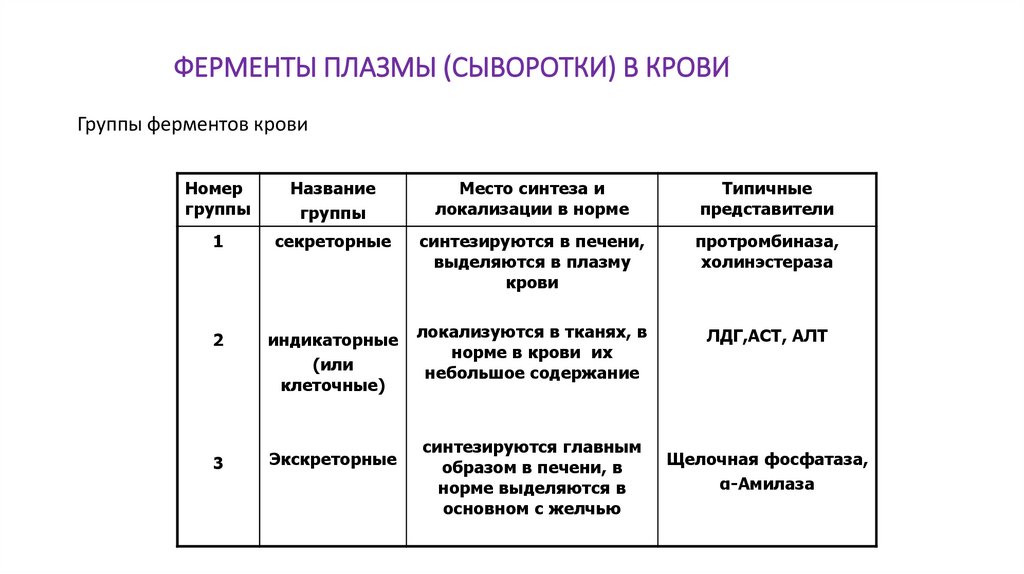
ФЕРМЕНТЫ ПЛАЗМЫ (СЫВОРОТКИ) В КРОВИГруппы ферментов крови
Номер
группы
Название
группы
Место синтеза и
локализации в норме
Типичные
представители
1
секреторные
синтезируются в печени,
выделяются в плазму
крови
протромбиназа,
холинэстераза
2
индикаторные
(или
клеточные)
локализуются в тканях, в
норме в крови их
небольшое содержание
ЛДГ,АСТ, АЛТ
3
Экскреторные
синтезируются главным
образом в печени, в
норме выделяются в
основном с желчью
Щелочная фосфатаза,
α-Амилаза
23.
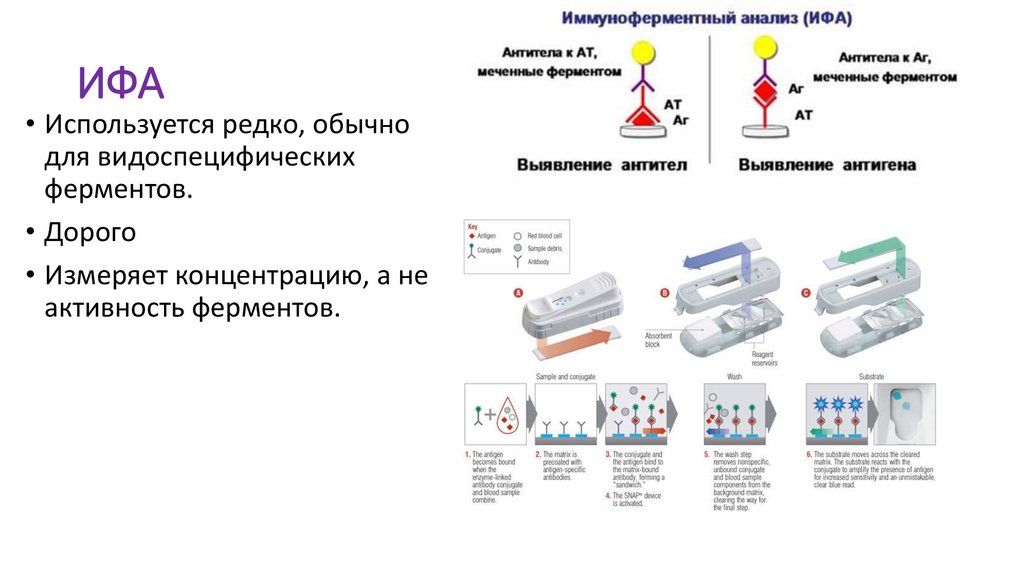
ИФА• Используется редко, обычно
для видоспецифических
ферментов.
• Дорого
• Измеряет концентрацию, а не
активность ферментов.










 Биология
Биология








