Похожие презентации:
Факторы, влияющие на растворение. Сольватная теория растворов
1.
Факторы, влияющие на растворение.Сольватная теория растворов
1
2.
Растворимостью называется способность вещества растворятьсяв том или ином растворителе.
Мерой растворимости вещества при данных условиях является его
содержание в насыщенном при данной температуре растворе.
Растворимость
численно
выражается
коэффициентом
растворимости, который равен отношению массы вещества в
насыщенном растворе к количеству растворителя. Коэффициент
растворимости измеряется в г/л воды или в г/100 г воды, иногда в г/100 г раствора.
2
3.
Растворимость зависит от:- природы растворенного вещества и растворителя;
- температуры;
- давления;
- присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется
принципом: подобное растворяется в подобном.
Полярные растворители, например, вода, хорошо растворяют вещества с
ионной связью (неорганические соли, кислоты и основания).
Хорошей растворимостью в воде обладают полярные органические
соединения, образующие с молекулами растворителя водородные связи
(спирты, карбоновые кислоты, амины).
Неполярные растворители, например, углеводороды,
неполярные и малополярные соединения (жиры).
растворяют
3
4.
Влияние температуры на растворимость зависит от теплового эффектарастворения и определяется принципом Ле Шателье.
Повышению растворимости газов способствует понижение температуры,
так как растворение газов – процесс экзотермический.
Растворимость большинства твердых веществ и жидкостей - процесс
эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении
происходит значительное изменение объема системы, что наблюдается
при растворении газов в жидкостях.
Растворимость газов растет с увеличением
сопровождается уменьшением объема системы.
давления,
так
как
4
5.
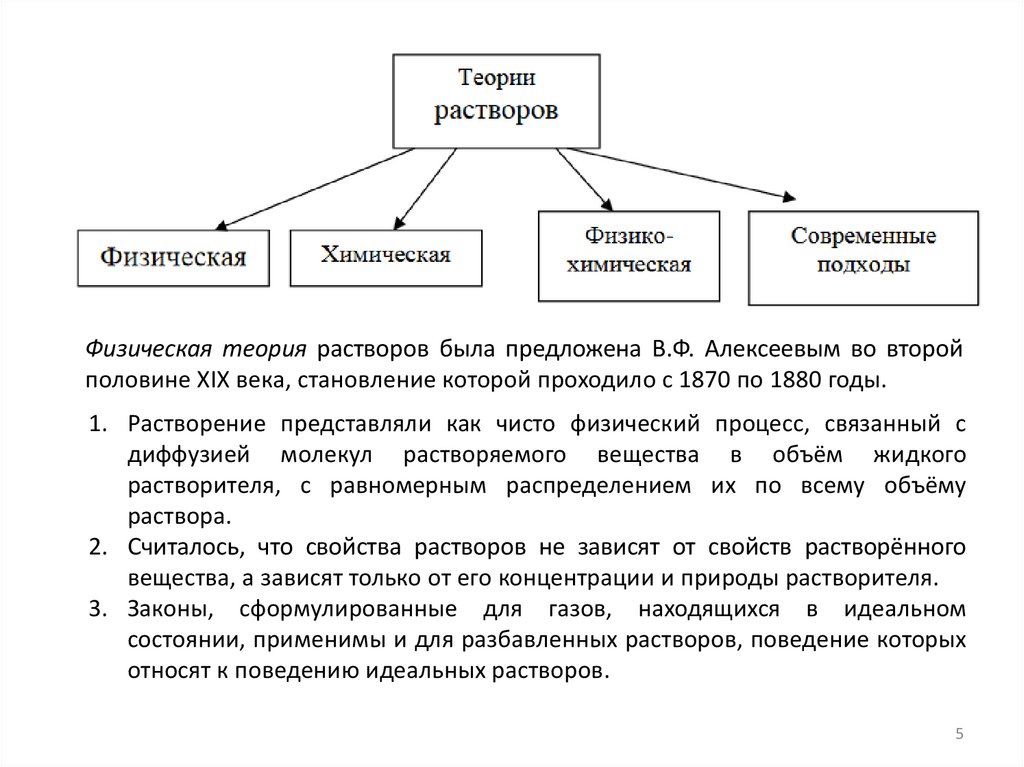
Физическая теория растворов была предложена В.Ф. Алексеевым во второйполовине XIX века, становление которой проходило с 1870 по 1880 годы.
1. Растворение представляли как чисто физический процесс, связанный с
диффузией молекул растворяемого вещества в объём жидкого
растворителя, с равномерным распределением их по всему объёму
раствора.
2. Считалось, что свойства растворов не зависят от свойств растворённого
вещества, а зависят только от его концентрации и природы растворителя.
3. Законы, сформулированные для газов, находящихся в идеальном
состоянии, применимы и для разбавленных растворов, поведение которых
относят к поведению идеальных растворов.
5
6.
Недостатки теорииФизическая теория не описывала свойства растворов, при
образовании которых выделяется или поглощается энергия в
форме теплоты, не объясняла поведение и свойства растворов
электролитов.
Физическая теория растворов и теория электролитической
диссоциации не учитывала взаимодействие молекул и ионов друг
с другом и с молекулами растворителя.
Физическая теория не объясняла механизм процесса растворения
полярных веществ в воде, образование и свойства
концентрированных растворов и др.
6
7.
Физико-химическая теория образования растворов развиваласьИ.П. Каблуковым. Он изучал явления сольватации.
Современные
теории,
объясняющие
свойства
растворов,
основываются на модельных подходах и детальном, групповом,
кинетическом
(теория
Френкеля),
термодинамическом,
кристаллохимическом, квантовохимическом описаниях процессов
образования растворов.
Современные квантово-химические расчёты свойств растворов,
основанные на методах Хартри-Фока, позволяют связать состав,
природу, структуру и тип взаимодействия частиц в растворе.
7
8.
Сущность процесса растворения. Термодинамикапроцесса растворения
В растворах между компонентами раствора имеется взаимодействие, что
приводит к образованию нестойких соединений переменного состава. Эти
соединения растворенного вещества и растворителя называется
сольватами, если растворитель – вода, то их называют гидратами.
Раствор является динамической системой, в котором распадающиеся
соединения находятся в подвижном равновесии с продуктами распада в
соответствии с законом действующих масс.
Сольватация (гидратация) обусловлена силами Ван-дер-Ваальса,
действующими между растворенными веществом и растворителем.
Сольватация протекает тем лучше, чем более полярны молекулы,
составляющие раствор.
Вода - хороший растворитель, так как её молекулы сильно полярны.
Гидратная вода может быть связана с молекулами твердого вещества и
входить в состав кристаллов (кристаллогидраты): CuSO4 ∙ 5 H2O –медный
купорос, CaSO4 ∙ 2 H2O – гипс.
8
9.
Современная теория растворения основана на физической теорииВант-Гоффа и С. Аррениуса и химической теории Д. И. Менделеева.
Согласно этой теории процесс растворения состоит из трех стадий:
1) механическое разрушение связей между частицами растворенного
вещества, например, разрушение кристаллической решетки соли
(это физическое явление);
2) образование сольватов (гидратов), т. е. нестойких соединений
частиц растворенного вещества с молекулами растворителя (это
химическое явление);
3) самопроизвольный процесс диффузии сольватированных
(гидратированных) ионов по всему объему растворителя (это
физический процесс).
9
10.
Тепловой эффект, сопровождающий процесс растворения,относящийся к 1 молю растворенного вещества называется
молярной теплотой растворения ∆ Н раств.
∆Н раств. = ∆Н 1 + ∆Н 2
∆Н 1 > 0 - количество теплоты, затраченной на распределение
частиц растворяемого вещества среди молекул растворителя
(процесс эндотермический).
∆Н 2 < 0 - тепловой
экзотермический).
эффект
сольватации
(процесс
Тепловой эффект сольватации - количество теплоты, которая
выделяется при взаимодействии растворенного вещества с
молекулами растворителя и образование связей между ними.
10
11.
Растворимость газов в жидкостях. Кессонная болезнь.Вещества со слабополярными молекулами, например жирны; кислоты, лучше
растворяются в растворителях, молекулы которые также мало полярны
(например, эфир) или неполярны бензолу Таким образом, взаимная
растворимость жидкостей зависит от их химического строения; вода и ртуть
практически не растворяют друг друга, вода и фенол обладают ограниченной
растворимостью, спирты в спиртах растворимы без ограничений, Чаще всего
взаимная растворимость тем выше, чем ближе химическое строение
смешиваемых веществ.
Растворение газов в жидкостях называют также абсорбцией газов жидкостями.
Концентрация большинства таких растворов невелика. Растворимость газа,
выраженная в молях на 1000 г растворителя, при постоянной температуре прямо
пропорциональна его давлению над раствором (закон Генри): C=K’p
11
12.
Если над раствором имеется смесь газов, то каждый из них растворяетсясоответственно его Парциальному давлению. Это имеет большое значение в
физиологических процессах переноса кислорода и двуокиси углерода кровью. В
отличие от растворов твердых и жидких веществ с повышением температуры
растворимость газов обычно уменьшается. Эту особенность используют, в частности,
в лабораториях для удаления кипячением из воды газов, прежде всего СO2. В крови
содержатся электролиты, белки, липоиды и другие вещества; их концентрация
может меняться в известных пределах; оказывая некоторое влияние на
растворимость в крови О2 и СO2. Необходимо указать, что изменение растворимости
газов под влиянием перемены давления может обусловить тяжелую патологию
человеческого организма. Резкое понижение атмосферного давления, например,
при слишком быстром подъеме водолазов или кессонщиков с больших глубин, при
разгерметизировании кабин или скафандров при высотных полетах приводит к
«закипанию» крови вследствие выделения растворенных в ней газов; их пузырьки
закупоривают мелкие сосудики в мозгу и других органах, что может привести к
серьезным заболеваниям и гибели человека. Пузырьки газов закупоривают мелкие
сосуды в различных тканях и органах, что приводит к тяжелому заболеванию или
даже гибели человека. Подобная же патология может возникнуть и в результате
резкого падения атмосферного давления при разгерметизировании скафандров
летчиков и кабин самолетов при высотных полетах. Для лечения кессонной болезни
больного помещают в барокамеру, где создают большое давление. Пузырьки газов
вновь растворяются в крови; при последующем медленном (в течение нескольких
суток) снижении давления в барокамере избыток газов удаляется из крови через
12
легкие.











 Химия
Химия








