Похожие презентации:
Решение заданий 31 ЕГЭ по химии: реакции, подтверждающие взаимосвязь различных классов неорганических веществ
1.
«Решение заданий 31 ЕГЭ по химии:реакции, подтверждающие
взаимосвязь различных классов
неорганических веществ»
УЧИТЕЛЬ ХИМИИ НЕСТЕРЕНКО Н.В.
2.
23.
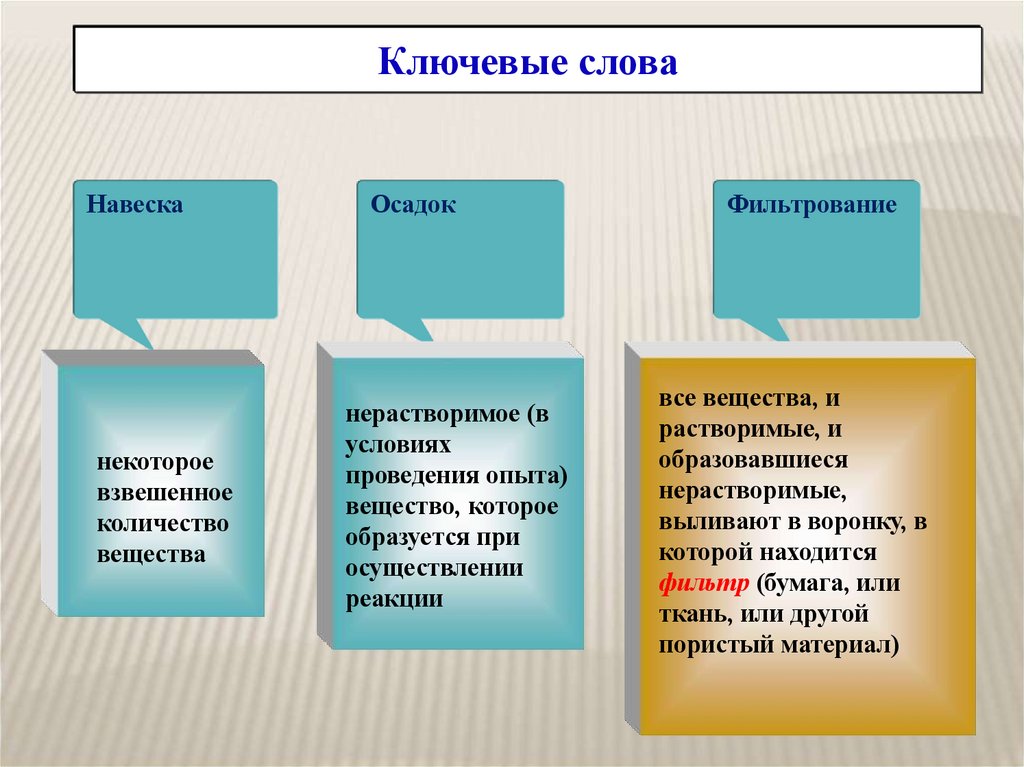
Ключевые словаНавеска
некоторое
взвешенное
количество
вещества
Осадок
нерастворимое (в
условиях
проведения опыта)
вещество, которое
образуется при
осуществлении
реакции
Фильтрование
все вещества, и
растворимые, и
образовавшиеся
нерастворимые,
выливают в воронку, в
которой находится
фильтр (бумага, или
ткань, или другой
пористый материал)
4.
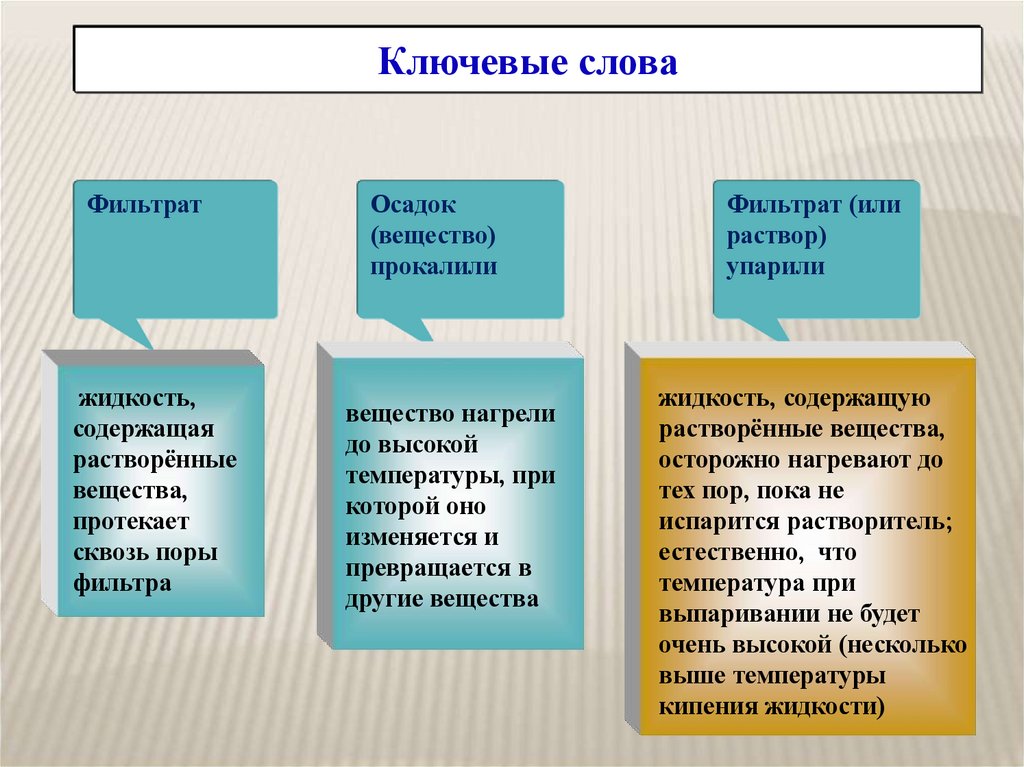
Ключевые словаФильтрат
жидкость,
содержащая
растворённые
вещества,
протекает
сквозь поры
фильтра
Осадок
(вещество)
прокалили
вещество нагрели
до высокой
температуры, при
которой оно
изменяется и
превращается в
другие вещества
Фильтрат (или
раствор)
упарили
жидкость, содержащую
растворённые вещества,
осторожно нагревают до
тех пор, пока не
испарится растворитель;
естественно, что
температура при
выпаривании не будет
очень высокой (несколько
выше температуры
кипения жидкости)
5.
ПРИМЕР № 1Творожистый осадок белого цвета, полученный
при взаимодействии раствора неизвестного
вещества с нитратом серебра, отфильтровали.
К фильтрату добавили раствор едкого кали.
Выпавший осадок бурого цвета отделили и
прокалили; остаток смешали с поташом и нагрели
до плавления. Составьте уравнения четырёх
описанных реакций.
6.
АНАЛИЗ И РЕШЕНИЕ• Анализируем фразу «Творожистый
осадок белого цвета, полученный при
взаимодействии раствора неизвестного
вещества с нитратом серебра,
отфильтровали».
• Опорные знания («ключевые слова») Творожистый осадок белого цвета и
нитрат серебра.
7.
АНАЛИЗ И РЕШЕНИЕ• Нерастворимое в воде и кислотах
творожистое вещество белого цвета, которое
образуется при добавлении AgNO3- хлорид
серебра AgCl;
• эта реакция является качественной реакцией
на хлорид- ионы, следовательно, в состав
вещества входят ионы Cl• Cl- + Ag+ = AgCl↓
Первое уравнение:
1) 3AgNO3+FeCl3=3 AgCl↓+Fe(NO3)3
8.
АНАЛИЗ И РЕШЕНИЕ• Анализируем фразу «К фильтрату добавили
раствор едкого кали. Выпавший осадок бурого
цвета отделили и прокалили».
• Фильтрат- раствор, прошедший через
фильтр, который задерживает
нерастворимые вещества.
• «Ключевые слова» – осадок бурого цвета, т.е.
образовался Fe(OH)3 – нерастворимое
вещество бурого цвета, следовательно, в
состав вещества входят ионы Fe3+ .
Второе уравнение:
2) Fe(NO3)3 +3KOH=3KNO3+Fe(OH)3↓
9.
АНАЛИЗ И РЕШЕНИЕ• Fe(OH)3 гидроксид железа (III)-амфотерный
гидроксид, разлагается при нагревании на
оксид металла и воду.
• Третье уравнение:
t0
3) 2 Fe(OH)3 = Fe2O3+3H2O
10.
АНАЛИЗ И РЕШЕНИЕ• Анализируем фразу «…остаток смешали с
поташом и нагрели до плавления».
• Поташ – техническое название карбоната
калия K2CO3.
• При сплавлении едких щелочей или
карбонатов щелочных металлов с
амфотерными оксидами образуются
соответствующие соли, в частности феррит
калия.
• Четвёртое уравнение:
4) Fe2O3 + K2CO3=2KFeO2+CO2↑
11.
АНАЛИЗ И РЕШЕНИЕ1) 3AgNO3+FeCl3=3 AgCl↓+Fe(NO3)3
2) Fe(NO3)3 +3KOH=3KNO3+Fe(OH)3↓
t0
3) 2 Fe(OH)3 = Fe2O3+3H2O
4) Fe2O3 + K2CO3=2KFeO2+CO2↑
12.
ПРИМЕР № 2Раствор, полученный при взаимодействии меди с
концентрированной азотной кислотой, выпарили и
осадок прокалили. Газообразные продукты реакции
разложения полностью поглощены водой, а над
твердым остатком пропустили водород. Напишите
уравнения описанных реакций.
13.
АНАЛИЗ И РЕШЕНИЕ• 1) Сu + 4HNO3 (конц.) = Cu(NO3)2 +
2NO2↑ +2Н2O
• 2) 2Cu(NO3)2 = 2СuО + 4NO2↑ + O2↑
• 3) СuО + Н2 = Сu + Н2O
• 4) 4NO2 + O2+ 2Н2O = 4HNO3
14.
ПРИМЕР № 3Простое вещество, полученное при нагревании
фосфата кальция с коксом и оксидом кремния,
сплавили с металлическим кальцием. Продукт
реакции обработали водой, а выделившийся газ
собрали и пропустили через раствор соляной
кислоты. Напишите уравнения описанных реакций.
15.
АНАЛИЗ И РЕШЕНИЕ• 1) Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р
+ 5CO↑
• 2) 2Р + ЗСа = Са3Р2
• 3) Са3Р2 + 6Н2O = 3Са(ОН)2 + 2РН3↑
• 4) РН3 + НСl = РН4Сl
16.
ТИПИЧНЫЕ ОШИБКИ:неумение проанализировать возможность взаимодействия
веществ (простых и сложных) с позиций принадлежности
их к определенным классам неорганических соединений
неумение проанализировать возможность взаимодействия веществ
(простых и сложных) с позиций возможности протекания
окислительно-восстановительных реакций
незнание специфических свойств галогенов, фосфора и их соединений,
кислот - окислителей, амфотерных оксидов и гидроксидов,
восстановительных свойств сульфидов и галогенидов
16
17.
ИСПОЛЬЗУЕМЫЕ ИСТОЧНИКИ:ДОРОНЬКИН В.Н.
• Химия. Задания высокого уровня сложности (часть
С) для подготовки к ЕГЭ: учебно- методическое
пособие/Под ред.В.Н. Доронькина. – Изд.5-е, исправ. И
доп. – Ростов н/Д: Легион, 2014. – 288 с. – (Готовимся к
ЕГЭ).
• Химические свойства неорганических
веществ. Лидин Р.А. и др. 3-е изд., испр. - М.: Химия,
2000 - 480 с.
• http://ege-study.ru/ege-ximiya/zadacha-s2-v-ege-po-ximii/
• http://himya.ucoz.ru/index/khimicheskie_svojstva_neorganicheski
kh_veshhestv/0-105
















 Химия
Химия








