Похожие презентации:
Расчеты по химическим формулам
1.
Урок - презентация7класс
Тема. Расчеты по химическим
формулам
Подготовил учитель химии МОУ «Школа №112 г.
Донецка» Скотаренко Н.А.
2.
Цели урока:расширить представления о химической
формуле, её использовании для расчётов
относительной молекулярной массы
вещества, массовой доли химического
элемента, научить выведению простейших
формул веществ по массовым долям
элементов;
развивать умения выполнять
познавательные и практические задания,
готовность к решению задач в том числе и
творческих.
3.
Актуализация и углублениезнаний
Ca , CO2 , H2 , Na2O , H2SO4
- прочитайте формулы предложенных
веществ и охарактеризуйте качественный
и количественный состав этих веществ;
- разделите предложенные вещества на
простые и сложные;
- с помощью периодической системы
химических элементов Д.И.Менделеева
определите относительную атомную массу
каждого элемента;
4.
5.
Относительная молекулярнаямасса( Mr ) - физическая величина,
которая показывает во сколько раз
масса определённой молекулы больше
1/12 массы атома 12С.
6.
Относительная молекулярная массаравна сумме относительных атомных
масс элементов, входящих в состав
молекулы, умноженных на количество
их атомов.
M r(АxByCz) = x . Ar(A) + y . Ar(B) + z . Ar(C)
7.
Вычислим относительнуюмолекулярную массу для
предложенных веществ.
M r (Са) = Аr (Са) = 40
M r (СО2) = Аr(С) + 2 Аr (О) = 12+ 2 . 16 =44
M r (Н2) = 2 Аr (Н) = 2 . 1 = 2
M r (Na2O) =
=2Аr (Na) + Аr (О) = 2 . 23 + 16 = 62
M r (H2SO4) =
=2 Аr (Н) + Аr (S) + 4 . Аr(О) = 2 +32 +64 = 98
8.
Массовая доля(обозначается буквой W)
показывает, какую часть от
относительной молекулярной массы
вещества составляет относительная
атомная масса элемента,
умноженная на индекс при знаке
элемента в формуле.
Ar(Э)∙n(Э)
W = _______________ ∙100%
M r(вещества)
9.
Ar(Э)∙n(Э)W = _______________ ∙100%
M r(вещества)
где: A r (Э) – относительная атомная масса
элемента;
n(Э) – количество атомов этого элемента;
M r (вещества) – относительная молекулярная
масса вещества, в состав которого входит
данный элемент.
10.
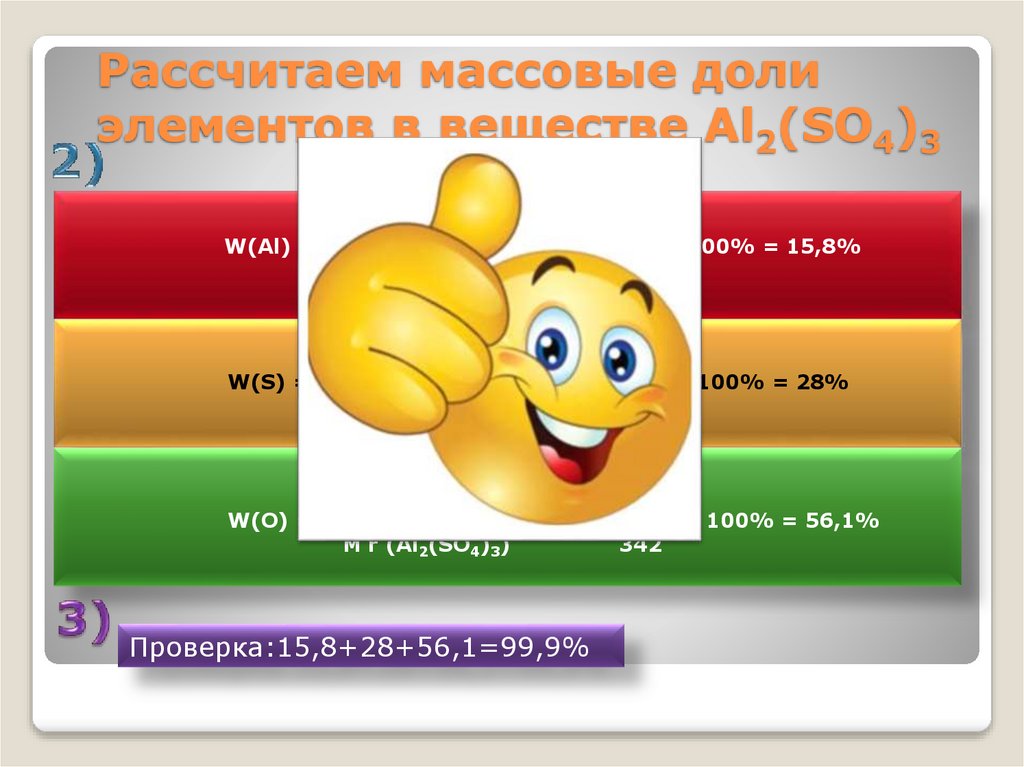
Рассчитаем массовые долиэлементов в веществе Al2(SO4)3
M r (Al2(SO4)3) =
=2 Аr (Al) + 3 .Аr (S) + 12 . Аr(О)=
= 2 . 27 + 3 . 32 + 12 . 16 = 342
11.
Рассчитаем массовые долиэлементов в веществе Al2(SO4)3
Ar(Al)∙n(Al)
27 . 2
W(Al) = _______________ ∙100% = ________ . 100% = 15,8%
M r(Al2(SO4)3)
342
Ar(S)∙n(S)
32 . 3
Ar(O)∙n(O)
16 . 12
W(S) = _______________ ∙100% = __________ . 100% = 28%
M r (Al2(SO4)3)
342
W(O) = _______________ ∙100% = __________ . 100% = 56,1%
M r (Al2(SO4)3)
342
Проверка:15,8+28+56,1=99,9%
12.
Выведение молекулярной формулыПо известным массовым долям элементов, входящих в
состав вещества, можно определить его молекулярную
формулу.
Дано:
W (Cu) = 79,5%
W (S) = 20,5%
Решение
W (Cu)
x : y = ________ :
Ar (Cu)
79,5
________
64
CuxSy
W (S)
:
_________ =
Ar (S)
20,5
_________
Ответ: Cu2S
32
= 1,24 : 0,64 =2 : 1
13.
Определить молекулярную формулуи относительную молекулярную
массу вещества.
Дано:
W (Na) = 32,9 %
W (Al) = 12,9 %
W (F) = 54,2 %
Найти:
NaxAlyFz
Mr (Na3AlF6)
14.
РешениеW (Na)
W (Al)
x : y : z = ________ : _________ :
A r (Na) A r (Al)
W (F)
32,9
__________ =
______
A r (F)
:
23
= 1,43 : 0,48 : 2,85 = 3 : 1 : 6
M r (Na3AlF6) = 3 . 23 + 27 + 6 . 19 = 210
Ответ: Na3AlF6 ; M r (Na3AlF6) = 210
12,9
54,2
______
: ______ =
19
27
15.
Самостоятельная работа1) Рассчитайте массовые доли элементов в
веществе:
I вариант Zn(NO3)2
II вариант (NH4)2 CO3
2) Определите простейшую формулу и
относительную молекулярную массу вещества.
I вариант W (Na) = 19,2%; W (Н) = 1,7%; W (Р) = 25,8%;
W (O) = 53,3%.
II вариант W (K) = 14,0%; W (Al) = 9,7%; W (Si) = 30,5%;
W (O) = 45,8%.
16.
Ответы!1)
I вариант
M r = 189 , W (Zn) = 34,4%; W (N) =14,8%; W (O) = 50,8 %.
II вариант
M r = 96 , W (N) = 29,2 %; W (Н) = 8,3 %; W (C) = 12,5 %;
W (O) = 50 %.
2)
I вариант
M r (NaH2PO4) = 120
II вариант
M r (KAlSi3O8) = 278
17.
18.
Домашнее задание§15 учить,
упр. 15.5, 15.13, 15.18
стр.102(письменно)
Дополнительно*
Какая руда богаче медью(в %): борит –
Cu3FeS2 или халькозин – Cu2S?
Ответ подтвердите расчётами.

















 Химия
Химия








