Похожие презентации:
Степень окисления
1. Степень окисления
2.
Заряд иона – это реальный заряд элемента всоединениях с ионной связью Na2+O2 Валентность – это число общих электронных пар
I II
H2O
Степень окисления – это условный заряд
элемента, если считать, что связи ионные
Na2+1O-2 H2+1O-2
3.
Степень окисления простых веществ равна нулю2. У водорода в соединениях степень окисления равна «+1»,
кроме бинарных соединений с металлами «-1»
3. Элементы IA, IIA, IIIA и Ag, Zn групп имеют постоянную
положительную степень окисления, равную номеру
группы
4. У неметаллов низшая степень окисления равна номер
группы минус восемь
н.с.о. (неМе) = (№группы – 8)
5. Указываем низшую степень окисления атома с
наибольшей электроотрицательностью
6. В соединении сумма всех степеней окисления равна нулю.
1.
N2O5
N2O
N2O3
PH3 NH3
NaH
4. У другого элемента рассчитываем степень окисления, исходя из того, что сумма степеней окисления всех элементов соединения равна
нулю.N2O5
N2O
N2O3
PH3 NH3
NaH
5. Расставьте степени окисления
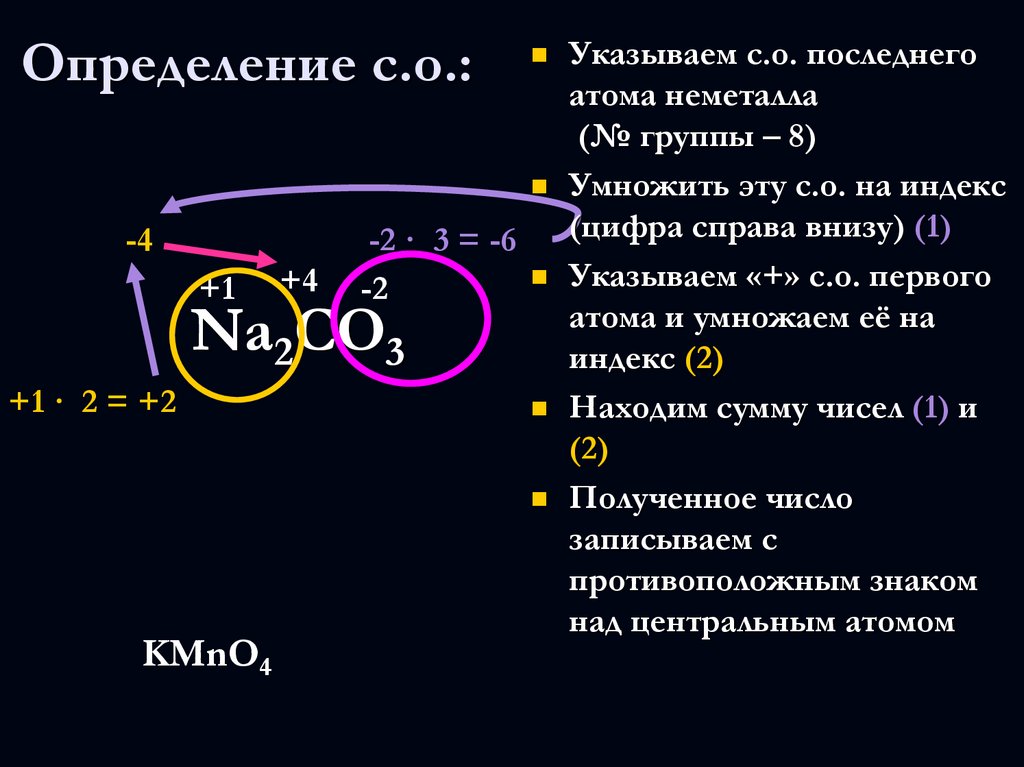
6. Определение с.о.:
-4+1
+4
Указываем с.о. последнего
атома неметалла
(№ группы – 8)
Умножить эту с.о. на индекс
(цифра справа внизу) (1)
-2 · 3 = -6
Указываем «+» с.о. первого
-2
атома и умножаем её на
3
индекс (2)
Находим сумму чисел (1) и
(2)
Полученное число
записываем с
противоположным знаком
над центральным атомом
Na2CO
+1 · 2 = +2
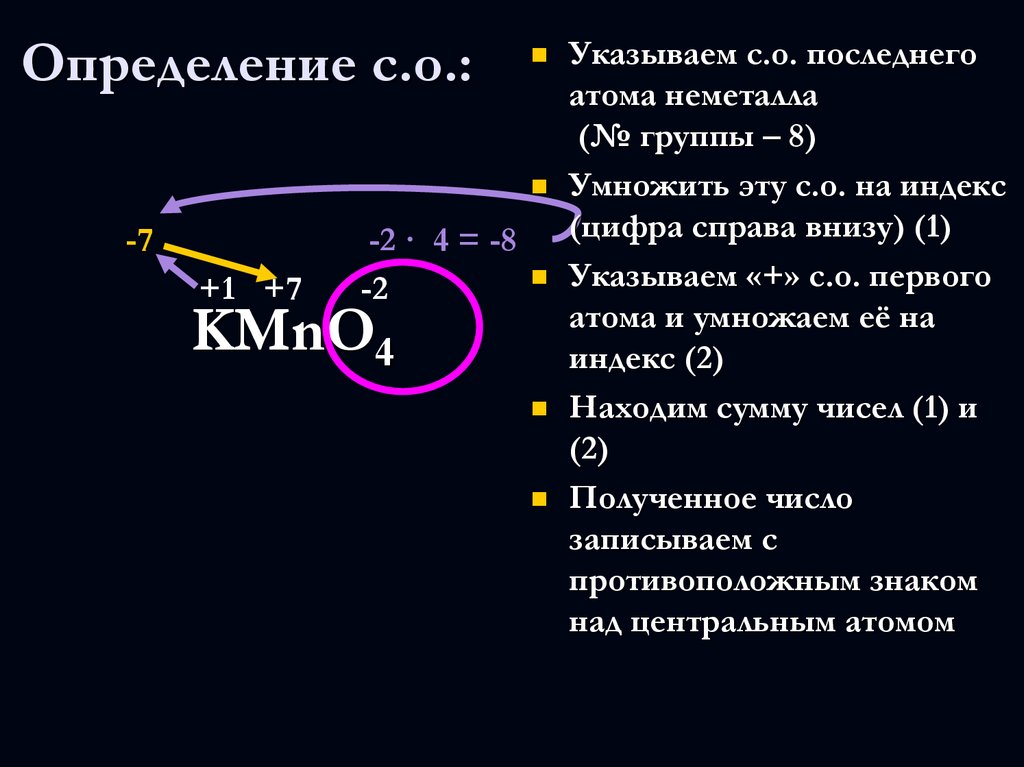
KMnO4
7. Определение с.о.:
-7+1 +7
Указываем с.о. последнего
атома неметалла
(№ группы – 8)
Умножить эту с.о. на индекс
(цифра справа внизу) (1)
-2 · 4 = -8
Указываем «+» с.о. первого
-2
атома и умножаем её на
4
индекс (2)
Находим сумму чисел (1) и
(2)
Полученное число
записываем с
противоположным знаком
над центральным атомом
KMnO
8. Определите степени окисления: Na2SO4; K2SO3; LiNO3; BaSO4; AlPO4
9. Na2SO4; K2SO3; LiNO3; BaSO4; AlPO4;
+1+6 -2
+1 +4 -2
+1 +5 -2
+2 +6 -2
+3 +5 -2
Na2SO4; K2SO3; LiNO3; BaSO4; AlPO4;
10. ОВР (окислительно-восстановительные реакции)
11.
12.
Окислитель понижает степень окисления,принимает электроны – восстанавливается
Восстановитель повышает степень
окисления, отдает электроны – окисляется
Чтобы определить переход электронов,
нужно из степени окисления хим.
элемента левой части вычесть степень
окисления хим. элемента правой части
учитывая знак.
Ключевой коэффициент ставится перед
формулой, где степень окисления хим.
элемента не повторяется (встречается в
уравнении единожды)
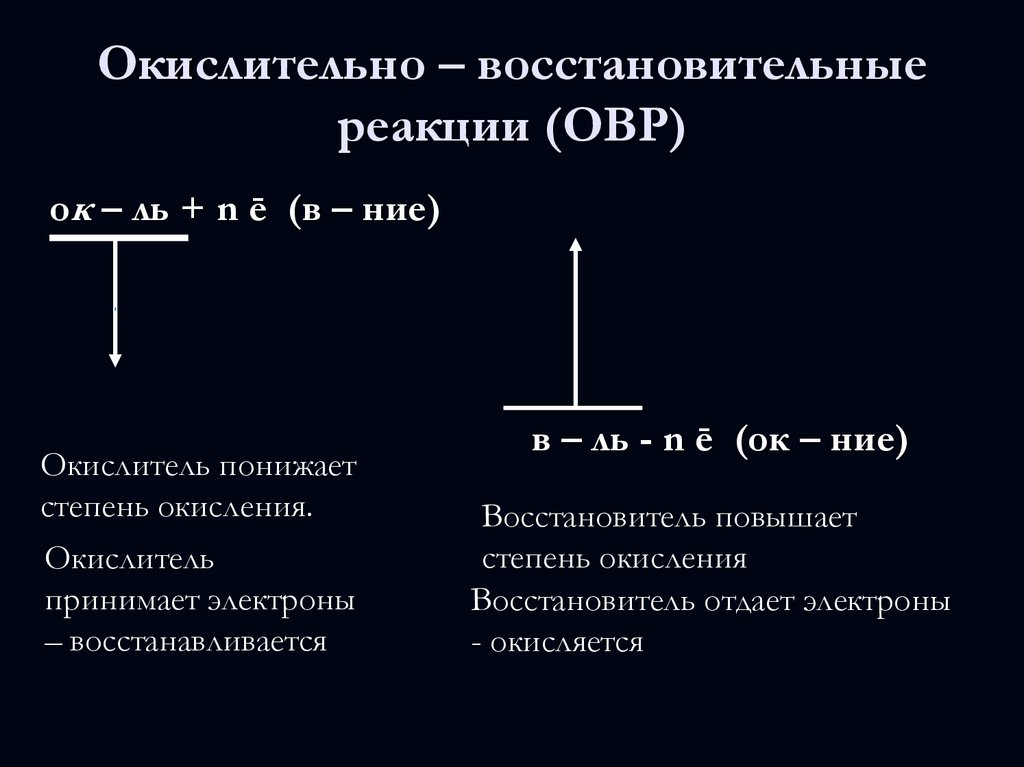
13. Окислительно – восстановительные реакции (ОВР)
ок – ль + n ē (в – ние)Окислитель понижает
степень окисления.
Окислитель
принимает электроны
– восстанавливается
в – ль - n ē (ок – ние)
Восстановитель повышает
степень окисления
Восстановитель отдает электроны
- окисляется
14.
15.
16.
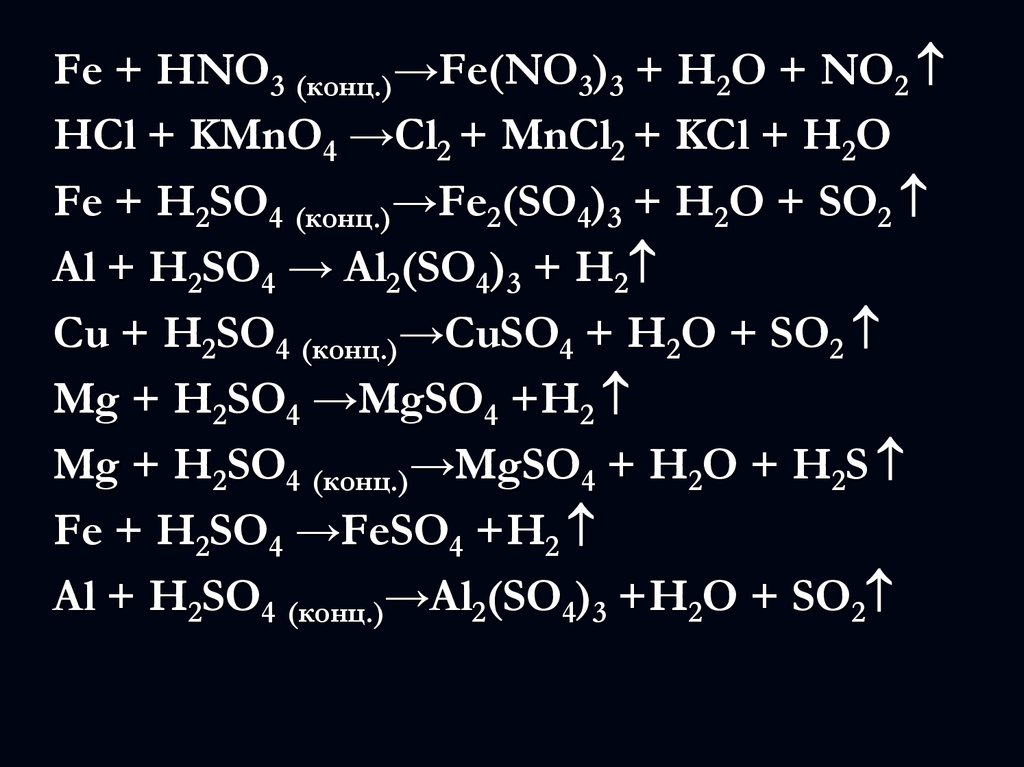
Fe + HNO3 (конц.)→Fe(NO3)3 + H2O + NO2HCl + KMnO4 →Cl2 + MnCl2 + KCl + H2O
Fe + H2SO4 (конц.)→Fe2(SO4)3 + H2O + SO2
Al + H2SO4 → Al2(SO4)3 + H2
Cu + H2SO4 (конц.)→CuSO4 + H2O + SO2
Mg + H2SO4 →MgSO4 +H2
Mg + H2SO4 (конц.)→MgSO4 + H2O + H2S
Fe + H2SO4 →FeSO4 +H2
Al + H2SO4 (конц.)→Al2(SO4)3 +H2O + SO2












 Химия
Химия








