Похожие презентации:
Общая и неорганическая химия
1.
* Общая и неорганическая химияПрограмма рассчитана на 120 часов, из них
аудиторных 64 часа, в том числе на лекции
отводится 20 часов, семинарские занятия – 16
часов, лабораторные занятия – 28 часов.
Форма аттестации – экзамен в 1-м семестре.
Лектор: старший преподаватель кафедры экологической
химии и биохимии Борсток Елена Петровна
2.
В результате изучения учебной дисциплиныстудент должен
знать:
* основные понятия и положения химии, основы теории химической связи
и валентности, периодический закон и периодическую систему
элементов, важнейшие классы неорганических соединений и их
свойства;
* классификацию и номенклатуру органических соединений, химические
свойства классов органических соединений;
* классификацию химических реакций, классификацию дисперсных
систем, основные понятия и методы электрохимии, адсорбционные
явления и методы их описания, энергетику и кинетику химических
процессов, колебательные реакции;
* основные схемы анализа сложных смесей, используя качественные
реакции разделения и обнаружения, способы описания химического
равновесия в гомогенных и гетерогенных системах, способы
определения pH сред, буферных систем, растворов солей, подвергающихся гидролизу;
* реакционную способность веществ, методы химической идентификации
веществ, основные понятия количественного анализа
9
3.
уметь:* производить расчеты химических реакций, в том числе, расчеты
концентраций растворов;
* применять методы термодинамики к задачам химии;
* рассчитывать концентрационные зависимости и приготавливать
соответствующие растворы;
* определять содержание веществ в исследуемом образце с помощью
методов количественного анализа;
* работать в химической лаборатории с химической посудой, весовым
оборудованием, реактивами, проводить простые химические
эксперименты и оформлять их результаты
владеть:
* приемами работы в химической лаборатории с химическими реактивами
и посудой;
* основными положениями химической термодинамики и кинетики;
* знаниями природы и типов химической связи и межмолекулярных
взаимодействий;
* знаниями типичных свойств важнейших классов неорганических
соединений.
4.
Рекомендуемая литератураОсновная
1. Ахметов, Н. С. Актуальные вопросы курса неорганической химии / Н. С.
Ахметов. – М.: Просвящение, 2019. – 224 с.
2. Бабков, А. В. Общая и неорганическая химия: учебник / Бабков А. В.,
Барабанова, Т. И., Попков, В. А. - Москва: ГЭОТАР-Медиа, 2020. - 384 с.
3. Глинка, Н.В. Общая химия / Н.В. Глинка. – М: Интеграл-Пресс, 2019. – 748с.
4. Грибанова, О.В. Общая и неорганическая химия: учебное пособие / О.В.
Грибанова. - Рн/Д: Феникс, 2019. – 416 c.
5. Зубович, И.А. Неорганическая химия/ И.А. Зубович. – М.: Высшая школа,
2019. – 432 с.
6. Подобед, Л.Ф. Сборник задач по общей и неорганической химии / Л.Ф.
Подобед, Е.П. Лобанова, Н.В. Богданова. – Минск, «ИВЦ Минфина», 2022.
7. Ткачев, С.В. Общая химия: учебное пособие/ С.В.Ткачев, В.В.Хрусталев. –
Минск: Вышэйшая школа, 2020. – 495 с.
8. Томашева,Е.В. Химия. Практикум: учебное пособие / Е.В.Томашева,
В.Л.Кубышин, И.В.Кулеш.- Минск: РИВШ, 2019. – 400 с.
9. Хаускрофт, К.Е., Констэбл, Э. Современный курс общей химии. В 2-х томах.
М.: Мир, 2020. - Ч1 — 540c., Ч2 — 528c.
Дополнительная
1. Денисова, В.В., Таланова В.М. Общая и неорганическая химия: учебное
пособие / Под ред. Денисова В.В., - Рн/Д: Феникс, 2018. – 144 c.
2. Коровин, H.В. Общая химия/ Н.В. Коровин. – М.: Высшая школа, 2018.
10
5.
*https://uzedu.online/himija/*https://uzedu.online/himija/1575/
*https://kitaphana.net/author/9/books
*https://glosbe.com/ru/tk/%D1%85%D0%B8
%D0%BC%D0%B8%D1%8F
*https://speak.tatar/ru/dict/rustuk/himiya/
*
6.
М.В. Ломоносов:«Химическая наука
рассматривает свойства и изменения тел, ...
состав тел, ... Объясняет причину того, что
с веществами при химических превращениях
происходит».
Д.И. Менделеев: «… Химия – это учение об
элементах и их соединениях…»
Михаил Васильевич
Ломоносов
(1711 – 1765гг)
Химия – наука о веществах,
их свойствах, превращениях
и явлениях,
сопровождающих эти
превращения.
2
7.
Лекция 1 (1+1ч).Основные законы химии и строение
электронных оболочек атомов
Содержание
1. Основные положения атомно-молекулярной теории.
Основные типы структур неорганических соединений.
Вещества с молекулярной и немолекулярной структурой.
Стехиометрические законы. Закон постоянства состава.
Нестехиометрические соединения. Химический эквивалент,
закон эквивалентов. Роль химии в развитии современной
техники, экологического образования и воспитания.
2. Квантово-механическая модель строения атома. Квантовые
числа. Атомные орбитали. Энергетические уровни и
подуровни. Строение электронных оболочек атомов
элементов. Многоэлектронный атом.
8.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕПредставления об атомах как мельчайших неделимых частицах зародились в
древней Греции. Основы современного атомно-молекулярного учения впервые
сформулировал М.В. Ломоносов (1748), но его представления были неизвестны
большинству учёных. Поэтому основоположником современного атомномолекулярного учения считается английский ученый Дж. Дальтон, который
сформулировал (1803–1807) его основные постулаты.
Основные современные положения атомно-молекулярной теории:
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но
отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы:
гомоядерные (при взаимодействии атомов одного элемента) или
гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при
химических - разрушаются; при химических реакциях атомы в
отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых
веществ из тех же самых атомов, из которых состоят
17
первоначальные вещества.
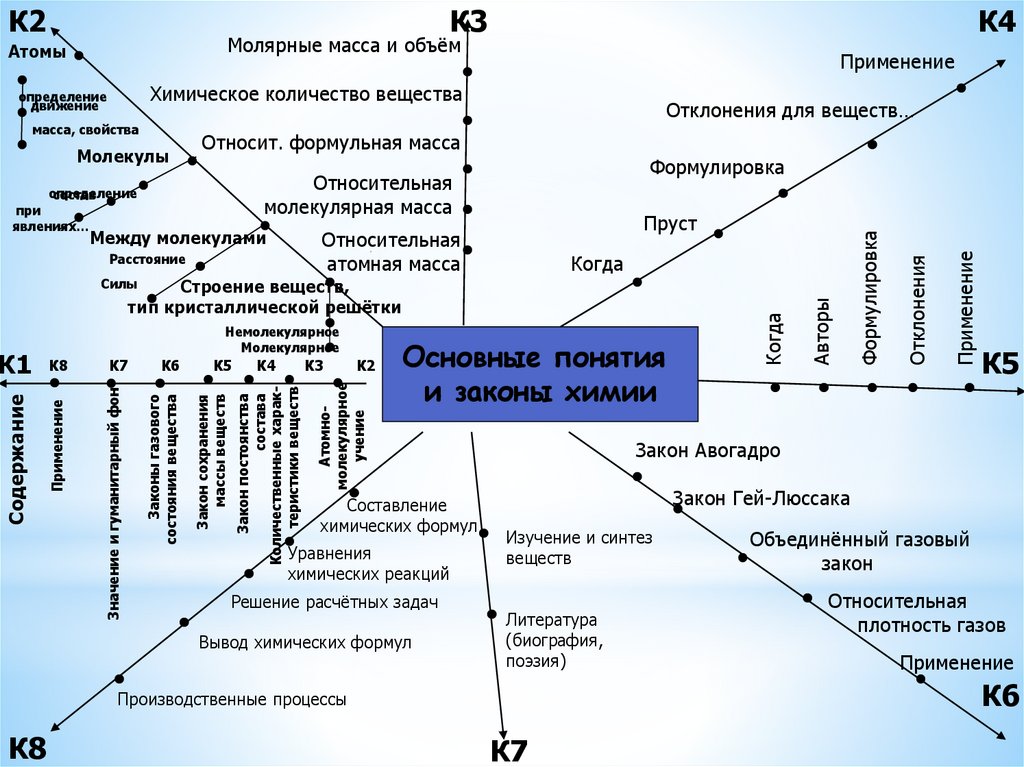
9.
К3К4
Молярные масса и объём
Применение
Химическое количество вещества
масса, свойства
Молекулы
Отклонения для веществ…
Относит. формульная масса
Формулировка
Относительная
молекулярная масса
определение
состав
при
явлениях…
Между молекулами
Пруст
Относительная
атомная масса
Расстояние
Когда
Строение веществ,
тип кристаллической решётки
Законы газового
состояния вещества
Закон сохранения
массы веществ
К4
К3
К2
Основные понятия
и законы химии
Составление
химических формул
Уравнения
химических реакций
Решение расчётных задач
Вывод химических формул
К5
Закон Авогадро
Закон Гей-Люссака
Изучение и синтез
веществ
Литература
(биография,
поэзия)
Объединённый газовый
закон
Относительная
плотность газов
Применение
К6
Производственные процессы
К8
Авторы
К5
Атомномолекулярное
учение
К6
Закон постоянства
состава
Количественные характеристики веществ
К7
Значение и гуманитарный фон
Применение
Содержание
К1 К8
Немолекулярное
Молекулярное
Когда
Силы
Применение
определение
движение
Отклонения
Атомы
Формулировка
К2
К7
10.
*Атом - наименьшая частица химического элемента,неделимая химичеки, но делимая физически, сохраняющая
все его химические свойства.
*Молекула – наименьшая химически и физически делимая
частица вещества, обладающая его химическими свойствами.
*Химический элемент - это вид атомов, характеризующийся
определенными зарядами ядер и строением электронных
оболочек.
* Химическая формула – запись вещества с помощью значков
химических элементов, показывающая, атомы каких
химических элементов и в каком соотношении связаны между
собой.
* Молекулярная химическая формула – отражает состав и
истинное соотношение атомов в молекуле (например,
С2Н5ОН).
*Структурная химическая формула – отражает состав и
последовательность связи атомов.
11.
*Международная единица атомных масс (1 а.е.м.) - равна 1/12массы изотопа 12C - основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-27 кг
*Относительная атомная масса (Ar) - безразмерная величина,
равная отношению средней массы атома элемента (с учетом
процентного содержания изотопов в природе) к 1/12 массы
атома 12C.
*Относительная молекулярная масса (Mr) - безразмерная
величина, показывающая, во сколько раз масса молекулы данного
вещества больше 1/12 массы атома углерода 12C.
Mr = mr / (1/12 mа(12C))
mr - масса молекулы данного вещества;
mа(12C) - масса атома углерода 12C.
Относительная молекулярная масса вещества равна сумме
относительных атомных масс всех элементов с учетом
индексов.
12.
*Количество вещества, моль - означает определенное числоструктурных элементов (молекул, атомов, ионов).
Обозначается n, измеряется в моль.
*Моль - количество вещества, содержащее столько же
частиц, сколько содержится атомов в 12 г углерода.
*Число Авогадро (NA) - количество частиц в 1 моль любого
вещества одно и то же и равно 6,02 • 1023. (Постоянная
Авогадро имеет размерность - моль-1).
*Молярная масса показывает массу 1 моля вещества
(обозначается M).
Молярная масса вещества равна отношению массы
вещества к соответствующему количеству вещества и
численно равна его относительной молекулярной массе,
однако первая величина имеет размерность г/моль, а вторая –
безразмерная.
M=m/n
13.
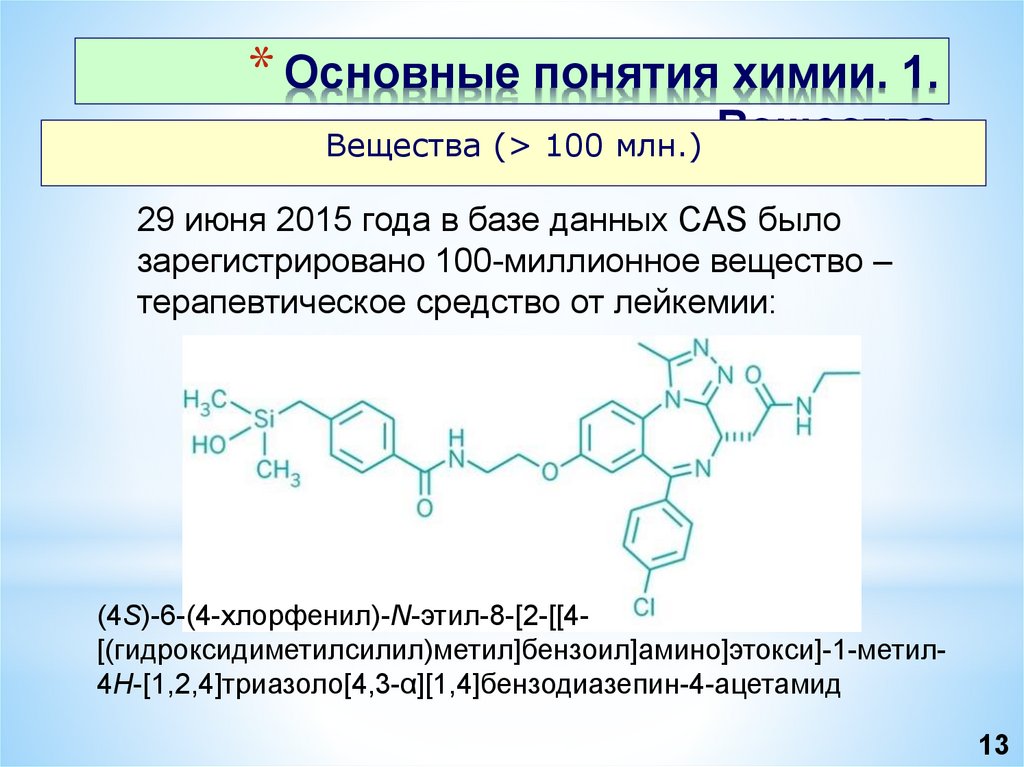
* Основные понятия химии. 1.Вещества (> 100 млн.) Вещества
29 июня 2015 года в базе данных CAS было
зарегистрировано 100-миллионное вещество –
терапевтическое средство от лейкемии:
(4S)-6-(4-хлорфенил)-N-этил-8-[2-[[4[(гидроксидиметилсилил)метил]бензоил]амино]этокси]-1-метил4H-[1,2,4]триазоло[4,3-α][1,4]бензодиазепин-4-ацетамид
13
14.
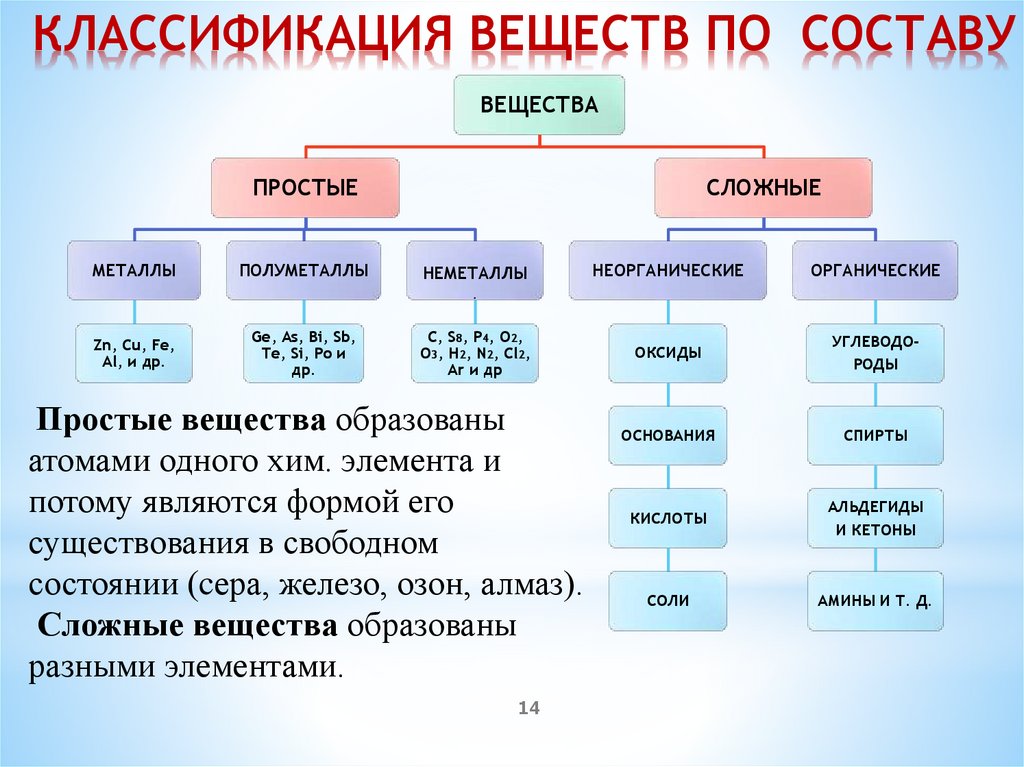
КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО СОСТАВУВЕЩЕСТВА
ПРОСТЫЕ
МЕТАЛЛЫ
ПОЛУМЕТАЛЛЫ
СЛОЖНЫЕ
НЕМЕТАЛЛЫ
НЕОРГАНИЧЕСКИЕ
ОРГАНИЧЕСКИЕ
ОКСИДЫ
УГЛЕВОДОРОДЫ
ОСНОВАНИЯ
СПИРТЫ
КИСЛОТЫ
АЛЬДЕГИДЫ
И КЕТОНЫ
СОЛИ
АМИНЫ И Т. Д.
.
Zn, Cu, Fe,
Al, и др.
Ge, As, Bi, Sb,
Te, Si, Po и
др.
C, S8, P4, O2,
O3, H2, N2, Cl2,
Ar и др
Простые вещества образованы
атомами одного хим. элемента и
потому являются формой его
существования в свободном
состоянии (cера, железо, озон, алмаз).
Сложные вещества образованы
разными элементами.
14
15.
** Аллотропия – способность химического элемента
образовывать несколько простых веществ, называемых
аллотропными модификациями
Аллотропные модификации углерода (С): алмаз, графит,
фуллерен, графен, нанотрубки
Основы химии. А. Згуро
15
05.09.2024
16.
S16
32,06
Сера
Элемент,
S
Простое вещество,
сера S
Сложное вещество,
пирит FeS2
21
17.
29Cu
63,546
Медь
Элемент,
Cu
Простое вещество,
медь Cu
Сложное вещество,
куприт Cu2O
22
18.
*Основные типы структурнеорганических соединений
*Неорганические вещества
классифицируются по
составу и по химическим
свойствам. По составу
неорганические вещества
делятся на бинарные –
состоящие только из двух
элементов, и
многоэлементные –
состоящие из нескольких
элементов.
Сложные
вещества обычно
делят на четыре
важнейших
класса: оксиды,
основания
(гидроксиды),
кислоты, соли.
19.
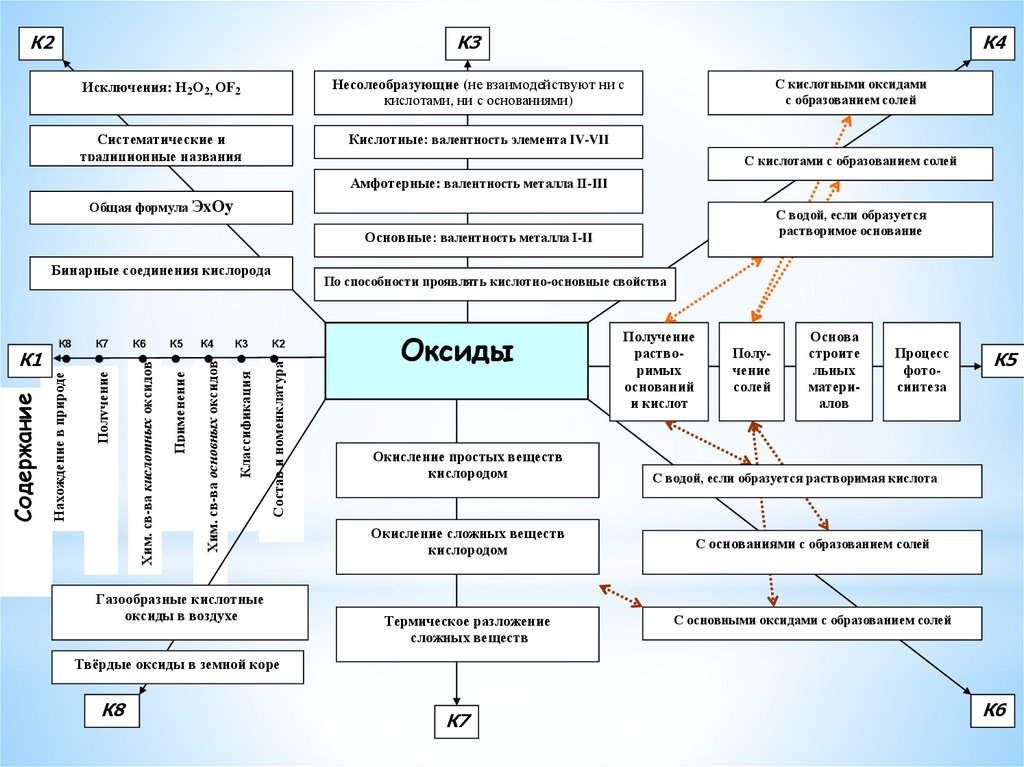
*Оксиды- бинарные соединения, содержащие кислород в
степени окисления -2.
Оксиды делят на две группы: солеобразующие и
несолеобразующие (СО, NO).
Солеобразующие оксиды принято делить на три
группы: основные, амфотерные, кислотные.
К основным относятся оксиды типичных металлов,
им соответствуют гидроксиды, обладающие
свойствами оснований (CuO, ZnO, PbO, Na2O).
Кислотные оксиды — оксиды неметаллов или
переходных металлов в высоких степенях
окисления (SO2 , CO2 , P2O5)
20.
К2К3
К4
Исключения: Н2О2, ОF2
Несолеобразующие (не взаимодействуют ни с
кислотами, ни с основаниями)
Систематические и
традиционные названия
Кислотные: валентность элемента IV-VII
С кислотными оксидами
с образованием солей
С кислотами с образованием солей
Амфотерные: валентность металла II-III
Общая формула ЭxОу
С водой, если образуется
растворимое основание
Основные: валентность металла I-II
По способности проявлять кислотно-основные свойства
К2
Состав и номенклатура
К3
Классификация
К4
Хим. св-ва основных оксидов
К5
Применение
К6
Хим. св-ва кислотных оксидов
К7
Получение
Содержание
К1
К8
Нахождение в природе
Бинарные соединения кислорода
Газообразные кислотные
оксиды в воздухе
Оксиды
Получение
растворимых
оснований
и кислот
Получение
солей
Основа
строите
льных
материалов
Процесс
фотосинтеза
Окисление простых веществ
кислородом
С водой, если образуется растворимая кислота
Окисление сложных веществ
кислородом
С основаниями с образованием солей
Термическое разложение
сложных веществ
К5
С основными оксидами с образованием солей
Твёрдые оксиды в земной коре
К8
К7
К6
21.
*Основаниями называются вещества(частицы), связывающие протоны (Бренстед).
К основаниям относятся аммиак, амины
(анилин), гидроксиды металлов.
Гидроксиды металлов делят на две группы:
растворимые в воде – щёлочи (образованные
щелочными и щелочноземельными
металлами) и нерастворимые в воде.
22.
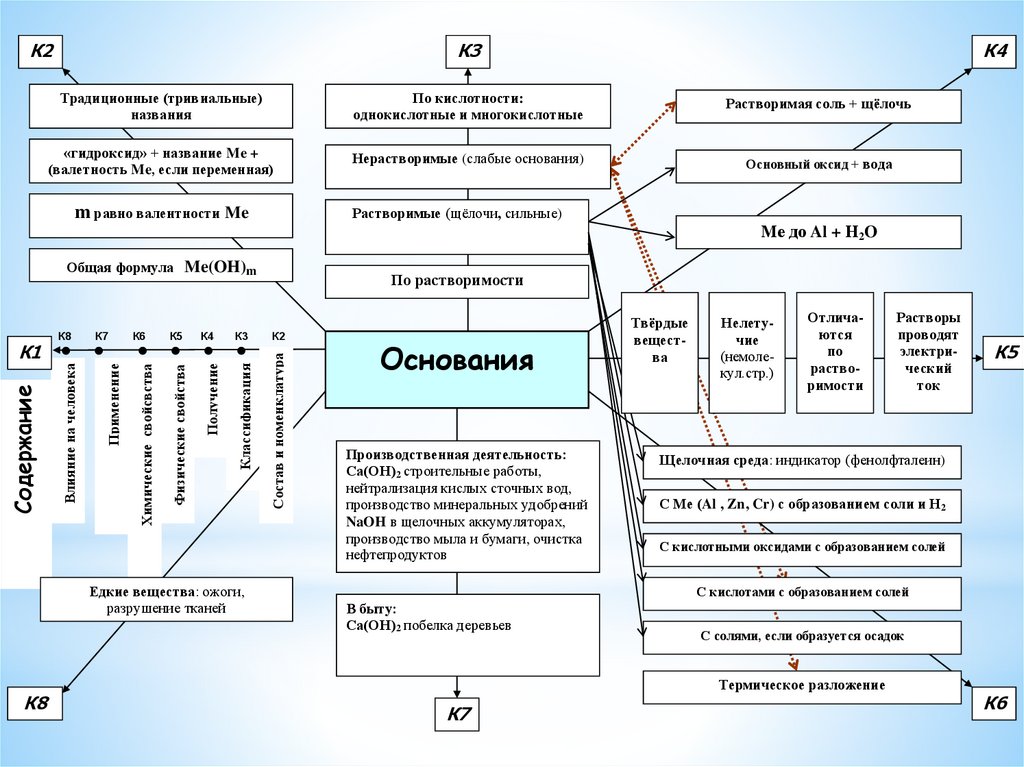
К2К3
Традиционные (тривиальные)
названия
По кислотности:
однокислотные и многокислотные
Растворимая соль + щёлочь
«гидроксид» + название Me +
(валетность Me, если переменная)
Нерастворимые (слабые основания)
Основный оксид + вода
m равно валентности Me
Растворимые (щёлочи, сильные)
Ме до Al + Н2O
К5
К4
К3
Получение
Классификация
Едкие вещества: ожоги,
разрушение тканей
К8
По растворимости
К2
Состав и номенклатура
К6
Физические свойства
К7
Применение
Влияние на человека
Содержание
К8
Химические свойсвства
Общая формула Me(OH)m
К1
К4
Основания
Производственная деятельность:
Са(ОН)2 строительные работы,
нейтрализация кислых сточных вод,
производство минеральных удобрений
NaOH в щелочных аккумуляторах,
производство мыла и бумаги, очистка
нефтепродуктов
Твёрдые
вещества
Нелетучие
(немолекул.стр.)
Отличаются
по
растворимости
Растворы
проводят
электрический
ток
К5
Щелочная среда: индикатор (фенолфталеин)
С Ме (Al , Zn, Cr) с образованием соли и Н2
С кислотными оксидами с образованием солей
С кислотами с образованием солей
В быту:
Са(ОН)2 побелка деревьев
С солями, если образуется осадок
Термическое разложение
К7
К6
23.
Кислоты - электролиты, которые придиссоциации в качестве катионов
образуют только H+).
24.
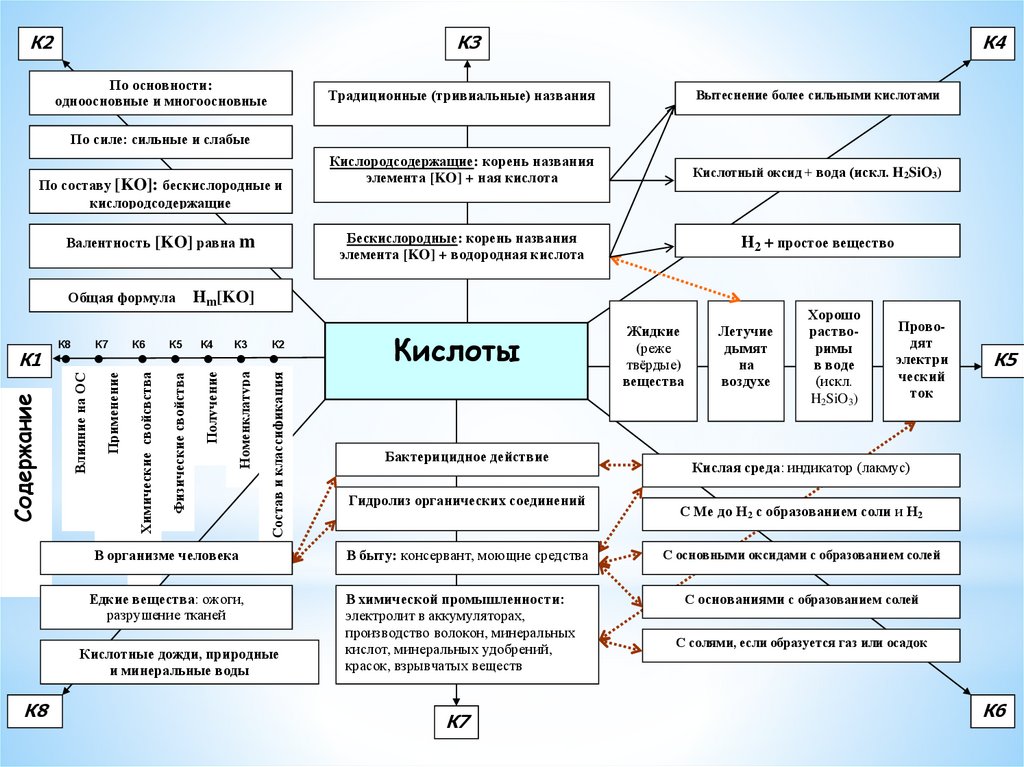
К2К3
По основности:
одноосновные и многоосновные
К4
Традиционные (тривиальные) названия
Вытеснение более сильными кислотами
Кислородсодержащие: корень названия
элемента [KO] + ная кислота
Кислотный оксид + вода (искл. H2SiO3)
Бескислородные: корень названия
элемента [KO] + водородная кислота
Н2 + простое вещество
По силе: сильные и слабые
По составу [KO]: бескислородные и
кислородсодержащие
Валентность [KO] равна m
К6
К5
К4
К3
К2
Физические свойства
Получение
Номенклатура
Состав и классификация
Применение
К7
Влияние на ОС
Содержание
К1
К8
Нm[KO]
Химические свойсвства
Общая формула
Бактерицидное действие
Гидролиз органических соединений
Летучие
дымят
на
воздухе
Хорошо
растворимы
в воде
(искл.
H2SiO3)
Проводят
электри
ческий
ток
С Ме до Н2 с образованием соли и Н2
В быту: консервант, моющие средства
С основными оксидами с образованием солей
Едкие вещества: ожоги,
разрушение тканей
В химической промышленности:
электролит в аккумуляторах,
производство волокон, минеральных
кислот, минеральных удобрений,
красок, взрывчатых веществ
С основаниями с образованием солей
К7
К5
Кислая среда: индикатор (лакмус)
В организме человека
Кислотные дожди, природные
и минеральные воды
К8
Кислоты
Жидкие
(реже
твёрдые)
вещества
С солями, если образуется газ или осадок
К6
25.
Соли - сложные вещества, которые состоят изатомов металла и кислотных остатков. Это наиболее
многочисленный класс неорганических соединений.
Средние - при диссоциации дают только катионы
металла (или NH4+)
Кислые - при диссоциации дают катионы металла
(NH4+), ионы водорода и анионы кислотного остатка.
26.
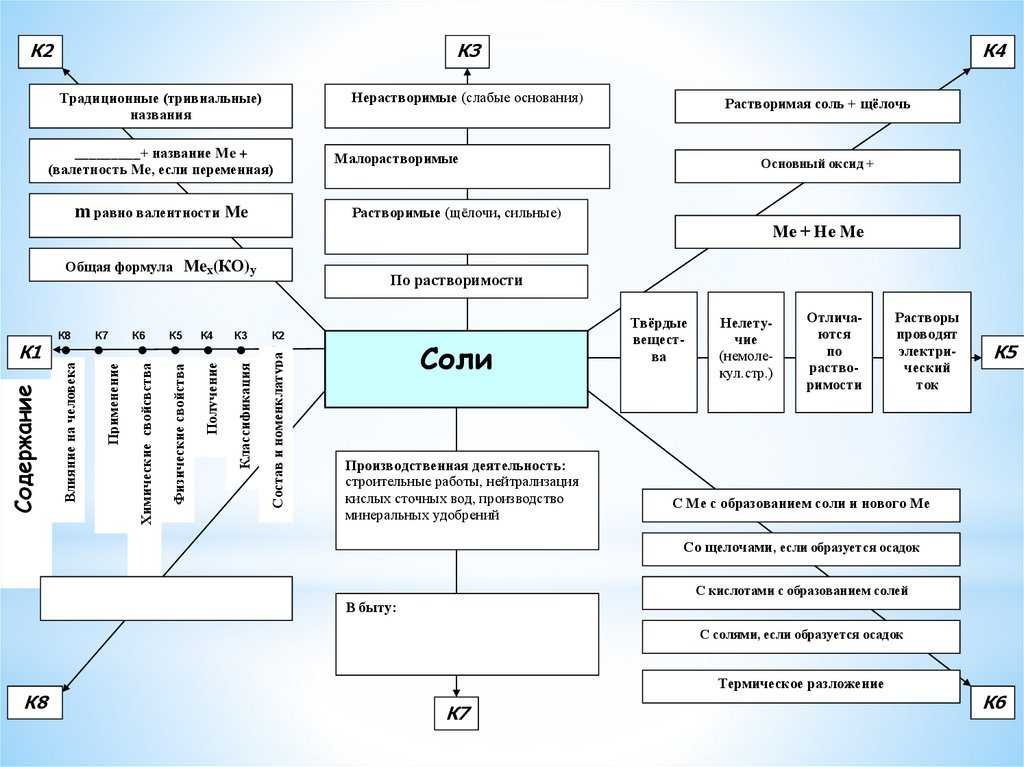
К2К3
Нерастворимые (слабые основания)
Традиционные (тривиальные)
названия
_________+ название Me +
(валетность Me, если переменная)
m равно валентности Me
К5
К4
К3
Физические свойства
Получение
Классификация
Малорастворимые
Основный оксид +
Ме + Не Ме
По растворимости
К2
Состав и номенклатура
К6
Химические свойсвства
Применение
Влияние на человека
Содержание
К1
К7
Растворимая соль + щёлочь
Растворимые (щёлочи, сильные)
Общая формула Meх(КО)у
К8
К4
Соли
Производственная деятельность:
строительные работы, нейтрализация
кислых сточных вод, производство
минеральных удобрений
Твёрдые
вещества
Нелетучие
(немолекул.стр.)
Отличаются
по
растворимости
Растворы
проводят
электрический
ток
К5
С Ме с образованием соли и нового Ме
Со щелочами, если образуется осадок
С кислотами с образованием солей
В быту:
С солями, если образуется осадок
К8
Термическое разложение
К7
К6
27.
Основные - при диссоциации дают катионы металла,анионы гидроксила и кислотного остатка.
Смешанные - образованы одним катионом и двумя
анионами
Комплексные - содержат сложные катионы или
анионы.
28.
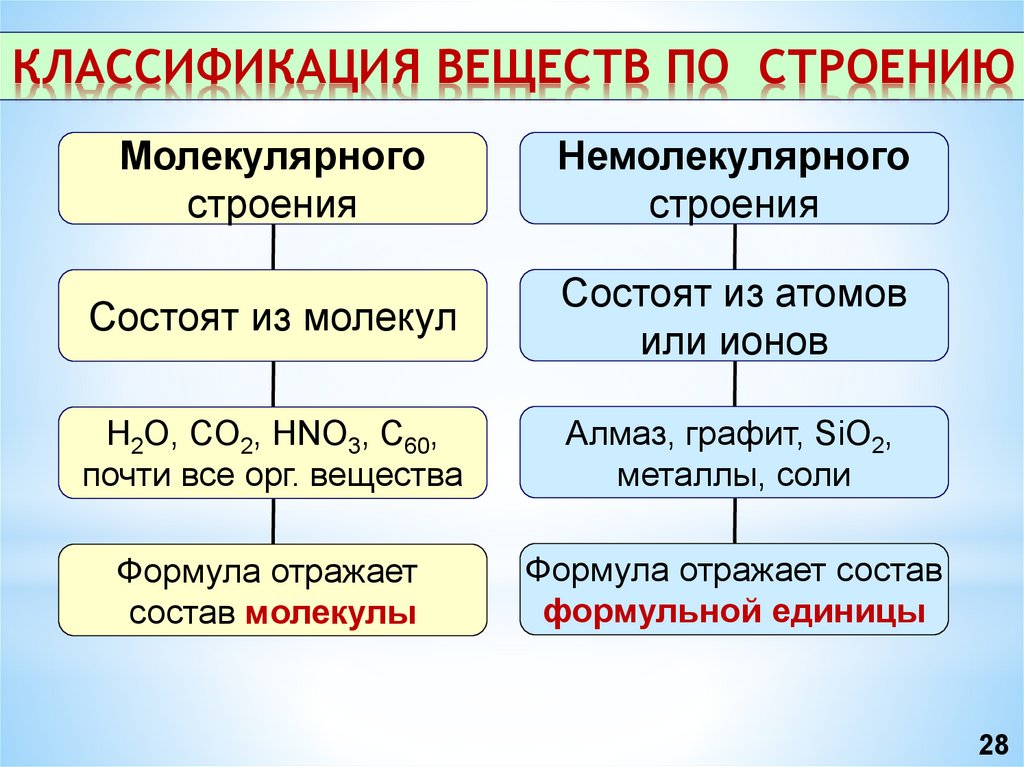
КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО СТРОЕНИЮМолекулярного
строения
Немолекулярного
строения
Состоят из молекул
Состоят из атомов
или ионов
H2O, CO2, HNO3, C60,
почти все орг. вещества
Алмаз, графит, SiO2,
металлы, соли
Формула отражает
состав молекулы
Формула отражает состав
формульной единицы
28
29.
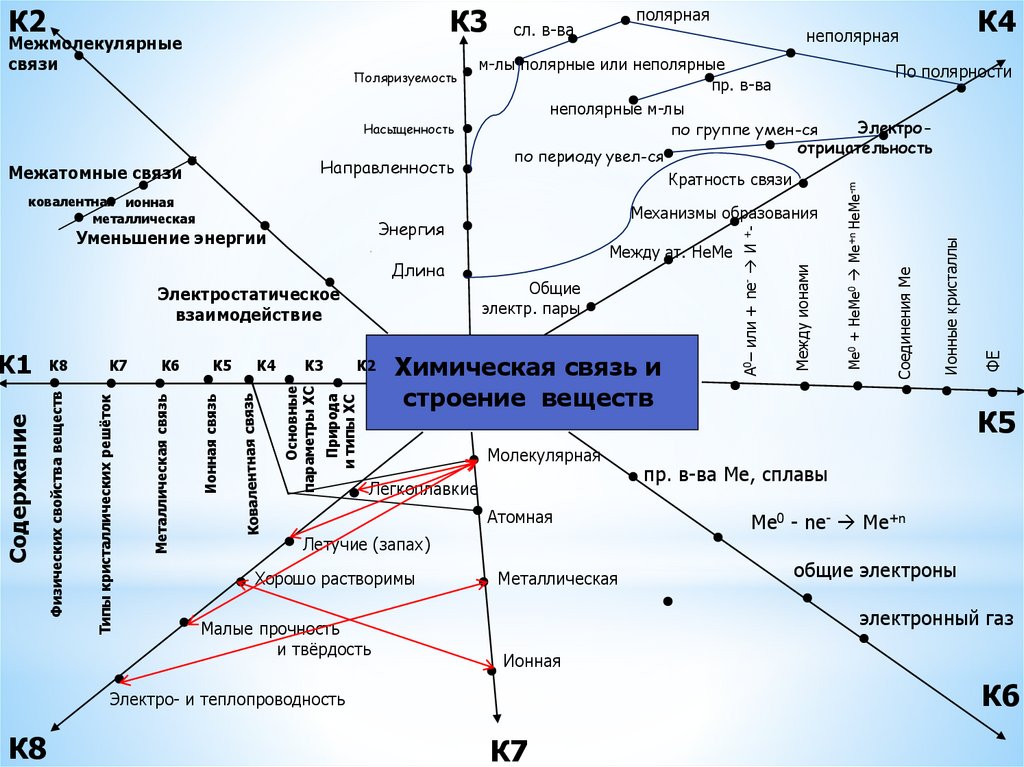
К3Уменьшение энергии
Длина
Электростатическое
взаимодействие
К3
К2
Природа
и типы ХС
К4
Основные
параметры ХС
К5
Ионная связь
К6
Металлическая связь
К7
Типы кристаллических решёток
Физических свойства веществ
Содержание
К1 К8
Механизмы образования
Энергия
Между ат. НеМе
Общие
электр. пары
Химическая связь и
строение веществ
Молекулярная
Легкоплавкие
Атомная
Летучие (запах)
Хорошо растворимы
Малые прочность
и твёрдость
Металлическая
К5
пр. в-ва Ме, сплавы
Ме0 - ne- Ме+n
общие электроны
электронный газ
Ионная
К6
Электро- и теплопроводность
К8
ФЕ
ковалентная ионная
металлическая
Ионные кристаллы
Направленность
Межатомные связи
Соединения Ме
Насыщенность
м-лы полярные или неполярные
По полярности
пр. в-ва
неполярные м-лы
Электропо группе умен-ся
отрицательность
по периоду увел-ся
Кратность связи
Me0 + НеМе0 Ме+n НеМе-m
Поляризуемость
неполярная
Между ионами
Межмолекулярные
связи
К4
полярная
сл. в-ва
А0– или + ne- И +-
К2
К7
30.
** Молекулярная: У веществ с
молекулярным строением в узлах
кристаллической решетки находятся
молекулы с прочными ковалентными
связями между атомами. В то же время
отдельные молекулы взаимосвязаны
гораздо слабее, что делает
молекулярный кристалл довольно
непрочным.
* С молекулярной: большинство простых
веществ неметаллов: O2, S8, P4, H2, N2,
Cl2; соединения неметаллов друг с
другом (бинарные и многоэлементные):
NH3, CO2, H2SO4.
30
05.09.2024
31.
* С немолекулярной: простые вещества металлы и ихсплавы: Na, Cu, Fe, ...; соединения металлов с
неметаллами: NaH, Na2SO4, CuCl2, Fe2O3; из
неметаллов: бор, кремний, углерод (алмаз), фосфор
(чёрный)
* Атомная: В узлах атомной кристаллической
решетки находятся атомы, связанные прочными
ковалентными связями в протяженную
пространственную сеть. В этом случае
структура отличается таким внутренним
единством, что можно сказать, что весь
кристалл представляет одну молекулу.
* Ионная: У веществ с ионной решеткой в узлах
расположены разноименно заряженные ионы,
удерживаемые силами электростатического
притяжения.
* Металлическая: Этим типом кристаллической решетки
обладают металлы с металлической химической
связью.
32.
Стехиометрия раздел химии, который изучает составвеществ и его изменение в ходе химических превращений, в
котором рассматриваются количественные (массовые,
объемные, мольные) соотношения между реагирующими
веществами и продуктами их взаимодействия
Теоретической основой расчетов количественных
соотношений между элементами в соединениях или между
веществами в уравнениях химических реакций являются
стехиометрические законы химии.
К законам стехиометрии относятся законы сохранения массы,
постоянства состава, кратных отношений, объемных отношений,
закон Авогадро и закон эквивалентов.
23
33.
* «Да – нет»*Дайте ответ «да» или «нет» на нижеследующие
утверждения.
1. Морская вода – чистое вещество.
2. Кислород в молекулах воды – простое вещество.
3. Фосфор – это метал.
4. Сложное вещество состоит из разных атомов.
5. Железо – вещество немолекулярного строения.
6. Поваренная соль – сложное вещество.
7. Дистиллированная вода – чистое вещество.
8. Сахар из водного раствора можно выделить
фильтрованием.
9. Простое вещество состоит из одинаковых атомов.
10.Поваренную соль из раствора выделяют выпариванием.
Задание: выпишите названия веществ, прозвучавших в тексте.
Классифицируйте эти вещества на простые и сложные, металлы
и неметаллы.
34.
Проверьте и оцените работу друг удруга
«10» – ошибок нет; «8» – 1-2 ошибки; «6» – 3-4
ошибки; «4» – 5-6 ошибок; «2» – работа не выполнена
*1- нет
*2 – нет
*3 – нет
*4 – да
*5 – да
*6 – да
*7 – да
Вещества : кислород,
* 8 – нет
* 9 – да
* 10 - да
Металлы: железо.
фосфор, железо, поваренная соль,
дистиллированная вода, сахар.
Простые вещества: кислород, фосфор,
железо.
Сложные вещества:
поваренная соль, дистиллированная вода.
Неметаллы: кислород, фосфор.
35.
ЗАКОН ПОСТОЯНСТВА СОСТАВАСформулирован в 1806 году Жозефом Луи Прустом
«От одного полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой
разницы нет между оксидом железа из Южного полушария и
Северного. Малахит из Сибири имеет тот же состав, как
и малахит из Испании.»
Жозеф Луи
Пруст
(1754–1826)
Химически чистое вещество независимо от
способа его получения всегда имеет постоянный
качественный и количественный состав
После того, как постоянство состава обычных соединений было
подтверждено, в середине-конце 19-го века было обнаружено, что
значительное количество твердых веществ (галогениды, оксиды,
карбонаты, гидроксиды, сульфиды, и т.п.) могут иметь переменный
состав в зависимости от условий синтеза и обработки.
26
36.
Сложные вещества образованы разнымиэлементами и могут иметь состав постоянный или
меняющийся в некоторых пределах.
Нестехиометрические соединения, химически
индивидуальные вещества переменного состава.
Оксид урана(VI): UO2 – UO2,5 – UO3
Клод Луи
Бертолле
(1748 – 1822)
Нитрид циркония: ZrN0,59, ZrN0,69, ZrN0,74, ZrN0,89
Они называются бертоллидами и встречаются среди оксидов,
гидридов, сульфидов, нитридов, карбидов, силицидов и других
неорганических кристаллических веществ.
Соединения постоянного состава (стехиометрические
соединения) называются дальтонидами
Соединения дальтонидов выражаются простыми
формулами с целочисленными стехиометрическими
индексами:
Джон Дальтон
(1766 – 1844)
H2O, HCl, CCl4, CO2, NH3 и другие.
27
37.
ЗАКОН ПОСТОЯНСТВА СОСТАВАCостав соединений молекулярной структуры,
т.е. состоящих из молекул, - является
постоянным независимо от способа получения.
Состав же соединений с немолекулярной
структурой (с атомной, ионной и металлической
решеткой) не является постоянным и зависит от
условий получения.
28
38.
ЗАКОН СОХРАНЕНИЯ МАССЫ И ЭНЕРГИИЕсли в одном месте что-то убудет, то в другом
обязательно прибудет. Энергия и масса не
исчезают, они просто трансформируются из
одного состояния в другое.
Ежели где убудет несколько материи, то
умножится в другом месте.
При любых процессах в изолированной системе
энергия не производится и не уничтожается, она
может только переходить из одной формы в
другую.
Сформулирован
16 июля 1748 года
Михаилом
Васильевичем
Ломоносовым
(1711 – 1765)
Закон сохранения массы – частный случай
закона сохранения материи и энергии
Масса веществ, вступающих в химическую
реакцию, равна массе веществ, образующихся
в результате реакции.
24
39.
ЗАКОН СОХРАНЕНИЯ МАССЫ И ЭНЕРГИИСвязь между массой и энергией:
E = mс2
где с - скорость света в вакууме
(с = 3•108 м/с)
Это соотношение (уравнение Эйнштейна)
показывает, что масса может переходить
в энергию и наоборот
В изолированной системе суммарная
масса веществ и суммарная энергия до
химической реакции равны суммарной
массе веществ и суммарной энергии
после реакции
Знаменитая формула на
небоскребе Тайбей 101 (Тайвань)
во время мероприятия
Всемирного года физики (2005)
25
40.
Эквивалент.Закон эквивалентов
41.
*Эквивалент – это частица или часть частицы,которая соединяется (взаимодействует) с одним
атомом водорода или с одним электроном
*Эквивалентом вещества называют такое его
количество, которое соединяется с 1 молем
атомов водорода или замещает то же количество
атомов водорода в химических реакциях.
*Примеры. В соединении HCl на один моль атомов
водорода приходится один моль атомов
Следовательно, эквивалент хлора равен 1.
HBr
H2O
NH3
1 моль Н
2 моль Н
3 моль Н
1 моль Br
1 моль О
1 моль N
1
2
3
хлора.
42.
*fэкв
– это безразмерная величина, обратная числу
эквивалентов
– число, показывающее, какая часть молекулы
или другой частицы вещества соответствует
эквиваленту (одному иону водорода в кислотноосновной реакции или одному электрону в реакции
окисления-восстановления).
Для атомов химических элементов
1
fэкв(Х) =
В
где В – валентность (степень окисления) элемента.
43.
Примеры.Определите фактор эквивалентности
а) для магния.
fэ(Mg) =
1
1
=
В
2
+6
б) для серы в MgSO4.
1
1
=
fэ(S) =
В
6
44.
fэкв = 1 / (n m),n – заряд элемента,
m – число атомов элемента стоящего в
химической формуле на первом месте
fэкв(N2О5) = 1/(5х2) = 1/10
45.
**Эквивалент вещества – это реальная или условная
частица в-ва, которая в кислотно-основных реакциях
присоединяет (или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях
принимает (или отдает) один электрон.
*Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH = K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода
замещаются на атомы калия, иначе, в реакцию вступают
два иона Н+ (кислота проявляет основность 2). Тогда по
определению эквивалентом H3PO4 будет являться
условная
частица
½
H3PO4,
т.к.
если
одна
молекула H3PO4 предоставляет два иона Н+, то один ион
Н+ дает половина молекулы H3PO4.
46.
*Частица
Фактор эквивалентности
Кислота
Основа
ние
Соль
f
э
Примеры
fЭ(H2SO4) = 1/2
(основность равна 2)
1
n(H )
где n(H+) – число отданных в ходе
реакции ионов водорода
(основность кислоты)
1
fЭ(Cu(OH)2) = 1/2
fэ
n(OH )
(кислотность равна 2)
где n(ОH–) – число отданных в
ходе реакции гидроксид-ионов
(кислотность основания)
f
э
1
n(Me) В (Ме)
1
n(A) В (A)
где n(Ме) – число атомов металла,
В(Ме) – валентность металла;
fЭ(Cr2(SO4)3) = 1/(2×3) =
= 1/6
47.
fэкв = 1/n,где n – эквивалент кислоты для данной реакции.
Н2SО4 +2NаОН Nа2SО4 + 2Н2О
fэкв (Н2SО4) = ½ ,
Н2SО4 +NаОН NаНSО4 + Н2О
fэкв (Н2SО4) = 1,
48.
Эквивалентная молярная массавещества (Mэкв)
(эквивалентной массой) называется выраженная
в граммах масса одного моля-эквивалента этого
вещества, т.е. это масса количества вещества
эквивалентов равного числу Авогадро (6,02.1023)
Она равна произведению молярной массы
формульной единицы и фактор эквивалентности
Мэкв. = М . fэкв
49.
*Следует различать эквивалентные массы
элементов и эквивалентные массы
соединений!
Эквивалентная молярная масса элемента
Мэкв. = А×fэкв
или
А А
Mэ
В Z
В - стехиометрическая валентность,
А-атомная масса элемента,
Z-заряд или степень окисления.
50.
*Определить эквивалентную массу
элементов кислорода и водорода в
соответствующих веществах
O2
H2
16
M э (O)
2
1
M э (H )
1
51.
51Эквивалент элемента
зависит от
степени
окисления
проявляемой
элементом в
различных
соединениях
fэкв = 1/n,
где n –
степень
окисления
Например:
СО
СО2
(с.о. углерода = +2) (с.о. углерода = +4)
fэкв(С) = 1/2
fэкв(С) = 1/4
Мэкв(С) = М 1/n =
Мэкв (С) = М 1/n
12 1/2 = =6г/моль = 12 1/4 = 3 г/моль
52.
*Определить эквивалентную массу Cr в
соединениях: Cr2O3; K2Cr2O7
Cr O3
3+
2
52
M э (Cr )
3
K 2Cr O7
52
M э (Cr )
6
6+
2
53.
*равна молярной массе оксида деленной
на произведение числа атомов
элемента, образующих оксид, на его
степень окисления
М(оксида)
M Э (оксида) =
n×В
М(Cr2O 3 )
M Э (Cr2O 3 ) =
2× 3
54.
Эквивалентная молярная массахимического соединения равна
сумме эквивалентных молярных
масс составляющих его частей.
Например, эквивалентная масса
бинарного соединения равна
сумме эквивалентных масс
образующих его элементов.
55.
*M Э (Al2O3 ) M Э (Al) M Э (O)
27 16
M Э (Al2O3 ) 17 г / моль
3 2
или
M(Al2O3 ) 102
M Э (Al2O3 )
17 г / моль
2 3
6
56.
равна молярной массе основания, делённой на«кислотность», т.е. число гидроксогрупп в
основании (а в реакции число замещенных гидроксогрупп)
М(основания)
M Э (основания) =
n × (OH )
90
M Э (Fe(OH)2 ) =
= 45 г/моль
2
57.
Al(OH)3 + HCl = Al(OH)2Cl + H2OМэ [Al(OH)3] = М [Al(OH)3] /1=78 г/моль
Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O
Мэ [Al(OH)3] = М [Al(OH)3] /2=39 г/моль
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Мэ [Al(OH)3] = М [Al(OH)3] /3=26 г/моль
58.
*1.H3PO 4 +KOH =KH2PO 4 +H2O
M ( H 3 PO4 )
Mэ
98г / моль
1 1
2.H3PO 4 +2KOH =K 2HPO 4 +2H2O
M ( H 3 PO4 )
Mэ
49 г / моль
2 1
3.H3PO 4 +3KOH =K 3PO 4 +3H2O
M ( H 3 PO4 )
Mэ
33г / моль
3 1
59.
*равна молярной массе соли
деленной на произведение числа
атомов металла, образующих
соль, на его степень окисления
60.
*окислительно-восстановительных
M
Mэ
n e
М – молярная масса
окислителя или
восстановителя,
n·e - число
электронов
принимаемых или
отдаваемых одной
молекулой
61.
*2KMnO4 + 5NaNO2 + 3H 2SO 4 =
2MnSO4 + 5NaNO3 +K 2SO 4 + 3H 2O
M(KMnO4 ) 155
M э (KMnO4) =
=
=31г/моль
5
5
+5e
+7
+2
Mn Mn n e = 5
62.
Если одно из реагирующих веществ или продуктовреакции (участников реакции) - газ, то для него вводится
понятие молярный объем эквивалента газа
Vэкв(Х) – объем одного моля эквивалентов газа при
нормальных условиях (н.у.)
*Молярный объем эквивалента газа Х при н.у.
Vэкв(Х) равен молярному объёму газа,
умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X)
fэкв(X) = 1/Z(B)
где Z(B) является произведением числа атомов в молекуле
простого вещества и валентности химического элемента
63.
Например, при нормальных условиях(P=760 мм.рт.ст., t = 0 оС) 1 моль-эквивалент
водорода занимает объем, равный
22,4 1
Vэ(H2) =
= 11,2 л/моль
2
Vэкв(О2) = 22,4×1/4= 5,6 л/моль.
64.
*в
окислительно-восстановительных реакциях
fэкв(X) = 1/Z(B)
где Z(B) является числом электронов, которые отдаёт или
присоединяет одна молекула вещества в хим.реакции
*4 NH3 + 3 О2 = 2 N2 + 6 H2О;
*4 NH3 + 5 О2 = 4 NO + 6 H2О
*Vэкв(О2) = 22,4 × 1/4 = 5,6 л.
*Vэкв(NH3) = 22,4 × 1/3 = 7,47 л – в первой реакции.
*Vэкв(NH3) = 22,4 × 1/5 = 4,48 л – во второй реакции.
65.
** – количество молярных масс эквивалентов
вещества (nэкв.) равно массе вещества (m)
деленной на молярную массу эквивалентов
этого вещества (Mэкв) или объему газа (V)
деленному на молярный объем
эквивалентов газа (Vэкв.):
* nэкв. = m/Mэкв. = V/Vэкв (моль-экв).
66.
* Закон эквивалентов* Вещества взаимодействуют друг с другом, а
продукты реакций образуются в количествах,
пропорциональных их эквивалентам.
Если взято n(экв1) моль эквивалентов одного вещества, то столько же
моль эквивалентов другого вещества n(экв2) потребуется в данной
реакции
n(экв1) = n(экв2)
Известна и другая формулировка этого закона:
Массы (или объёмы) реагирующих друг с другом и
образующихся веществ пропорциональны их
эквивалентным массам (или объёмам – для газов)
m1 M Э1
m2 M Э 2
67.
Если известно, что одно из веществ газ, то законэквивалентов записывается в виде:
m1 M э (1)
Vэ (2)
V2
где m1, Мэ(1) – масса и эквивалентная масса
реагирующего вещества; V2, Vэ(2) – объем и
эквивалентный объем газообразного вещества.
68.
*0,304г магния вытеснили
0,0252 г водорода.
Вычислите эквивалентную
массу магния.
69.
*Воспользуемся законом
эквивалентов и запишем:
m(Mg) M Э (Mg)
=
m(H 2 )
M Э (H 2 )
0.304
x
0.0252 1.008
x 12,16 г / моль
70.
*Мышьяк образует два оксида, один
содержит 65,2% As, а другой 75,7% As.
Вычислить Мэкв мышьяка, его
валентность и составить формулы
оксидов.
71.
*Воспользуемся законом
эквивалентов:
m( As ) M Э ( As )
m(O)
M Э (O)
72.
*AsxОy–100%, тогда
ω(О)=100% – ω(As)=100% – 65,2%=34,8%
Т.к. дано бинарное соединение, то в формулу закона
эквивалентов можно подставлять %, получим:
As M экв ( As ) 65.2 M экв ( As )
O M экв (O ) 34.8
8
73.
*65, 2 8г / моль
M экв ( As )
15г / моль
34,8
АAs
АAs
75
M экв ( As )
ВAs
5
ВAs
M экв ( As ) 15
Формула 1-го оксида имеет вид:
As2О5
74.
*Находим формулу второго оксида:
AsxОy–100%, тогда
ω(О)=100% – ω(As)=100% – 75,7%=24,3%
As M экв ( As ) 65.2 M экв ( As )
O M экв (O )
34.8
8
75.
*75, 7 8г / моль
M экв ( As )
25г / моль
24,3
АAs
АAs
75
M экв ( As )
ВAs
3
ВAs
M экв ( As ) 25
Формула 2-го оксида имеет вид:
As2О3
76.
* Пример 2.* Решение:
Согласно закону эквивалентов, количество
эквивалентов галогена, металла и кислорода численно равны
между собой, nэкв(О2) = nэкв(Г) что составляет:
nэкв(О2) =
Зная количество эквивалентов и массу вещества можно
определить эквивалентную массу этого вещества:
nэкв(Г) =
* Ответ: 126,8 г/моль.
77.
* Пример 3.Решение:
Поскольку эквивалентный объем водорода известен
(11,2л/моль), составим пропорцию:
19,55 г/моль металла эквивалентны 11,2 л/моль водорода
хг
металла эквивалентны
Откуда: Масса металла равна 5,24 г
3л
водорода
78.
* Пример 4.Решение. При решении задачи следует иметь в виду, что
эквивалентная масса химического соединения равна
сумме эквивалентных масс составляющих его частей:
а) эквивалентная масса гидроксида равен сумме
эквивалентных масс металла и гидроксильной группы;
_
Мэкв (МеОН) = Мэкв (Ме) + Мэкв (ОН ) = X + (17:1)
б) эквивалентная масса соли равен сумме эквивалентных
масс металла и кислотного остатка.
_
Мэкв (МеNO3) = Мэкв (Ме) + Мэкв (NO3 ) = X + (62:1)
Учитывая сказанное, подставляем соответствующие
данные в уравнение
m1 M Э1
m2 M Э 2
3.85 : 1.6 = (X + 62) : (X + 17)
Х = Мэкв (Ме) = 15 г/моль
79.
* Домашнеезадание
1. Пятивалентный элемент образует оксид, в котором
содержание этого элемента равно 65,22 %. Вычислить
молярную массу эквивалента элемента и назвать его.
2. Найдите эквивалентную массу и определите металл, если
1 г его вытесняет из кислоты 560 мл водорода (н.у.).
3. Найдите эквивалентную массу металла, если 3,55 г
оксида которого дают 7,55 г сульфата этого металла.
4. Для растворения 4,2 г некоторого металла потребовалось
3,75 г серной кислоты. Определите эквивалентную массу
металла и объем выделившегося водорода.
5. 16г едкого натрия прореагировало с 19,6г фосфорной
кислоты. Найдите эквивалентную массу фосфорной
кислоты и составьте уравнение реакции ее
взаимодействия с NaOH.
6. Найдите эквивалентную массу металла, если при
разложении 17,7 г его йодида образовалось 1,12л паров
йода (при н.у.).
80.
*81.
В настоящее время растёт темп добычи и переработкигромадного объема минеральных ресурсов, растёт
необходимость повышения производительности труда и
эффективности производства. Успехи человека в решении
больших и малых проблем выживания в значительной мере
были достигнуты благодаря развитию химии, становлению
различных химических технологий.
Успехи многих отраслей человеческой деятельности, таких, как
энергетика, металлургия, машиностроение, легкая и пищевая
промышленность и других, во многом зависит от состояния и
развития химии. Огромное значение химия имеет для успешной
работы сельскохозяйственного производства, фармацевтической
промышленности.
82.
Химическая промышленность производит десяткитысяч наименований продуктов, многие из которых по
технологическим и экономическим характеристикам
успешно конкурируют с традиционными материалами,
а часть — является уникальной по своим параметрам.
Химия дает материалы с заранее заданными
свойствами, в том числе и такими, которые не
встречаются в природе. Подобные материалы
позволяют проводить технологические процессы с
большими скоростями, температурами, давлениями, в
условиях агрессивных сред. Внедрение химических
методов ведёт к интенсификации технологических
процессов, увеличению выхода полезного вещества,
снижению отходов, повышению качества.
83.
Для промышленности химия поставляет такие продукты, каккислоты и щелочи, краски, синтетические волокна и т.п. Для
сельского хозяйства химическая промышленность выпускает
минеральные удобрения, средства защиты от вредителей,
химические добавки и консерванты к кормам для животных.
Для домашнего хозяйства и быта химия поставляет моющие
средства, краски, аэрозоли и др. продукты.
Однако химизация имеет негативную сторону. Химия прямо
или опосредованно затронула практически все компоненты
окружающей среды: сушу, атмосферу, воду Мирового океана
— внедрилась в природные круговороты веществ. В
результате этого нарушилось сложившееся в течение
миллионов лет равновесие природных процессов на
планете, химизация стала заметно отражаться на здоровье
самого человека.
84.
Угроза экологической катастрофы требуетрешительного пересмотра отношений
современной «химической» цивилизации и
природы в сторону оптимизаций этих
отношений.
85.
В настоящее время наметились следующие путирешения сложных экологических проблем:
комплексная переработка сырья; пересмотр
традиционных процессов получения известных
продуктов; внедрение бессточных и замкнутых схем
водопотребления; очистка выбрасываемых газов.
Экологические проблемы порождены не только
экономикой и техникой, но и нравственным
состоянием человека. Вопрос состоит не только в том,
чтобы остановить процесс разрушения природы
техническими средствами. Вопрос состоит в том,
чтобы в корне изменить потребительское отношение
человека к окружающему миру.












































































 Химия
Химия








