Похожие презентации:
Методы определения средних молекулярных масс
1.
2.
3.
4.
5.
6.
7.
Методы определения средних молекулярных масс1)Химические методы, основанные на химическом взаимодействии специально подобранного
реагента с химически активными концевыми группами
(Чаще всего концевые группы определяются титрованием, реже с помощью ИК- , ЯМР- и массспектроскопии). Молекулярная масса, определяемая по количеству концевых групп в
молекуле, зависит от числа молекул полимера и является среднечисловой ММ.
2) Термодинамические
Термодинамические методы основаны на пропорциональности изменения количественных свойств растворов
(понижение температуры замерзания, повышение температуры кипения, осмотическое давление и д.р.) числу
молекул растворенного вещества. Растворы полимеров используемых концентраций не подчиняются
термодинамическим законам, справедливым для идеальных растворов, поэтому результаты измерений
экстраполируют на бесконечное разбавление.
- криоскопический метод (по Т замерз);
- эбуллиоскопический метод (по Т кип);
среднечисловая ММ
- метод осмотического давления
3) Вискозиметрический метод средневязкостная ММ
4) Метод седиментации или ультрацентрифугирование Z-cредняя ММ
5) Метод диффузии
средневесовая ММ
6) Метод светорассеяния
7) Метод гель-проникающей хроматографии
8.
МЕТОДЫ ОПРЕДЕЛЕНИЯ СРЕДНЕЧИСЛОВОЙ МОЛЕКУЛЯРНОЙ МАССЫХИМИЧЕСКИЕ МЕТОДЫ
Метод концевых групп
Линейная макромолекула имеет (в зависимости от химического строения
полимера) различные концевые группы: OH, COOH, и др. Определение числа
концевых групп химическими и физико–химическими методами
(спектроскопическими, радиометрическими и т. д.) позволяет определить Mn в
диапазоне от 103 до 105.
Если m – число концевых групп в макромолекуле (ее «основность»), а L – ее
эквивалентная масса, то
Mn = L • m
(1)
Поскольку L = a/e, где а – навеска вещества; е – общее число эквивалентов
концевых групп, то
Mn = ma/e
(2)
Определение Mn по концевым группам осложняется изменением химической
природы концевых групп некоторых макромолекул в результате побочных
реакций декарбоксилирования, солеобразования, этерификации и т.п.
Применение химических методов ограничивается точностью аналитического
определения концевых групп в полимере. Метод концевых групп применим для
определения Mn ≤ 5• 104 .
9.
ФИЗИЧЕСКИЕ МЕТОДЫЗначения Mn можно оценивать по коллигативным свойствам растворов.
Коллигативные свойства растворов — это свойства растворов,
обусловленные только самопроизвольным движением молекул, то есть они
определяются не химическим составом, а числом кинетических единиц —
молекул в единице объёма или массы.
Широкое распространение получили следующие методы оценки
коллигативных свойств:
1) повышение температуры кипения раствора ΔTЭ (эбулиоскопия);
2) понижение температуры замерзания раствора ΔTk (криоскопия);
3) изотермическая дистилляция;
4) определение осмотического давления π (осмометрия).
10.
ЭбулиоскопияВ бесконечно разбавленных растворах активность растворителя в растворе становится близкой к
активности чистого растворителя. В этих условиях изменение температуры, необходимое для
повышения давления паров от p до р0 , определяется уравнением:
lim(∆TЭ/C)C 0= (RT2/pL) • (1/M1)
где R– универсальная газовая постоянная, кал/(град•моль);
Т – температура кипения растворителя, К;
ρ – плотность растворителя, г/мл;
L – теплота парообразования, кал/г;
С – концентрация растворенного вещества, г/мл;
М – молекулярная масса вещества.
Так как С = gi/b, где gi – масса фракции полимера, г; b – объем растворителя, мл;
То ΔTЭ = KЭ • (gi/Mi), где КЭ = RT2/pbL
Значение КЭ, пересчитанное на 1000 г растворителя, получило название эбулиоскопической константы,
величина которой определяется химической природой выбранного растворителя.
Для полидисперсного препарата
ΔTЭ = KЭ • Σ(gi/Mi)
Но так как gi/g = fi (массовая доля молекул с молекулярной массой Mi), а среднечисловая молекулярная
масса может быть определена Mn = 1/ Σ(KЭg/Mn) , то
ΔTЭ = KЭg/Mn
Достоинство эбулиоскопического метода определения молекулярного веса заключается в том, что при
этом удается определить число всех молекул высокомолекулярного вещества, включая наиболее
низкомолекулярные фракции.
Область применимости эбулиоскопического метода определяется чувствительностью прибора для
измерения температуры. При возможности фиксации значений ΔTЭ ≈ 10-5 град.
11.
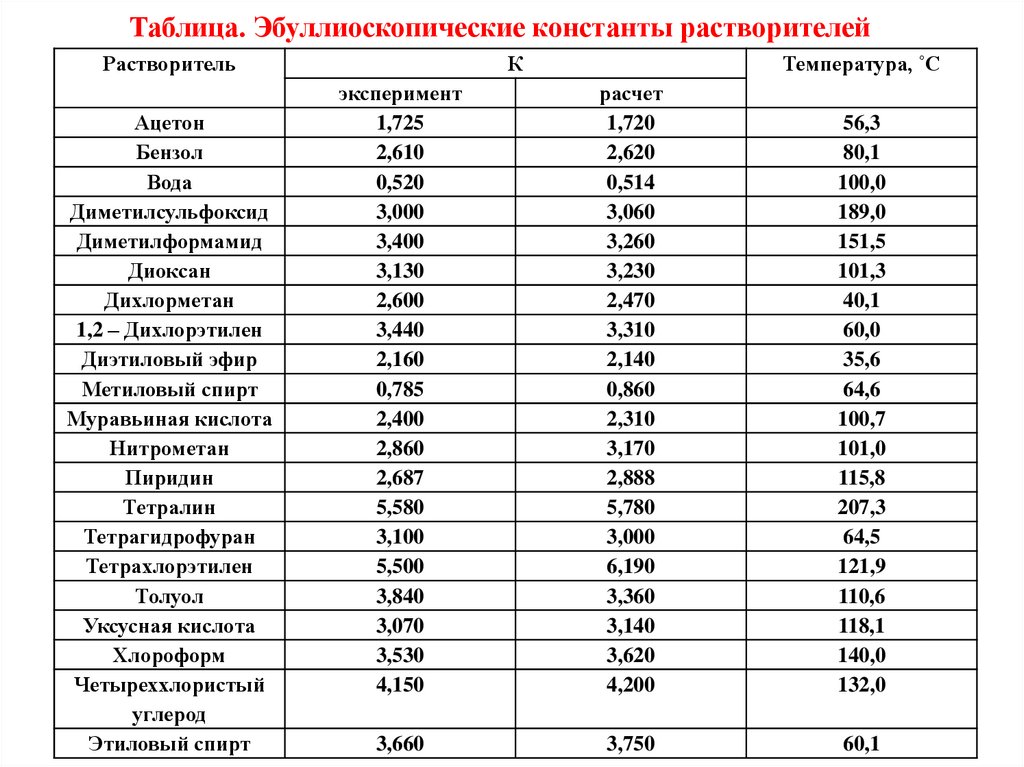
Таблица. Эбуллиоскопические константы растворителейРастворитель
Ацетон
Бензол
Вода
Диметилсульфоксид
Диметилформамид
Диоксан
Дихлорметан
1,2 – Дихлорэтилен
Диэтиловый эфир
Метиловый спирт
Муравьиная кислота
Нитрометан
Пиридин
Тетралин
Тетрагидрофуран
Тетрахлорэтилен
Толуол
Уксусная кислота
Хлороформ
Четыреххлористый
углерод
Этиловый спирт
К
Температура, ˚С
эксперимент
1,725
2,610
0,520
3,000
3,400
3,130
2,600
3,440
2,160
0,785
2,400
2,860
2,687
5,580
3,100
5,500
3,840
3,070
3,530
4,150
расчет
1,720
2,620
0,514
3,060
3,260
3,230
2,470
3,310
2,140
0,860
2,310
3,170
2,888
5,780
3,000
6,190
3,360
3,140
3,620
4,200
56,3
80,1
100,0
189,0
151,5
101,3
40,1
60,0
35,6
64,6
100,7
101,0
115,8
207,3
64,5
121,9
110,6
118,1
140,0
132,0
3,660
3,750
60,1
12.
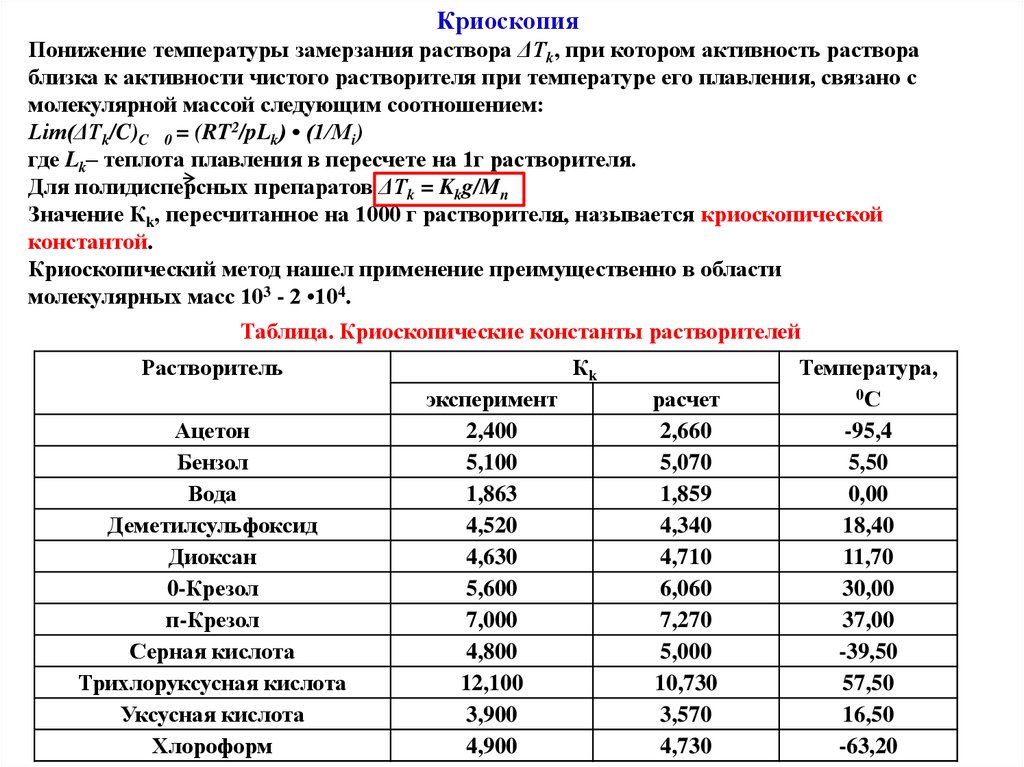
КриоскопияПонижение температуры замерзания раствора ΔTk, при котором активность раствора
близка к активности чистого растворителя при температуре его плавления, связано с
молекулярной массой следующим соотношением:
Lim(ΔTk/C)C 0 = (RT2/pLk) • (1/Mi)
где Lk– теплота плавления в пересчете на 1г растворителя.
Для полидисперсных препаратов ΔTk = Kkg/Mn
Значение Кk, пересчитанное на 1000 г растворителя, называется криоскопической
константой.
Криоскопический метод нашел применение преимущественно в области
молекулярных масс 103 - 2 •104.
Таблица. Криоскопические константы растворителей
Растворитель
Ацетон
Бензол
Вода
Деметилсульфоксид
Диоксан
0-Крезол
п-Крезол
Серная кислота
Трихлоруксусная кислота
Уксусная кислота
Хлороформ
Кk
эксперимент
2,400
5,100
1,863
4,520
4,630
5,600
7,000
4,800
12,100
3,900
4,900
расчет
2,660
5,070
1,859
4,340
4,710
6,060
7,270
5,000
10,730
3,570
4,730
Температура,
0С
-95,4
5,50
0,00
18,40
11,70
30,00
37,00
-39,50
57,50
16,50
-63,20
13.
ОсмометрияПри растворении полимера происходит уменьшение химического потенциала
растворителя в растворе μ1 по сравнению с его величиной в чистом
растворителе μ10. Это обуславливает одностороннее движение частиц
растворителя в раствор через полупроницаемую перегородку, разделяющую
раствор и чистый растворитель. Разбавление раствора прекращается, когда
активность молекул растворителя по обе стороны мембраны становится
одинаковой. Это может быть достигнуто при бесконечно большом разбавлении
раствора. При этом объем раствора увеличивается, что влечет за собой
соответствующее повышение гидростатического давления. Такое равновесное
гидростатическое давление эквивалентно осмотическому.
Если π - осмотическое давление, то в соответствии с уравнением Вант-Гоффа
πV = nRT , где n – число молей растворенного вещества; V- объем раствора.
Или с учетом активности
πV1 = -RTlna1 ,
где а1– активность растворителя.
С другой стороны
n = CiV/Mi ,
где Сi- массовая концентрация растворенного
вещества.
При сопоставлении уравнений легко видеть, что
- (μ1 - μ10)/V1 = π , т.е. величина осмотического давления однозначно
характеризует изменение химического потенциала раствора при изменении его
концентрации.
14.
Принципиальная схема осмометра приводится нарисунке. Сосуд, снабженный двумя одинаковыми
капиллярами, разделен мембраной, которая способна
пропускать только молекулы растворителя. В отсек А
наливают растворитель, а в отсек Б – испытуемый
раствор. Осмометр тщательно термостатируют. В
результате осмоса объем жидкости в отсеке Б
увеличивается до тех пор, пока гидростатическое
давление столба жидкости в капилляре отсека Б не
уравновесит величину осмотического давления.
Подставляя значения n получаем
π = RTCi/Mi
Или для полидисперсного продукта
π = RTΣi(Ci/Mi) = RTC/Mn
Уравнение Вант-Гоффа применимо к идеальным системам, где взаимодействием между
растворенными частицам можно пренебречь.
При переходе к реальной системе приходится учитывать возможные контакты между
макромолекулами, что математически можно описать некоторым степенным рядом.
Для изменения химического потенциала раствора справедлив следующий ряд:
- (μ1 - μ10) = (RTV1C) • (1/M2 + А2C + А3C2 +….)
Соответственно для осмотического давления:
π = RTC • (1/M2 + А2C + А3C2 +….)
Такие уравнения называются вириальными, а коэффициенты А2, А3 и следующие –
вириальными коэффициентами.
15.
Осмотические свойства разбавленных растворов полимеров в большинстве случаевудовлетворительно описываются вириальным уравнением с двумя первыми членами:
π/С = RT • (1/M2 + А2C) Уравнение графически изображается прямой с тангенсом угла наклона tgα =
RTА2 , после экстраполяции отсекающей на оси ординат отрезок, равный RT/ M2.
Величина π/С называется приведенным
осмотическим давлением; величина RT/ Mn = π/С c 0
= [π] – характеристическим осмотическим давлением
(концентрация раствора С выражается в г/мл).
Следовательно, по результатам измерений
осмотического давления молекулярный вес полимера
может быть вычислен из уравнения:
[π] = RT/Mn
где T - абсолютная температура, °К
R = 82,06 мл• атм/(град •моль) - универсальная
газовая постоянная;
π - осмотическое давление, атм.
Для определения молекулярной массы осмометрическим методом применяют два способа: статический, когда
измеряется равновесная разность уравнений в осмометре, и динамический, когда измеряется скорость проникновения
растворителя через мембрану в зависимости от приложенного давления. В случае полимеров, растворимых в
органических растворителях, обычно используют в качестве полупроницаемой мембраны пленку бактериальной
целлюлозы, свежесформованный целлофан, а так же поливинилспиртовую пленку.
Величину осмотического давления оценивают по изменению высоты столба жидкости в капилляре. Если ρ - плотность
раствора (практически равна плотности растворителя), то π ( в атм ) можно вычислить по формуле:
π = ∆hρ/1033,3
Возможность определения молекулярной массы осмотическим методом ограничиваются точностью отсчета Δh и
проницаемостью мембраны для частиц исследуемого вещества. Наиболее достоверные значения Mn находятся в
пределах от 1∙104 до 7∙105.
16.
МЕТОДЫ ОПРЕДЕЛЕНИЯ СРЕДНЕВЕСОВОЙ МОЛЕКУЛЯРНОЙ МАССЫГИДРОДИНАМИЧЕСКИЕ МЕТОДЫ
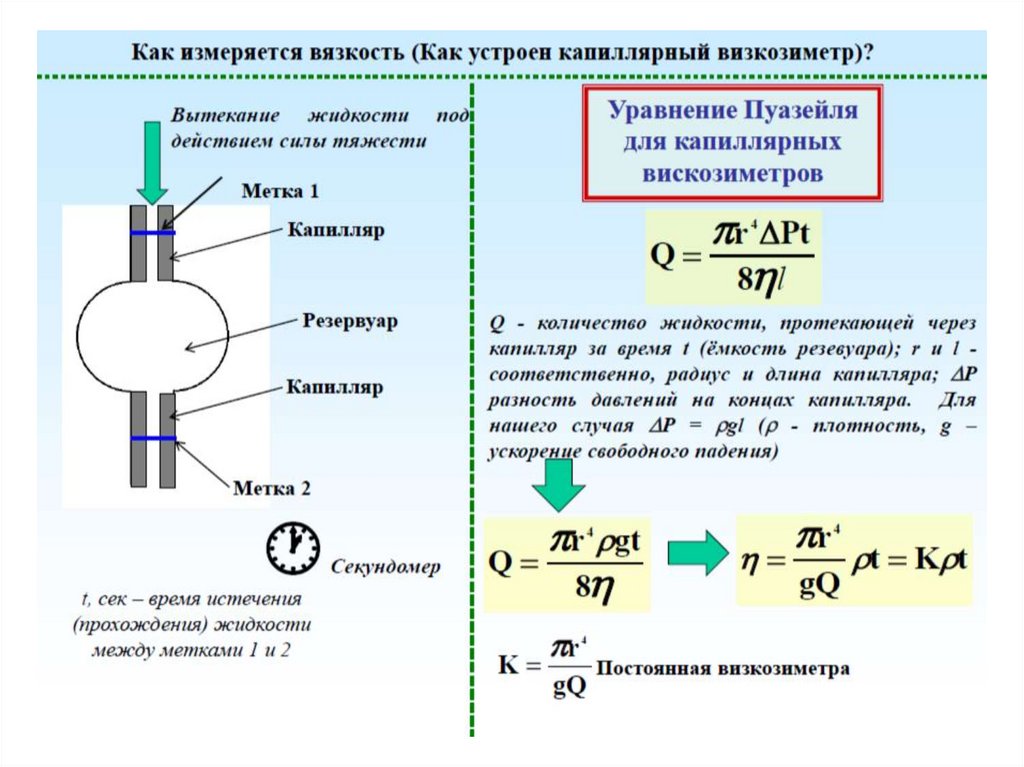
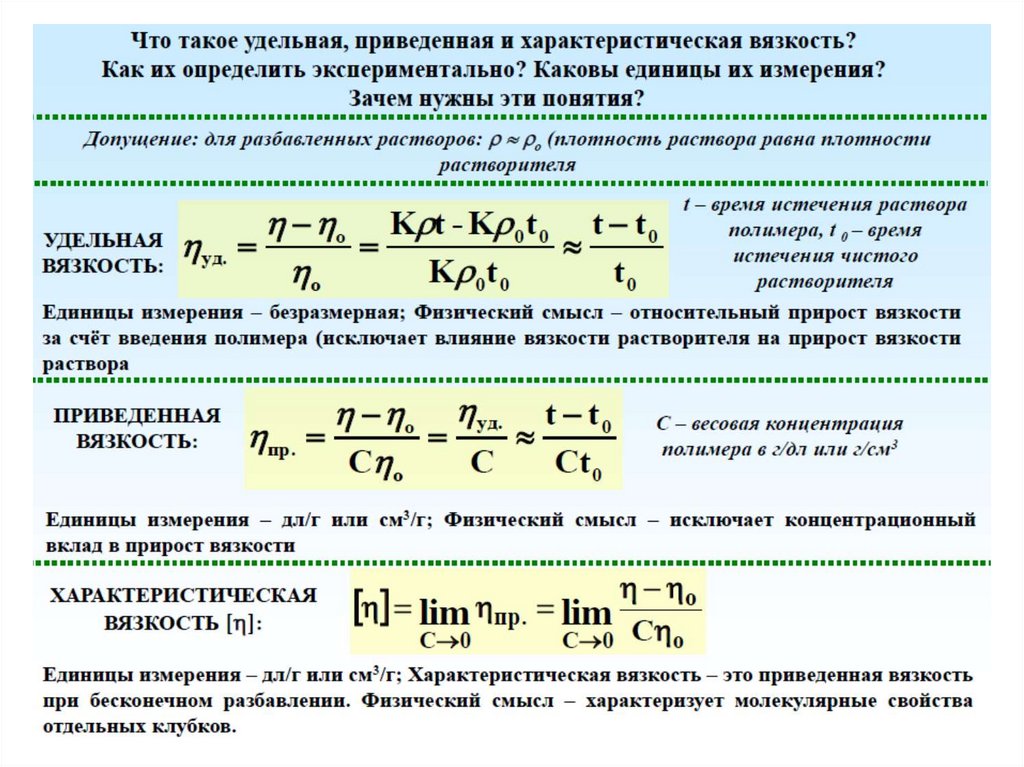
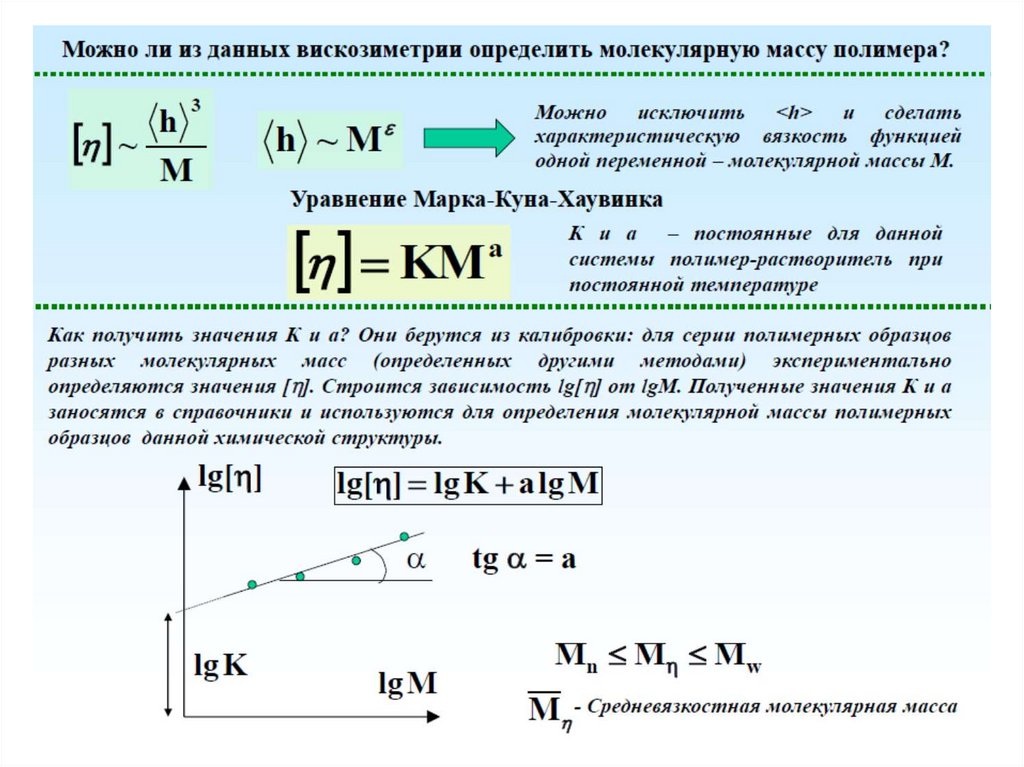
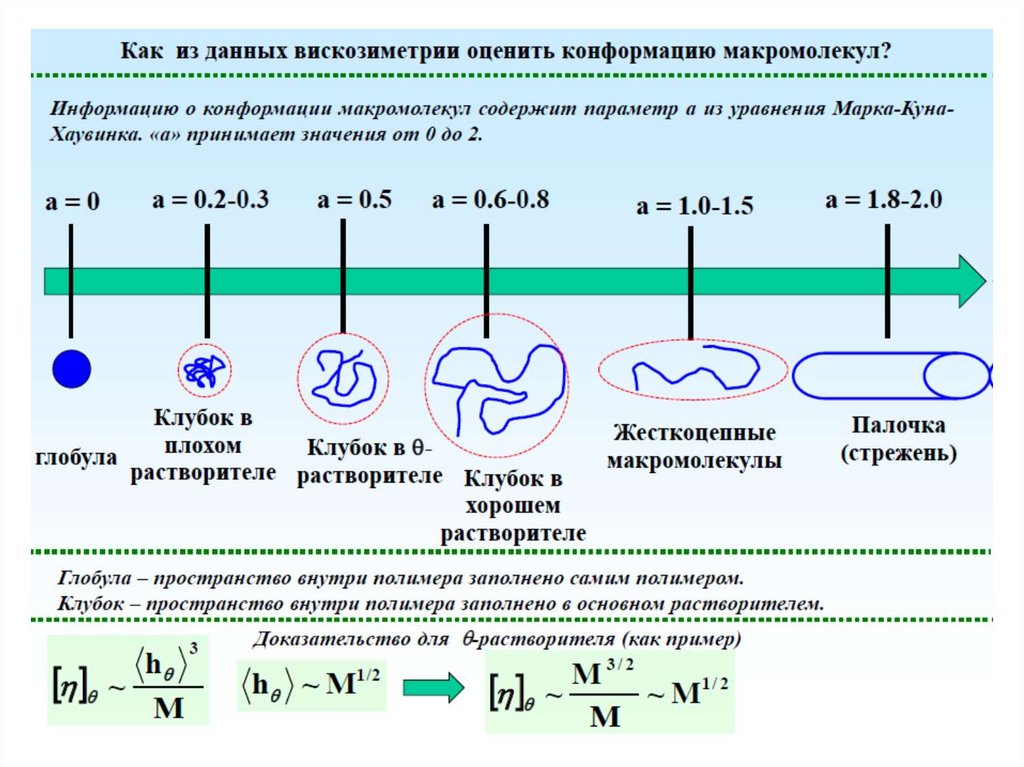
Вискозиметрия
В соответствии с законом Ньютона сила, необходимая для
сдвига двух соседних гипотетических слоев жидкости,
отнесенная к единице площади (так называемое
напряжение сдвига τ), пропорциональна скорости сдвига
(или градиенту скорости сдвига D):
τ = η ·dV/dx
Коэффициент
пропорциональности
η
называется
коэффициентом вязкости (или вязкостью).
η = [пуаз]
0.01 Пуаз = 1 сПуаз Вязкость воды = 1 сПуаз
Жидкости, вязкость η которых в изометрических условиях остается постоянной при
любых значениях τ и градиента скорости, называются ньютоновскими; все остальные
– неньютоновскими (аномально вязкими). Практически все растворы полимеров
относятся к неньютоновским жидкостям. Вязкость в растворах полимеров изменяется
в зависимости от напряжения сдвига τ. По характеру изменения вязкости различают
область наибольшей ньютоновновской вязкости (ηн =Const), область структурной
вязкости (η≠Const) и область наименьшей ньютоновской вязкости (η ∞ = Const).
17.
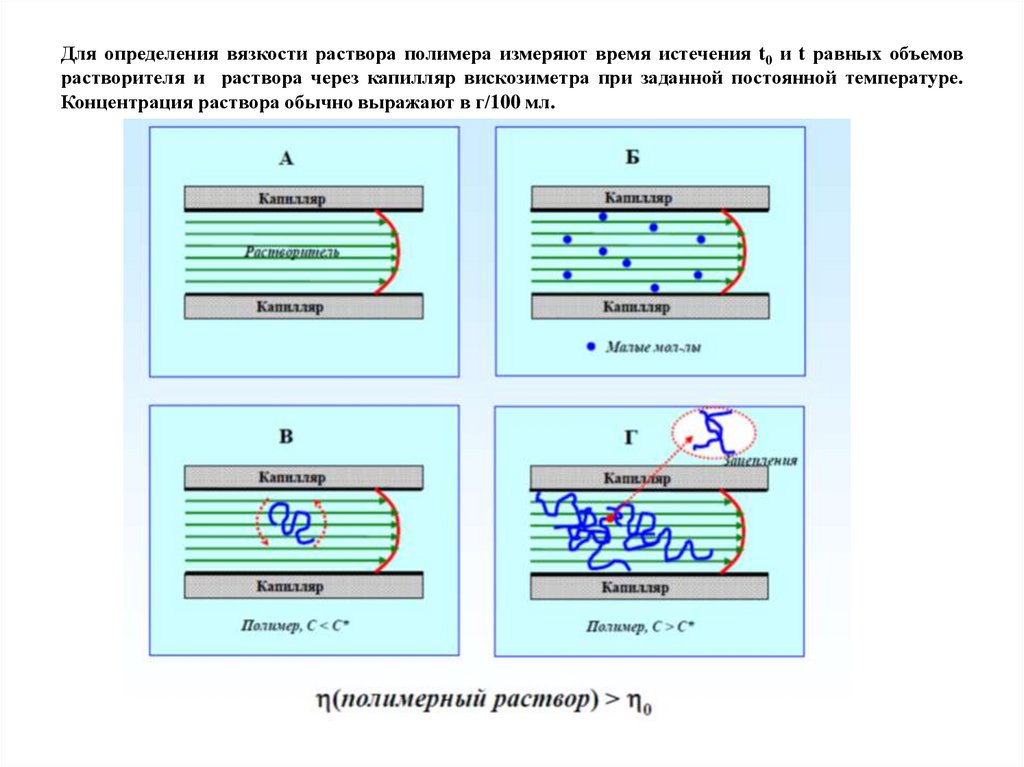
Для определения вязкости раствора полимера измеряют время истечения t0 и t равных объемоврастворителя и раствора через капилляр вискозиметра при заданной постоянной температуре.
Концентрация раствора обычно выражают в г/100 мл.
18.
19.
20.
21.
22.
23.
Диффузионные методыЭти методы основаны на измерении коэффициента диффузии D для 4-5 р-ров полимера
различных концентраций (но не более l/[ƞ]), после чего экстраполяцией к C→ 0 определяют D0.
Коэффициент диффузии измеряют, оценивая скорость размывания границы между р-ром
полимера и растворителем. Эту скорость чаще всего оценивают по скорости изменения
показателей преломления d раствора при диффузии макромолекул из более концентрированного
раствора в чистый растворитель. Для большинства органических соединений наблюдается
линейная зависимость D от C.
Зависимость D от концентрации может быть описана уравнением
D = D0(1 + KDС) , где KD – эмпирический коэффициент, зависящий в изотермических
условиях от выбора системы полимер – растворитель.
Зависимость коэффициента диффузии D0 от молекулярной массы может быть описана
следующим образом:
D0 = KDMD-b , где b – величина, обусловленная формой молекулы (b ≥ 0,5 ).
Значения KD и b
Полимер - растворитель
Полистирол – четыреххлористый углерод
Полистирол - дихлорэтан
Полистирол - толуол
Полиметилакрилат - хлороформ
Полибутилметакрилат - хлороформ
Полифенилметакрилат - бутилацетат
Поли - β винилнафталин - бензол
Полиакрилонитрил - диметилформамид
KD·104
1,20
1,12
1,66
4,50
3,90
2,52
3,50
2,19
-b
0,55
0,56
0,51
0,60
0,59
0,56
0,57
0,58
24.
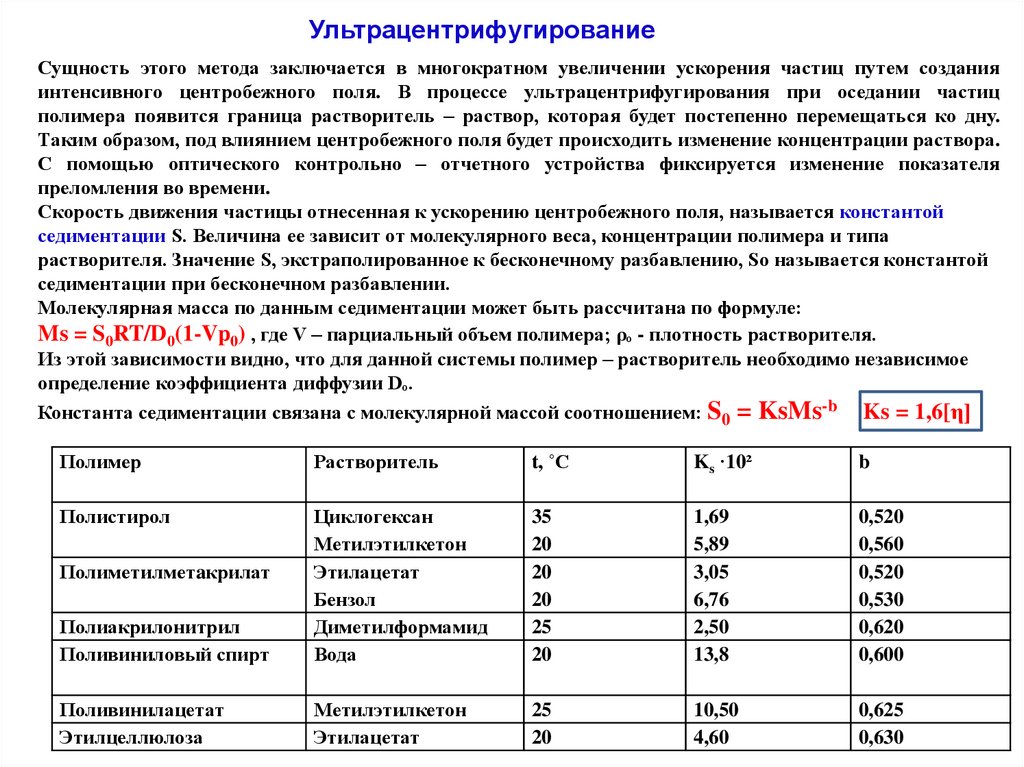
УльтрацентрифугированиеСущность этого метода заключается в многократном увеличении ускорения частиц путем создания
интенсивного центробежного поля. В процессе ультрацентрифугирования при оседании частиц
полимера появится граница растворитель – раствор, которая будет постепенно перемещаться ко дну.
Таким образом, под влиянием центробежного поля будет происходить изменение концентрации раствора.
С помощью оптического контрольно – отчетного устройства фиксируется изменение показателя
преломления во времени.
Скорость движения частицы отнесенная к ускорению центробежного поля, называется константой
седиментации S. Величина ее зависит от молекулярного веса, концентрации полимера и типа
растворителя. Значение S, экстраполированное к бесконечному разбавлению, Sо называется константой
седиментации при бесконечном разбавлении.
Молекулярная масса по данным седиментации может быть рассчитана по формуле:
Ms = S0RT/D0(1-Vp0) , где V – парциальный объем полимера; ρₒ - плотность растворителя.
Из этой зависимости видно, что для данной системы полимер – растворитель необходимо независимое
определение коэффициента диффузии Dₒ.
Константа седиментации связана с молекулярной массой соотношением: S0 = KsMs-b Ks = 1,6[η]
Полимер
Растворитель
t, ˚C
Ks ·10²
b
Полистирол
Полиакрилонитрил
Поливиниловый спирт
Циклогексан
Метилэтилкетон
Этилацетат
Бензол
Диметилформамид
Вода
35
20
20
20
25
20
1,69
5,89
3,05
6,76
2,50
13,8
0,520
0,560
0,520
0,530
0,620
0,600
Поливинилацетат
Этилцеллюлоза
Метилэтилкетон
Этилацетат
25
20
10,50
4,60
0,625
0,630
Полиметилметaкрилат
25.
МЕТОД СВЕТОРАССЕЯНИЯПринцип этого метода определения молекулярной массы состоит в
измерении
углового
распределения
рассеянного
раствором
монохроматического света. Рассеяние света растворами полимеров
обусловлено флуктуациями плотности вследствие теплового движения
частиц. Флуктуации плотности раствора приводят к оптической
неоднородности среды. Степень рассеяния монохроматического света
раствором (мутность) связана с осмотическим давлением реального
раствора уравнением Дебая. На практике при определении мутности
вычисляют величину числа Рэлея.
Для изучения светорассеяния растворов полимеров применяют
нефелометры различного типа. Существуют два основных метода
интерпретации результатов измерений для растворов больших частиц:
метод асимметрии и метод двойной экстраполяции.













 Химия
Химия








