Похожие презентации:
Основы теплотехники и термодинамики. Лекция № 1
1.
1ЛЕКЦИЯ № 1
по теме № 2
«ОСНОВЫ ТЕПЛОТЕХНИКИ И
ТЕРМОДИНАМИКИ»
2.
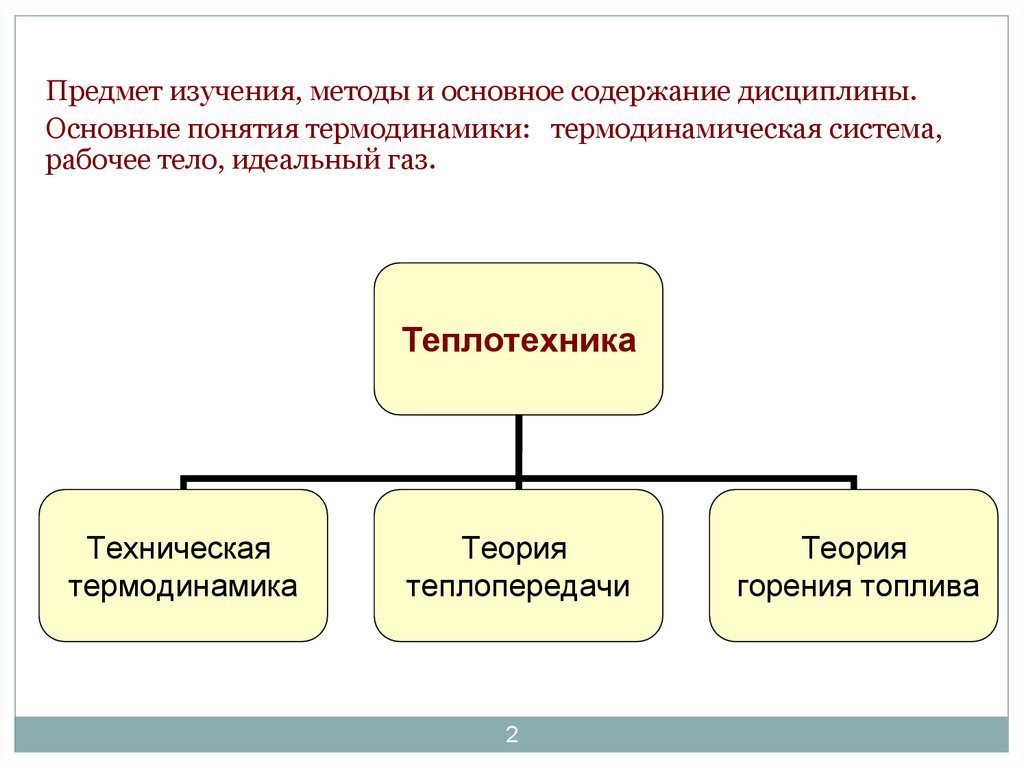
Предмет изучения, методы и основное содержание дисциплины.Основные понятия термодинамики: термодинамическая система,
рабочее тело, идеальный газ.
Теплотехника
Техническая
термодинамика
Теория
теплопередачи
2
Теория
горения топлива
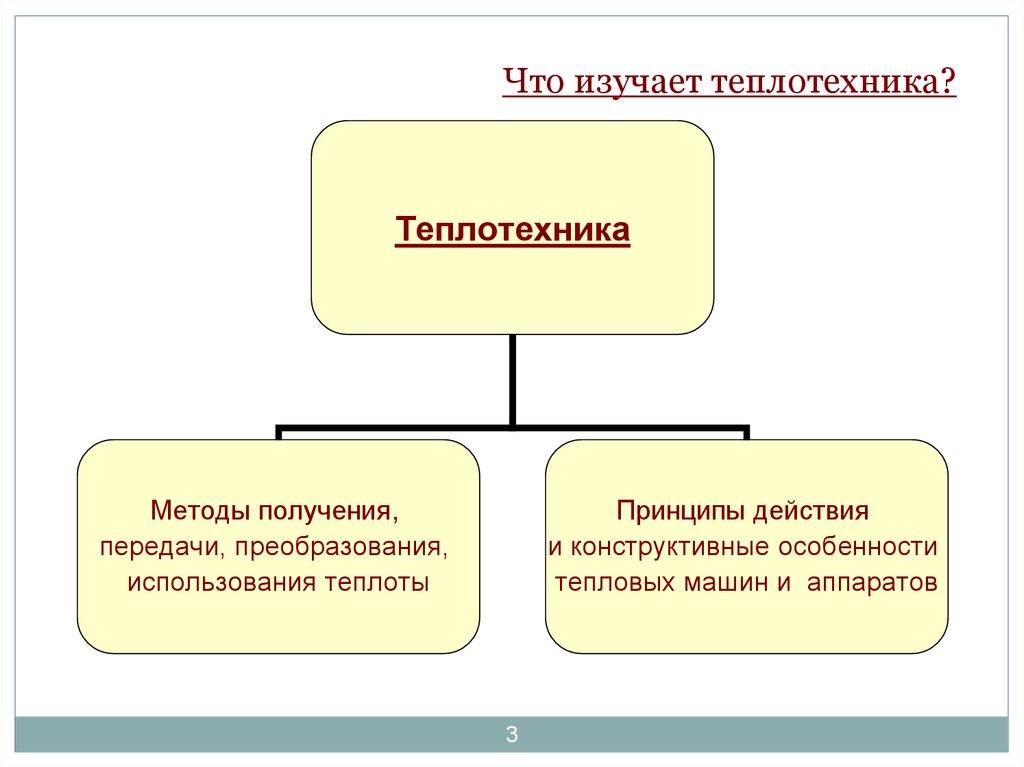
3. Что изучает теплотехника?
ТеплотехникаМетоды получения,
передачи, преобразования,
использования теплоты
Принципы действия
и конструктивные особенности
тепловых машин и аппаратов
3
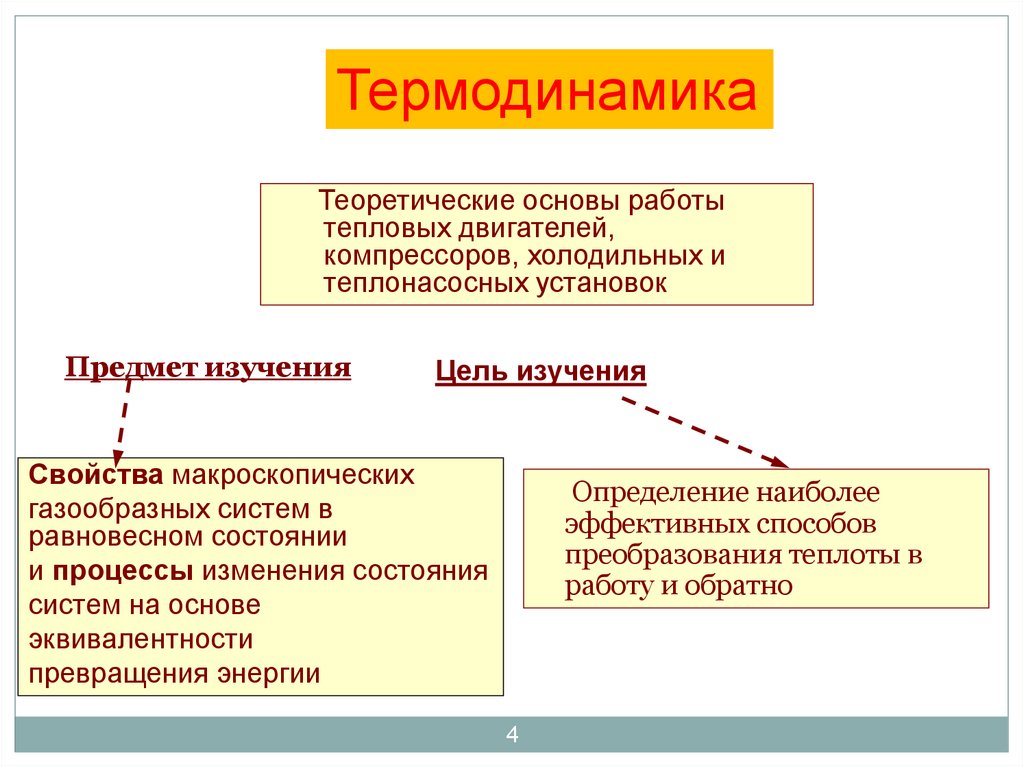
4. Предмет изучения
ТермодинамикаТеоретические основы работы
тепловых двигателей,
компрессоров, холодильных и
теплонасосных установок
Предмет изучения
Цель изучения
Свойства макроскопических
газообразных систем в
равновесном состоянии
и процессы изменения состояния
систем на основе
эквивалентности
превращения энергии
Определение наиболее
эффективных способов
преобразования теплоты в
работу и обратно
4
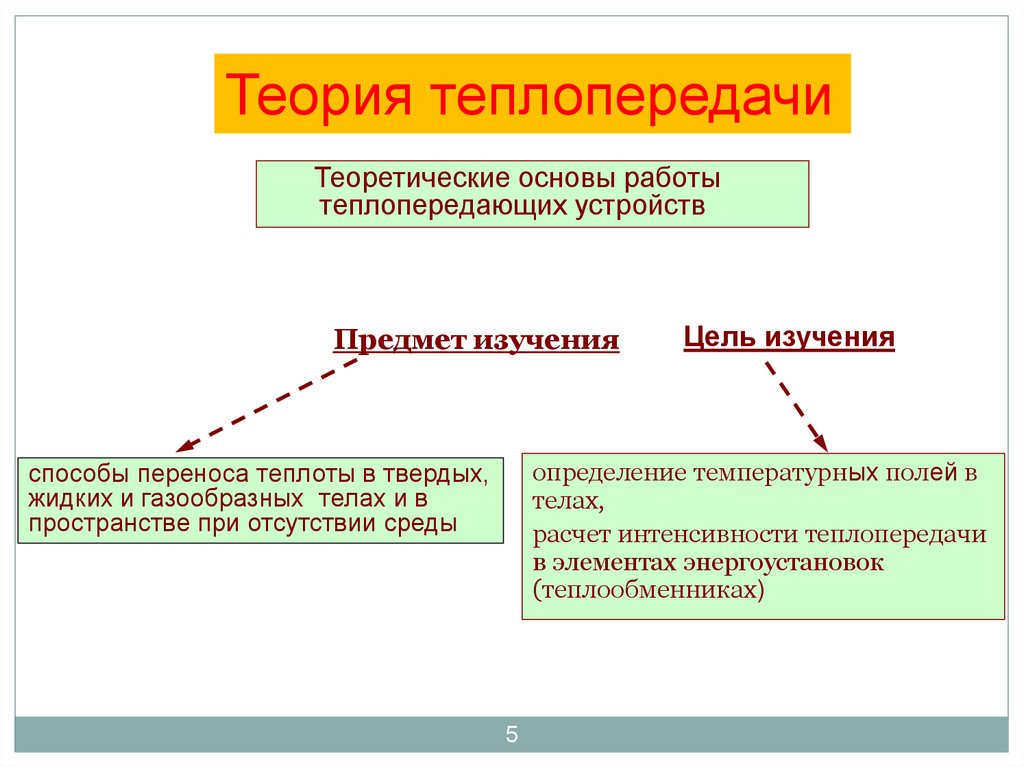
5. Предмет изучения
Теория теплопередачиТеоретические основы работы
теплопередающих устройств
Предмет изучения
Цель изучения
определение температурных полей в
телах,
расчет интенсивности теплопередачи
в элементах энергоустановок
(теплообменниках)
способы переноса теплоты в твердых,
жидких и газообразных телах и в
пространстве при отсутствии среды
5
6. «Начала» термодинамики»
Если масса системы неизменна, то«теплота (Q), полученная системой
извне, используется на изменение ее
внутренней
энергии
(ΔU)
и
совершение работы расширения (L)
над внешними силами (окружающей
средой»
Первое начало:
невозможен
процесс
возникновения
или
исчезновения энергии (общий
закон сохранения энергии)
Второе начало:
невозможен циклический процесс,
имеющий единственным своим
результатом
превращение
теплоты в работу.
В
термодинамическом
цикле
невозможно превратить всю теплоту
в работу
6
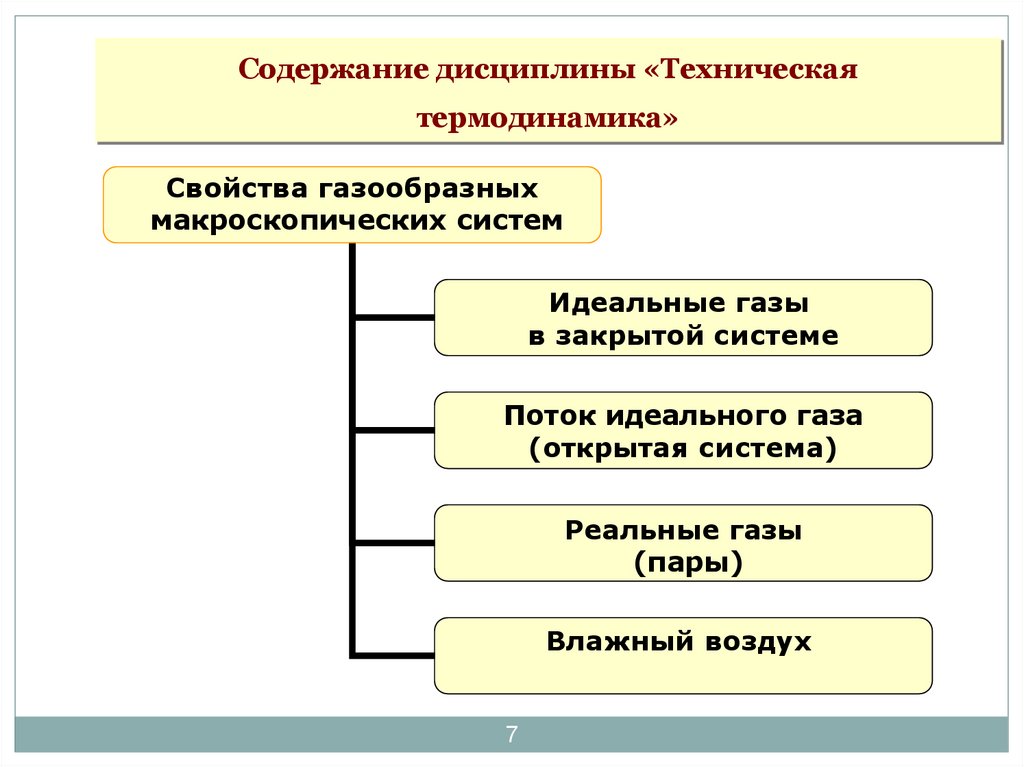
7. Содержание дисциплины «Техническая термодинамика»
Свойства газообразныхмакроскопических систем
Идеальные газы
в закрытой системе
Поток идеального газа
(открытая система)
Реальные газы
(пары)
Влажный воздух
7
8. Параметры термодинамического состояния
Абсолютное давление (p), Па.Единицы измерения: Н/м2 (Паскаль), м
p= g h
Давление:
Абсолютное,
барометрическое (атмосферное)
В=101325 Па 0,1 МПа
1 мм.рт.ст. = 133,3 Па
манометрическое
(p=B+Pман ),
вакууметрическое (p=B-Pвак )
8
9. Параметры термодинамического состояния
Абсолютная температура, TЕдиницы измерения:
К,( Кельвин); 1 К = 1 оС
Удельный объем ( ),
Единицы измерения:
м3/кг
Абсолютная температура:
Удельный объем:
характеризует степень
нагретости тел, является
среднестатистическим
результатом хаотичного
движения свободных частиц.
характеризует плотность
рабочего тела =1/ .
представляет собой меру
средней
кинетической
энергии молекул
9
10. Уравнение состояния идеального газа
Если термодинамические параметры одинаковы во всехточках и при этом неизменны во времени, то такое состояние
называется равновесным
для 1 моля (кмоля):
где R - универсальная
газовая постоянная
p R T
- работа, совершаемая 1 молем
идеального газа при изменении
температуры на 1К в изобарном
процессе
является постоянным числом для любого идеального газа,
имеет единицы измерения Дж/(кмоль К)
и число:
8314 Дж/(кмоль К).
10
11. Уравнение состояния идеального газа
p R Tдля 1 кг:
где R - индивидуальная
газовая постоянная
- работа единицы массы (1 кг)
идеального газа в изобарном
процессе при изменении температуры
на 1 К.
Является постоянным числом только для конкретного газа,
имеет единицы измерения Дж/(кг К)
11
12. Термодинамические процессы и циклы
Термодинамический процесс:всякое изменение хотя бы одного из
параметров состояния.
Прямые и обратные процессы:
Принято считать:
Если в процессе имеет место
увеличение объема (расширение), то
это процесс прямой;
Если объем уменьшается (сжатие), то
это процесс обратный
12
Термодинамический цикл:
совокупность термодинамических
процессов, в которых рабочее
тело, пройдя ряд состояний,
возвращается в исходное
состояние.
Прямые и обратные циклы
Если направление процессов по
часовой стрелке, то цикл
прямой;
Если направление процессов
против часовой стрелки , цикл
обратный.
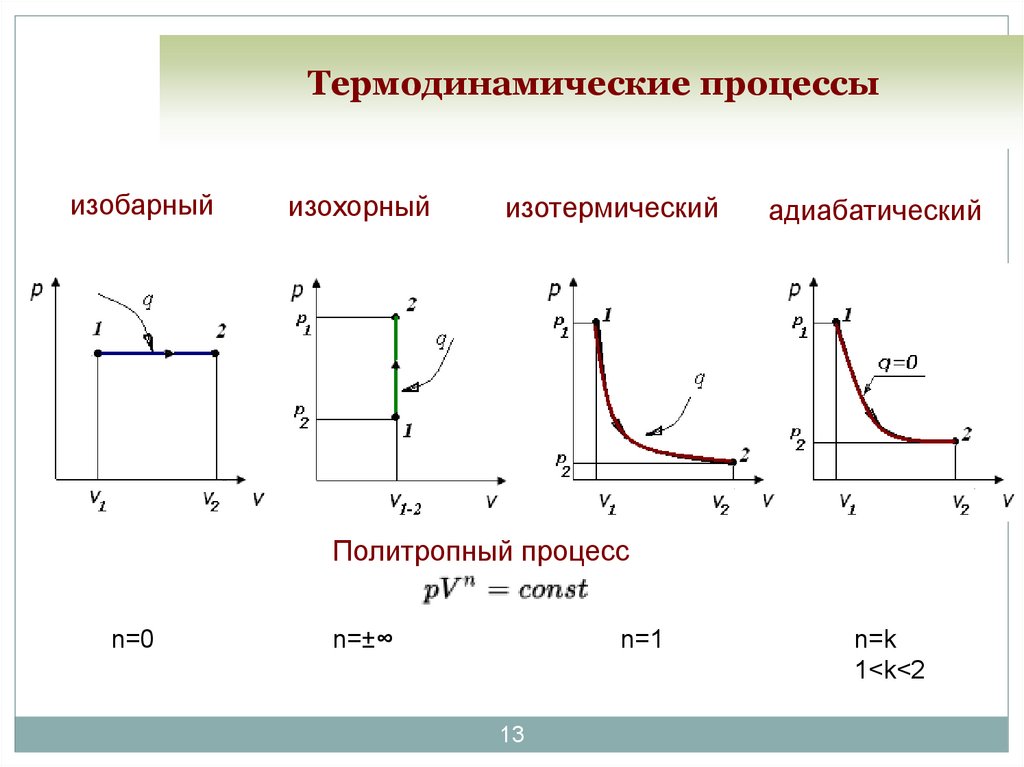
13. Термодинамические процессы
изобарныйизохорный
изотермический
адиабатический
Политропный процесс
n=0
n=±∞
n=1
13
n=k
1<k<2
14. Термодинамические процессы
ПроцессИзобарный,
p const
Изохорный
const
Изотермический
T const; 0
Адиабатический
q 0
Взаимосвязь параметров
Выражение
первого начала
термодинамики
T2 2
T1 1
q U l
T2 p2
T1
p1
q U
p2 1
p1 2
q l
p2 1
p1 2
14
k
U l
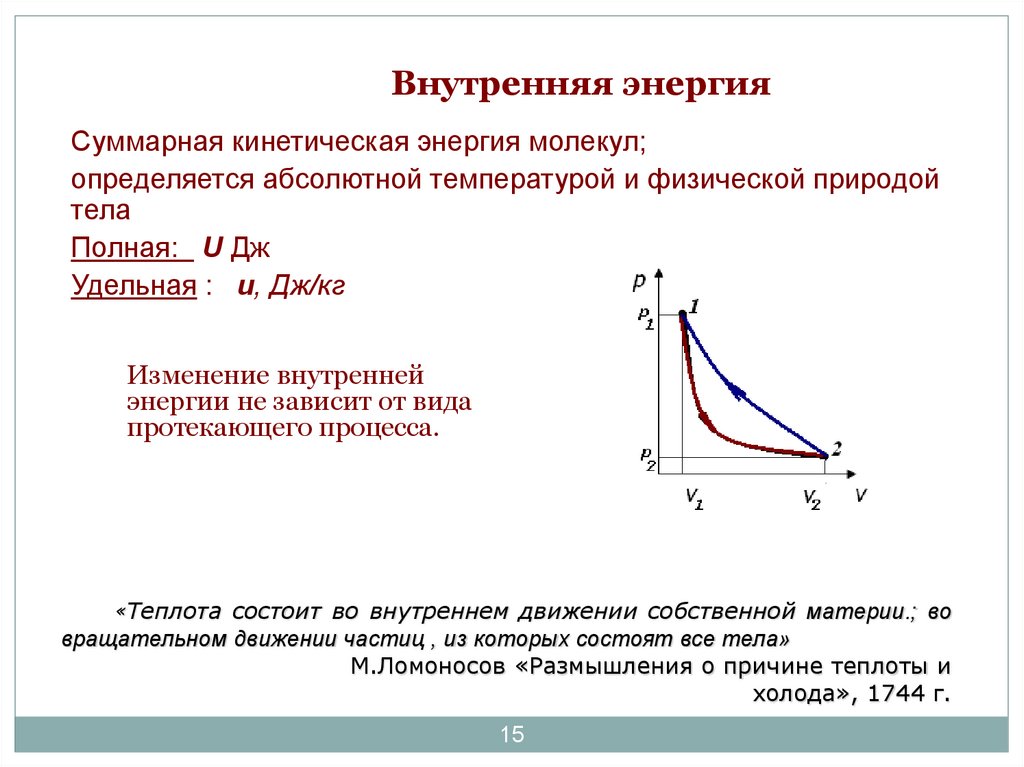
15. Внутренняя энергия
Суммарная кинетическая энергия молекул;определяется абсолютной температурой и физической природой
тела
Полная: U Дж
Удельная : u, Дж/кг
Изменение внутренней
энергии не зависит от вида
протекающего процесса.
«Теплота состоит во внутреннем движении собственной материи.; во
вращательном движении частиц , из которых состоят все тела»
М.Ломоносов «Размышления о причине теплоты и
холода», 1744 г.
15
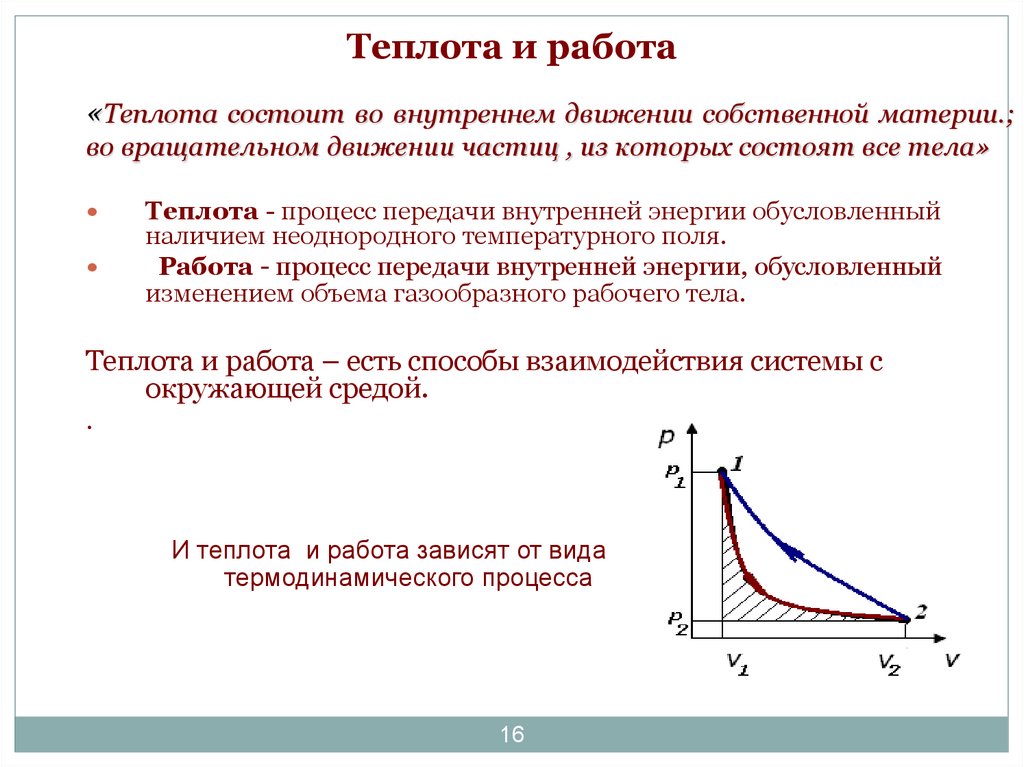
16. Теплота и работа
«Теплота состоит во внутреннем движении собственной материи.;во вращательном движении частиц , из которых состоят все тела»
Теплота - процесс передачи внутренней энергии обусловленный
наличием неоднородного температурного поля.
Работа - процесс передачи внутренней энергии, обусловленный
изменением объема газообразного рабочего тела.
Теплота и работа – есть способы взаимодействия системы с
окружающей средой.
.
И теплота и работа зависят от вида
термодинамического процесса
16
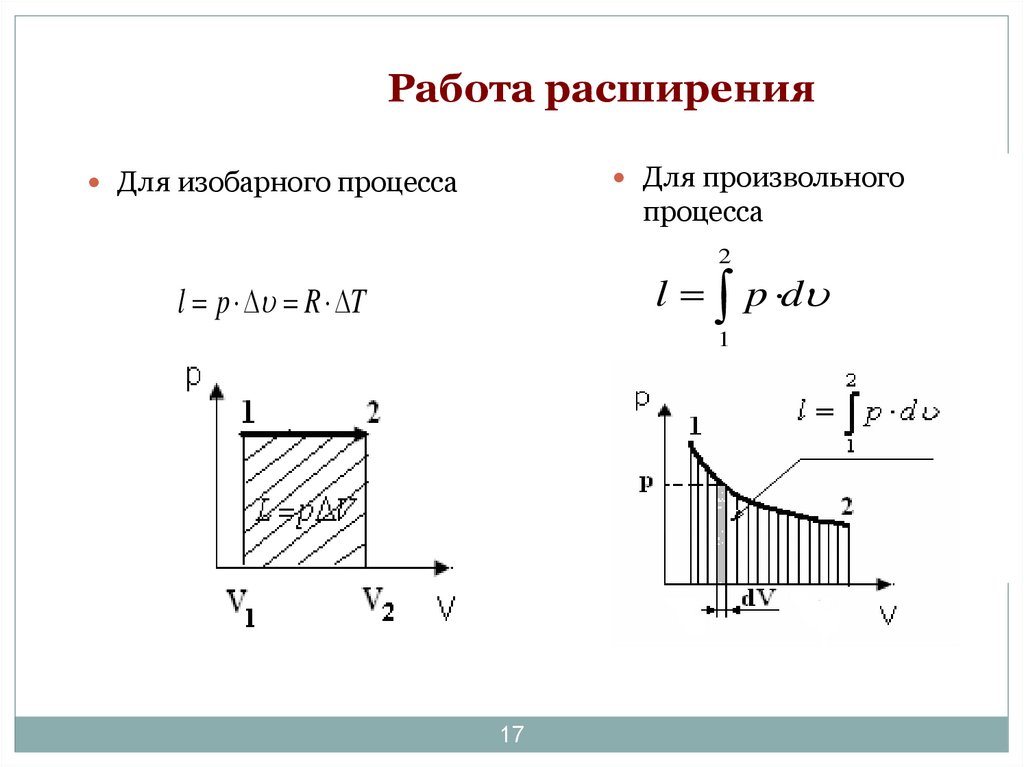
17. Работа расширения
Для произвольногоДля изобарного процесса
процесса
2
l p d
l p R T
1
17
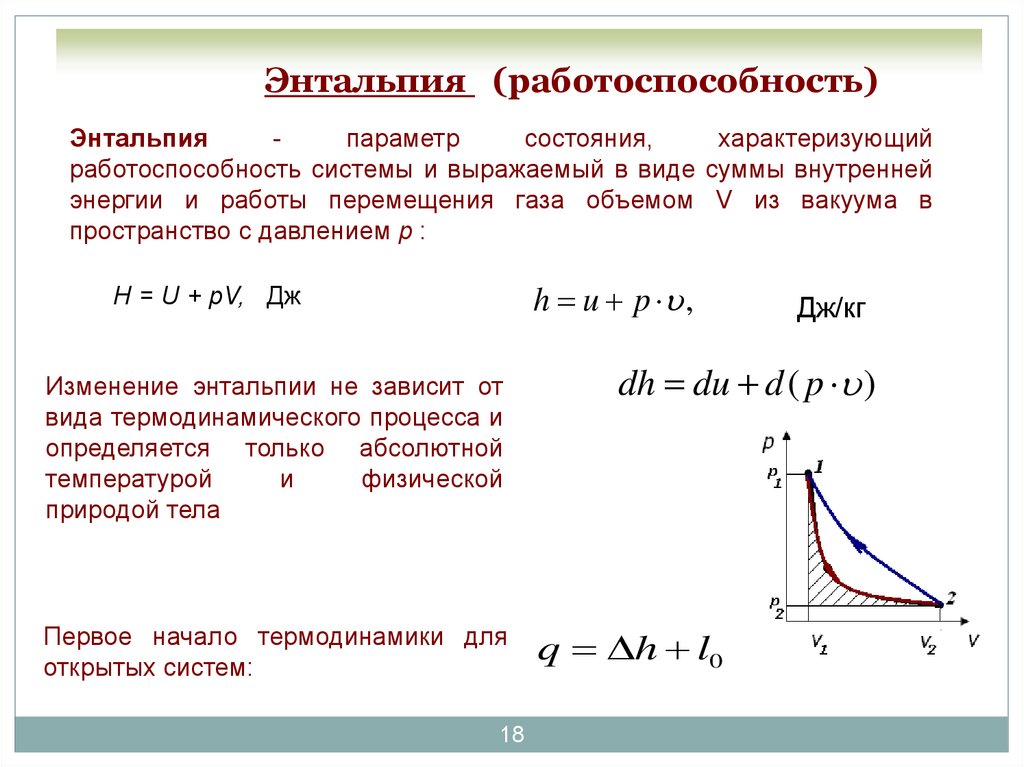
18. Энтальпия (работоспособность)
Энтальпияпараметр
состояния,
характеризующий
работоспособность системы и выражаемый в виде суммы внутренней
энергии и работы перемещения газа объемом V из вакуума в
пространство с давлением р :
h u p ,
H = U + pV, Дж
Изменение энтальпии не зависит от
вида термодинамического процесса и
определяется только абсолютной
температурой
и
физической
природой тела
Первое начало термодинамики для
открытых систем:
18
Дж/кг
dh du d ( p )
q h l0
19. Работа
Работа расширения, используется для неизменноймассы системы (в закрытых термодинамических
системах) и определяется в общем случае как
2
l ðàñø p d
1
Работа вытеснения
(перемещения), используется при
перемещении массы (газовых
потоков )из области с давлением р1
в область с давлением р2 :
lвытес p2 2 p1 1
или
dlвытес d ( p )
Работа располагаемая,
определяется как разность работы
расширения и работы вытеснения:
dl0 dl расш dlвытес
.
2
l0 dp
1
19
;
или
20. Энтропия
Энтропия – есть мера неупорядоченности системы:Важно изменение энтропии, а не её абсолютное значение
Энтропия – параметр состояния,
дифференциал которого равен
элементарному количеству теплоты,
отнесенному к абсолютной температуре.
20
dq
dS
T
!
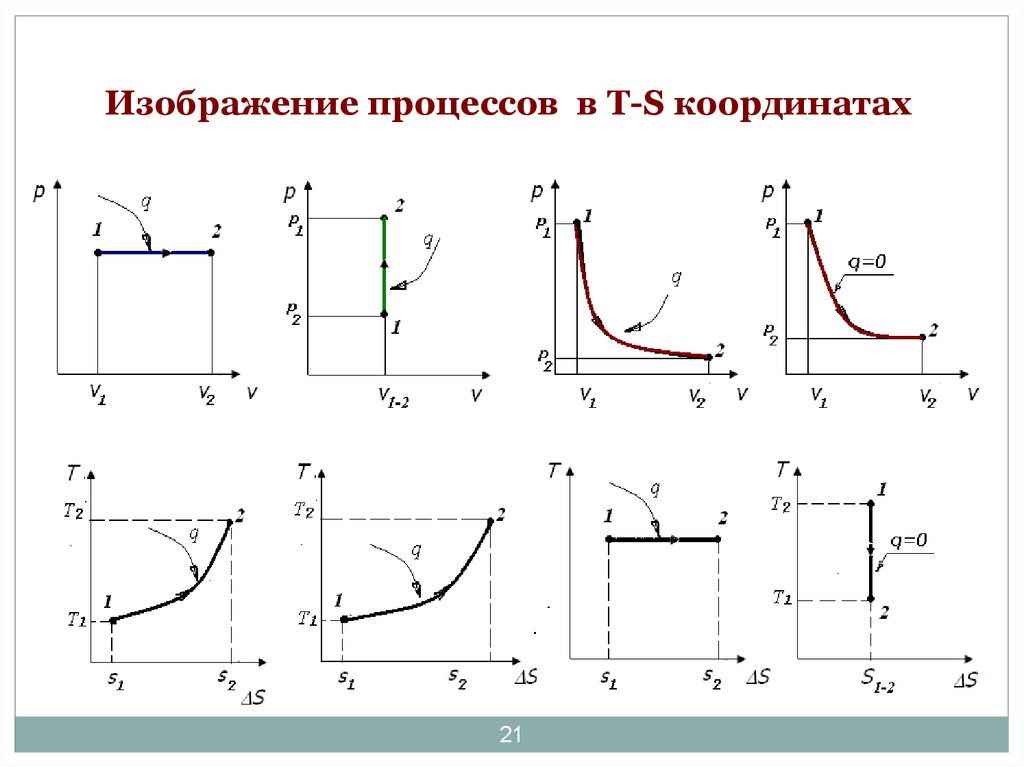
21. Изображение процессов в Т-S координатах
изобарныйизохорный
изотермический
21
адиабатический
22. Теплоемкость идеальных газов
Очевидно:При подводе теплоты к рабочему телу
увеличивается
внутренней энергии и изменяются параметры состояния
(температура).
Одинаковое количество теплоты, подведенное к телам разной
природы, вызывает неодинаковое изменение температуры.
Количество теплоты необходимое для одинакового изменения
температуры разных тел зависит от физической природы тела
и количества вещества. Чем больше вещества в системе, тем
больше требуется теплоты.
22
23. Теплоёмкость
свойстворабочего
тела,
характеризующее
количество
теплоты,
получаемое
или
отдаваемое телом, отнесенное к
изменению температуры при
бесконечно малом изменении
его
термодинамического
состояния.
-
23
24.
Виды удельной теплоемкостиТеплоемкость
массовая
объёмная
24
мольная
25. Виды удельной теплоемкости
массоваяC
c
m
Дж
кг К
объёмная
C
c'
V
Дж
м3 К
мольная
(z – количество молей)
C Дж
c ,
z кмоль К
Взаимосвязь между массовой и мольной:
C
c
c'
c
m
V
25
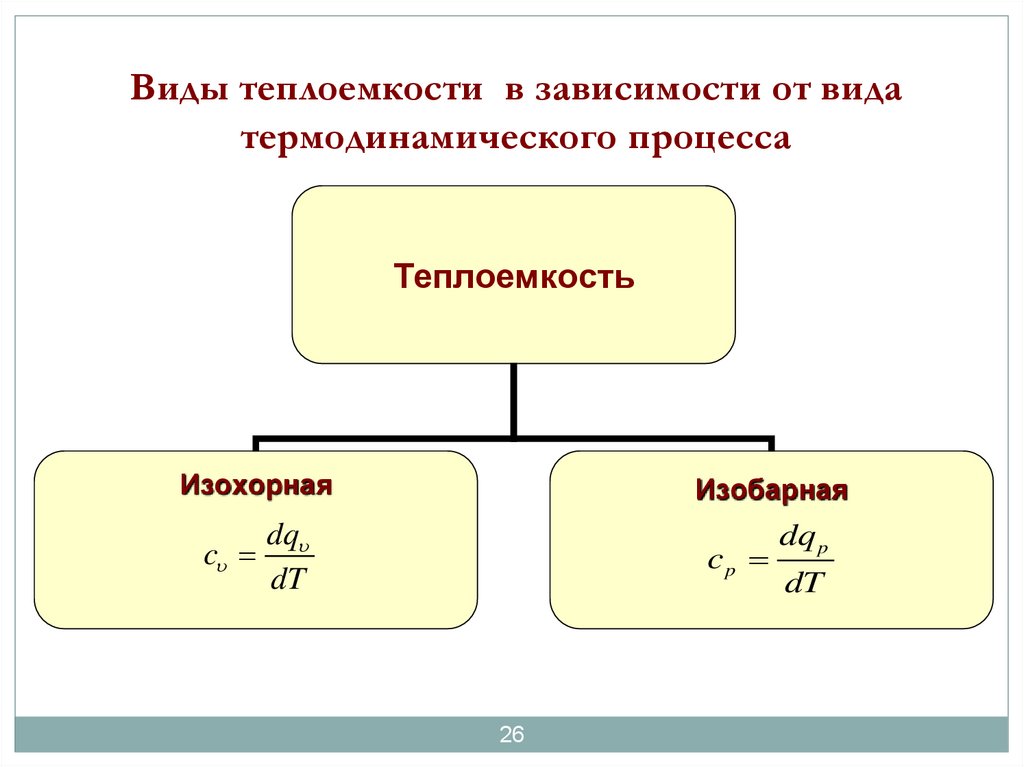
26.
Виды теплоемкости в зависимости от видатермодинамического процесса
Теплоемкость
Изохорная
Изобарная
dq
c
dT
cp
26
dq p
dT
27. Важные соотношения
cPk
c
Уравнения Майера
Для 1 кг:
с p c R
Для 1 моля:
с p c R
k- показатель адиабаты
k =5/3 = 1,67 - 1- атомный газ;
k = 7/5 = 1,4 - 2-х атомный;
k= 9/5 = 1,29 - 3-х и более атомный
R
c
k 1
газ.
cP
27
k R
k 1
28. Смеси идеальных газов (газовые смеси)
Состав смеси обычно задаетсяVi
ri
Vсм
mi
gi
mсм
объемными,
массовыми
мольными долями.
28
i
zi
см
29. Термодинамические параметры смеси, заданной объемными долями
Плотностьn
см (ri i )
i 1
Молярная кажущаяся
масса
n
см (ri i )
i 1
Газовая постоянная
Парциальные давления
Rсм
29
1
n
ri
R
i 1
i
pi ri pсм
30. Термодинамические параметры смеси, заданной массовыми долями
см1
n
gi
i 1 i
см
1
n
gi
i 1 i
Плотность
Молярная кажущаяся масса
Газовая постоянная
n
Rсм ( g i Ri )
i 1
Парциальные давления
Ri
pi gi
pсм
R см
30
31. Политропные процессы в идеальных газах
Уравнение политропногопроцесса
d
dp
n
p
Соотношения между
параметрами состояния
n
2
p1
p2
1
p n const
Показатель политропы
n
2
1
c cp
c c
Теплоемкость процесса
p2
p
1
n k
c c
n 1
31
n 1
n 1
n
T1
T2
T2
T1
32. Энергетические параметры состояния для неизотермического политропного процесса
Изменение внутреннейэнергии
Изменение энтропии
T2
s c ln
T1
u c T
Изменение энтальпии
n k
T2
S c
ln
n 1
T1
h c p T
32
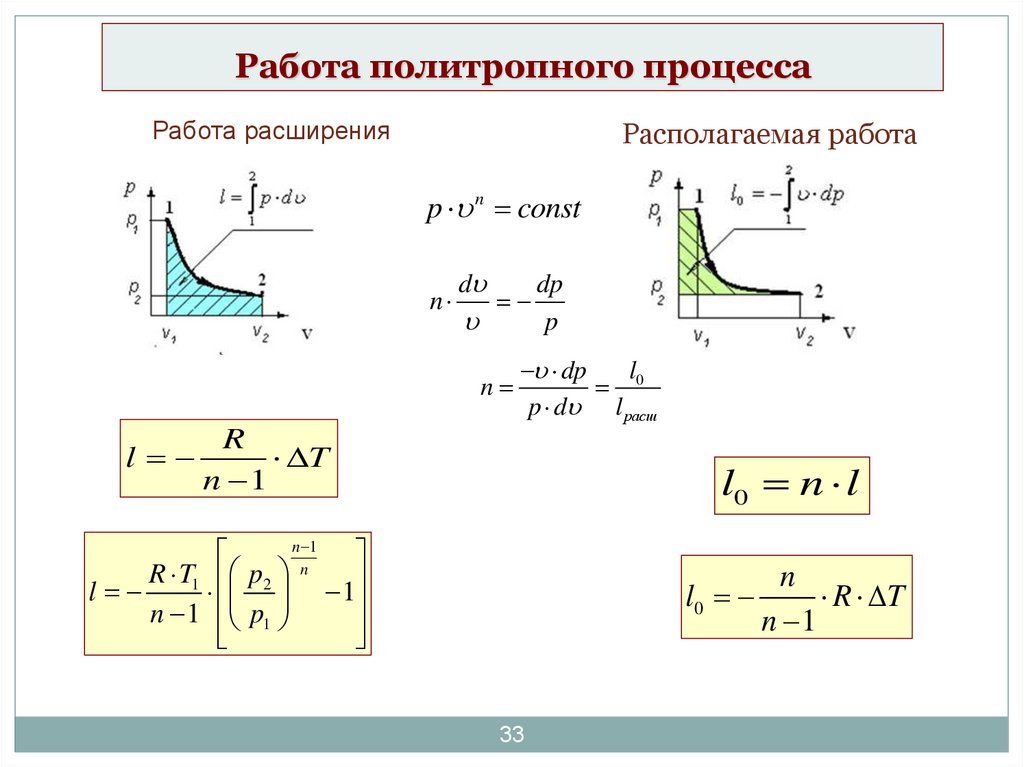
33. Работа политропного процесса
Работа расширенияРасполагаемая работа
p n const
n
d
n
dp
p
l
dp
0
p d l расш
R
l
T
n 1
l0 n l
n 1
n
R T1 p2
l
1
n 1 p1
n
l0
R T
n 1
33
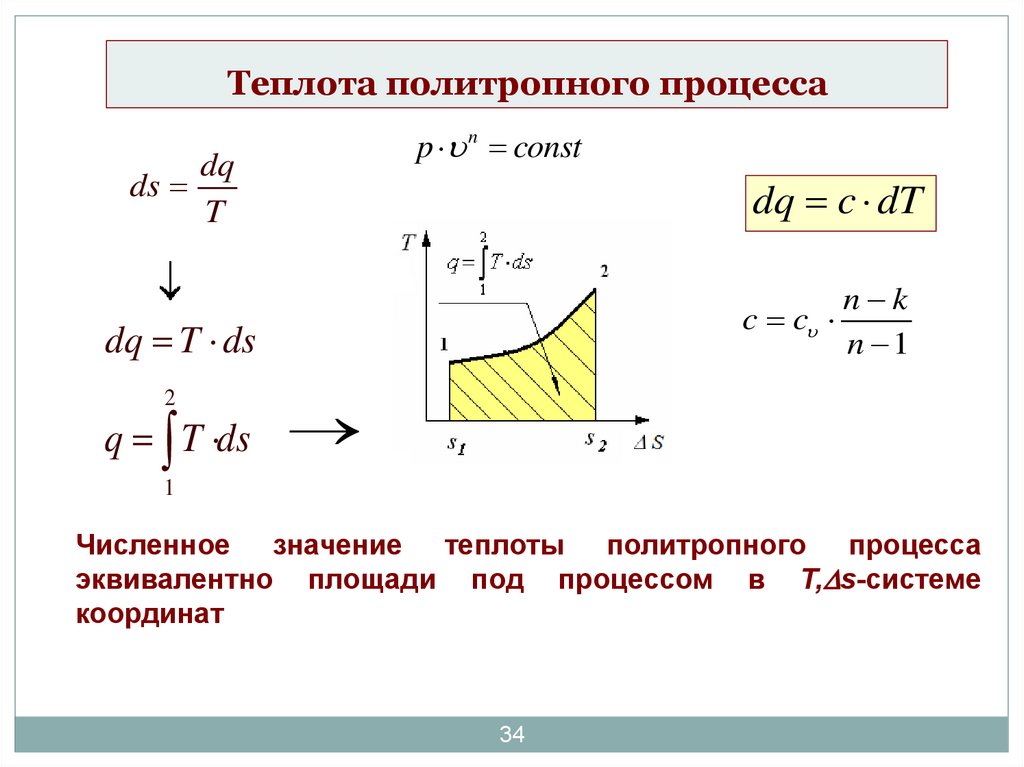
34. Теплота политропного процесса
dsp n const
dq
T
dq c dT
c c
dq T ds
2
q T ds
n k
n 1
1
Численное значение теплоты политропного процесса
эквивалентно площади под процессом в T, s-системе
координат
34
35. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1.Теплотехника: Учебник для втузов. Под общ. ред. А.М.Архарова, В.Н., Афанасьева.– М., Изд-во. ГТУ им Н.Э.
Баумана, 2004. – 712с.
2.Рабинович О.М. Сборник задач по технической
термодинамике.- М.: машиностроение, 1969.- 344 с.
3.Теплотехника. // Под ред. В.Н. Луканина - М.: Высшая школа, 2000.671с.
4.Нащокин В.В. Техническая термодинамика и теплопередача. -М.:
Высшая школа, 1980.- 469 с.
5.Теплотехника // Под ред. А.П.Баскакова, М.: Энергоатомиздат, 1991.224с.
35




















 Физика
Физика








