Похожие презентации:
Строение атома. Лекция 1
1.
Донской государственныйтехнический
университет
Кафедра «Химия»
ЛЕКЦИЯ 1
«СТРОЕНИЕ АТОМА»
2.
Донской государственныйтехнический университет
Кафедра «Химия»
1.
2.
3.
4.
5.
Экспериментальные доказательства
сложной структуры атома
Доквантовые модели атома
Корпускулярно-волновой дуализм
Квантовые числа
Принципы построения и способы
изображения электронных структур
3.
Донской государственныйтехнический университет
Кафедра «Химия»
Химический элемент-вид атомов,
характеризующийся определенной
величиной положительного заряда ядра
Атом - наименьшая частица
элемента,обладающая его химическими
свойствами
Изотопы-атомы, обладающие одинаковым
зарядом ядра, но разным числом нейтронов
4.
Донской государственныйтехнический университет
Кафедра «Химия»
Ядро атома состоит из протонов и
нейтронов
Число протонов в ядре равно
атомному номеру элемента и числу
электронов в атоме
Атом - электронейтрален
5.
Донской государственныйтехнический университет
Кафедра «Химия»
ИЗОТОПЫ ХЛОРА
6.
Донской государственный техническийуниверситет
Кафедра «Химия»
Экспериментальные основы
Спектральный анализ, спектры
(Г. Кирхгоф, 1859; Дж.Бальмер, 1885, И.Ридберг
Периодический закон
(Д.Менделеев 1869)
Фотоэффект
(А. Столетов, 1888)
Катодные лучи
(Ж. Перрен, 1895)
Рентгеновские лучи (В.Рентген 1895)
Радиоактивность
(А. Беккерель, 1896)
Открытие электрона
(Дж. Томпсон, 1897)
7.
Донской государственный техническийуниверситет
Кафедра «Химия»
1903г. Джозеф Томсон предложил одну из
первых модель строения атома.
Атом – шар, по всему объёму
которого равномерно распределён
положительный заряд.
Внутри шара находятся электроны.
Каждый электрон может совершать
колебательные движения около
своего положения равновесия.
Положительный заряд шара равен
по модулю суммарному заряду
электронов, поэтому заряд атома в
целом равен нулю.
8.
Донской государственныйтехнический университет
Кафедра «Химия»
Модель Томсона нуждалась в экспериментальной
проверке.
Важно было проверить, действительно ли
положительный заряд распределён по всему объёму
атома с постоянной плотностью.
В 1911г. Эрнест Резерфорд совместно со своими
сотрудниками провёл ряд опытов по исследованию
состава и строения атомов.
9.
Донской государственныйтехнический университет
Кафедра «Химия»
Идея опыта Резерфорда:
Зондировать атом альфа–частицами.
Альфа-частицы возникают при распаде радия.
Масса альфа-частицы в 8000 раз больше массы
электрона.
Электрический заряд альфа-частицы в 2 раза больше
заряда электрона.
Скорость альфа-частицы около 15 000 км/с.
Альфа-частицы является ядром атома гелия.
10.
Донской государственныйтехнический университет
Кафедра «Химия»
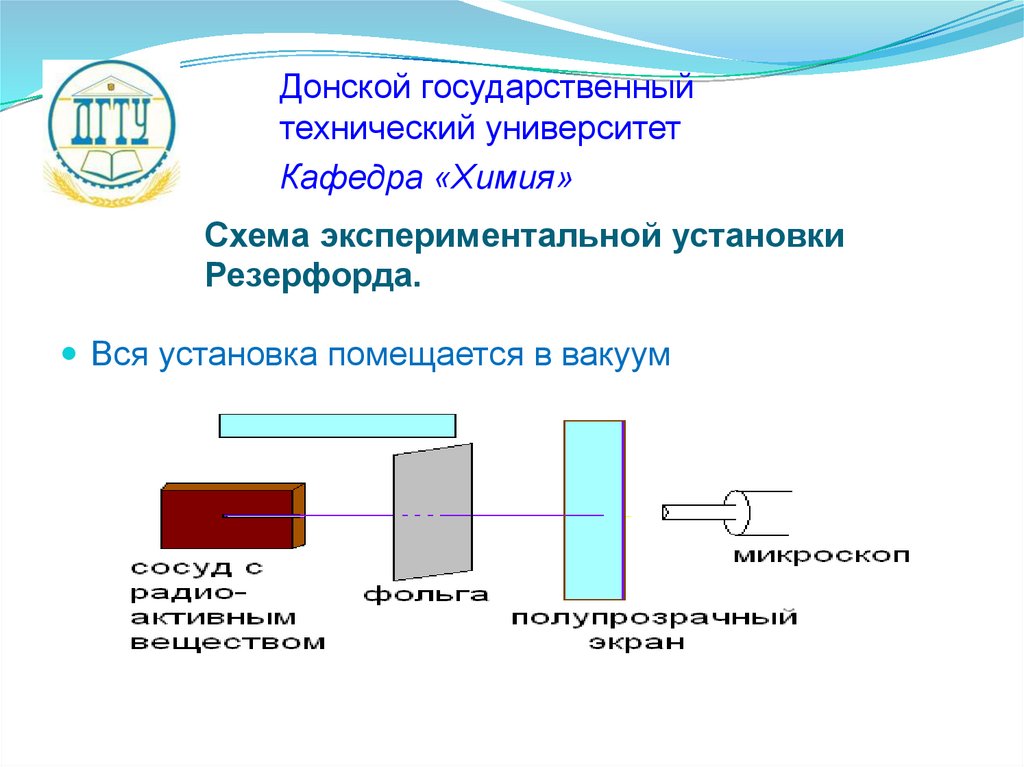
Схема экспериментальной установки
Резерфорда.
Вся установка помещается в вакуум
11.
Донской государственныйтехнический университет
Кафедра «Химия»
Противоречие модели Томсона с
экспериментом:
Так как масса электронов мала, они не могут заметно
изменить траекторию движения альфа-частиц.
Заметное рассеивание альфа-частиц может вызвать
только положительная часть атома и лишь в том
случае, если она сконцентрирована в очень малом
объёме.
12.
Донской государственныйтехнический университет
Кафедра «Химия»
Выводы из опыта по рассеиванию альфачастиц Резерфорда:
Существует атомное ядро,
т.е. тело малых размеров, в котором
сконцентрирована почти вся масса
атома и весь положительный заряд.
В ядре сконцентрирована почти вся
масса атома.
Вокруг ядра по замкнутым орбитам
вращаются отрицательные частицыэлектроны.
отрицательный заряд всех электронов
распределён по всему объёму атома.
13.
Донской государственный техническийуниверситет
Кафедра «Химия»
Принцип квантования
(М. Планк, 1900)
атомы излучают энергию порциями, кратными
некоторой минимальной величине - кванту,
фотону - h
h = 6,626•10-34(Дж•c)–пост. Планка
Е = h
=c
14.
Донской государственный техническийуниверситет
Кафедра «Химия»
Постулаты Бора
Первый постулат Бора: атомная система
может находится только в особых
стационарных, или квантовых, состояниях,
каждому из которых соответствует
определенная энергия En. В стационарном
состоянии атом не излучает.
Постулат находится в противоречии с классической механикой (Энергия
движущихся электронов может быть любой), с электродинамикой
Максвелла, т.к. допускает возможность ускоренного движения без
излучения электромагнитных волн.
15.
Донской государственный техническийуниверситет
Кафедра «Химия»
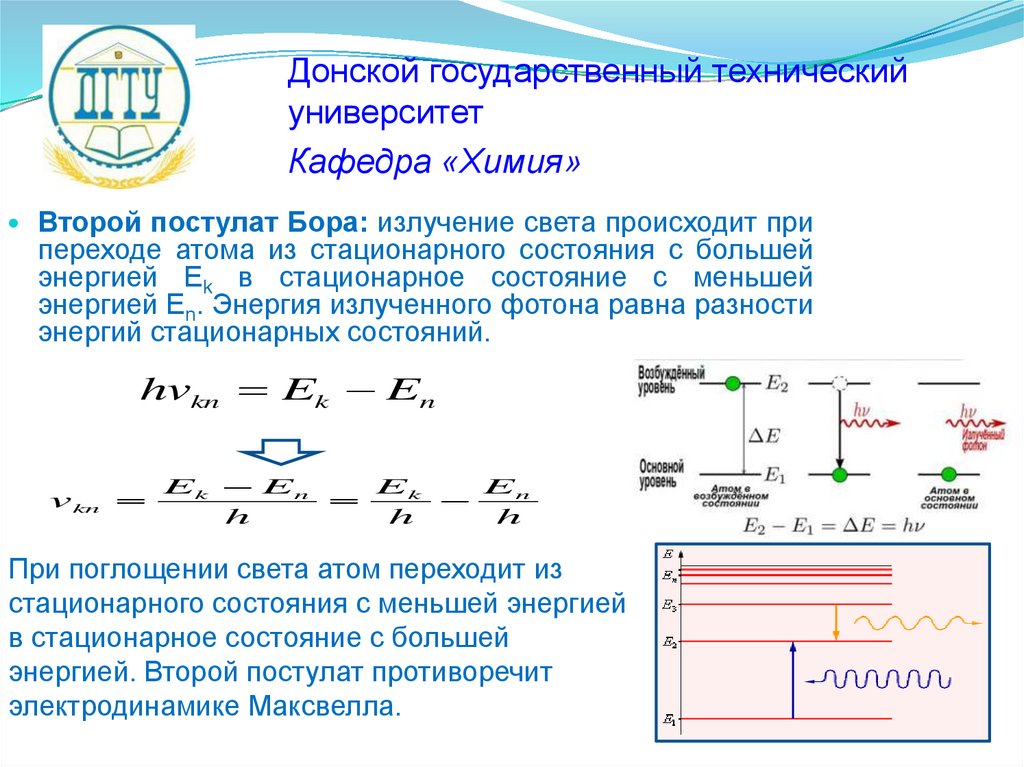
Второй постулат Бора: излучение света происходит при
переходе атома из стационарного состояния с большей
энергией Ek в стационарное состояние с меньшей
энергией En. Энергия излученного фотона равна разности
энергий стационарных состояний.
hvkn Ek En
vkn
Ek En
Ek
En
h
h
h
При поглощении света атом переходит из
стационарного состояния с меньшей энергией
в стационарное состояние с большей
энергией. Второй постулат противоречит
электродинамике Максвелла.
16.
Донской государственный техническийуниверситет
Кафедра «Химия»
Модель атома водорода по Бору
Бор рассматривал простейшие круговые орбиты.
- потенциальная энергия взаимодействия электрона с ядром в
e2
абсолютной системе единиц. e – модуль заряда электрона, r –
Wp
расстояние от электрона до ядра.
r
Произвольная постоянная, с точностью до которой определяется
потенциальная энергия, принята равной нулю.
Wp<0, так как взаимодействующие частицы имеют заряды противоположных
знаков.
E=Eкин+Wp – полная энергия атома.
2
2
mv e
E
2
r
2
v
aц.с.
r
- центростремительное ускорение по
второму закону Ньютона сообщает
электрону на орбите кулоновская сила.
17.
Донской государственный техническийуниверситет
Кафедра «Химия»
Правило квантования
Из первого постулата Бора энергия может принимать только определенное
значение En.
Электрон движется по круговой орбите, то
mv модуль импульса e
не меняются
r радиус орбиты
mar – момент импульса в механике
Дж с - Постоянная Планка.
Бор mvr
кг м
м Дж с
с
Бор предположил, что произведение модуля импульса на радиус орбиты кратно
постоянной Планка.
mvr n , где n 1, 2, 3,... правило квантования
18.
Донской государственный техническийуниверситет
Кафедра «Химия»
Принцип неопределенности
(В. Гейзенберг, 1925)
Движение электрона в атоме не может быть описано
определённой траекторией
Положение и скорость движения электрона в атоме
можно найти лишь с определенной долей точности
h
X ( m x )
2
19.
Донской государственный техническийуниверситет
Кафедра «Химия»
Уравнение Шредингера
h
2 ( 2 2 2 ) U E
8 m x
y
z
2
2
2
2
НΨ = Е·Ψ
Энергия электрона в атоме водорода может быть
представлена как функция неких чисел n,m,l,
называемых квантовыми числами
20.
Донской государственныйтехнический университет
Кафедра «Химия»
Главное квантовое число(n)
n - 1, 2, 3,… , определяет энергию электрона в
атоме
Энергетический уровень - состояние
электронов в атоме с тем или иным значением n
Основное состояние атома - min энергия
электронов
Возбужденное состояние – более высокие
значения энергии электронов
21.
Донской государственный техническийуниверситет
Кафедра «Химия»
Орбитальное квантовое число (l)
характеризует форму электронного облака l
= 0, 1, 2, 3….n-1
Подуровень: s, p, d, f
Т.е. энергетический уровень (n) содержит
совокупность энергетических подуровней,
отличающихся
по
энергиям
(в
многоэлектронном атоме)
22.
Донской государственный техническийуниверситет
Кафедра «Химия»
Maксимальная емкость подуровня:
2(2l+1)e
Максимальная емкость уровня:
2n2е
23.
Донской государственный техническийуниверситет
Кафедра «Химия»
Типы и формы атомных орбиталей
S
Px,Py,Pz
dxz,dxy,dz2
dx2-y2,dyz
24.
Донской государственный техническийуниверситет
Кафедра «Химия»
Магнитное
квантовое
число
(ml)
характеризует ориентацию электронных
облаков в пространстве ml меняется от
–l до +l, а всего = 2l + 1 значений
Например:
l = 0 (s); ml = 0
l = 1 (p); ml = 0, +1, -1
25.
Донской государственный техническийуниверситет
Кафедра «Химия»
Спиновое квантовое число (ms)
характеризует собственный магнитный
момент электрона, который или
совпадает с ориентацией орбитального
момента, или направлен в
противоположную сторону.
ms имеет значения: +1/2 или -1/2
26.
Донской государственный техническийуниверситет
Кафедра «Химия»
Атомная орбиталь (АО)
это состояние электрона в атоме, которое
описывается волновой функцией с
набором из трех квантовых чисел n, l, ml
Условное изображение АО
АО обозначают с помощью кв. чисел
Например:
1s (n = 1, l = 0, ml = 0)
2p (n = 2, l = 1, ml = -1, 0, +1)
27.
Донской государственный техническиуниверситет
Кафедра «Химия»
Закономерности формирования
электронных структур
Принцип наименьшей энергии:
электрон размещается на АО
c
min энергией
Принцип Паули: в атоме не может
быть двух электронов с одинаковым
набором 4-х кв.чисел
Правила Гунда: (1) на одном
подуровне сумма спинов электронов
максимальна, (2) сумма магнитных квх чисел максимальна.
28.
Донской государственный техническиуниверситет
Кафедра «Химия»
Правила Клечковского
Ниже по энергии находится та орбиталь,
для которой сумма (n + l) минимальна
Если сумма (n + l) для двух подуровней
одинакова , то сначала электроны
заполняют АО с меньшим n
29.
Донской государственный техническиуниверситет
Кафедра «Химия»
Последовательность заполнения АО
по правилам Клечковского
1sι
2s2pι 3s3pι 4s3d4pι
6s4f5d6pι 7s5f6d7p
5s4d5pι
30.
Донской государственный техническиуниверситет
Кафедра «Химия»
Способы изображения электронных
структур
Электронная формула
Графическая структура
Энергетическая диаграмма
31.
Донской государственный техническиуниверситет
Кафедра «Химия»
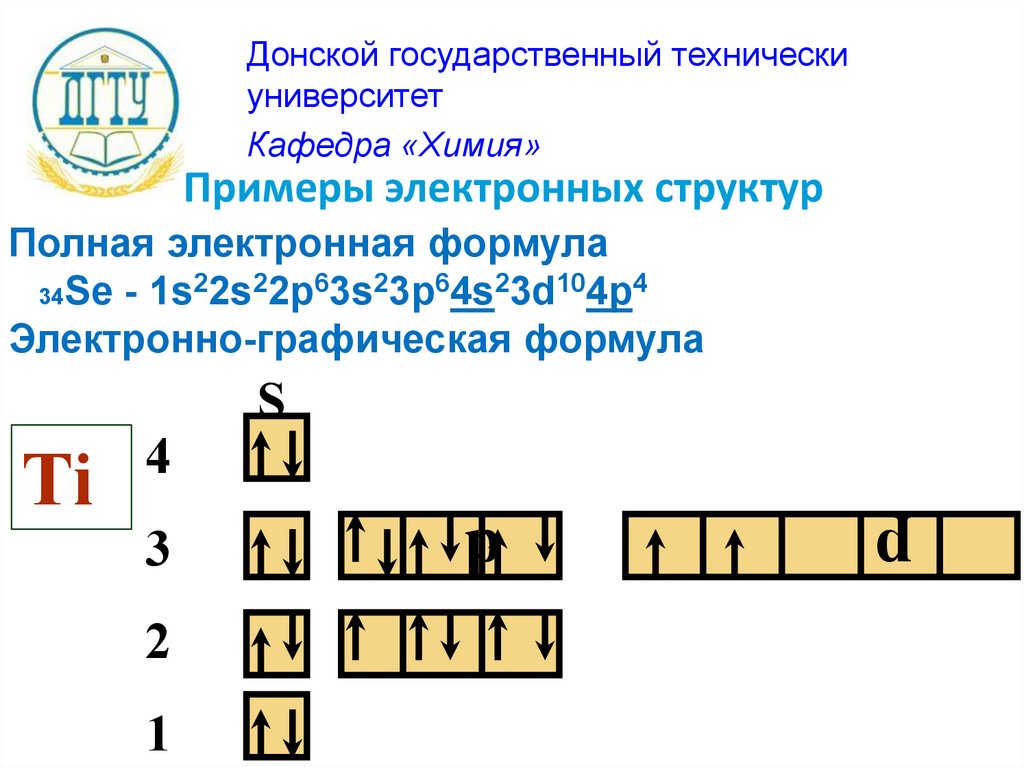
Примеры электронных структур
Полная электронная формула
2
2
6
2
6
2
10
4
34Se - 1s 2s 2p 3s 3p 4s 3d 4p
Электронно-графическая формула
2
1
d
3
p
Ti
4
S
32.
Донской государственный техническийуниверситет
Кафедра «Химия»
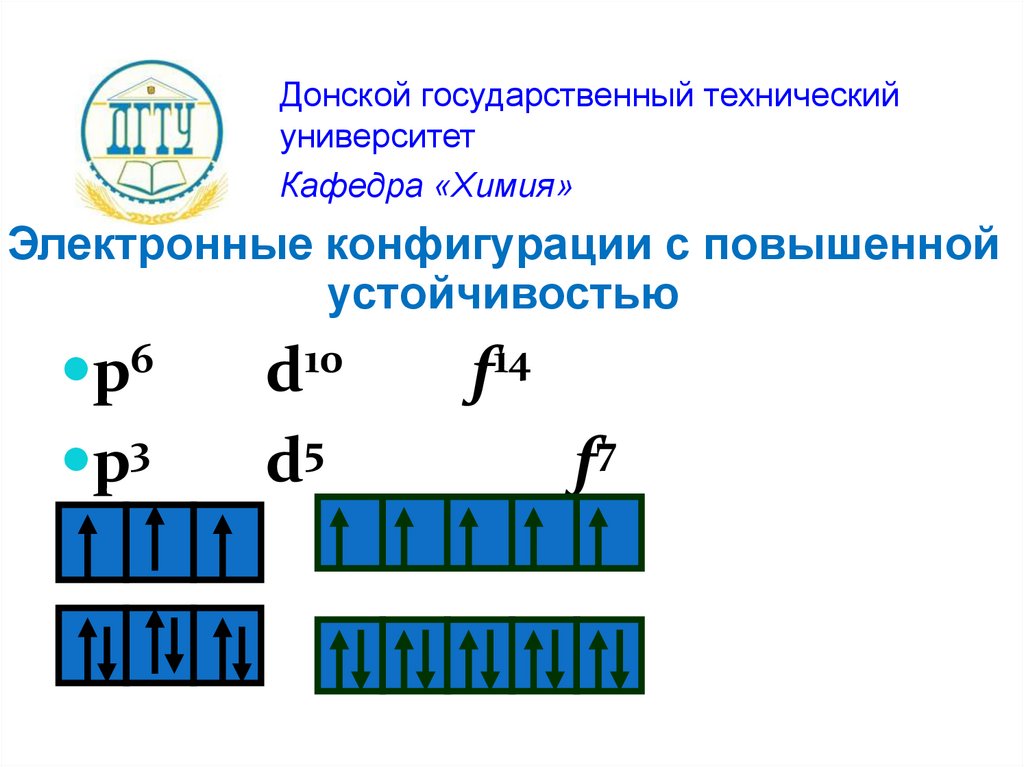
Электронные конфигурации с повышенной
устойчивостью
p6
p3
d10
d5
f14
f7




























 Физика
Физика








