Похожие презентации:
Biomolecule – macro- și
1.
BIOCHIMIABIOMOLECULE – MACRO- ȘI
MICROMOLECULE, MOLECULE COMPLEXE
AMINOACIZII: STRUCTURA,
CLASIFICAREA, ROLUL BIOLOGIC
Structura, clasificarea proteinelor
2.
Biochimia:• pentru prima dată ca termen a fost introdus în 1903
de către Carl Neiberg.
• “bios” - înseamnă viaţă
• ştiinţa despre structura şi transformarea
substanţelor chimice în organism, despre
procesele fizico-chimice care stau la baza
activităţii vitale ----studiază bazele moleculare
ale vieții
3.
Deosebim:• Biochimia structurală (statică,descriptivă) prezintă structura chimică a materiei vii (P, G; L;
AN), proprietăţile și rolul lor.
• Biochimia metabolică (dinamică) – prezintă
metabolismul P; G, L; AN şi reglarea hormonală
sau enzimatică ale proceselor metabolice în
organism.
• Biochimia clinică (funcţională)– cercetează
procesele chimice ce stau la baza diferitelor
manifestări ale vitalităţii.
4.
Importanța biochimiei• oferă cunoștințele necesare înțelegerii stării de
sănătate și a mecanismelor patogenice în orice
boală;
• permite tratarea cu succes a avitaminozelor, a
insuficiențelor și hiperfuncțiilor endocrine;
• explică modul de acțiune al medicamentelor, ca
modulatori ai activității enzimatice, oferind datele
necesare pentru sinteza de substanțe cu ac țiune
farmacologică dorită.
5.
Compoziţia chimică şi organizarea materiei vii:• Din cele cca. 100 elemente chimice întâlnite în
litosferă şi atmosferă, un număr relativ mic
participă la alcătuirea materiei vii.
• Acestea se numesc bioelemente (elemente
biogene) - elemente chimice care dau naștere
organismului viu.
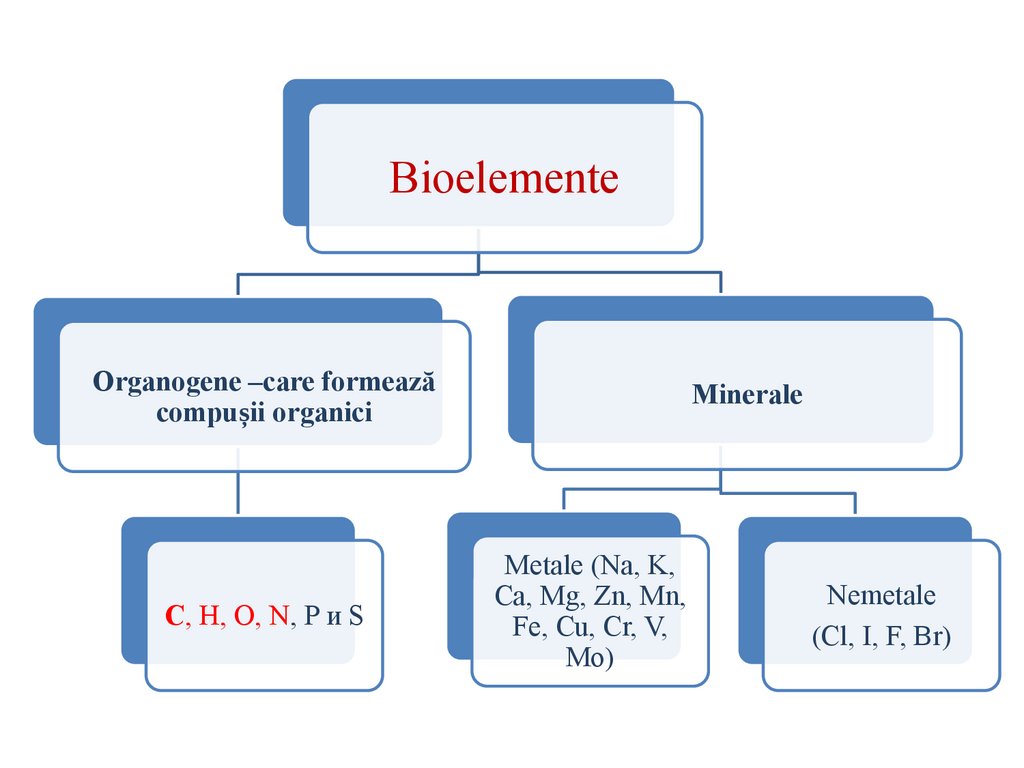
6.
BioelementeOrganogene –care formează
compușii organici
C, H, O, N, P и S
Minerale
Metale (Na, K,
Ca, Mg, Zn, Mn,
Fe, Cu, Cr, V,
Мо)
Nemetale
(Cl, I, F, Br)
7.
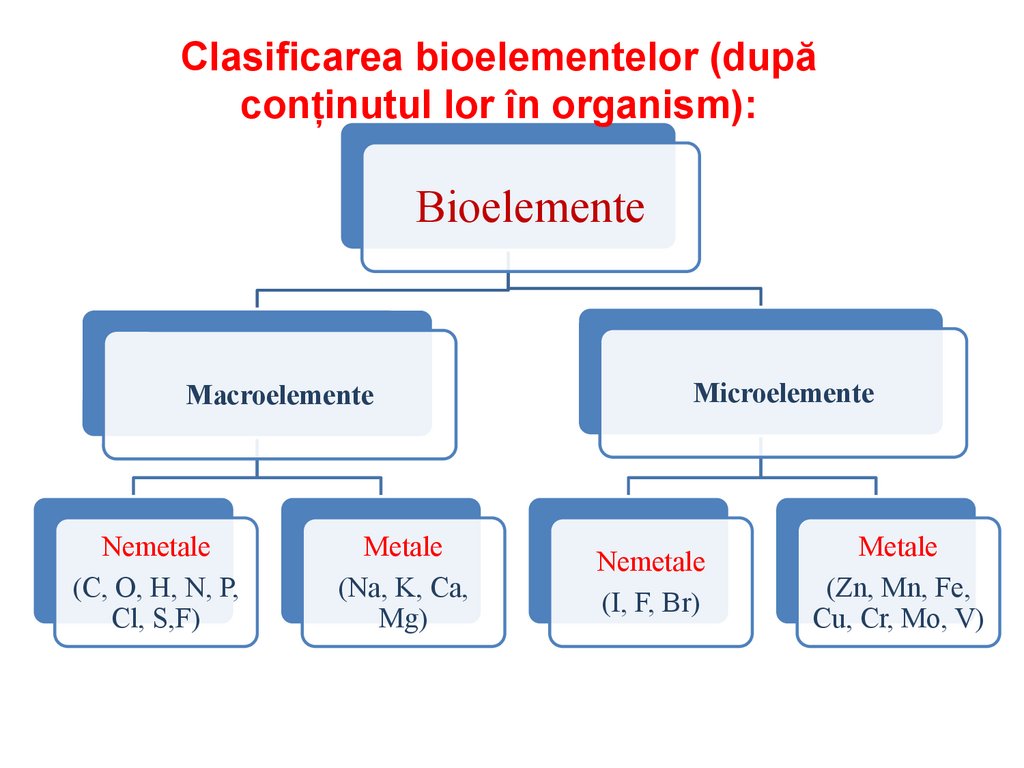
Clasificarea bioelementelor (dupăconținutul lor în organism):
Bioelemente
Macroelemente
Nemetale
(С, О, Н, N, Р,
Сl, S,F)
Metale
(Na, K, Ca,
Mg)
Microelemente
Nemetale
(I, F, Br)
Metale
(Zn, Mn, Fe,
Cu, Cr, Mo, V)
8.
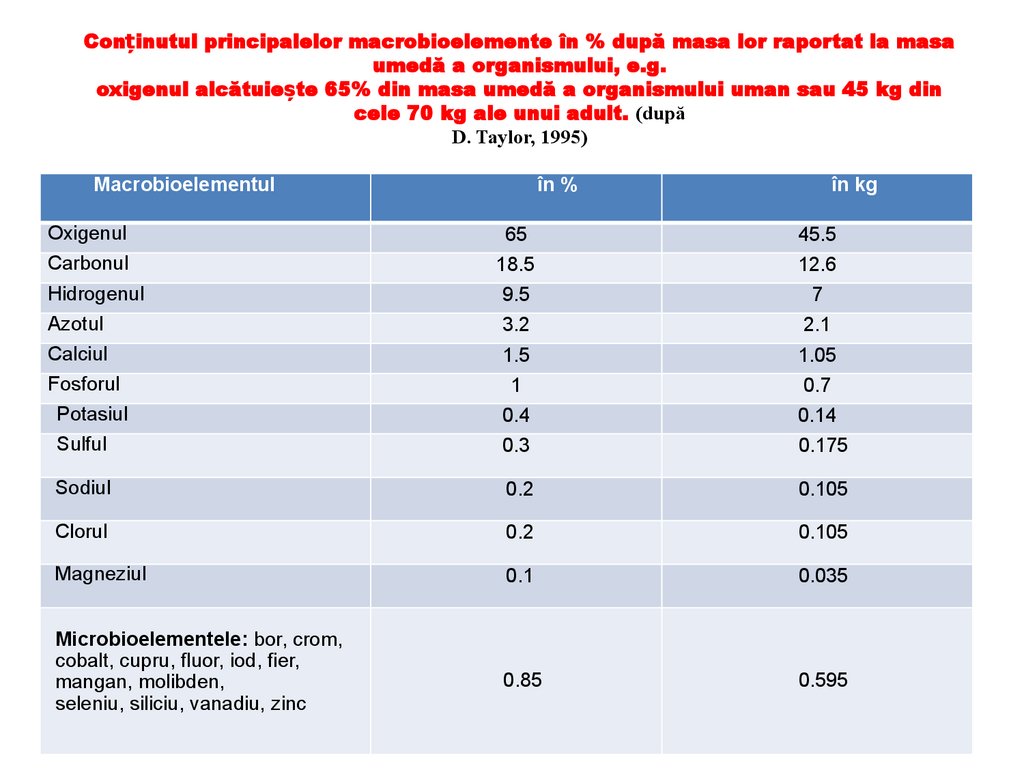
Conținutul principalelor macrobioelemente în % după masa lor raportat la masaumedă a organismului, e.g.
oxigenul alcătuiește 65% din masa umedă a organismului uman sau 45 kg din
cele 70 kg ale unui adult. (după
D. Taylor, 1995)
Macrobioelementul
în %
în kg
Oxigenul
65
45.5
Carbonul
18.5
12.6
Hidrogenul
9.5
7
Azotul
3.2
2.1
Calciul
1.5
1.05
Fosforul
1
0.7
Potasiul
Sulful
0.4
0.14
0.3
0.175
Sodiul
0.2
0.105
Clorul
0.2
0.105
Magneziul
0.1
0.035
Microbioelementele: bor, crom,
cobalt, cupru, fluor, iod, fier,
mangan, molibden,
seleniu, siliciu, vanadiu, zinc
0.85
0.595
9.
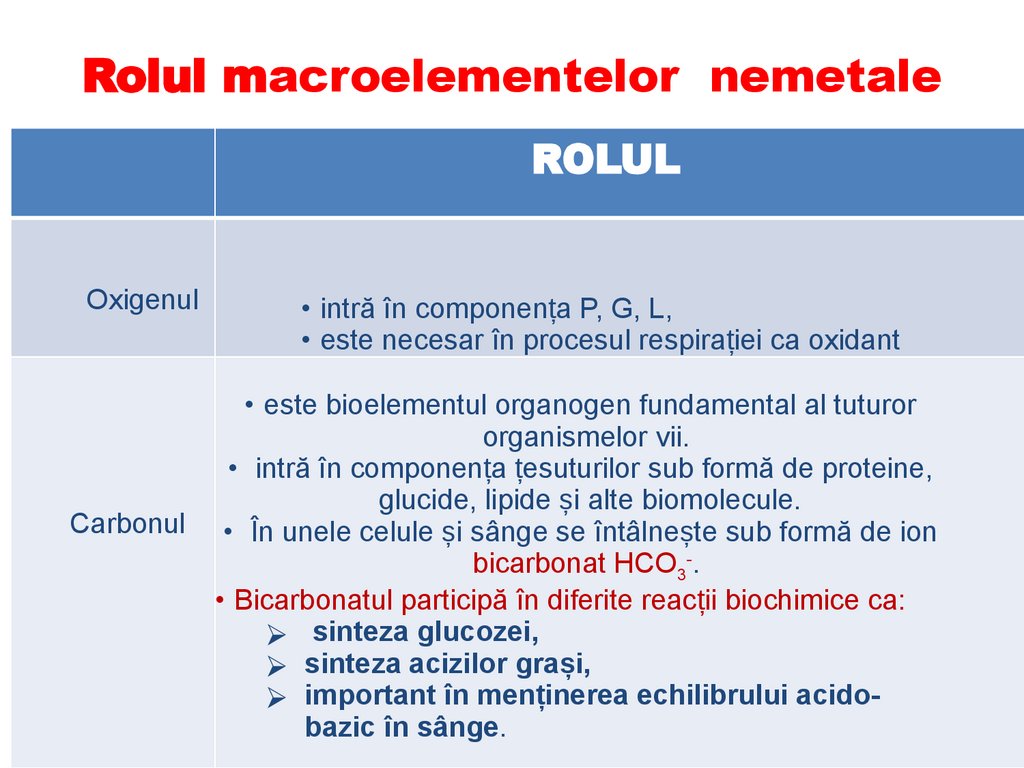
Rolul macroelementelor nemetaleROLUL
Oxigenul
Carbonul
• intră în componența P, G, L,
• este necesar în procesul respirației ca oxidant
• este bioelementul organogen fundamental al tuturor
organismelor vii.
• intră în componența țesuturilor sub formă de proteine,
glucide, lipide și alte biomolecule.
• În unele celule și sânge se întâlnește sub formă de ion
bicarbonat HCO3-.
• Bicarbonatul participă în diferite reacții biochimice ca:
⮚ sinteza glucozei,
⮚ sinteza acizilor grași,
⮚ important în menținerea echilibrului acidobazic în sânge.
10.
Rolul macroelementelor nemetaleMacro
bioele
mentul
Hidrogenul
Azotul
ROLUL
• nu se întâlnește în stare liberă atomară H sau
moleculară H2 ci doar în componența diferitor
biomolecule sau în stare ionizată H+ așa numitul
proton de hidrogen.
• Ionii H+ contribuie la crearea mediului acid în
organism.
• intră în componența tuturor biomoleculelor proteinelor, glucidelor, lipidelor, acizilor nucleici etc.
• Este un component principal al aminoacizilor,
proteinelor, acizilor nucleici.
• Se întâlnește și în componența unor compușii
anorganici ca oxidul de azot NO și ionii sau sărurile de
amoniu NH4+.
• Datorită capacității lui de a forma legături donoracceptor poate fixa protonii - conferă proprietăți bazice
proteinelor,
11.
Rolul macroelementelor nemetaleMacro
bioele
mentul
Clorul
ROLUL
• se întâlnește în formă ionică de clorură Cl-.
• importanți în formarea acidului clorhidric HCl (componentul
sucului gastric)
• pot fi activatorii unor enzime(amilaza salivară)
• implicați în procesele de transport al gazelor (O2 și CO2) în
sânge.
• în sinteza unor compuși cu acțiune bactericidă (acidul
hipocloros HOCl produs de unele leucocite) având astfel un
rol important în imunitate.
• este un component important al acizilor nucleici, unor proteine
(fosfoproteine), lipide (fosfolipide) și a mineralelor care alcătuiesc țesutul
Fosforul
osos.
• În oase și dinți se conține preponderent sub formă de hidroxiapatită
Са10(РO4)6(ОН)2.
• este componentul unor biomolecule cu valoare energetică ca ATP-ul,
creatinfosfatul, fosfoenolpiruvatul.
• este componentul sistemelor tampon sangvine
12.
Rolul macroelementelor nemetaleROLUL
Macr
obioe
leme
ntul
Sulful
• Intră în componența aminoacizilor cisteina și
metionina respectiv în componența proteinelor.
• este componentul unor biomolecule importante
ca taurina, coenzima A, S-adenozilmetionina și a
unor vitamine ca tiamina (B1) și biotina (H).
• în organism se mai întâlnește și în formă
anorganică ca sulfat.
13.
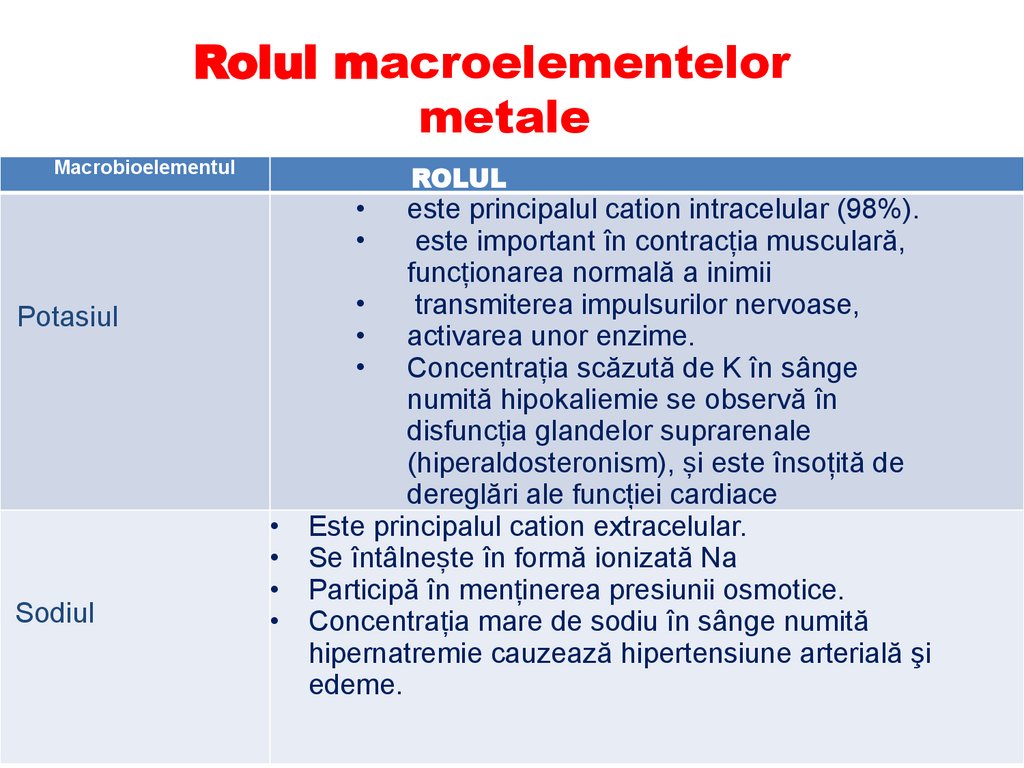
Rolul macroelementelormetale
Macrobioelementul
Potasiul
Sodiul
ROLUL
este principalul cation intracelular (98%).
este important în contracția musculară,
funcționarea normală a inimii
transmiterea impulsurilor nervoase,
• activarea unor enzime.
• Concentrația scăzută de K în sânge
numită hipokaliemie se observă în
disfuncția glandelor suprarenale
(hiperaldosteronism), și este însoţită de
dereglări ale funcţiei cardiace
Este principalul cation extracelular.
Se întâlnește în formă ionizată Na
Participă în menținerea presiunii osmotice.
Concentrația mare de sodiu în sânge numită
hipernatremie cauzează hipertensiune arterială şi
edeme.
14.
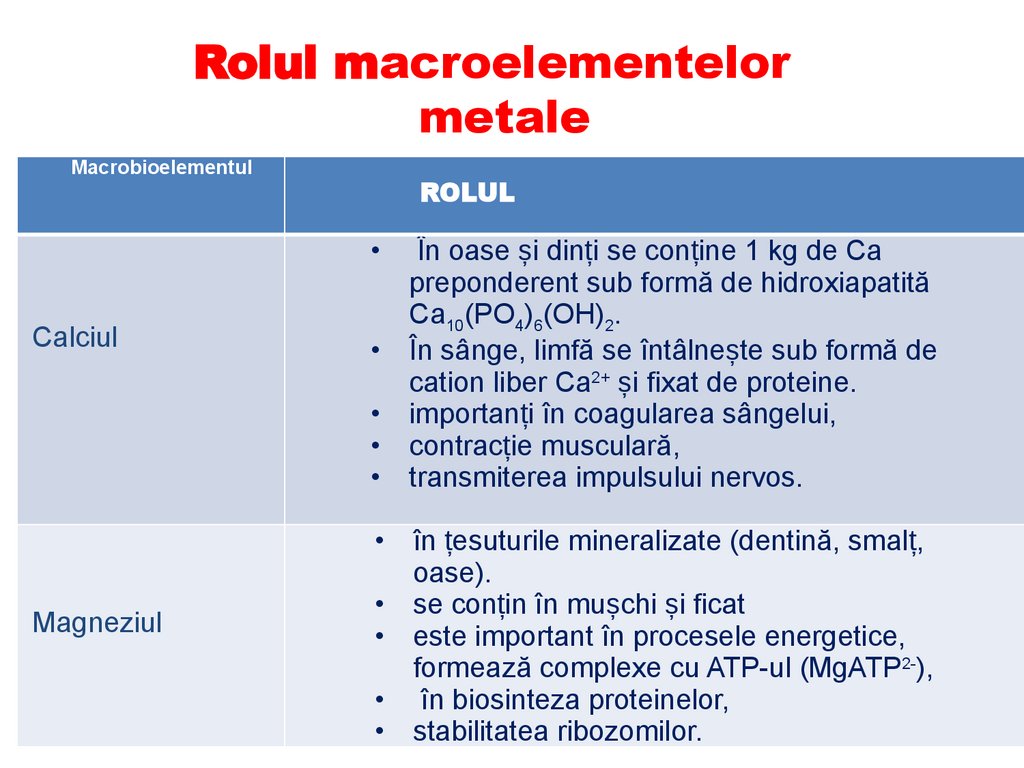
Rolul macroelementelormetale
Macrobioelementul
ROLUL
Calciul
Magneziul
În oase și dinți se conține 1 kg de Ca
preponderent sub formă de hidroxiapatită
Са10(РO4)6(ОН)2.
În sânge, limfă se întâlnește sub formă de
cation liber Ca2+ și fixat de proteine.
importanți în coagularea sângelui,
contracție musculară,
transmiterea impulsului nervos.
• în țesuturile mineralizate (dentină, smalț,
oase).
• se conțin în mușchi și ficat
• este important în procesele energetice,
formează complexe cu ATP-ul (MgATP2-),
• în biosinteza proteinelor,
• stabilitatea ribozomilor.
15.
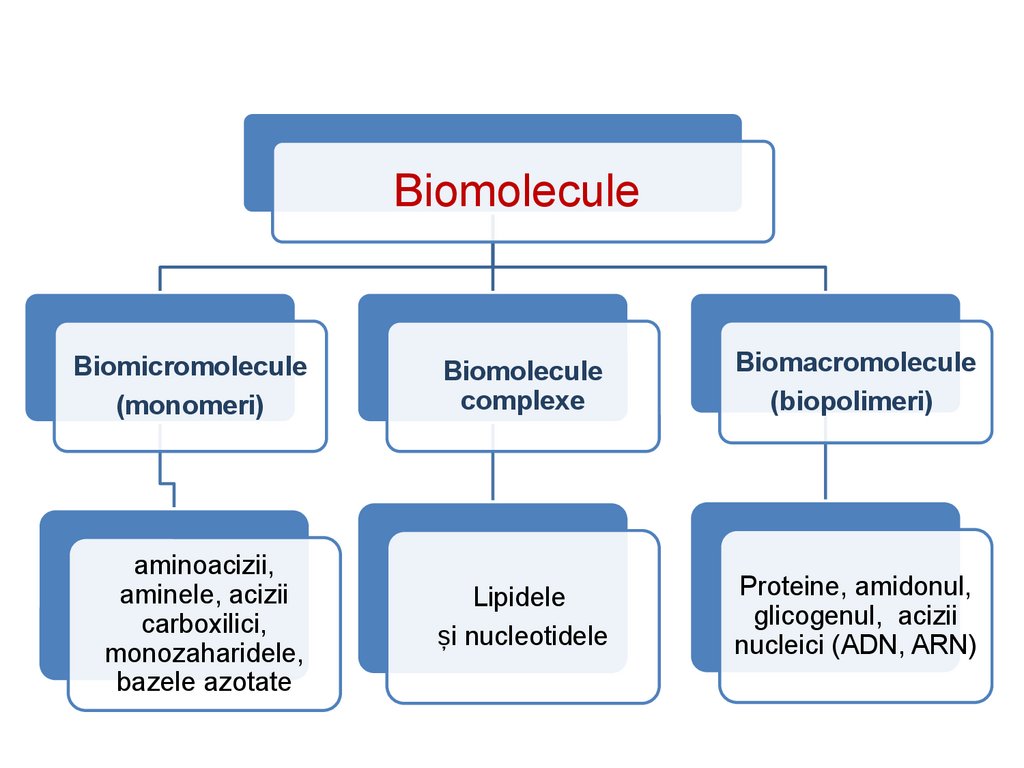
BiomoleculeleBiomoleculele sunt molecule primite cu alimentația sau
sintetizate de organism cu destinație structurală
(anatomică) și fiziologică. Ele pot fi divizate în
biomicromolecule, biomolecule complexe și
biomacromolecule (biopolimeri).
16.
BiomoleculeBiomicromolecule
(monomeri)
Biomolecule
complexe
Biomacromolecule
(biopolimeri)
aminoacizii,
aminele, acizii
carboxilici,
monozaharidele,
bazele azotate
Lipidele
și nucleotidele
Proteine, amidonul,
glicogenul, acizii
nucleici (ADN, ARN)
17.
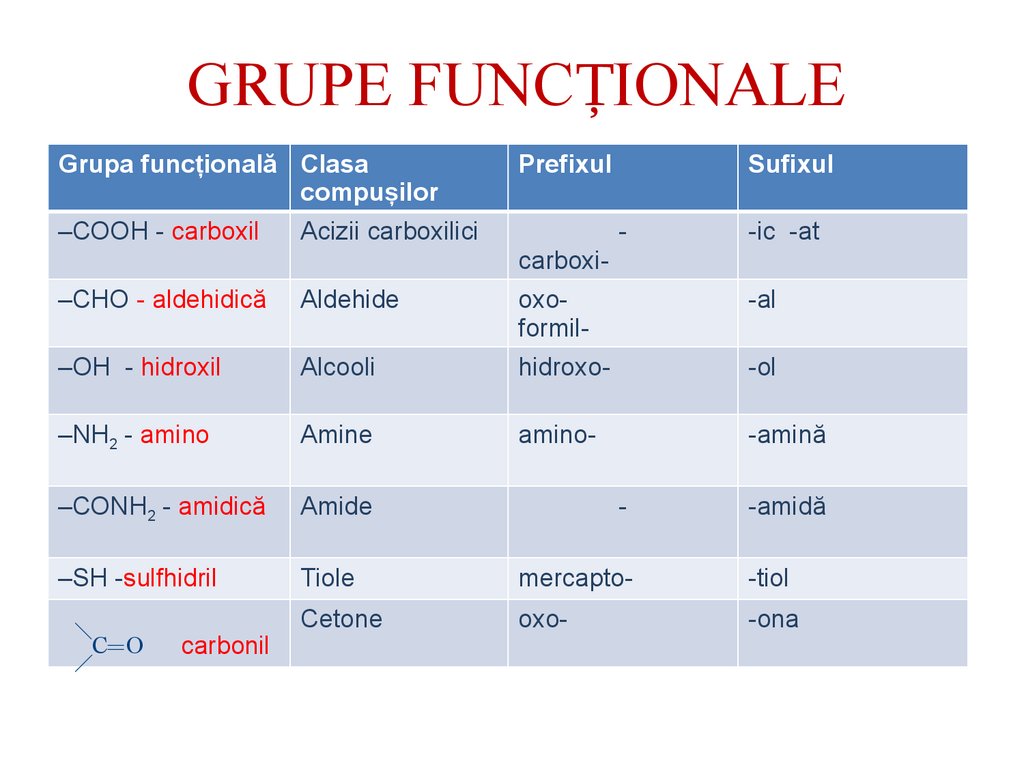
GRUPE FUNCȚIONALEGrupa funcțională Clasa
compușilor
Prefixul
Sufixul
–СООН - carboxil
Acizii carboxilici
–СНО - aldehidică
Aldehide
oxoformil-
-al
–ОН - hidroxil
Alcooli
hidroxo-
-ol
–NН2 - amino
Amine
amino-
-amină
–СОNН2 - amidică
Amide
-
–SH -sulfhidril
Tiole
mercapto-
-tiol
Cetone
oxo-
-оna
C O
carbonil
carboxi-
-
-ic -at
-amidă
18.
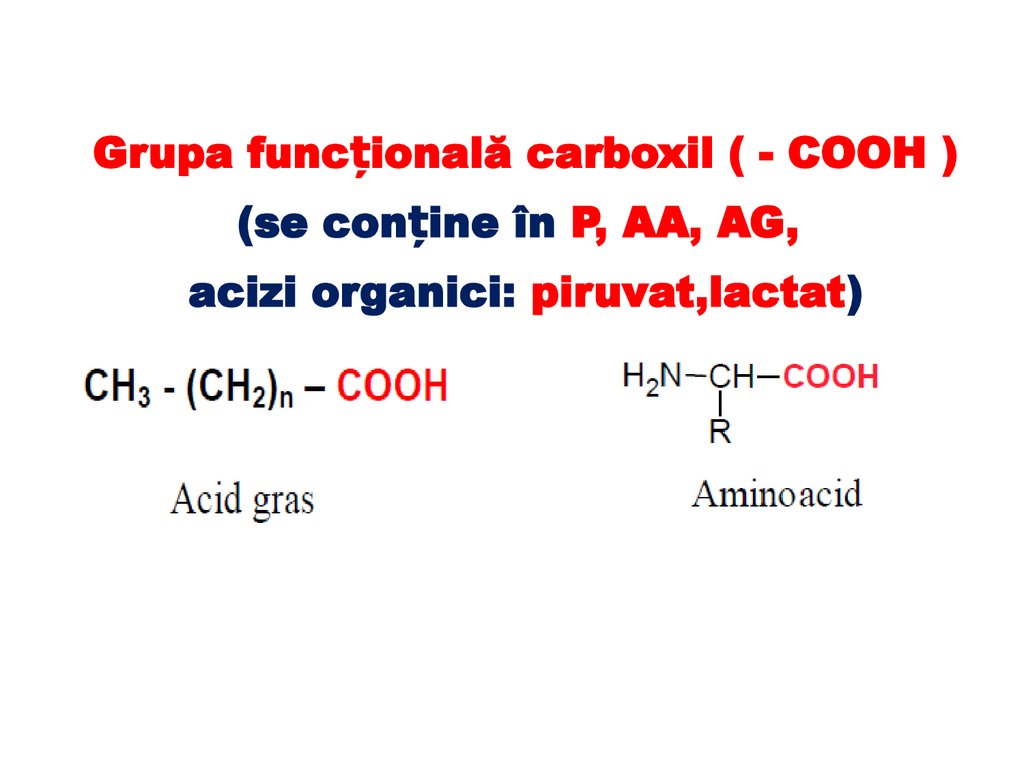
Grupa funcțională carboxil ( - COOH )(se conține în P, AA, AG,
acizi organici: piruvat,lactat)
19.
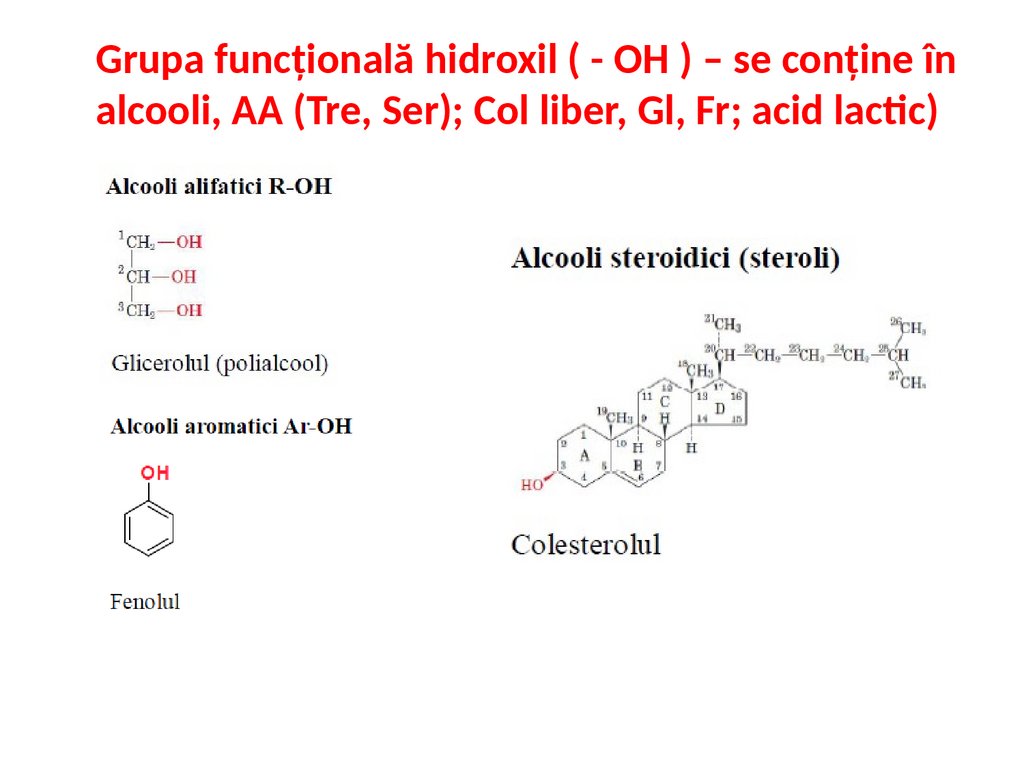
Grupa funcțională hidroxil ( - OH ) – se conține înalcooli, AA (Tre, Ser); Col liber, Gl, Fr; acid lactic)
20.
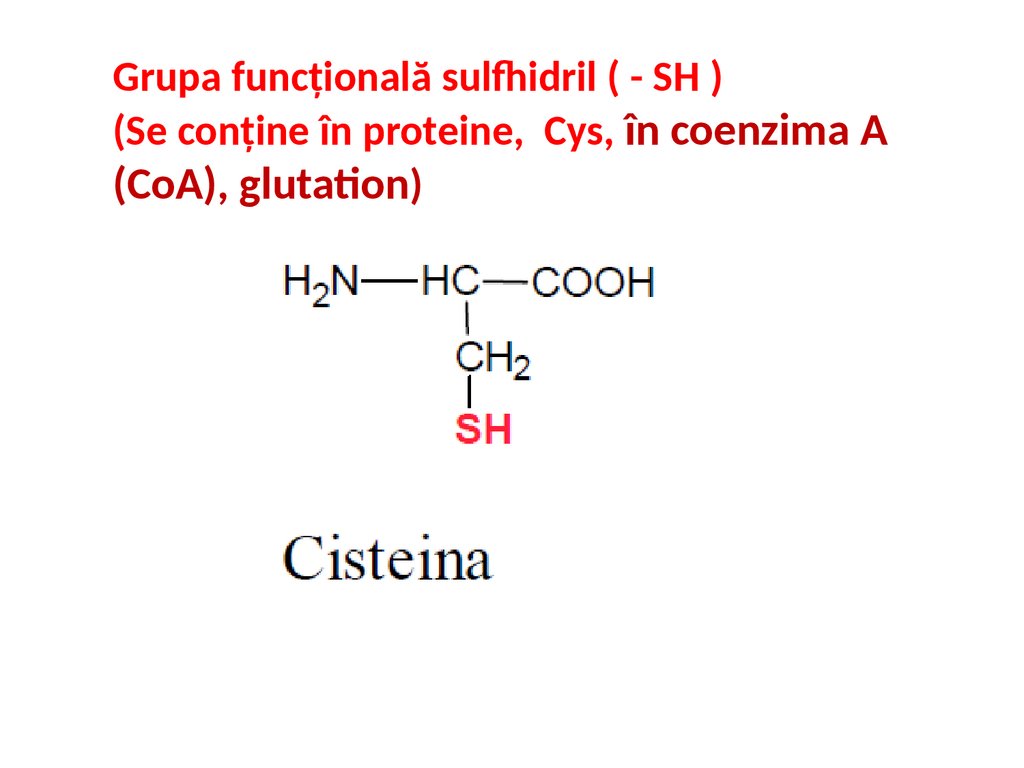
Grupa funcțională sulfhidril ( - SH )(Se conține în proteine, Cys, în coenzima A
(CoA), glutation)
21.
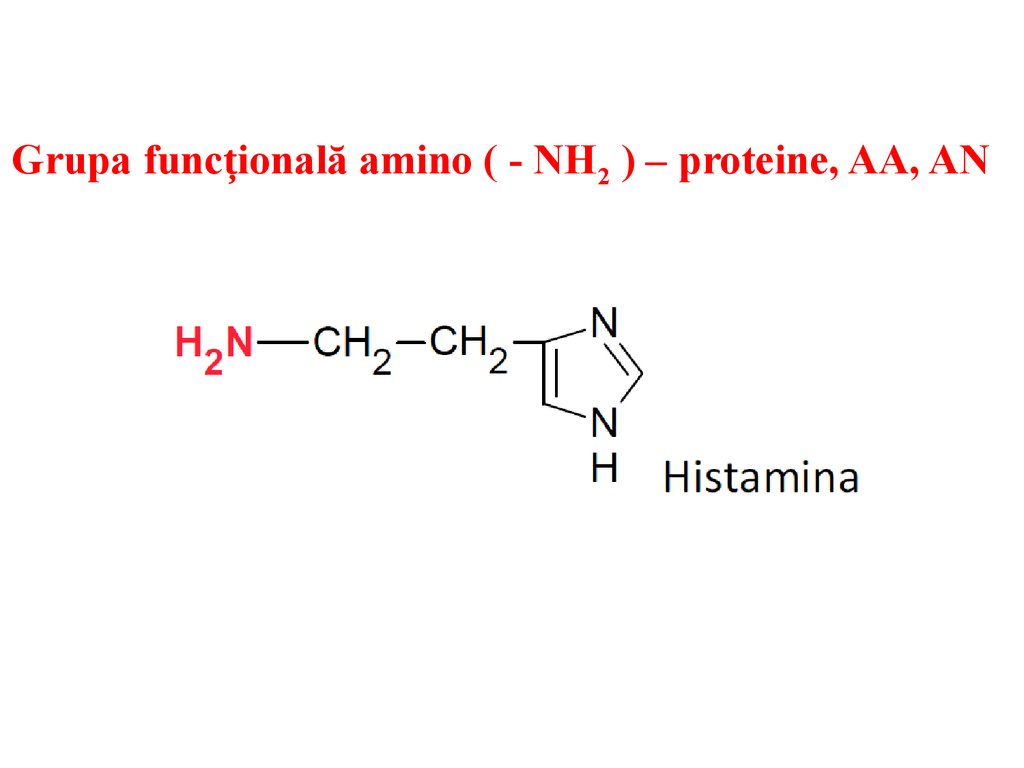
Grupa funcțională amino ( - NH2 ) – proteine, AA, AN22.
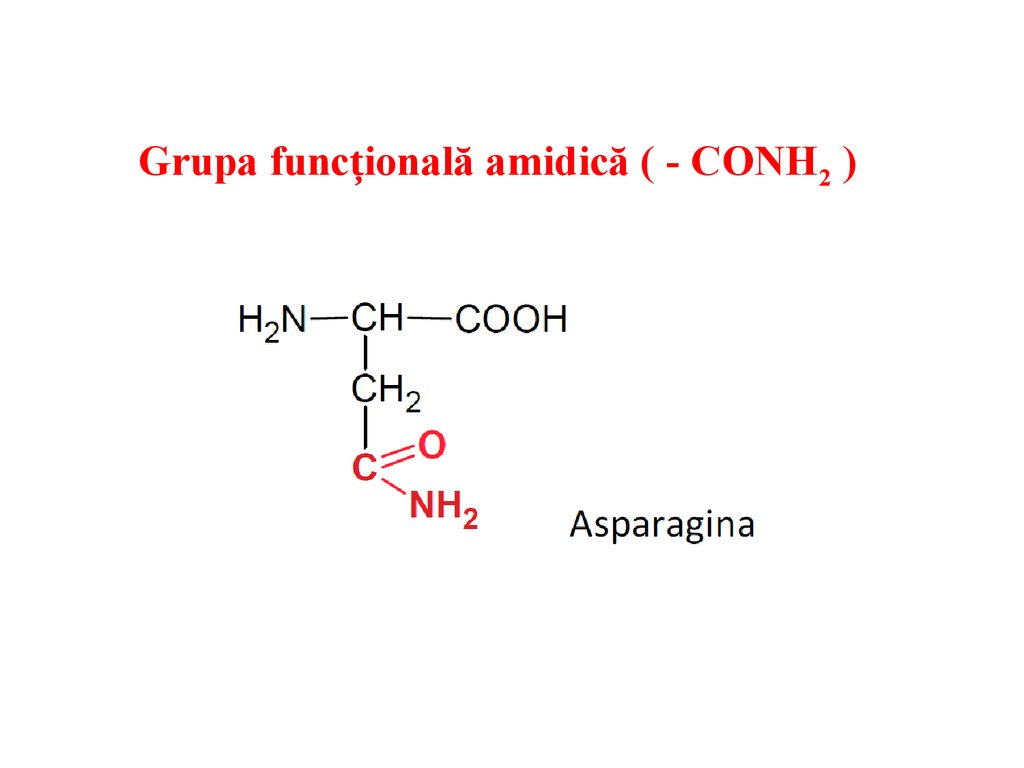
Grupa funcțională amidică ( - CONH2 )23.
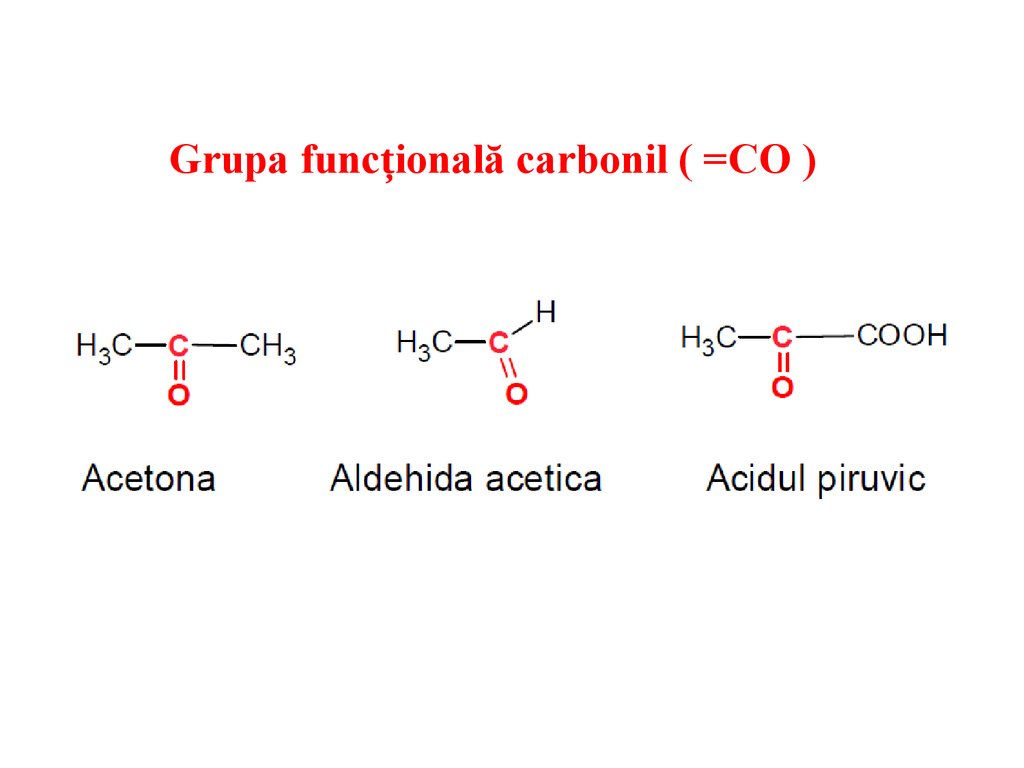
Grupa funcțională carbonil ( =CO )24.
Tipuri de legături chimiceLegătura
covalentă
nepolarăse stabileste
intre atomi
identici de
nemetale
O=O
N=N
F-F
C-C
C-H
Legătura covalentă – se
formează pe baza
cuplului comun de
electroni.
Poate fi polară și
nepolară
Ex: Cl2;O2; N2, CH4
25.
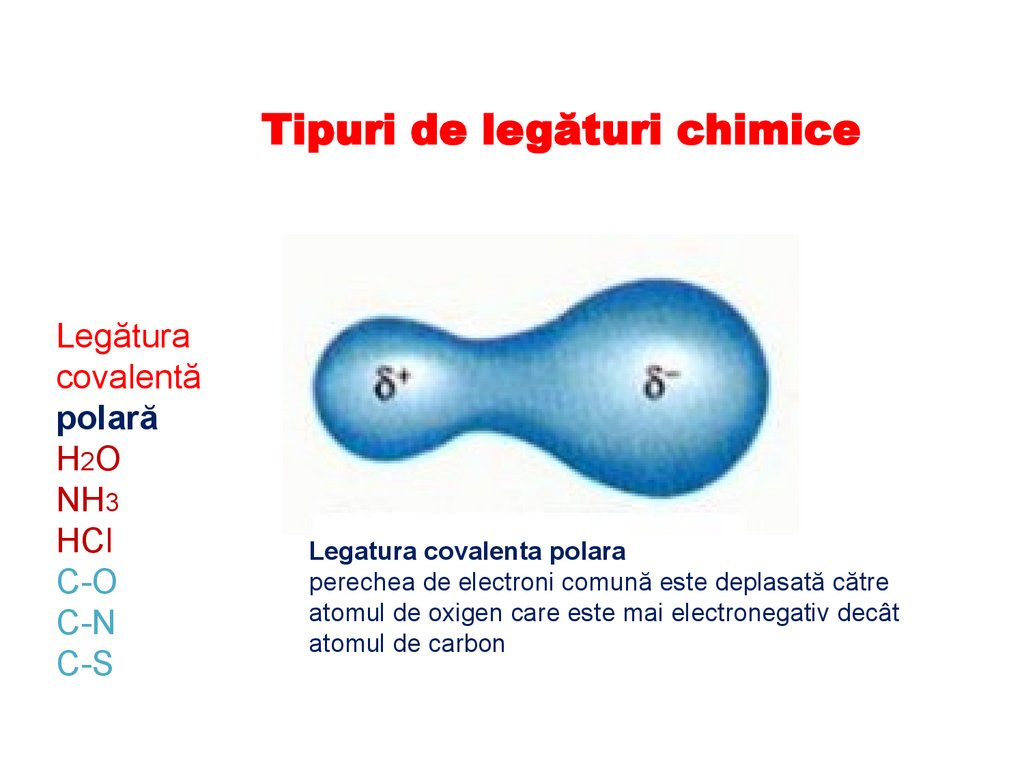
Tipuri de legături chimiceLegătura
covalentă
polară
H2O
NH3
HCl
C-O
C-N
C-S
Legatura covalenta polara
perechea de electroni comună este deplasată către
atomul de oxigen care este mai electronegativ decât
atomul de carbon
26.
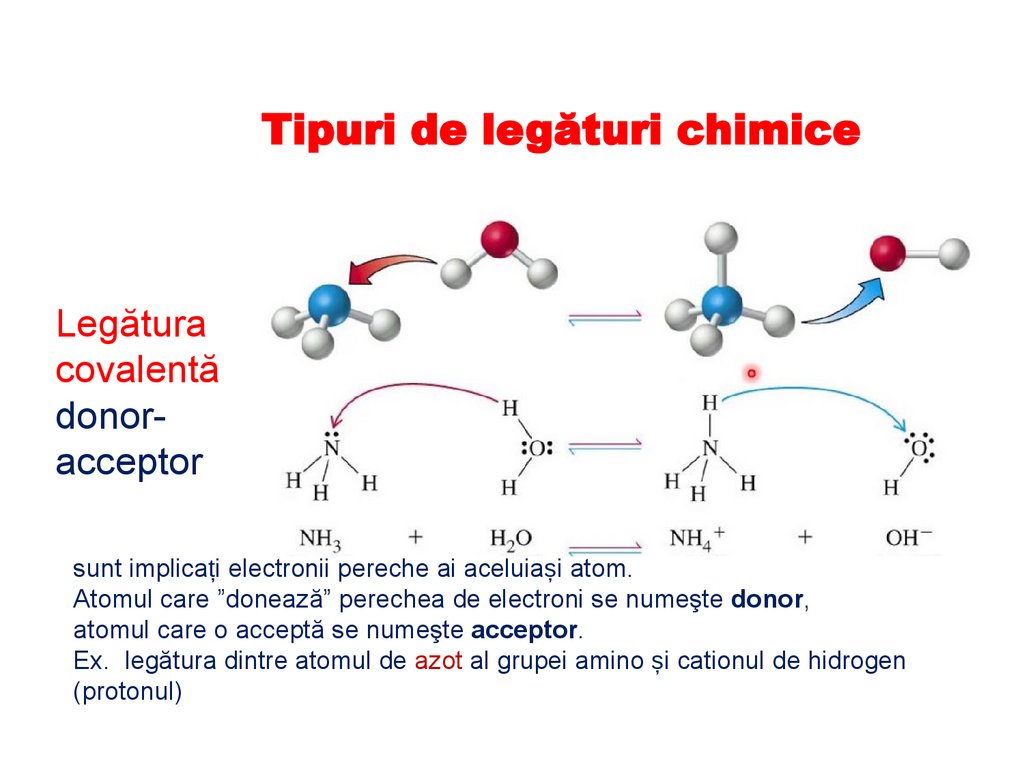
Tipuri de legături chimiceLegătura
covalentă
donoracceptor
sunt implicați electronii pereche ai aceluiași atom.
Atomul care ”donează” perechea de electroni se numeşte donor,
atomul care o acceptă se numeşte acceptor.
Ex. legătura dintre atomul de azot al grupei amino și cationul de hidrogen
(protonul)
27.
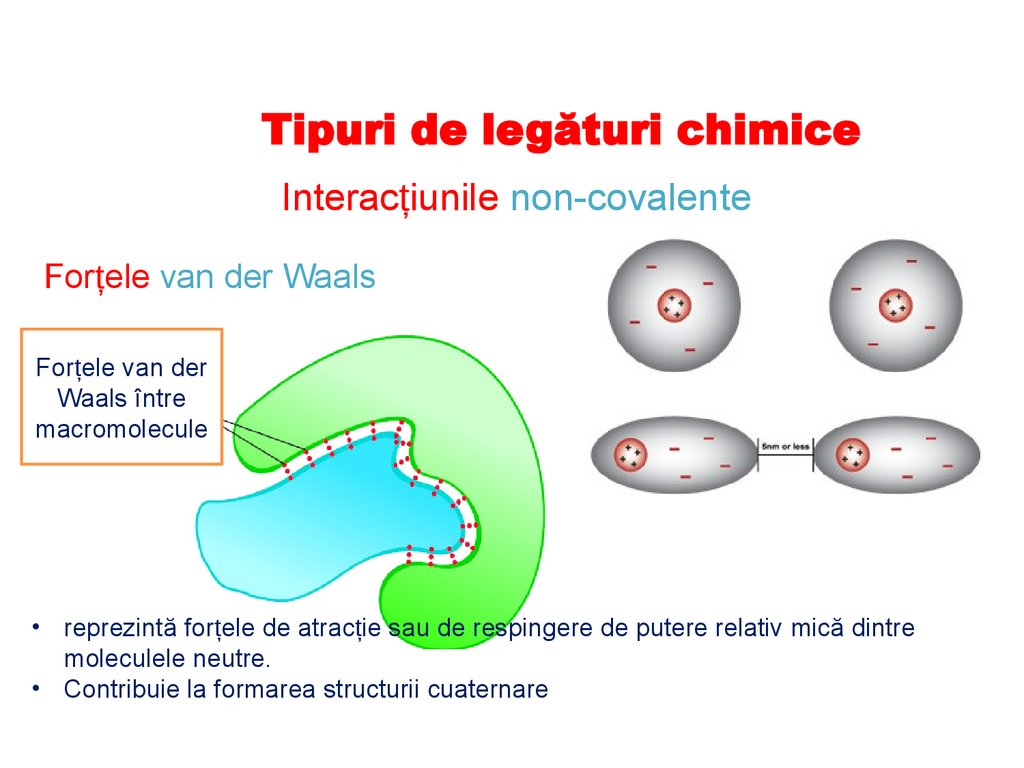
Tipuri de legături chimiceInteracțiunile non-covalente
Forțele van der Waals
Forțele van der
Waals între
macromolecule
• reprezintă forțele de atracție sau de respingere de putere relativ mică dintre
moleculele neutre.
• Contribuie la formarea structurii cuaternare
28.
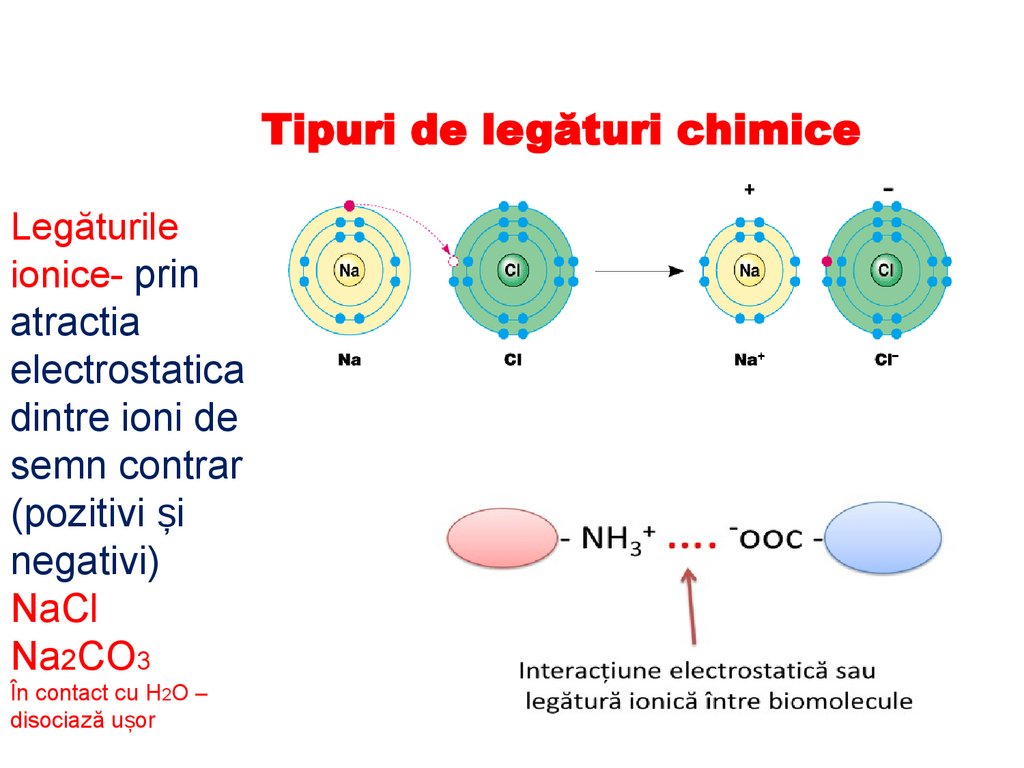
Tipuri de legături chimiceLegăturile
ionice- prin
atractia
electrostatica
dintre ioni de
semn contrar
(pozitivi și
negativi)
NaCl
Na2CO3
În contact cu H2O –
disociază ușor
29.
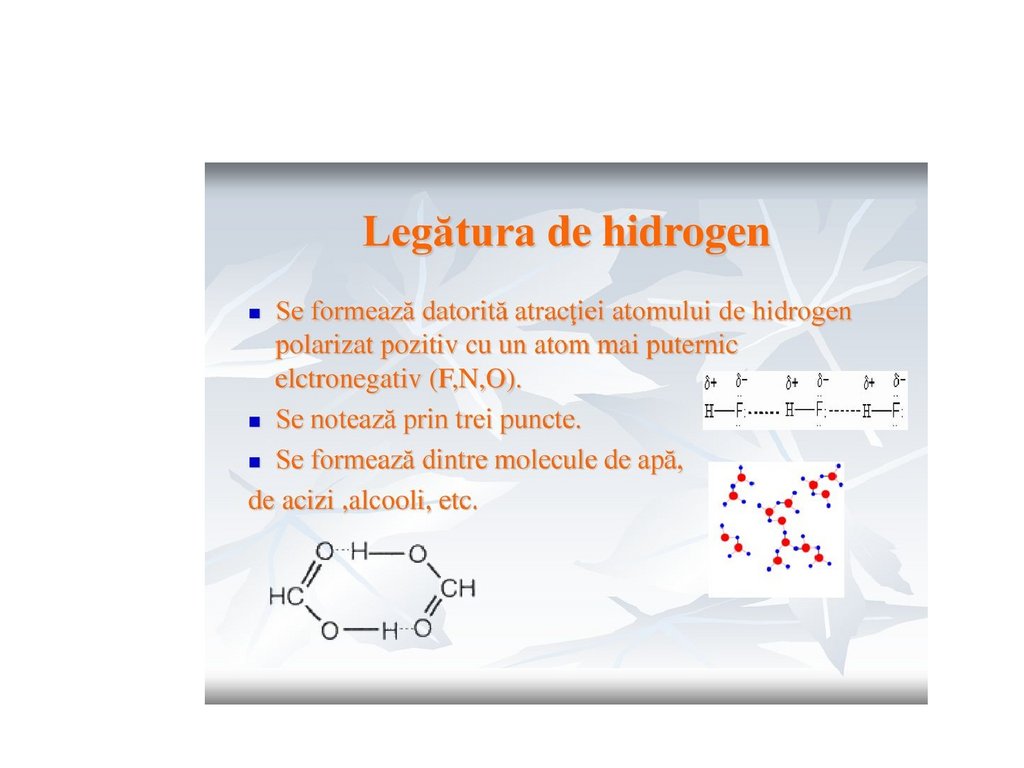
Tipuri de legături chimiceLegăturile
de
hidrogen
poate apărea intermolecular sau
intramolecular
Mai slabe ca cele covalente, dar
nu mai slabe ca van-der-Waals
Apare în proteine, ADN, ARN,
AA.
30.
31.
Tipuri de legături chimiceInteracțiuni
hidrofobe
32.
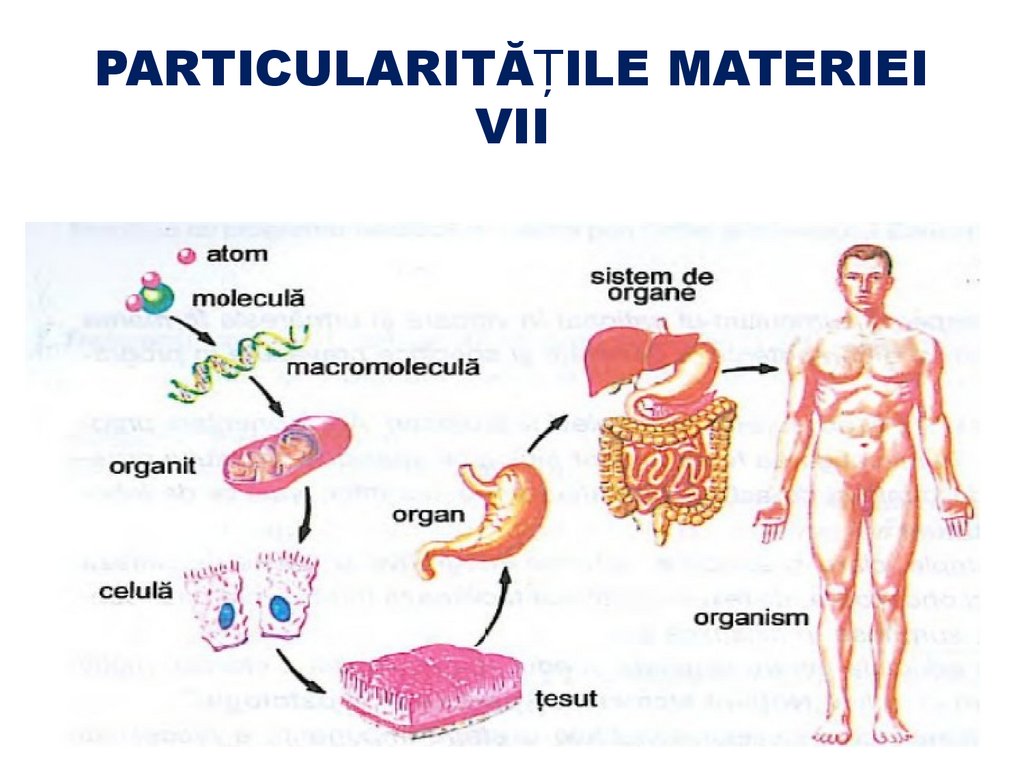
PARTICULARITĂȚILE MATERIEIVII
33.
PARTICULARITĂȚILE MATERIEI VII34.
PARTICULARITĂȚILE MATERIEI VIIGradul superior de organizare structurală (caracterizat
prin structura compusă şi diversitatea de molecule)
Funcţia strict determinată şi sensul său specific pentru
fiecare parte componentă.
Capacitatea de a transforma şi a utiliza energia
Schimbul de substanţe cu mediul înconjurător şi
autoreglarea transformărilor chimice.
Capacitatea
de
autoreplicare
informaţiei genetice.
sau
transmitere
a
35.
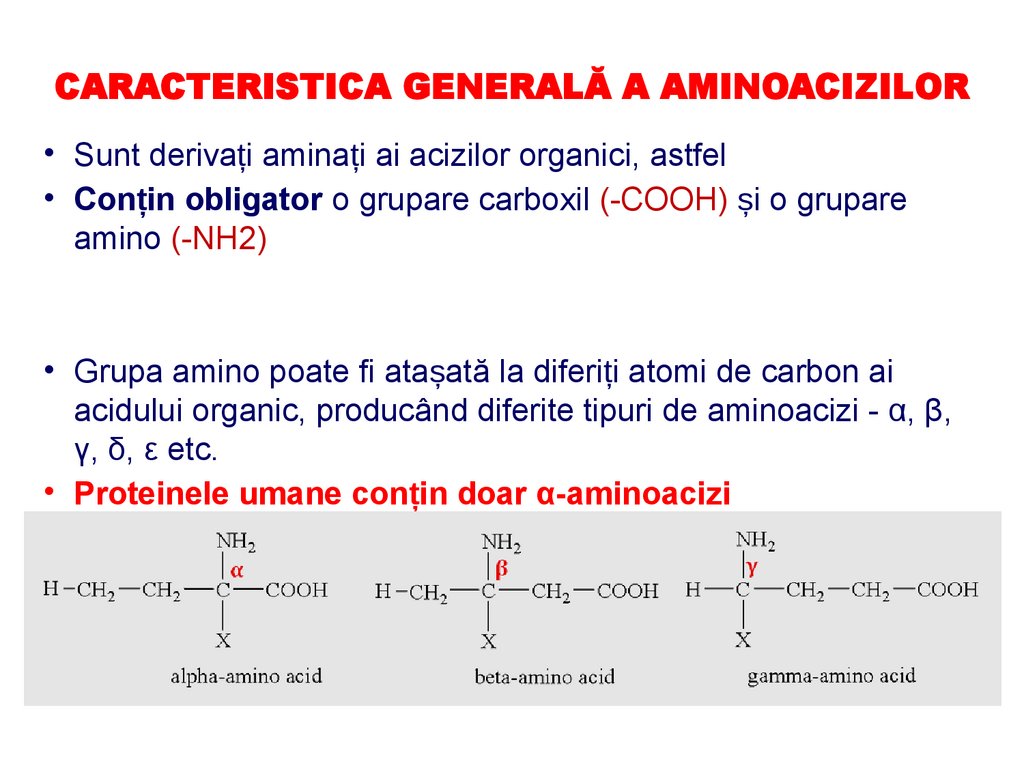
CARACTERISTICA GENERALĂ A AMINOACIZILOR• Sunt derivați aminați ai acizilor organici, astfel
• Conțin obligator o grupare carboxil (-COOH) și o grupare
amino (-NH2)
• Grupa amino poate fi atașată la diferiți atomi de carbon ai
acidului organic, producând diferite tipuri de aminoacizi - α, β,
γ, δ, ε etc.
• Proteinele umane conțin doar α-aminoacizi
36.
Funcțiile aminoacizilor (AA) :1. sunt elementele structurale fundamentale ale
proteinelor;
2. sunt precursori ai:
− hormonilor,
− bazelor azotate purinice și pirimidinice,
− porfirinelor (hemurilor),
− vitaminelor (ex .: acid folic)
− aminelor biogene - reglatori locali (ex .: histamina) și
neuromediatori (ex .: dopamina)
37.
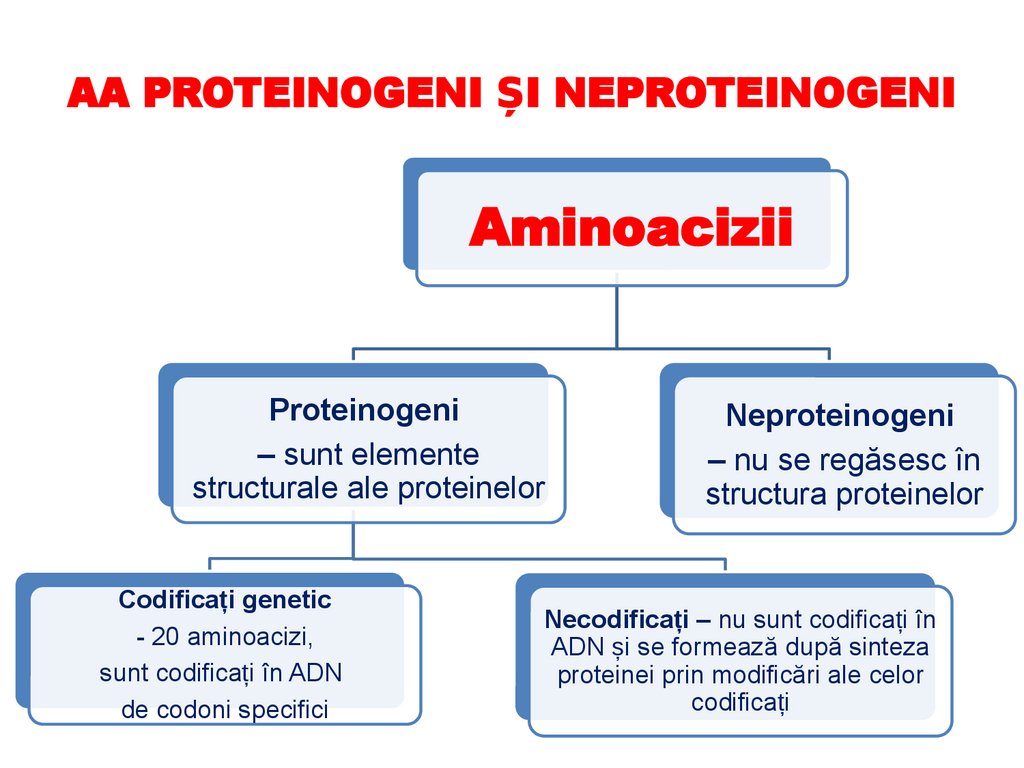
AA PROTEINOGENI ȘI NEPROTEINOGENIAminoacizii
Proteinogeni
– sunt elemente
structurale ale proteinelor
Codificați genetic
- 20 aminoacizi,
sunt codificați în ADN
de codoni specifici
Neproteinogeni
– nu se regăsesc în
structura proteinelor
Necodificați – nu sunt codificați în
ADN și se formează după sinteza
proteinei prin modificări ale celor
codificați
38.
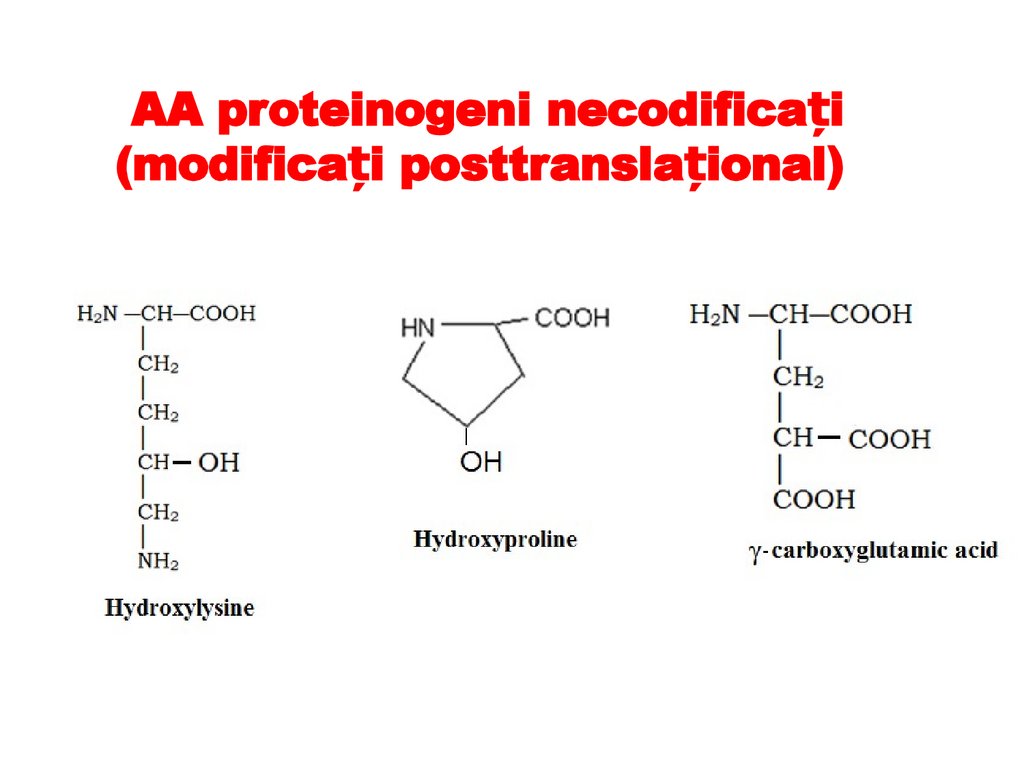
AA proteinogeni necodificați(modificați posttranslațional)
39.
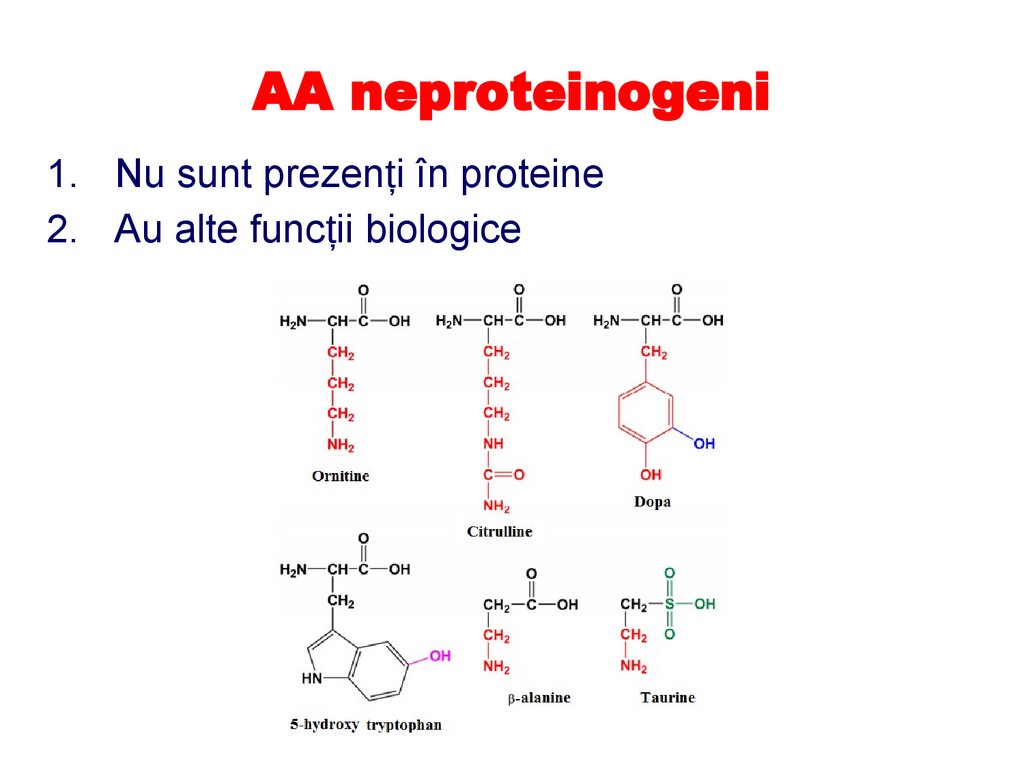
AA neproteinogeni1. Nu sunt prezenți în proteine
2. Au alte funcții biologice
40.
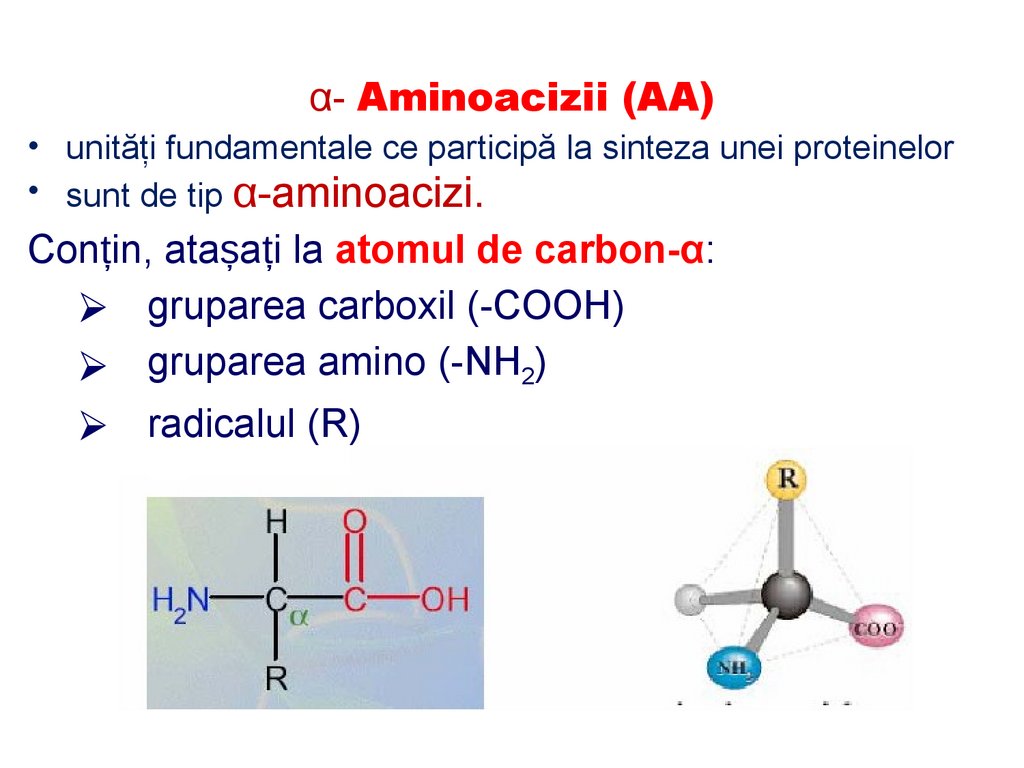
α- Aminoacizii (AA)• unităţi fundamentale ce participă la sinteza unei proteinelor
• sunt de tip α-aminoacizi.
Conțin, atașați la atomul de carbon-α:
⮚ gruparea carboxil (-COOH)
⮚ gruparea amino (-NH2)
⮚ radicalul (R)
41.
Stereoizomeria aminoacizilor• Două molecule sunt stereoizomeri dacă sunt
formate din aceeași atomi, conectați în aceeași
secvență, dar atomii sunt poziționați diferit în
spațiu.
• Diferența dintre stereoizomeri poate fi observată
numai atunci când este luată în considerare
aranjarea tridimensională a moleculelor.
• Stereoizomerii pot fi împărțiți în izomeri optici și
geometrici.
42.
Stereoizomeria aminoacizilor• Molecule chirale sunt molecule ce dețin centre chirale (un
atom de carbon asimetric), care este un atom de carbon la
care sunt atașate 4 grupe funcționale diferite, deci el este
completamente asimetric
• Toți α-aminoacizii (cu excepția glicinei) conțin un α-carbon
chiralic și formează L- și D- stereoizomeri, care sunt
imaginea în oglindă unul al celuilalt
• Proteinele umane conțin doar α-L-aminoacizi
43.
• CLASIFICAREA ȘISTRUCTURA CHIMICĂ A AA
44.
PROPRIETĂȚILE fizico-cimice ale α-AA1. AA se deosebesc după radical - R, care le conferă proprietăți specifice.
2. Radicalul poatea avea proprietăți hidrofobe sau hidrofile.
3. Radicalii hidrofili pot fi neutri, acizi sau bazici, în funcție de grupele
funcționale.
4. În cazul în care radicalul unui AA este hidrofob sau hidrofil neutru (nu
are grupuri care pot fi încărcate) atunci R nu va influența sarcina
electrică totală a AA și proprietățile sale acide sau bazice.
5. Radicalul hidrofil poate conține grupe funcționale care pot avea
sarcină, astfel va influența sarcina electrică totală a AA și proprietățile
sale acide sau bazice:
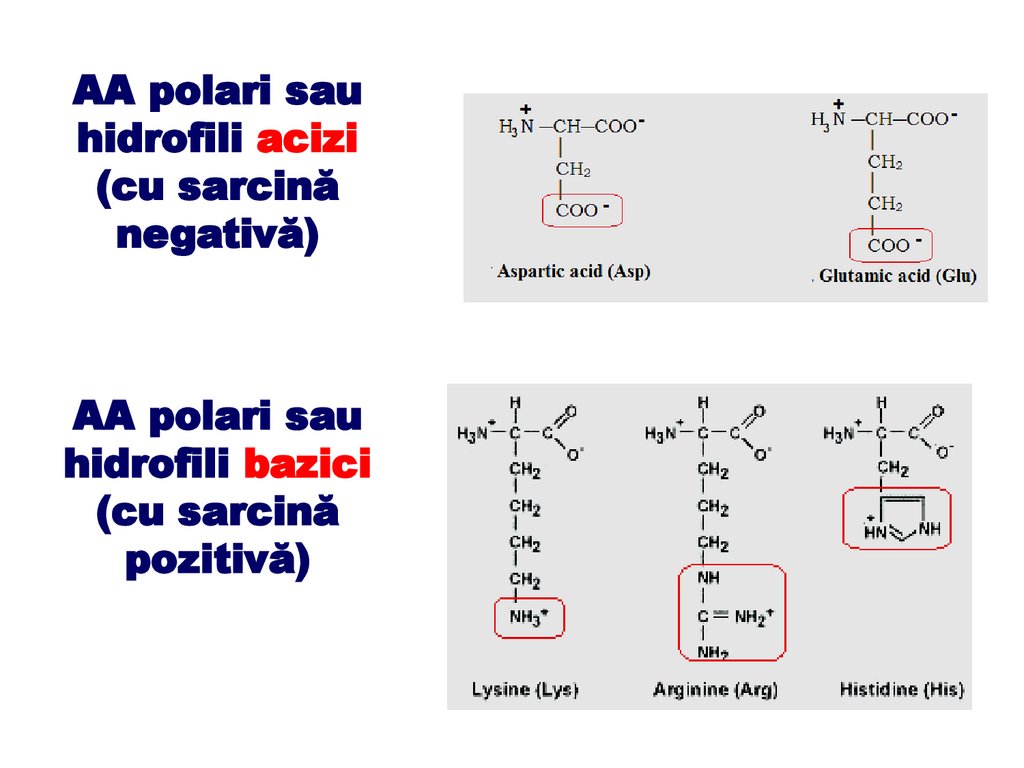
- o grupare – COO‒ adiţională (cazul acizilor aspartic şi glutamic)
aminoacizii au caracter acid și sarcină negativă;
- o grupare – NH3+ suplimentară (cazul argininei, lizinei) aminoacizii
respectivi au caracter bazic și sarcină pozitivă.
45.
CLASIFICAREA AAa. după proprietățile fizico-chimice
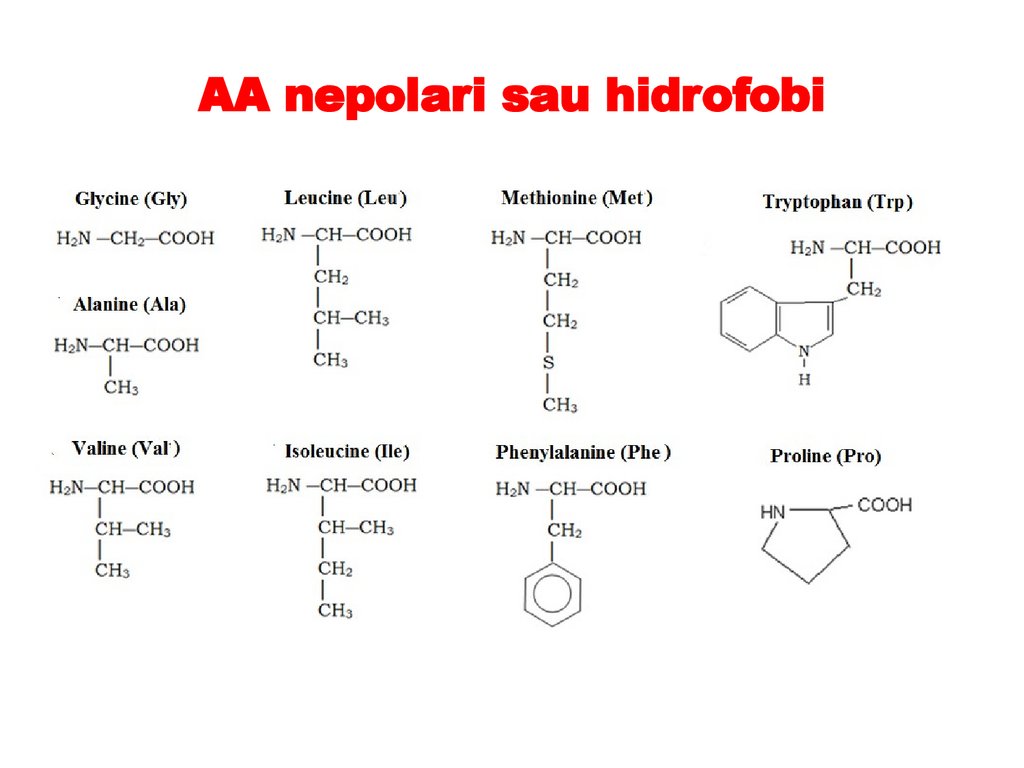
1. AA nepolari (hidrofobi): glicina, alanina, valina, leucina,
izoleucina, prolina, fenilalanina, triptofanul şi metionina.
– Toți AA hidrofobi sunt neutri
– Toți sunt puțin solubili în apă și bine solubili în solvenți
organici
2. AA polari (hidrofili):
✔ Neutri - serină, treonină, cisteină, tirozină, asparagină,
glutamină
✔ Acizi - Asp (acid aspartic) și Glu (acid glutamic)
✔ Bazici - Lys (lizină), Arg (arginină) și His (histidină)
Aceşti AA sunt mai solubili în apă datorită grupărilor funcționale –COOH, OH, -SH, -NH2, -CO-NH2, guanidino și imidazol, care pot interacționa cu
apa
46.
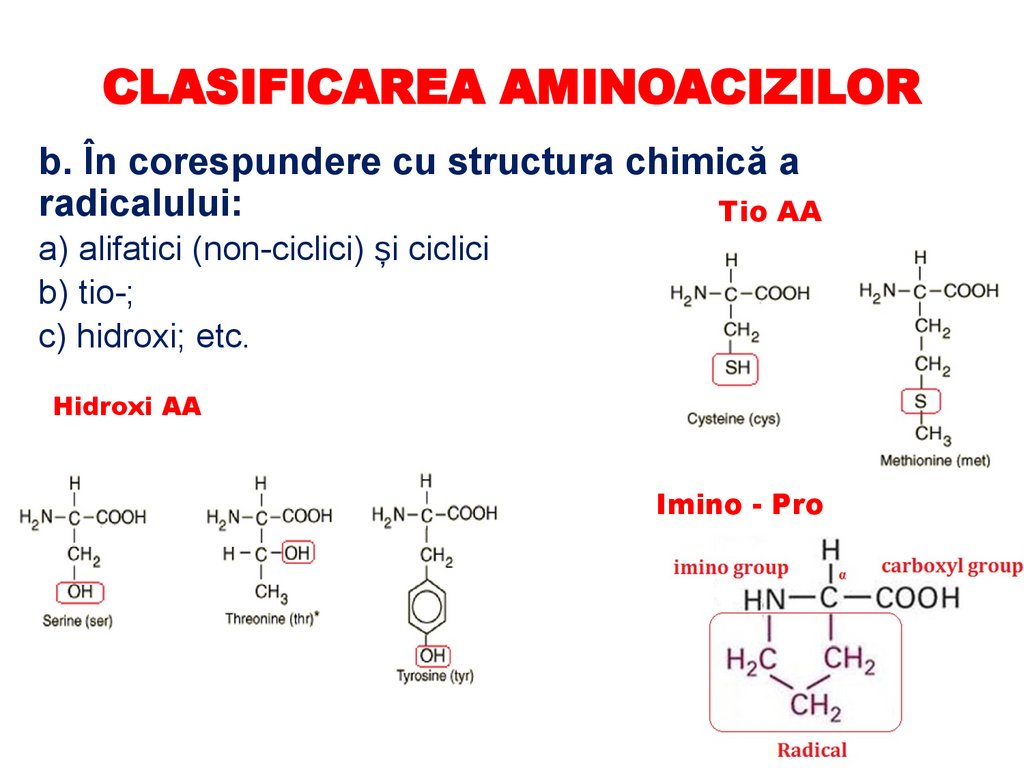
CLASIFICAREA AMINOACIZILORb. În corespundere cu structura chimică a
radicalului:
Tio AA
a) alifatici (non-ciclici) și ciclici
b) tio-;
c) hidroxi; etc.
Hidroxi AA
Imino - Pro
47.
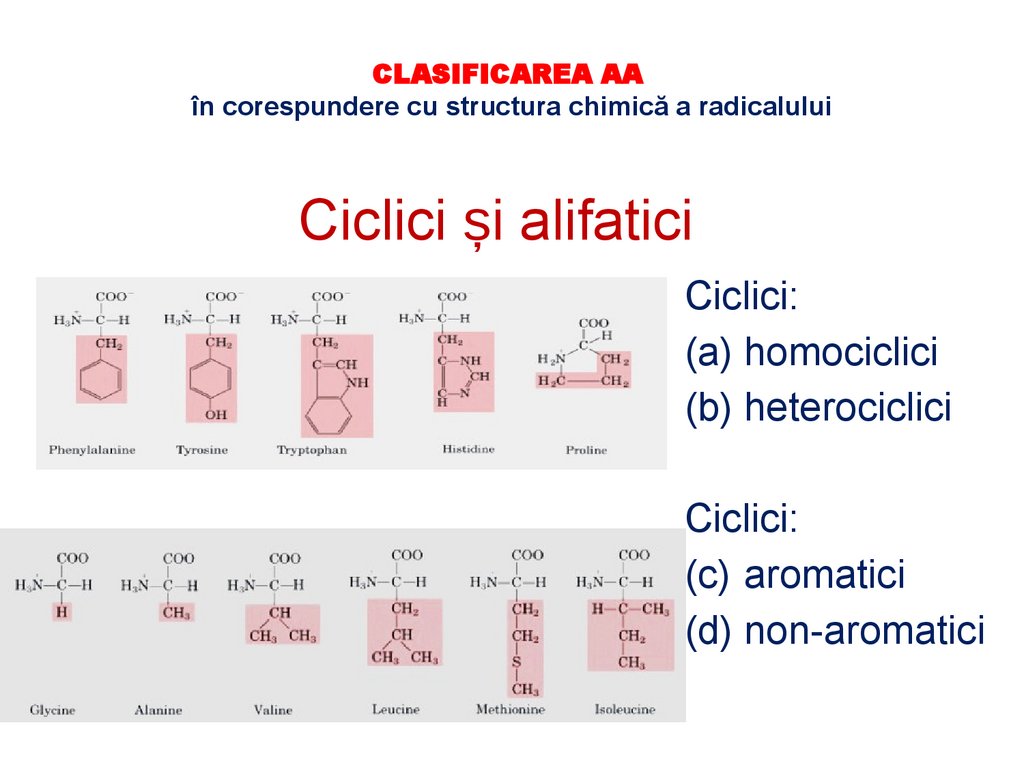
CLASIFICAREA AAîn corespundere cu structura chimică a radicalului
Ciclici și alifatici
Ciclici:
(a) homociclici
(b) heterociclici
Ciclici:
(c) aromatici
(d) non-aromatici
48.
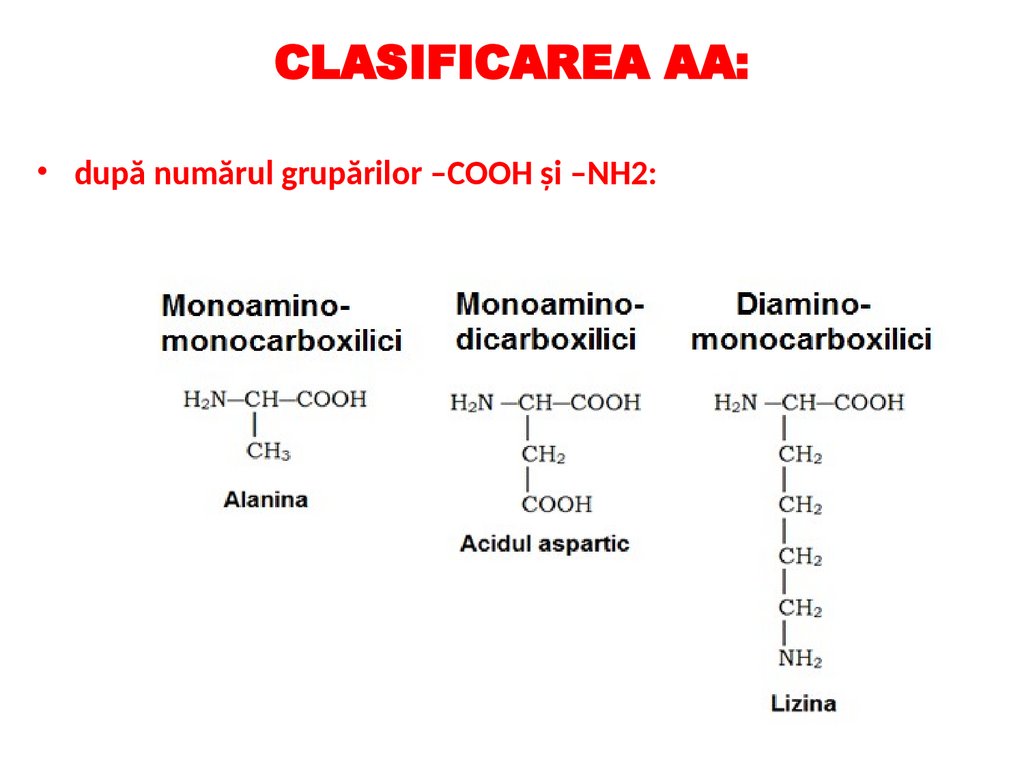
CLASIFICAREA AA:• după numărul grupărilor –COOH şi –NH2:
49.
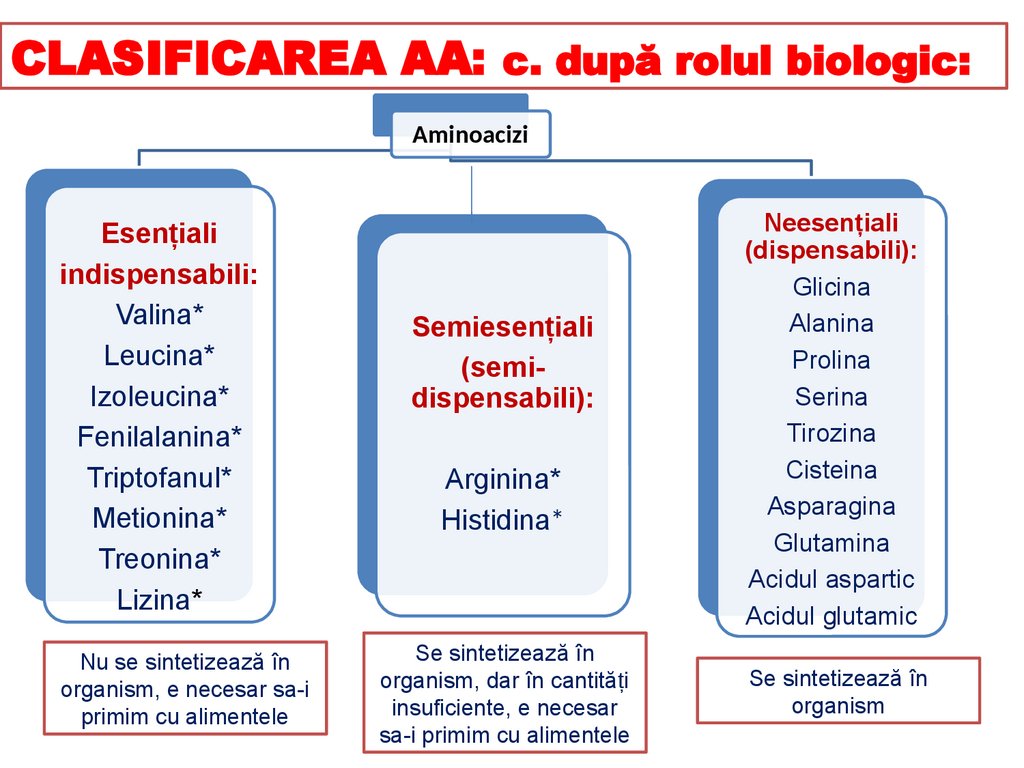
CLASIFICAREA AA: c. după rolul biologic:Aminoacizi
Esențiali
indispensabili:
Valina*
Leucina*
Izoleucina*
Fenilalanina*
Triptofanul*
Metionina*
Treonina*
Lizina*
Nu se sintetizează în
organism, e necesar sa-i
primim cu alimentele
Semiesențiali
(semidispensabili):
Arginina*
Histidina*
Se sintetizează în
organism, dar în cantități
insuficiente, e necesar
sa-i primim cu alimentele
Neesențiali
(dispensabili):
Glicina
Alanina
Prolina
Serina
Tirozina
Cisteina
Asparagina
Glutamina
Acidul aspartic
Acidul glutamic
Se sintetizează în
organism
50.
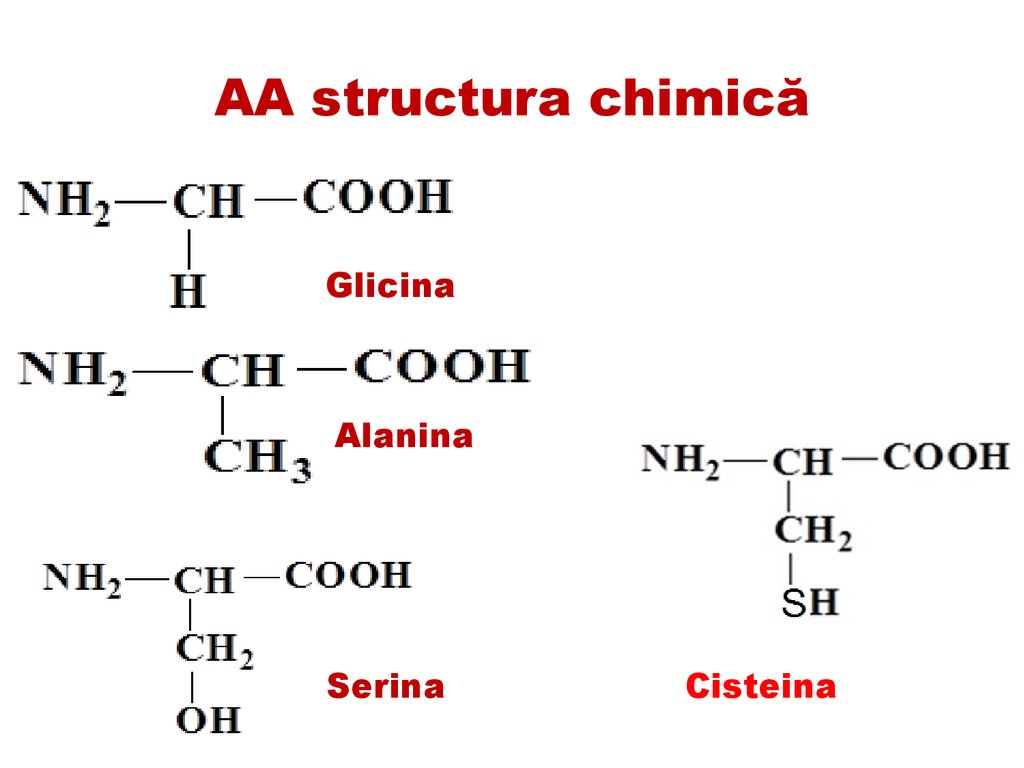
AA structura chimicăGlicina
Alanina
Serina
Cisteina
51.
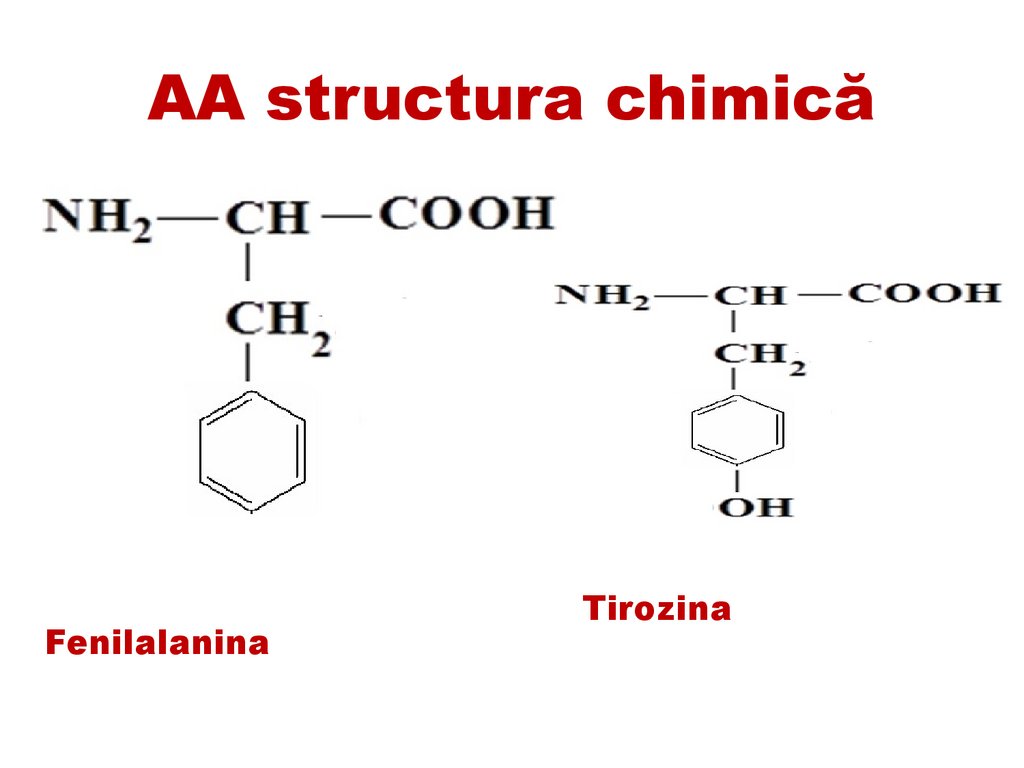
AA structura chimicăFenilalanina
Tirozina
52.
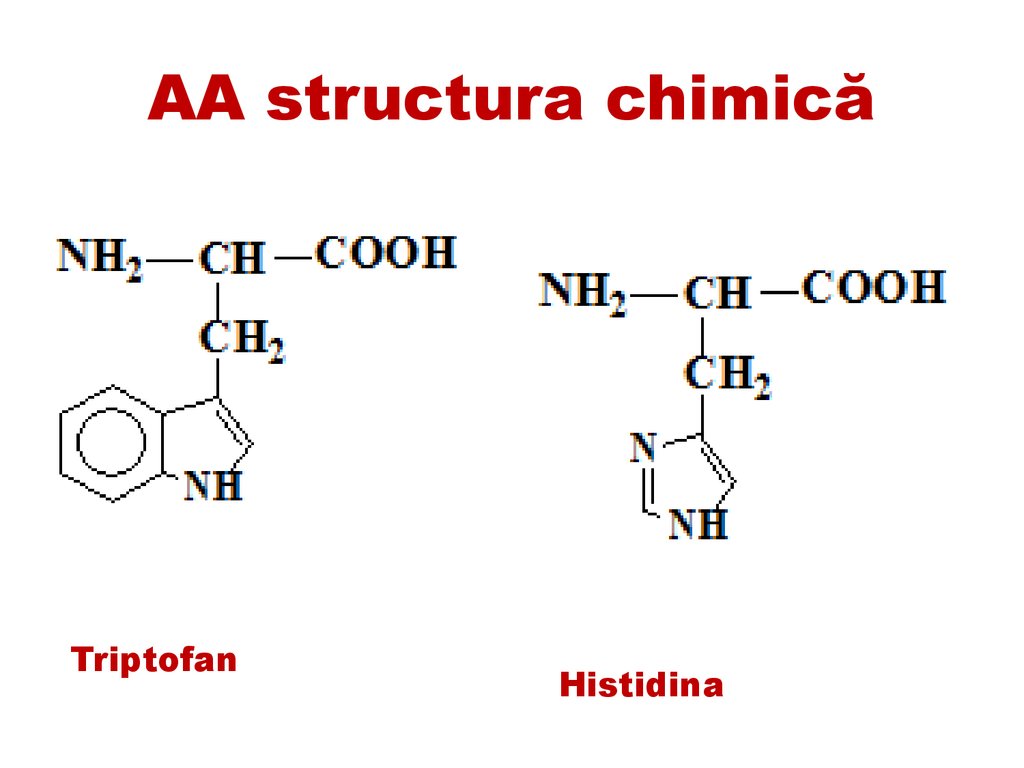
AA structura chimicăTriptofan
Histidina
53.
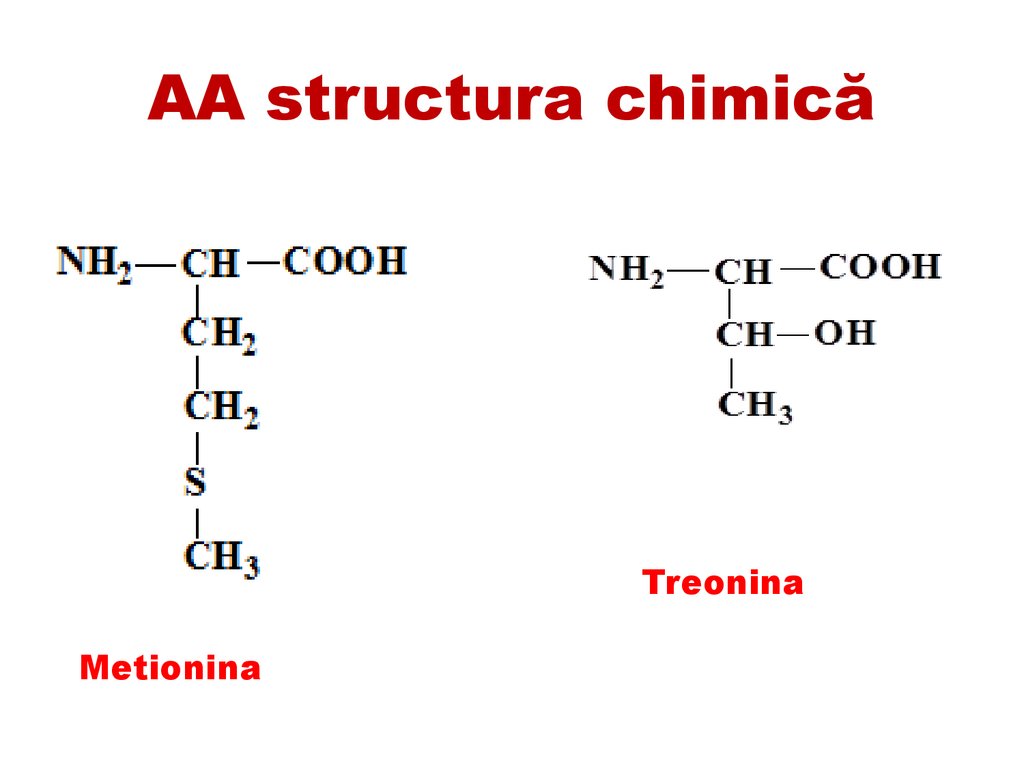
AA structura chimicăTreonina
Metionina
54.
AA structura chimicăIzoleucina
Arginina
Valina
55.
AA structura chimicăLeucina
Lizina
56.
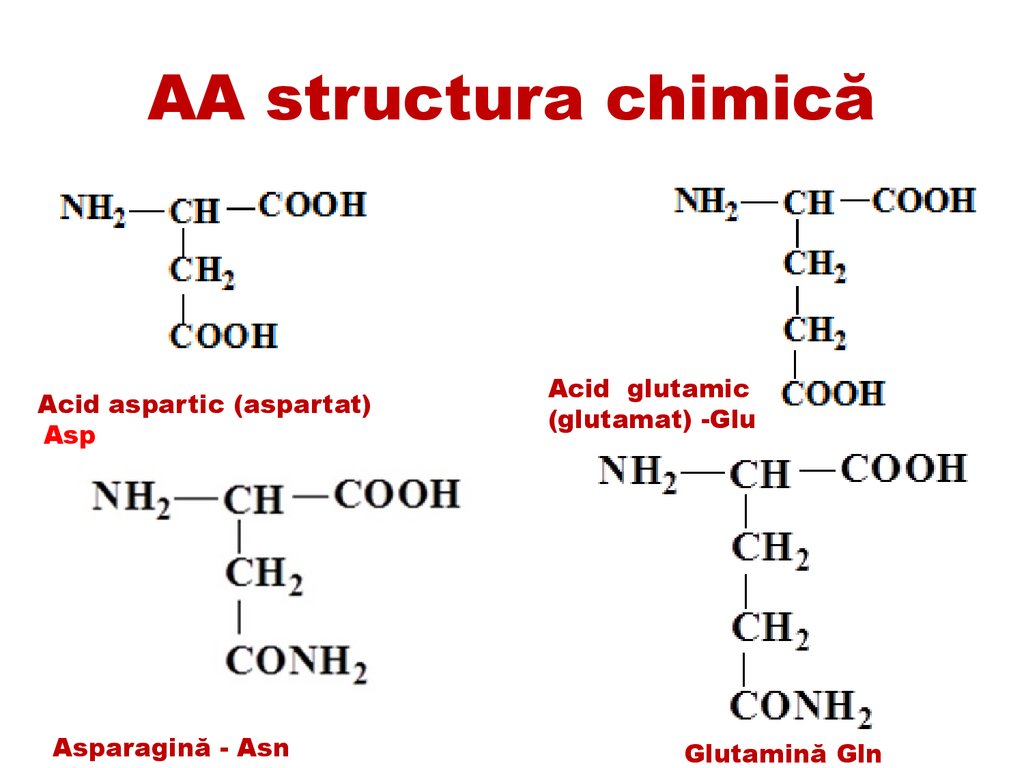
AA structura chimicăAcid aspartic (aspartat)
Asp
Asparagină - Asn
Acid glutamic
(glutamat) -Glu
Glutamină Gln
57.
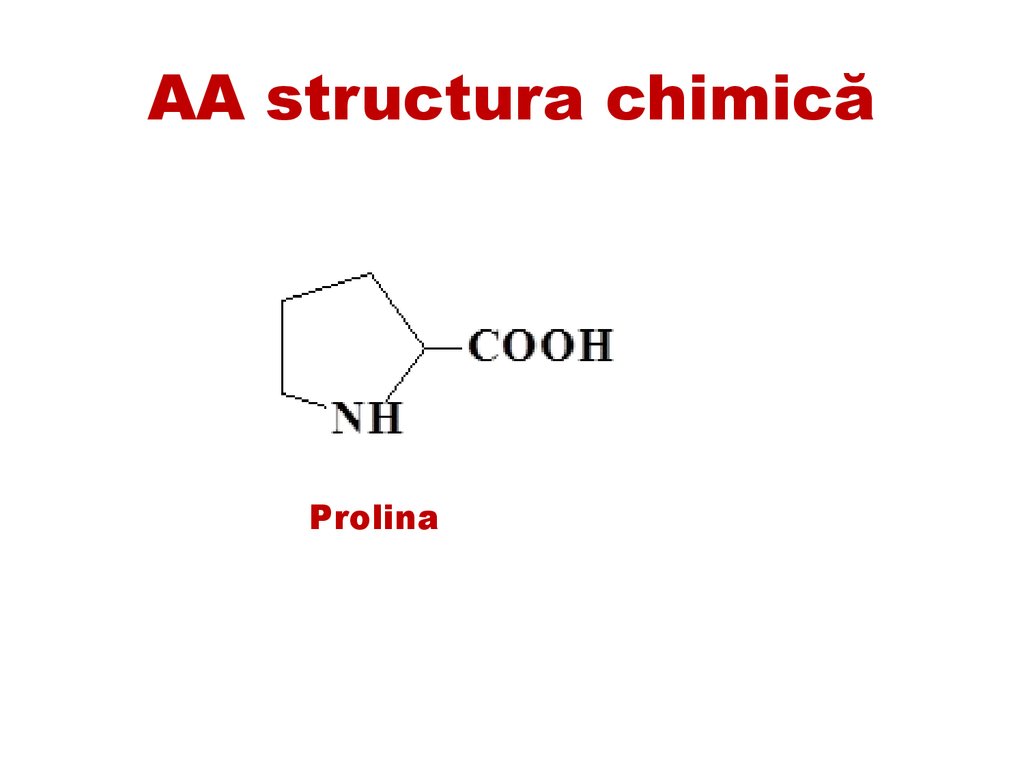
AA structura chimicăProlina
58.
AA nepolari sau hidrofobi59.
AA polari sau hidrofili neutri60.
AA polari sauhidrofili acizi
(cu sarcină
negativă)
AA polari sau
hidrofili bazici
(cu sarcină
pozitivă)
61.
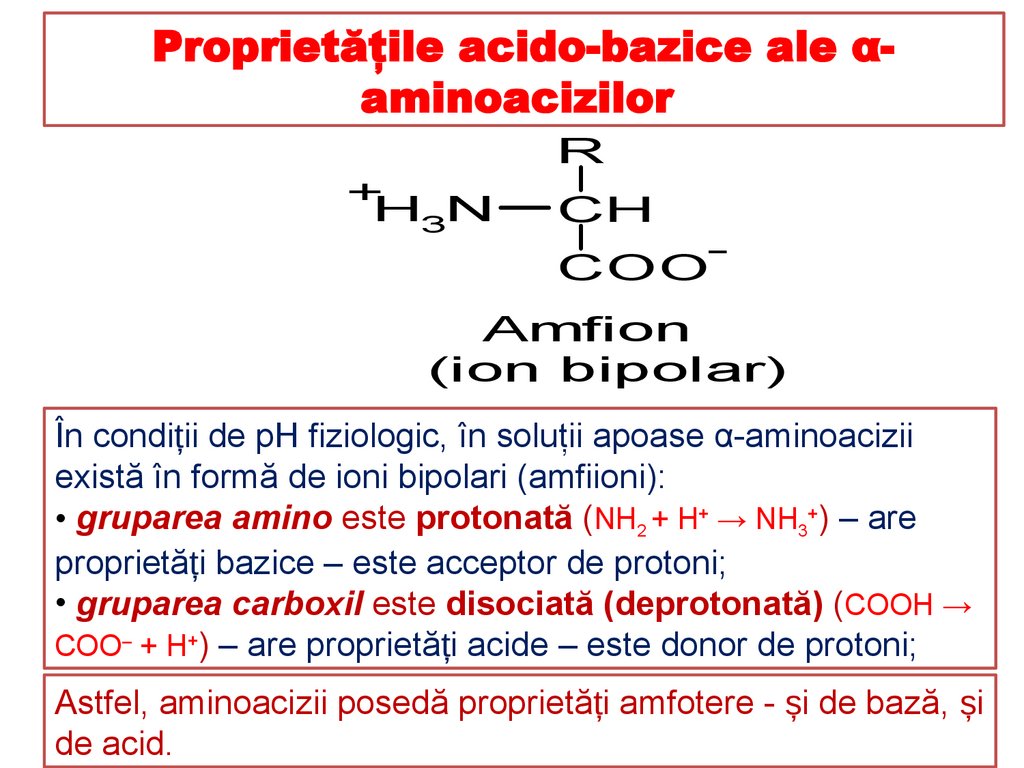
Proprietăţile acido-bazice ale αaminoacizilor+H N
3
R
CH
COO
Amfion
(ion bipolar)
În condiții de pH fiziologic, în soluţii apoase α-aminoacizii
există în formă de ioni bipolari (amfiioni):
• gruparea amino este protonată (NH2 + H+ → NH3+) – are
proprietăți bazice – este acceptor de protoni;
• gruparea carboxil este disociată (deprotonată) (COOH →
COO‒ + H+) – are proprietăți acide – este donor de protoni;
Astfel, aminoacizii posedă proprietăți amfotere - și de bază, și
de acid.
62.
Sarcina α-AA1 .sarcina este determinată de:
prezența grupelor carboxil și amino în componen ța radicalului
a) dacă predomină gr. -COO- sarcina este negativă
b) dacă predomină gr.-NH3+ sarcina este pozitivă
c) dacă numărul de grupe carboxil și amino este egală AA nu are sarcină
2. Sarcina este influențată de pH mediului:
La un pH anumit, AA este echilibrat între formele anionică și cationică și există în forma unui ion neutru, bipolar (zwitterion) – aceasta este starea izoelectrică a αAA.
d) AA acizi iși pierd sarcina in mediu acid (aproximativ 3)
e) AA bazici iși pierd sarcina in mediu bazic (aproximativ 8)
c) AA neutri iși pierd sarcina la pH aproximativ = 6
Acest pH este numit punct izoelectric al AA (pI).
Așa dar: Punctul izoelectric reprezinta pH-ul la care sarcina netă a AA este nulă
• La pH=pI solubilitatea AA este minimă
1. În soluție cu pH mai acid decât pI AA este protonat și există în formă de cation (+);
2. În soluție cu pH mai bazic decât pI, AA este deprotonat și există în formă de anion (‒)
• Datorită capacităţii lor de a disocia ca anioni sau cationi, AA se pot deplasa sub acţiunea unui câmp electric, astfel:
- Astfel AA încărcați pozitiv (cationi) migrează spre catod (electrod încărcat negativ),
- AA incarcați negativ (anioni) migrează spre anod (electrod încarcat pozitiv)
- AA aflați în starea lor izoelectrică nu migrează în câmpul electric
63.
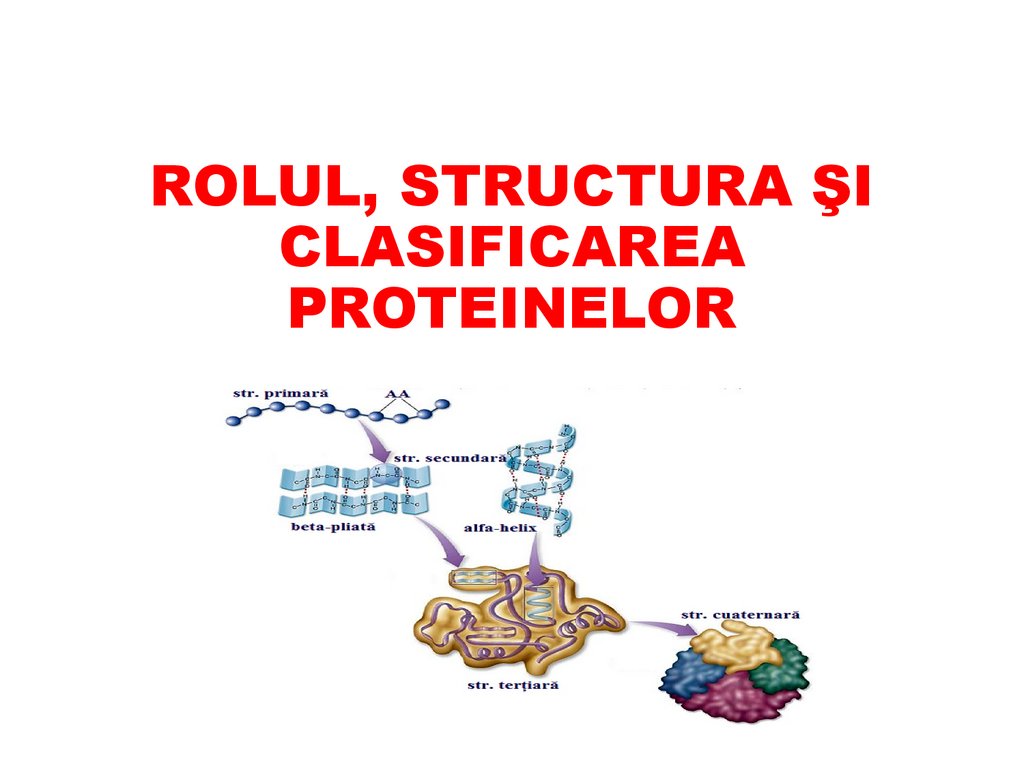
ROLUL, STRUCTURA ŞICLASIFICAREA
PROTEINELOR
64.
OBIECTIVE1. Rolul biologic al proteinelor.
2. Nivelurile de organizare structural-funcțională a
moleculei proteice: structura primară, secundară,
terţiară şi cuaternară; caracteristică generală, legăturile
specifice acestor structuri. Metodele de determinare a
compoziției și succesiunii aminoacizilor în lanțul
polipeptidic. Noțiuni despre domeniile structurale.
3. Clasificarea proteinelor.
4. Proteinele simple (albuminele, histonele) - proprietăţile
şi particularităţile structurale. Rolul biologic.
5. Proteinele conjugate: nucleoproteinele, fosfoproteinele,
lipoproteinele,
glicoproteinele,
metaloproteinele,
cromoproteinele
(hemoși
flavoproteinele),
caracteristica lor generală.
6. Proteinele globulare. Hemoglobina – structura şi rolul
biologic.
7. Proteinele
fibrilare:
colagenul
și
elastina
–
particularităţile componenţei aminoacidice şi structurale.
65.
ROLUL PROTEINELOR• structurală – formează structurile celulare, ale țesuturilor și
organelor (colagenul, elastina)
• catalitică – enzimele catalizează reacțiile chimice în
organism (amilaza, lipaza, pepsina)
• reglatoare – hormonii reglează funcțiile la nivel de celule,
țesut, organ și organism (insulina, hormonul paratiroid)
• de transport – proteinele transportă diferiți compu și în
sânge, prin membrane etc (albumina, transferina,
ceruloplasmina)
• de menținere a presiunii oncotice a sângelui (albumina)
• contractilă – asigură contracția musculară (actina, miozina)
• de protecție – imunoglobulinele asigură protec ția de
organisme sau substanțe străine
66.
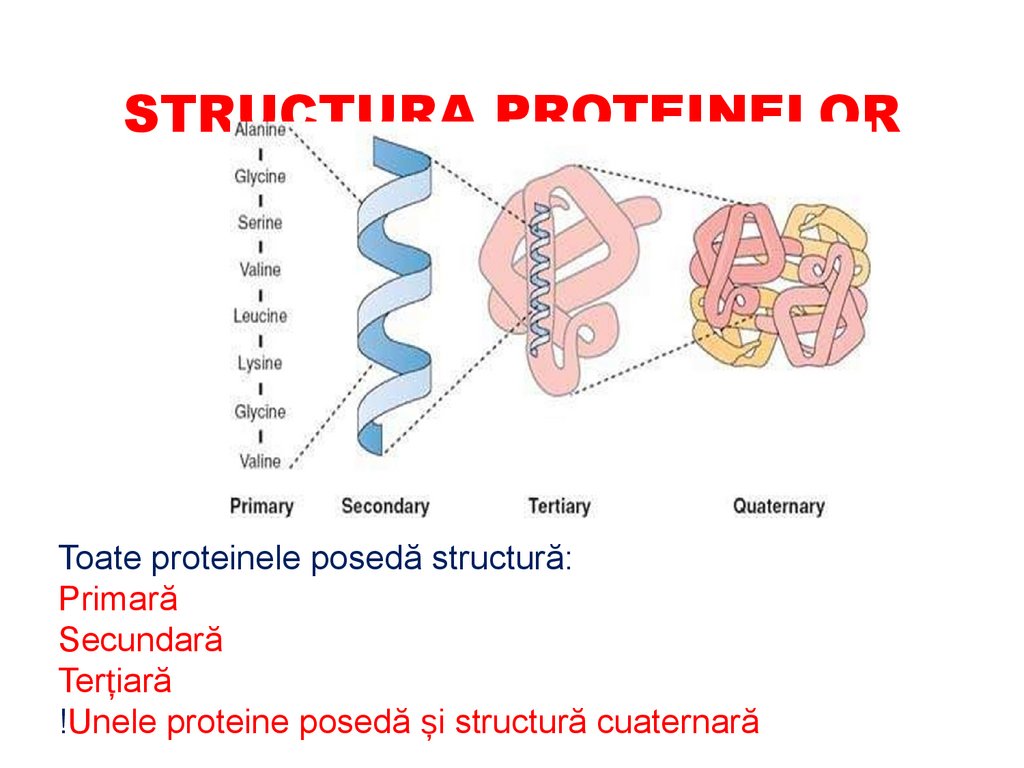
STRUCTURA PROTEINELORToate proteinele posedă structură:
Primară
Secundară
Terțiară
!Unele proteine posedă și structură cuaternară
67.
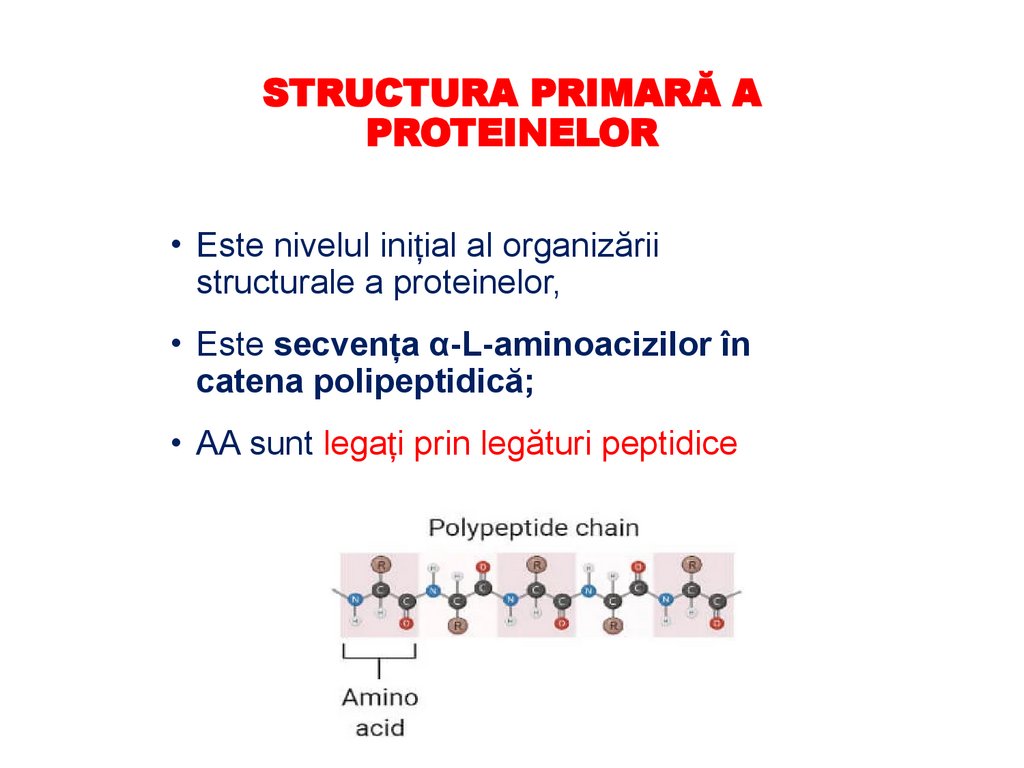
STRUCTURA PRIMARĂ APROTEINELOR
• Este nivelul inițial al organizării
structurale a proteinelor,
• Este secvența α-L-aminoacizilor în
catena polipeptidică;
• AA sunt legați prin legături peptidice
68.
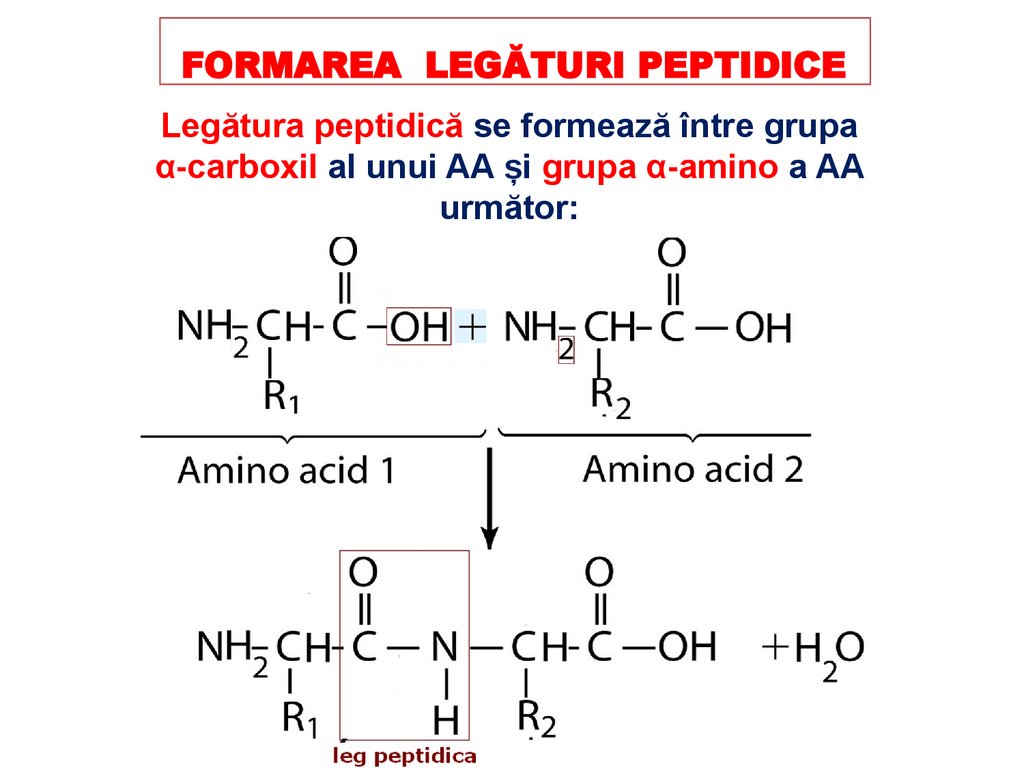
FORMAREA LEGĂTURI PEPTIDICELegătura peptidică se formează între grupa
α-carboxil al unui AA și grupa α-amino a AA
următor:
69.
PEPTIDE ȘI PROTEINE1.
Lanțurile ce conțin:
‒
de la 2 până la 10 aminoacizi se numesc oligopeptide:
2 aminoacizi - dipeptidă;
3 aminoacizi- tripeptidă; etc.
• până la 50 aminoacizi se numesc polipeptide
• mai mult de 50 aminoacizi se numesc proteine
2.
Aminoacizi sunt uniți prin legături peptidice
70.
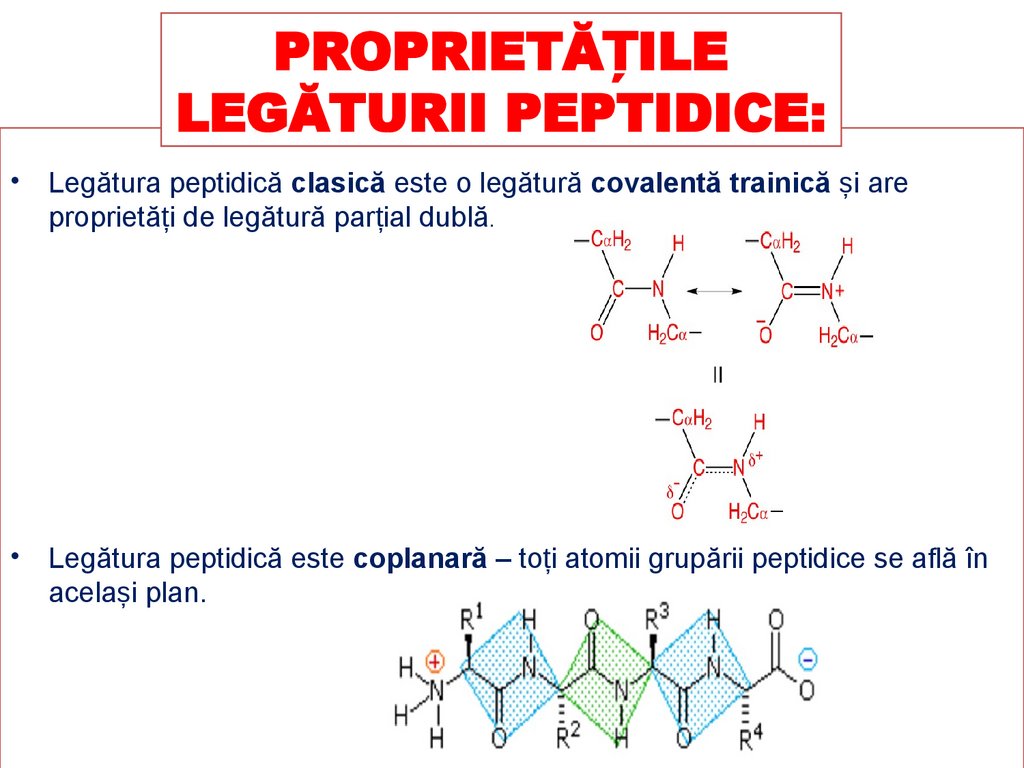
PROPRIETĂȚILELEGĂTURII PEPTIDICE:
• Legătura peptidică clasică este o legătură covalentă trainică și are
proprietăți de legătură parțial dublă.
• Legătura peptidică este coplanară – toți atomii grupării peptidice se află în
același plan.
71.
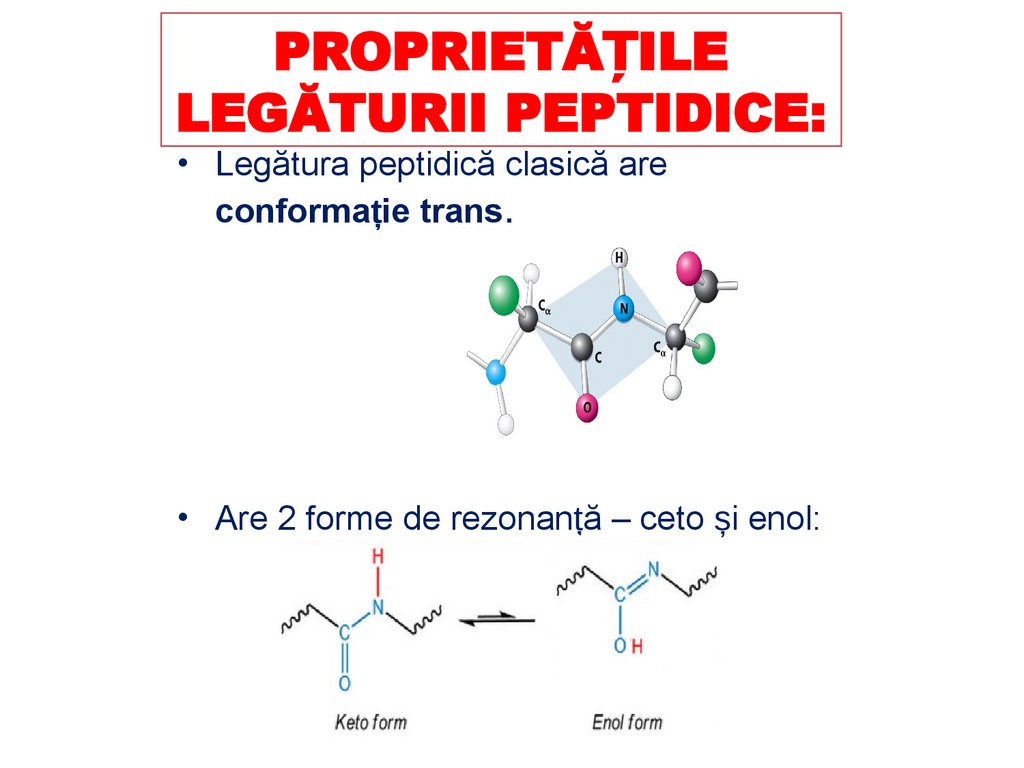
PROPRIETĂȚILELEGĂTURII PEPTIDICE:
• Legătura peptidică clasică are
conformație trans.
• Are 2 forme de rezonanță – ceto și enol:
72.
PROPRIETĂȚILELEGĂTURII PEPTIDICE:
• Fiecare legătură peptidică clasică este capabilă să
formeze 2 legături de hidrogen cu alți atomi
polari.
• Prolina formează
legătură peptidică atipică:
73.
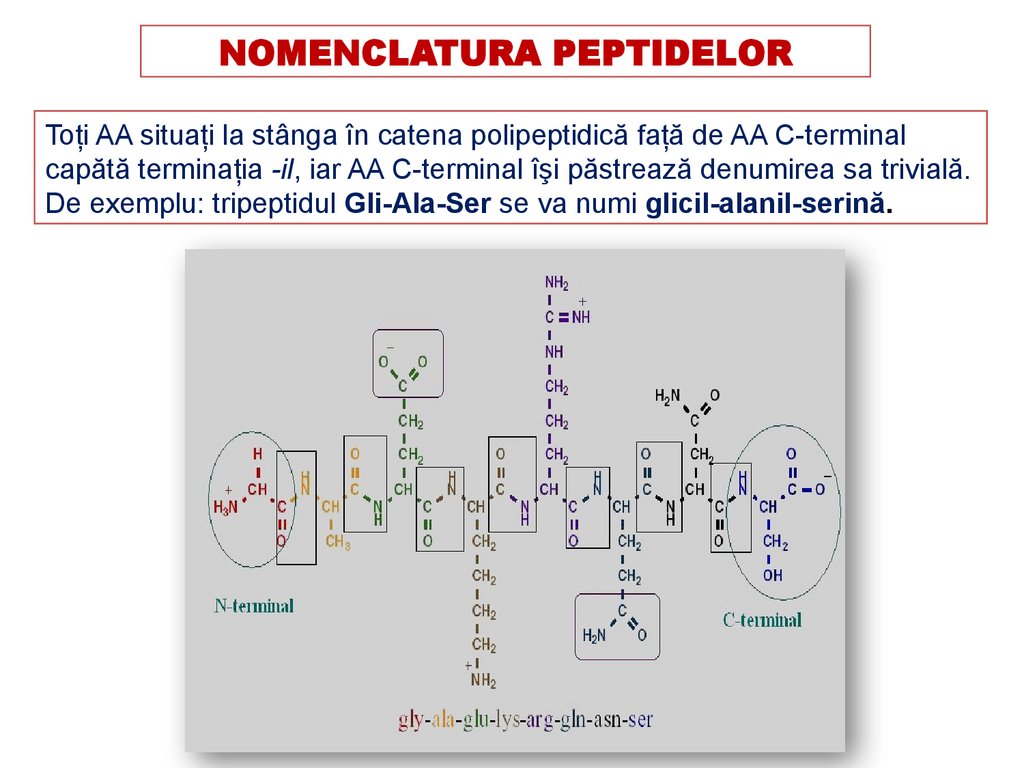
NOMENCLATURA PEPTIDELORToţi AA situaţi la stânga în catena polipeptidică faţă de AA C-terminal
capătă terminaţia -il, iar AA C-terminal îşi păstrează denumirea sa trivială.
De exemplu: tripeptidul Gli-Ala-Ser se va numi glicil-alanil-serină.
74.
STRUCTURA PRIMARĂA PROTEINELOR
• Este determinată genetic de către gena din ADN
care codifică succesiunea AA în catenă printr-o
succesiune de codoni
• Succesiunea AA în structura primară determină
nivelurile ulterioare de organizare structurală –
secundară, terțiară și cuaternară și subsecvent
realizare funcției
75.
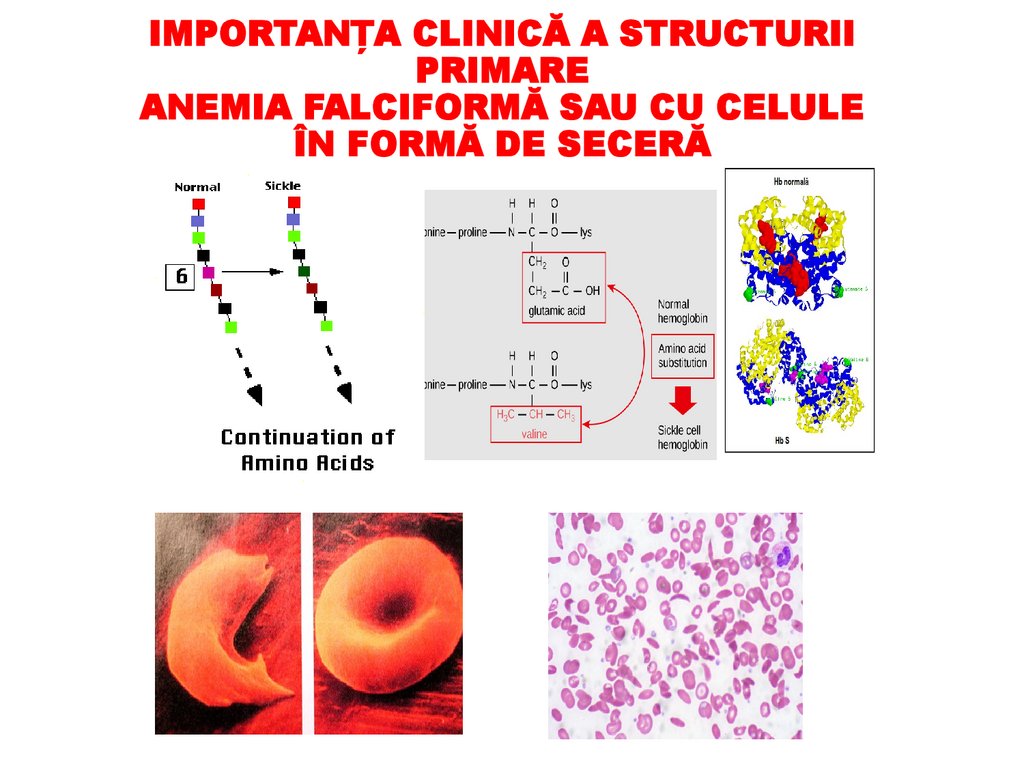
IMPORTANȚA CLINICĂ A STRUCTURIIPRIMARE
ANEMIA FALCIFORMĂ SAU CU CELULE
ÎN FORMĂ DE SECERĂ
76.
Determinarea structuriiprimare
• 2 etape:
• A. determinarea compoziției AA
• B. determinarea succesiunii AA
77.
Determinareacompoziției AA în
proteină
1. Hidroliza acidă completă (fierberea proteinei în soluţie de acid
clorhidric)
2. prin cromatografie are loc determinarea fiecărui aminoacid în
hidrolizat
În prezent o astfel de analiză se realizează în mod automat cu ajutorul
unor aparate speciale numite analizatoare de aminoacizi.
78.
Principiile de descifrarea AA N şi C terminal:
La determinarea AA N-terminal se utilizează:
1. -metoda Sandger (cu fluordinitrobenzol)
2. - metoda Edmann (cu fenilizotiocianat)
3. -metoda cu dansyl
4. - metoda enzimatică (cu aminopeptidaza)
Determinarea AA C-terminal se efectuează
prin:
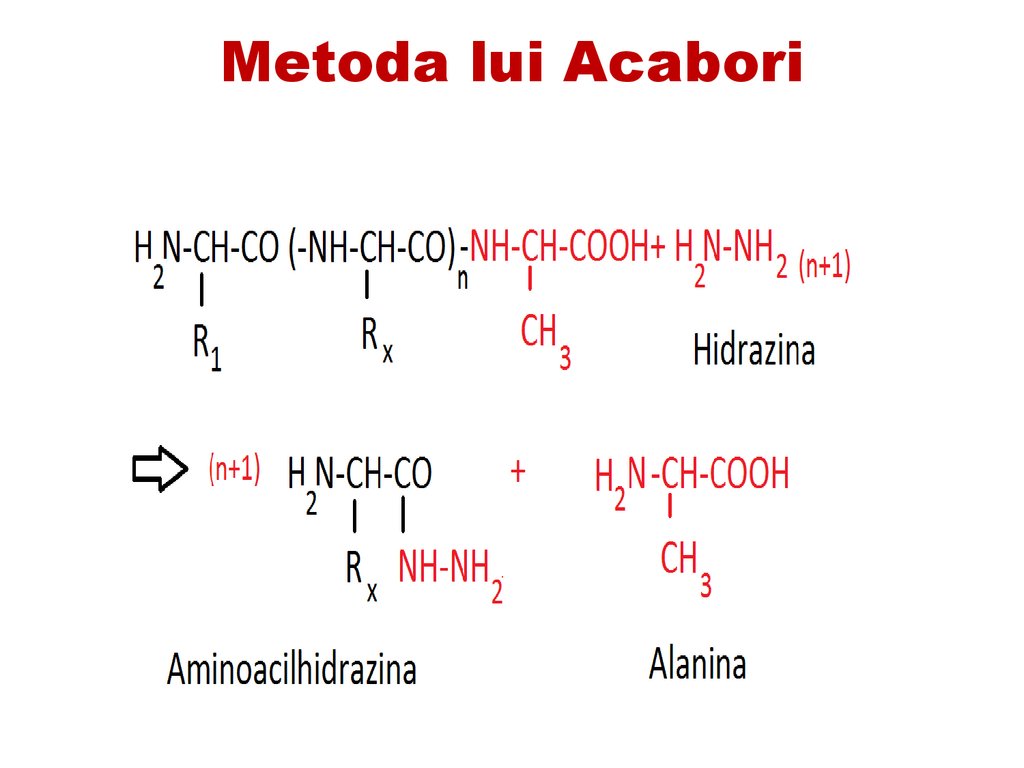
5. metoda chimică cu hidrazina (metoda
Acabori)
6. metoda enzimatică (carboxipeptidază)
7. folosind reducători: NaBH4 sau LiBH4
79.
SUPRAPUNEREADIFERITOR SEGMENTE
DE PEPTIDE
80.
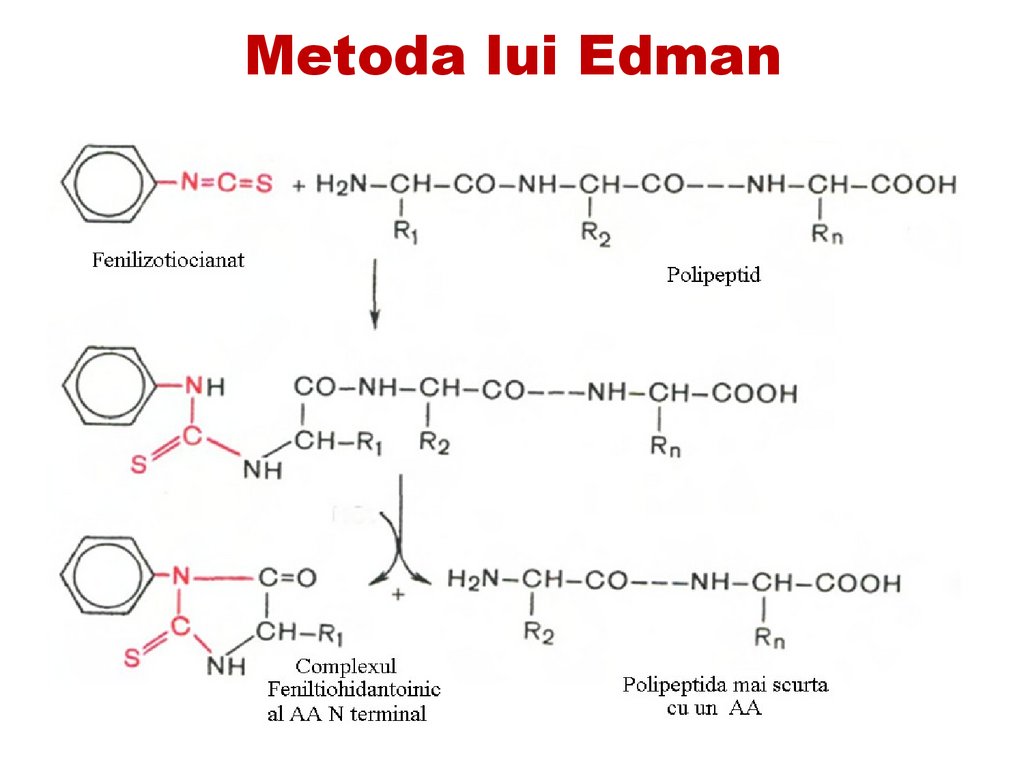
Metoda Edman- constă în interacţiunea aminoacidului Nterminal cu fenilizotiocianat în mediu slab
bazic.
• La
o tratare ulterioară cu un acid slab fără
încălzire
se
produce
scindarea
aminoacidului N-terminal sub formă de
derivat feniltiohidantoinic, care se identifică
în continuare prin metoda cromatografică.
Acest procedeu se repetă de mai multe ori
până la scindarea completă a fragmentului
de peptide.
Metoda Edman s-a dovedit a fi utilă pentru
reproducere într-un aparat automat numit
secvenator cu ajutorul căruia pot fi realizate
40–50 etape de scindare.
81.
Metoda lui Edman82.
Metoda lui Acabori83.
METODA FOLOSINDREDUCĂTORI: NaBH4 sau
LiBH4
84.
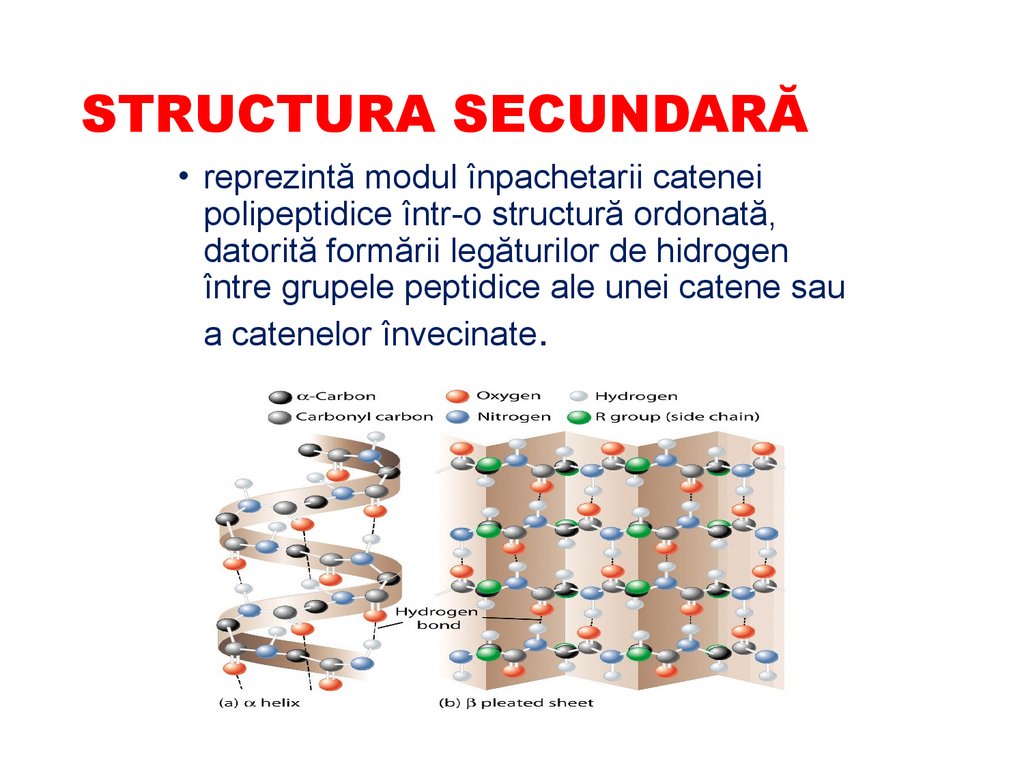
STRUCTURA SECUNDARĂ• reprezintă modul înpachetarii catenei
polipeptidice într-o structură ordonată,
datorită formării legăturilor de hidrogen
între grupele peptidice ale unei catene sau
a catenelor învecinate.
85.
STRUCTURA SECUNDARĂ• După configuraţie
structura secundară se
împarte în:
⮚α-spirală (α-keratina,
Mb)
⮚ β-structură (fibroina
din mătase, βkeratina)
⮚spirala de colagen
86.
1.2.
3.
4.
5.
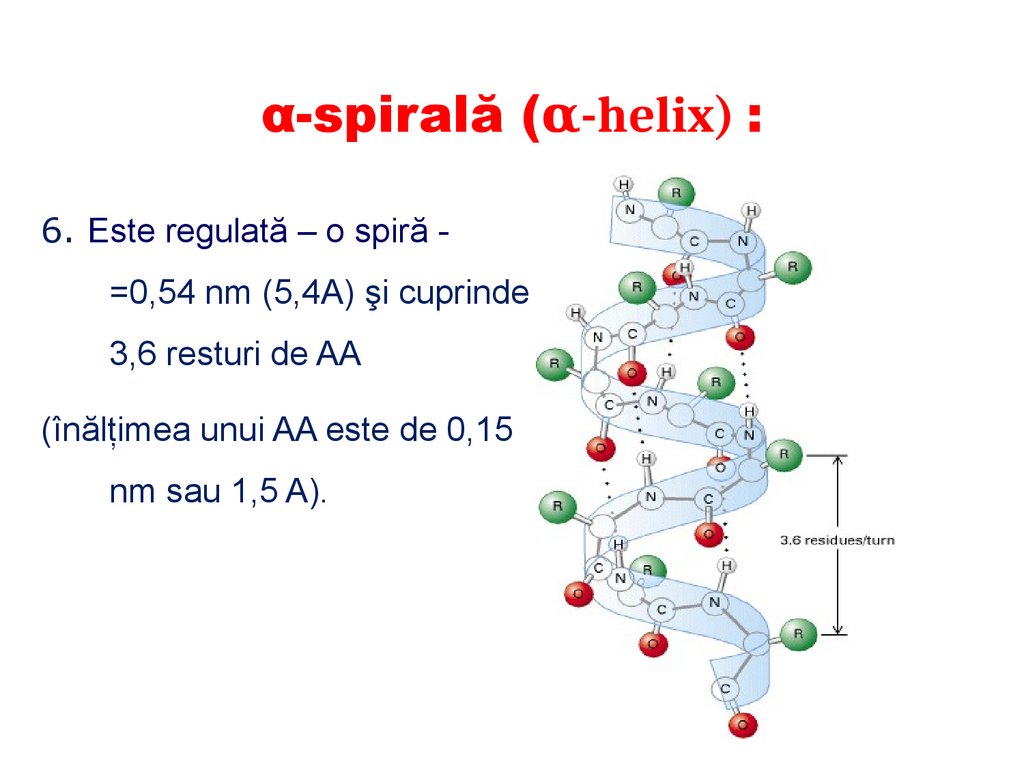
α-spirală (α-helix) :
E formată de o singură catenă
polipeptidică
Este orientată spre dreapta
posedă simetrie elicoidală;
Este stabilizată de legăturile de
hidrogen (se formează între
grupele peptidice ale 1şi ale
celui de al 4 rest de AA);
radicalii laterali ai AA nu
participă la formarea α-spiralei
şi sunt dispuşi în exterior.
87.
α-spirală (α-helix) :6. Este regulată – o spiră =0,54 nm (5,4A) şi cuprinde
3,6 resturi de AA
(înălţimea unui AA este de 0,15
nm sau 1,5 A).
88.
AA CE DIMINUIEAZĂFORMAREA ELICEI:
Prezenţa:
• prolinei (atomul de N nu are H şi nu e capabil să
formeze legături de hidrogen intracatenar – se formează
o îndoire, o încovoiere în lanţ)
• radicalilor voluminoşi (Val, Ile; Asn conferă o strângere
sterică a elicei)
• Ser, Thr – gr. OH pot forma punţi de H – pot servi ca
factori destabilizatori
• Glu, Lyz, His, Arg – apar forţe electrostatice de
respingere sau atragere
89.
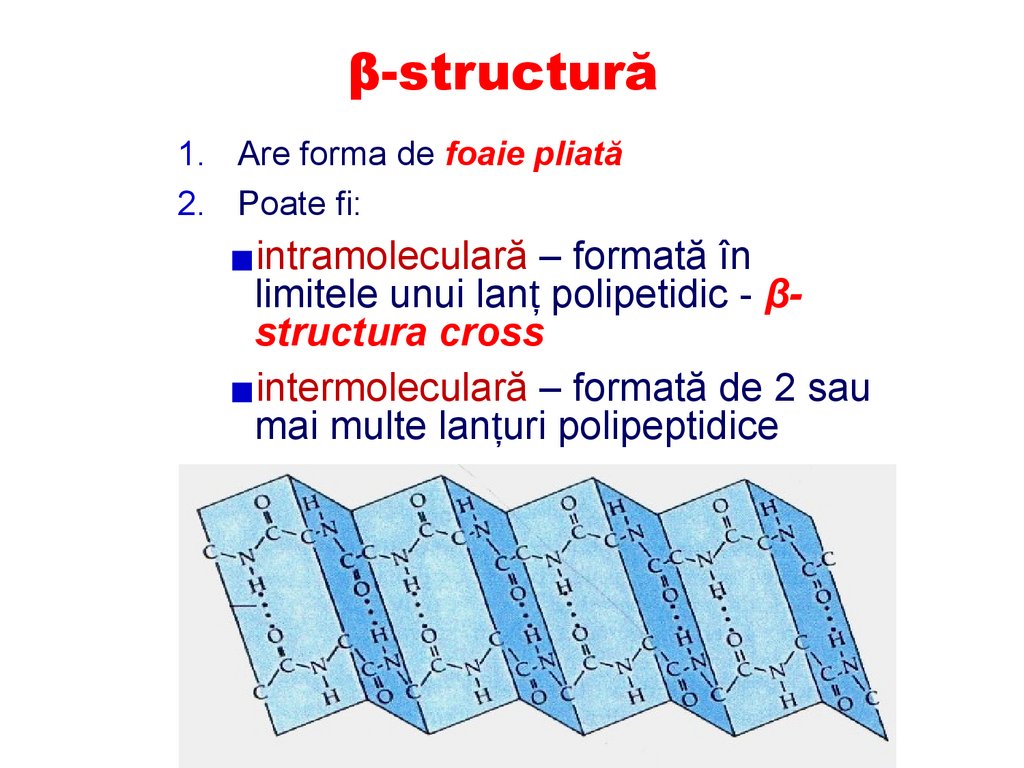
β-structură1. Are forma de foaie pliată
2. Poate fi:
▪intramoleculară – formată în
limitele unui lanț polipetidic - βstructura cross
▪intermoleculară – formată de 2 sau
mai multe lanțuri polipeptidice
90.
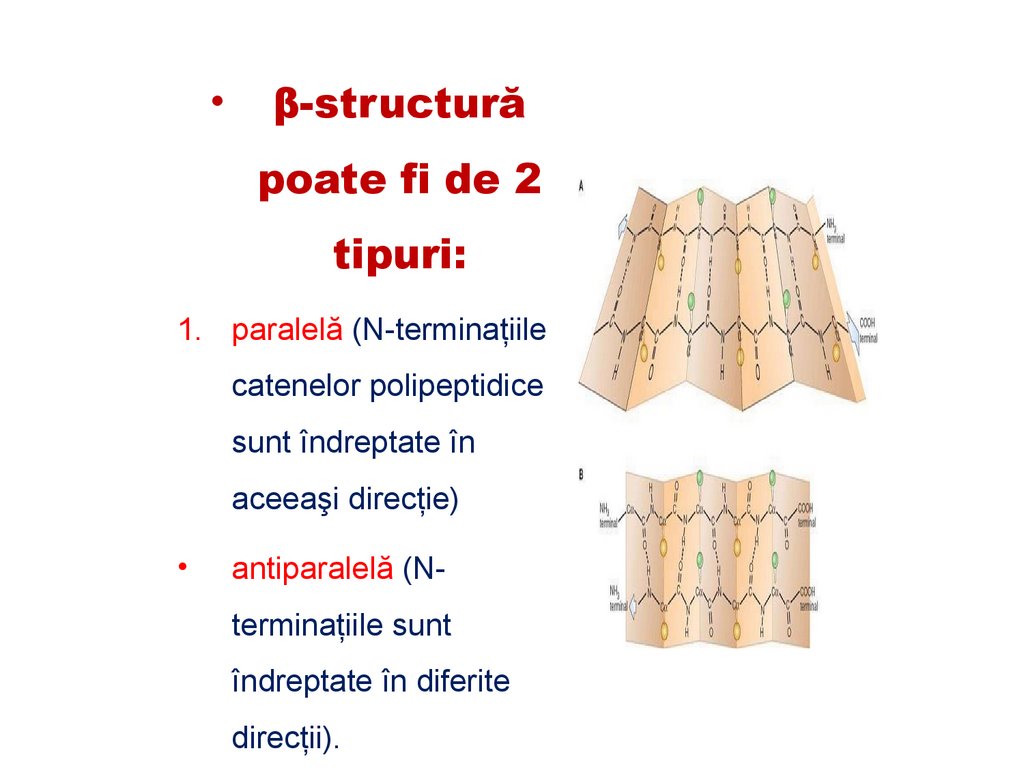
β-structură
poate fi de 2
tipuri:
1. paralelă (N-terminaţiile
catenelor polipeptidice
sunt îndreptate în
aceeaşi direcţie)
antiparalelă (Nterminaţiile sunt
îndreptate în diferite
direcţii).
91.
DEOSEBIRILE DE ALFASPIRALĂ:
• are formă plată
• distanţa între 2 resturi de AA este de 3,5 A
• punţile de H sunt intercatenare dar nu
intracatenare ca la spirală
• radicalii AA se orientează în ambele părţi ale
structurii beta
• Met, Val, Ile – favorizează formarea structurii
plisate, Lys, Ser, Asp - o destabilizează
92.
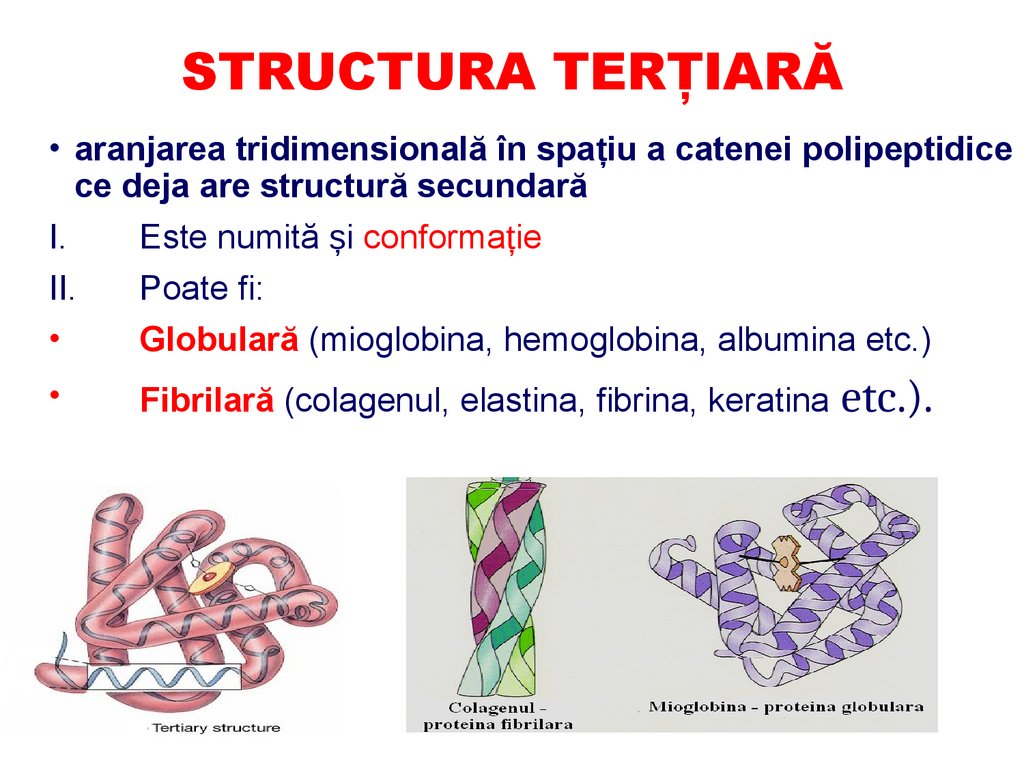
STRUCTURA TERŢIARĂ• aranjarea tridimensională în spațiu a catenei polipeptidice
ce deja are structură secundară
I.
Este numită și conformație
II.
Poate fi:
Globulară (mioglobina, hemoglobina, albumina etc.)
Fibrilară (colagenul, elastina, fibrina, keratina etc.).
93.
LEGĂTURILE CESTABILIZEAZĂ
STRUCTURA TERŢIARĂ:
• se formează datorită interacţiunii dintre
radicalii AA situaţi la distanță (departe unul de
altul)
I. Legăturile covalente:
• disulfidice (Cys-SH + HS-Cys --- Cys-S-S-Cys,
• Esterice (Glu-COOH + HO-Ser ----- Glu-CO-O-Ser
• Pseudopeptidice - Glu-COOH + έH2N-Lys --- Glu-CO-HNLys
94.
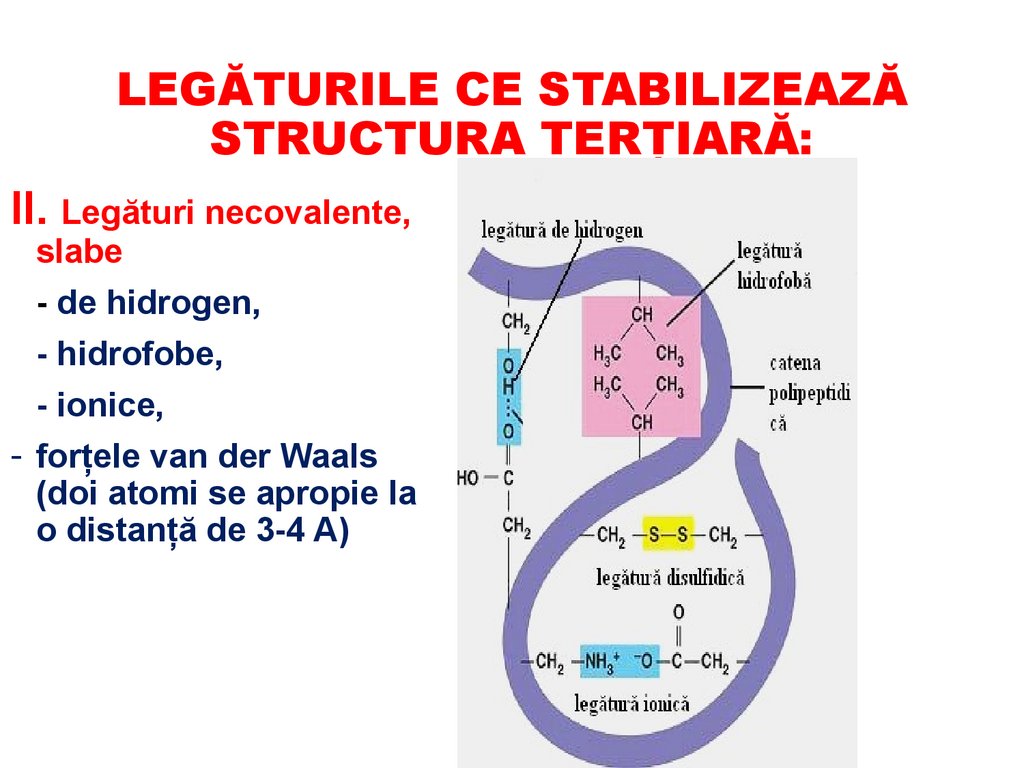
LEGĂTURILE CE STABILIZEAZĂSTRUCTURA TERŢIARĂ:
II. Legături necovalente,
slabe
- de hidrogen,
- hidrofobe,
- ionice,
- forţele van der Waals
(doi atomi se apropie la
o distanţă de 3-4 A)
95.
Anume organizarea în structură tridimensionalăconferă proteinelor activitate biologică.
• După sinteză, proteine se împachetează în structura
secundară, determinată de cea primară, apoi se
asamblează în una din miile de variante posibile în
structura terțiară.
• doar o singură conformație pe care o poate lua proteina
este asociată cu funcție biologică
• FOLDING – aranjarea spaţială corectă a catenei
96.
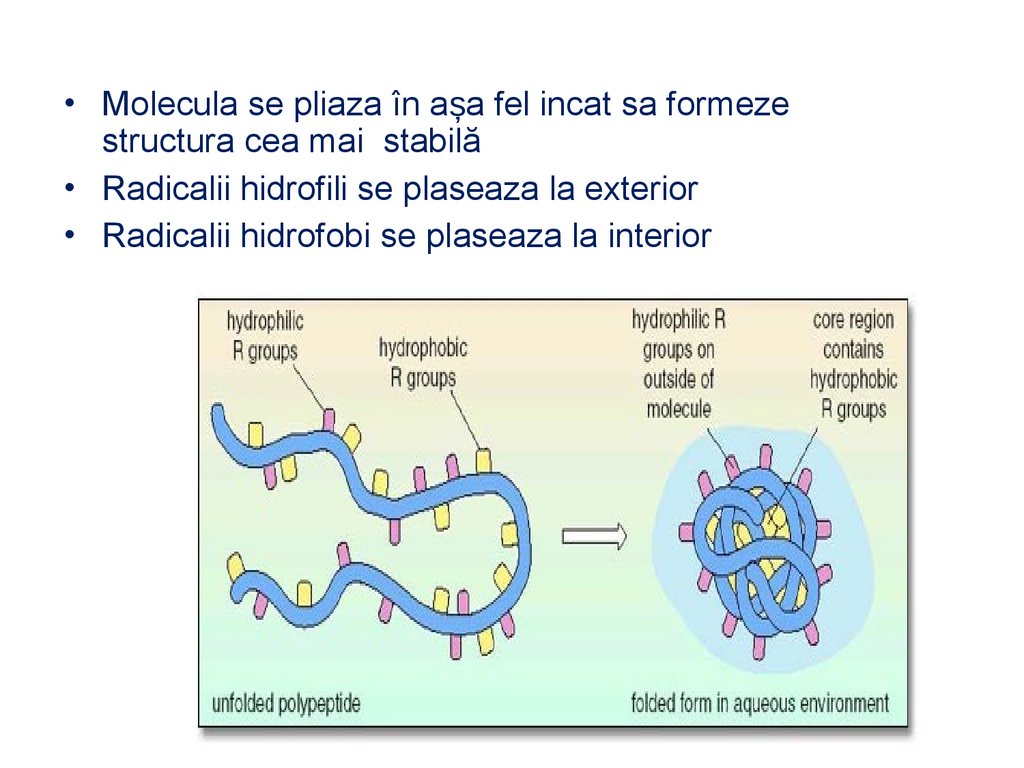
• Molecula se pliaza în așa fel incat sa formezestructura cea mai stabilă
• Radicalii hidrofili se plaseaza la exterior
• Radicalii hidrofobi se plaseaza la interior
97.
STRUCUTRA CUATERNARĂaranjarea spaţială într-o moleculă unică a mai multor
catene polipeptidice
Este specifică doar pentru proteinele oligomerice –
formate din mai multe lanțuri polipeptidice
Catenele individuale se numesc monomeri (protomeri
sau subunități).
• Activitate biologică posedă doar molecula integră oligomerul, protomerii separaţi sunt inactivi.
• Ex.: CPK (2); Hb (4); LDH (4); GDH (6)
98.
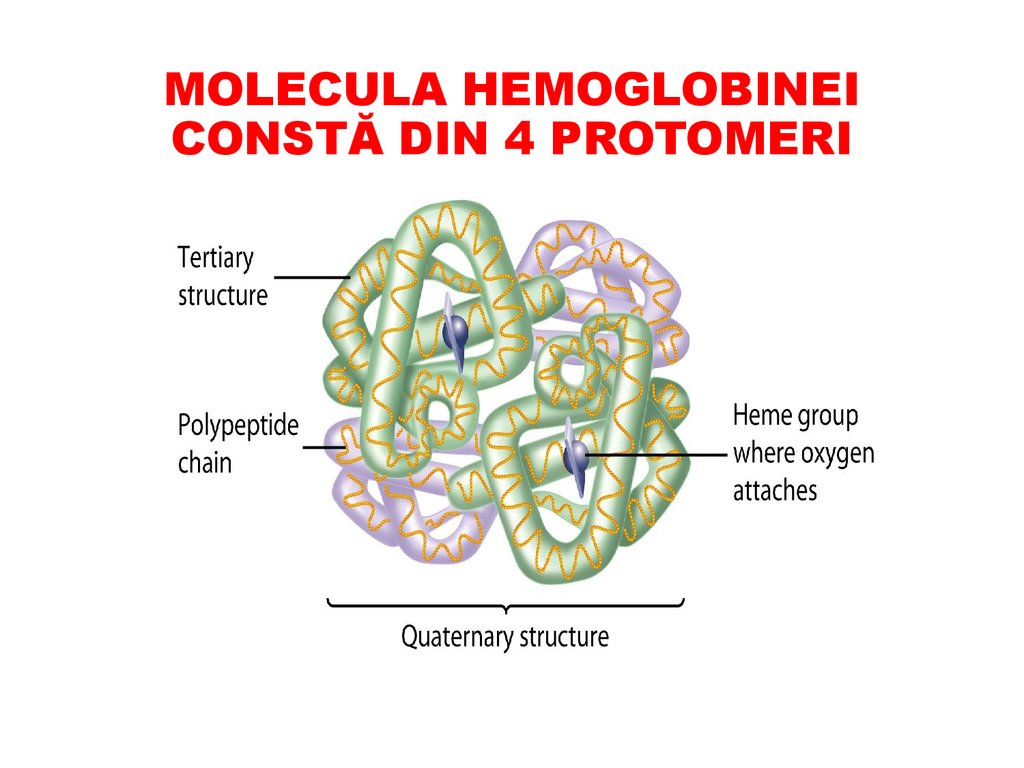
MOLECULA HEMOGLOBINEICONSTĂ DIN 4 PROTOMERI
99.
LEGĂTURILE CE DETERMINĂ ŞISTABILIZEAZĂ STRUCTURA
CUATERNARĂ:
• legăturile necovalente (de hidrogen, forţele Van der
Waals, electrostatice, forţe hidrofobe etc.).
• Cât priveşte legăturile covalente (disulfidice,
pseudopeptidice), ele deasemenea stabilizează aceste
structurii, însă nu determină formarea lor.
• Asamblarea protomerilor în structura cuaternară se
realizează între suprafeţele de contact complementare.
• Interacţiunile prin suprafeţe complementare prezintă
fenomenul de cooperare- primele interacţiuni favorizează
formarea celorlalte
100.
COLAGENULcea mai răspândita proteină din organism (30-35%
din cantitatea totală de proteine).
este o proteină extracelulară, fibrilară, componenta
majoră a ţesutului conjuctiv şi osos.
Rolul:
1.
în ţesutul conjuctiv ea oferă rezistenţă,
2.
în cel osos constituie carcasa organică a
mineralizării.
101.
PARTICULARITĂŢISTRUCTURALE:
1. Fiecare al treilea AA din catenă este
prezentat prin glicină (30%)
2. Fiecare al patrulea - prin Pro şi hidroxiPro
(25%)
3. Conţine 10% Ala
4. Conţine hidroxilizină
5. Conţinut redus de Tyr, absenţa Trp şi Cys
❑Se deosebesc 3 tipuri de lanţuri
peptidice: α1, α2, α3.
❑α1 prezintă 5 subtipuri:: α1I, α1II,
α1III, α1IV, αV
❑ Prin combinarea lor se formează
diverse tipuri de colagen.
102.
(STRUCTURA PRIMARĂ ACOLAGENULUI:
prezintă o catenă polipeptidică curbată
alcătuită din circa 1000 AA.
succesiune repetitivă – (Gly-XY)n, unde X şi Y sunt în
majoritatea cazurilor Pro şi hidroxi
Pro
un număr mare de legături peptidice
atipice, formate de grupa imino a Pro şi
hidroxi Pro
103.
PARTICULARITĂŢILE STRUCTURIISECUNDARE:
• α-spirala colagenică (alfa spirală
cu simetrie elicoidală nu se poate
forma din cauza Pro, OH-Pro şi
Gly)
• stabilizată de interacţiuni sterice
între inelele Pro şi hidroxi Pro
• răsucită spre stânga
• mai laxă decât α-spirala clasică: 1
spiră – 3,3 resturi de AA
A. Alfahelix
B.Colagen
helix
104.
PARTICULARITĂŢILESTRUCTURII COLAGENULUI (III)
nu posedă structură terţiară
tipică
3 alfa catene spiralate, răsucite
împreună sub forma unei spirale
comune formează
tropocolagenul
Tropocolagenul - unitatea
structurală a colagenului
• este stabilizat de legături de
hidrogen între grupele
peptidice din diferite catene
105.
PARTICULARITĂŢILESTRUCTURII
COLAGENULUI
• Structura cuaternară: aşezarea subunităţilor de
tropocolagen sub formă de trepte, fiecare moleculă fiind
deplasată cu ¼ din lungime faţă de moleculele vecine.
• Monomerii sunt legaţi stabil prin legături covalente
încrucişate inter şi intramoleculare, care le conferă
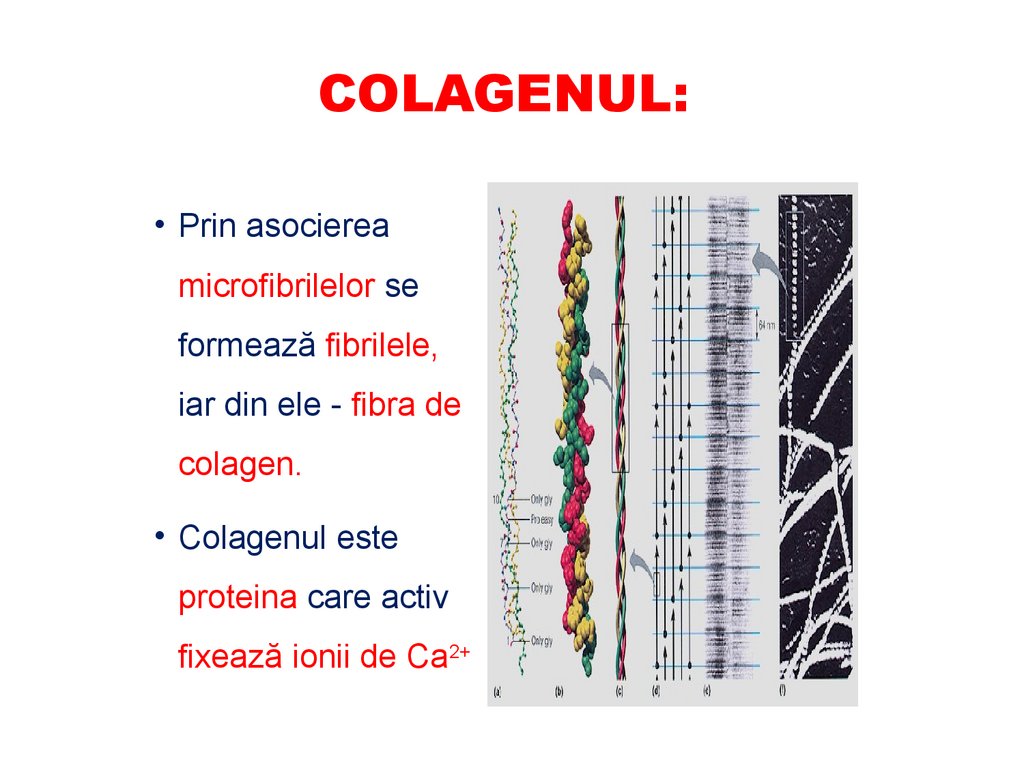
microfibrilelor rezistenţă mecanică.
106.
COLAGENUL:• Prin asocierea
microfibrilelor se
formează fibrilele,
iar din ele - fibra de
colagen.
• Colagenul este
proteina care activ
fixează ionii de Ca2+
107.
CLASIFICAREAPROTEINELOR
❑SIMPLE
❑CONJUGATE
108.
PROTEINELE SIMPLE(HOLOPROTEINE)
Histonele
• localizate în nucleu,
• conţin AA bazici pînă la 30% (Arg,
Lys).
• au sarcina pozitivă,
• sunt legate electrostatic cu AN.
Rolul: reglarea metabolică a activităţii
genomului, funcţie structurală
109.
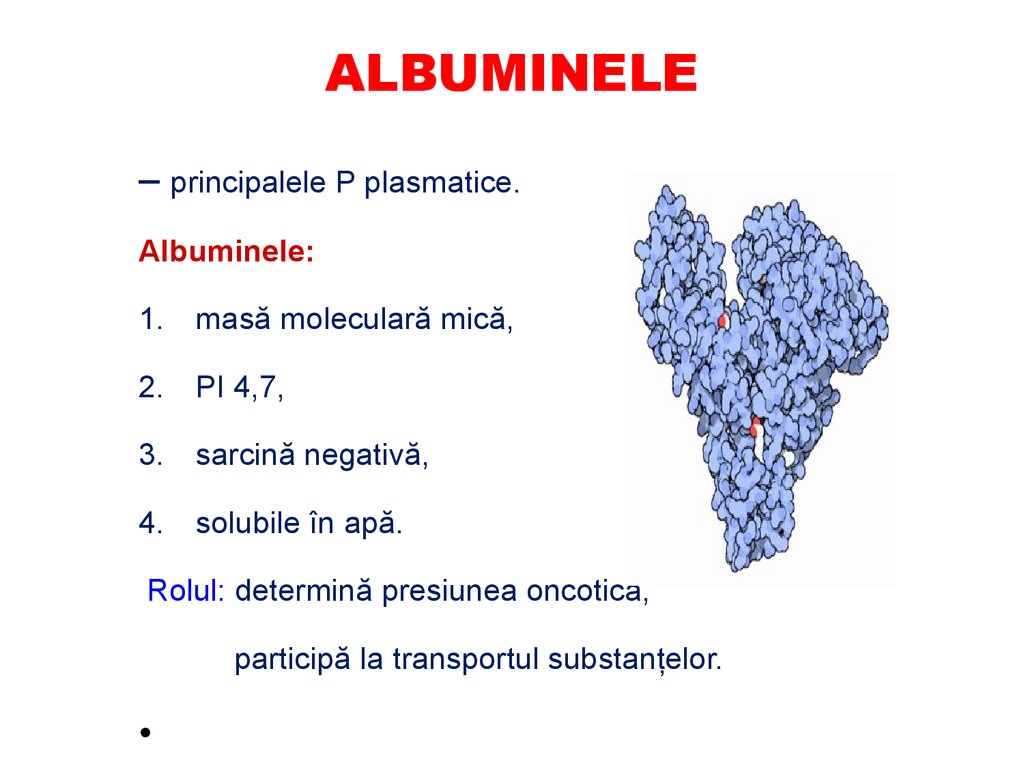
ALBUMINELE– principalele P plasmatice.
Albuminele:
1.
masă moleculară mică,
2.
PI 4,7,
3.
sarcină negativă,
4.
solubile în apă.
Rolul: determină presiunea oncotică,
participă la transportul substanţelor.
110.
PROTEINELE CONJUGATE(HETEROPROTEINE, PROTEIDE):
1. Nucleoproteine
2. Cromoproteine
3. Fosfoproteine
4. Lipoproteine
5. Metaloproteine
6. Glicoproteine
111.
Nucleoproteinele• compuse din proteine şi acizi nucleici.
• Ex.: cromatina; ribosomul
• Componenţa proteică o alcătuiesc histonele, bogate în
Arg şi Lys.
• Rol: stocarea, transmiterea şi exprimarea informaţiei
genetice, biosinteza proteinelor, diviziunea celulară.
112.
CROMOPROTEINELE – compuse din proteină şi parteaneproteică colorată.
Reprezentanţii: hemoproteidele (Mb; Hb),
sistemul de citocromi, catalaza, peroxidaza,
clorofila.
Rolul:
1.
participă în fotosinteză
2.
transportul oxigenului şi CO2
3.
reacţiile de oxido-reducere
4.
senzaţiile de lumină şi culoare
113.
CROMOPROTEINELEMIOGLOBINA
• STRUCTURĂ:
• Mb - alcătuită dintr-un
singur lanţ polipeptidic
de care este legat hemul
prin legături necovalente.
• Rolul: fixează în mod
reversibil O2 din muşchi
(îl preia de la Hb şi îl
cedează MC musculare)
HEMOGLOBINA
• STRUCTURĂ:
• Hb: formată din 4 lanţuri
polipeptidice: 2 alfa şi 2
beta . Fiecare lanţ
polipeptidic este legat de un
hem.
• Rolul:
• Transportul oxigenului
• ca sistem tampon
114.
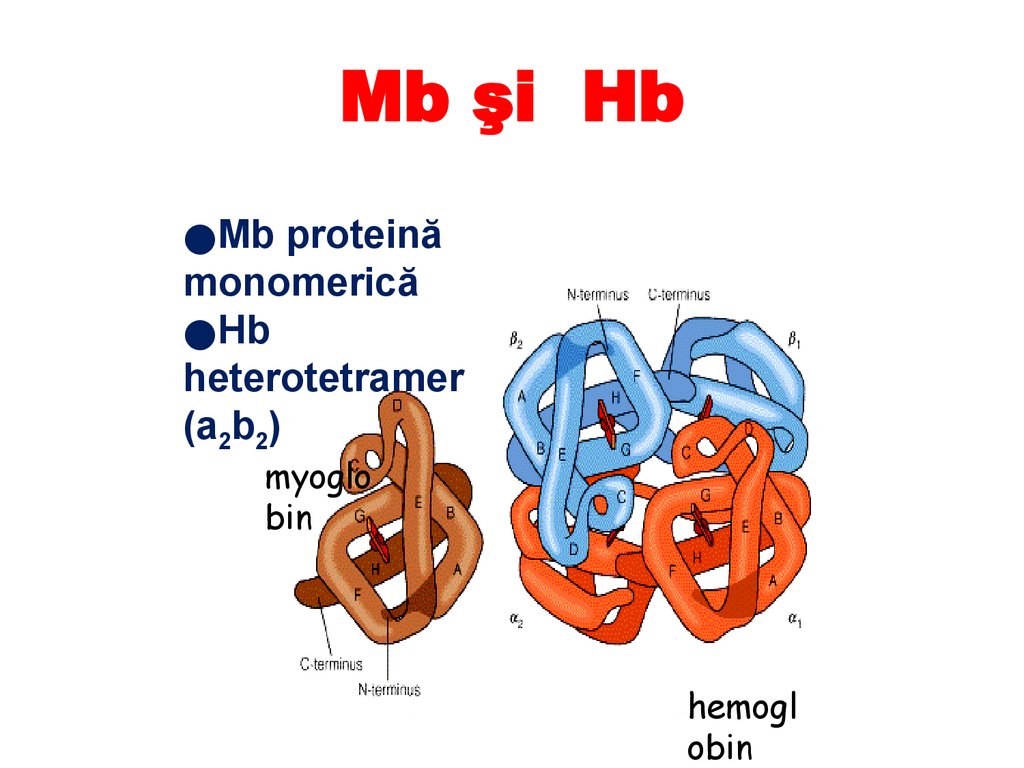
Mb şi Hb●Mb proteină
monomerică
●Hb
heterotetramer
(a2b2)
myoglo
bin
hemogl
obin
115.
FOSFOPROTEINELE:P + acidul fosforic (legate prin legături esterice- de
hidroxiaminoacizi Ser, Tre )
• Reprezentanţi: glicogen fosforilaza; cazeinogenul (proteina
laptelui), vitelina, vitelenina (din gălbenuşul de ou), ihtulina
(din icre de peşte).
• Rolul:
- servesc ca material energetic, plastic în porocesul de
embriogeneză şi creştere postnatală
- alimentar
116.
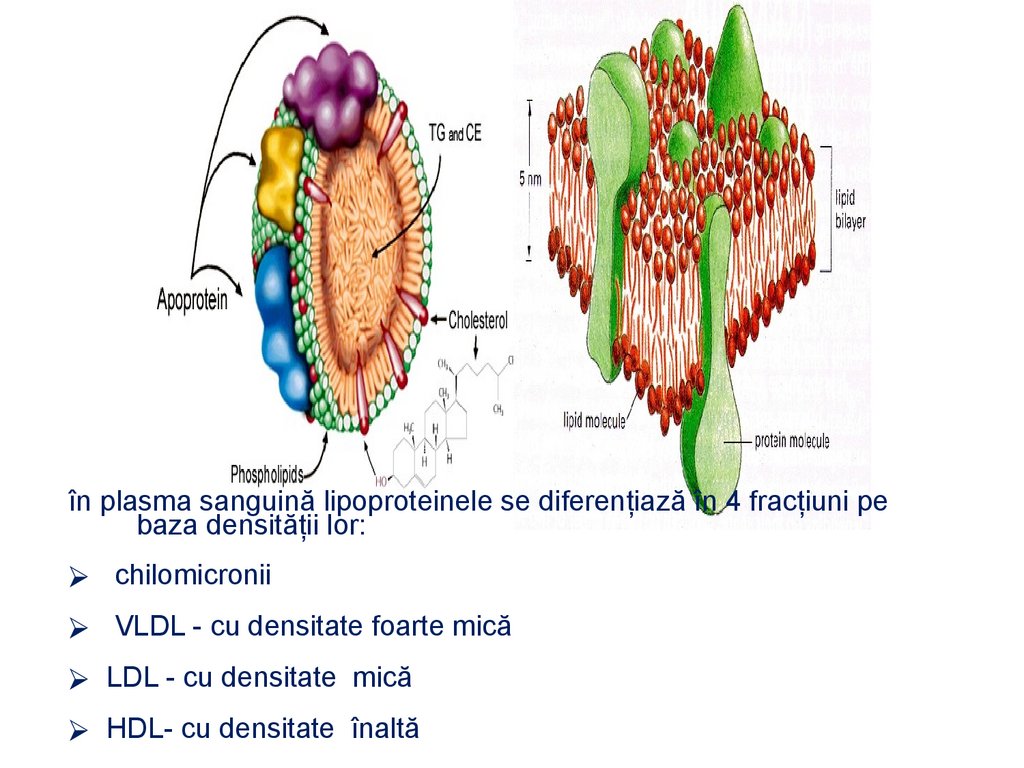
LIPOPROTEINE - proteine + lipide(fosfolipide, acizi graşi liberi,
colesterol)
Rolul:
1.
Reprezintă constituienţi structurali ai celulelor
2.
intervin în permeabilitatea biomembranelor
3.
participă la transportul prin sânge şi limfă a
unor substanţe liposolubile (vitaminelor
liposolubile A, D, E, K, unor hormoni,
medicamente)
4.
furnizează energia
117.
în plasma sanguină lipoproteinele se diferenţiază în 4 fracţiuni pebaza densităţii lor:
⮚ chilomicronii
⮚ VLDL - cu densitate foarte mică
⮚ LDL - cu densitate mică
⮚ HDL- cu densitate înaltă
118.
Glicoproteinele – proteine +glucidică (glucozamină, galactozamină, a.
hialuronic, glucozaminglicani)
Rolul:
1.
Receptori
2.
sunt constituienţi plastici ai celulei,
intră în componenţa membranelor
biologice
3.
au rol de protecţie a mucoaselor
gastrointestinale, ale aparatului
respirator şi urogenital faţă de acţiunea
enzimelor proteolitice, a unor compuşi
chimici sau agenţi mecanici
4.
sunt componente specifice de grup
119.
METALOPROTEINE: proteină+metal (Fe, Cu, Zn )
• Feritina – conţine Fe, localizată în ficat, constituie rezerva,
depozitul de Fe din organism
• Transferina – conţine Fe, Cu şi Zn, se află în plasma
sanguină, transportă Fe în oprganism
• Ceruloplasmina – conţine Cu, se află în plasma sanguină,
transportor al Cu în organism şi acţiune oxidazică asupra
vitaminei C.
120.
PROTEINELE FIXATOARE DE Ca2+sunt proteine ce posedă afinitate majoră de
legare a ionilor de Ca2+
conţin resturi de γ carboxiglutamat de care se
fixează ionii de Ca2+
γ carboxiglutamatul se formează din Glu sub
acţiunea enzimei, care ca coenzimă are vitamina
K.
Exemple:
1. calmodulina – o proteină mică ce posedă patru
locusuri de fixare pentru ionii de Ca2+
2. factorii coagulării sângelui(II,VII,IX, X)
3. fosfolipaza C
4. Colagenul
5. Ca-ATP-aza




























































 Лингвистика
Лингвистика



