Похожие презентации:
Периодическая система Д.И. Менделеева
1.
Периодическая система Д.И.Менделеева
2.
Д.И.Менделеев3.
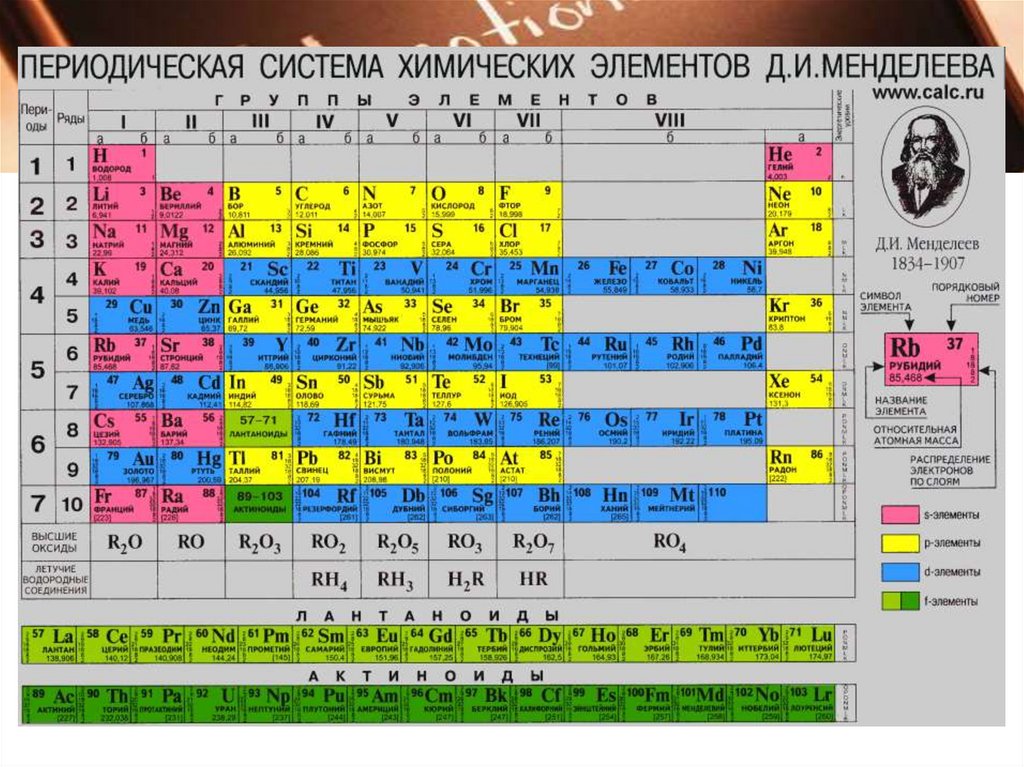
Каждый химический элемент занимаетопределенное место в таблице (клетку), где
приведены его характеристики
4.
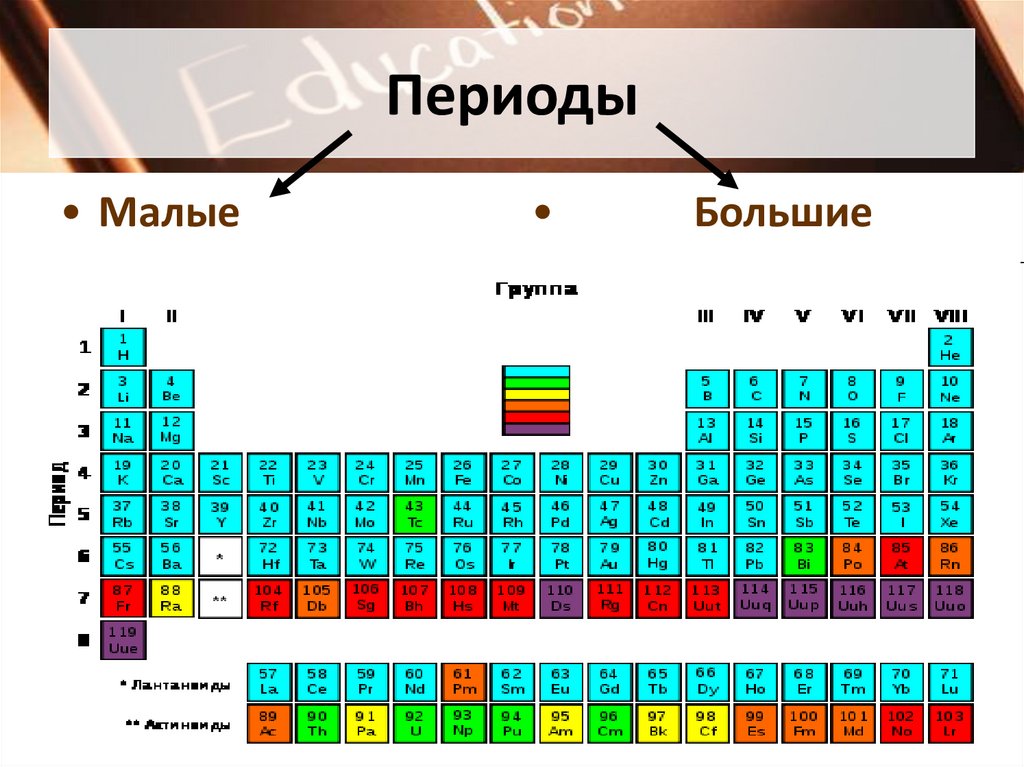
Период• Горизонтальный ряд элементов,
расположенных в порядке возрастания
заряда ядра их атомов
Номер периода показывает
число занятых электронами
энергетических уровней
Каждый период начинается
элементом, атомы которого
образуют активные металлы
и заканчивается элементом,
атомы которого образуют
благородные газы
5.
Периоды• Малые
Большие
6.
7.
Группы• Это вертикальный столбец элементов,
атомы которых имеют одинаковое
количество валентных электронов.
Номер группы показывает
число валентных электронов
в атомах
О 2е, 6е; 32 S 2e,8e,6e
8
8.
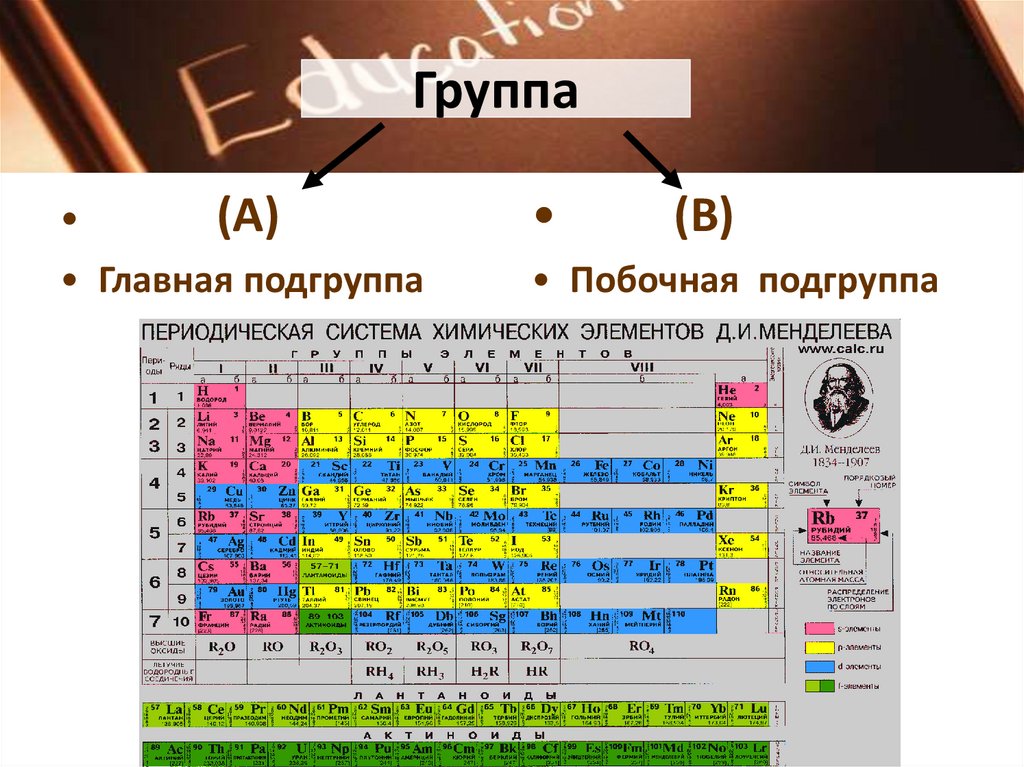
Группа(А)
• Главная подгруппа
(В)
• Побочная подгруппа
9.
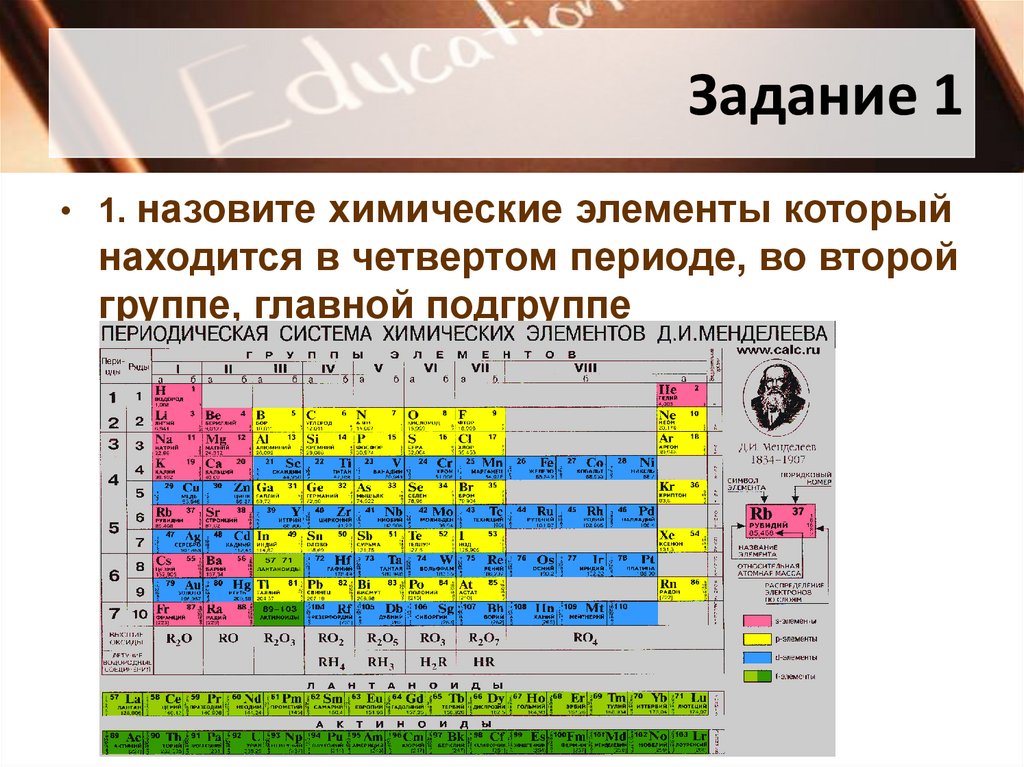
Задание 1• 1. назовите химические элементы который
находится в четвертом периоде, во второй
группе, главной подгруппе
10.
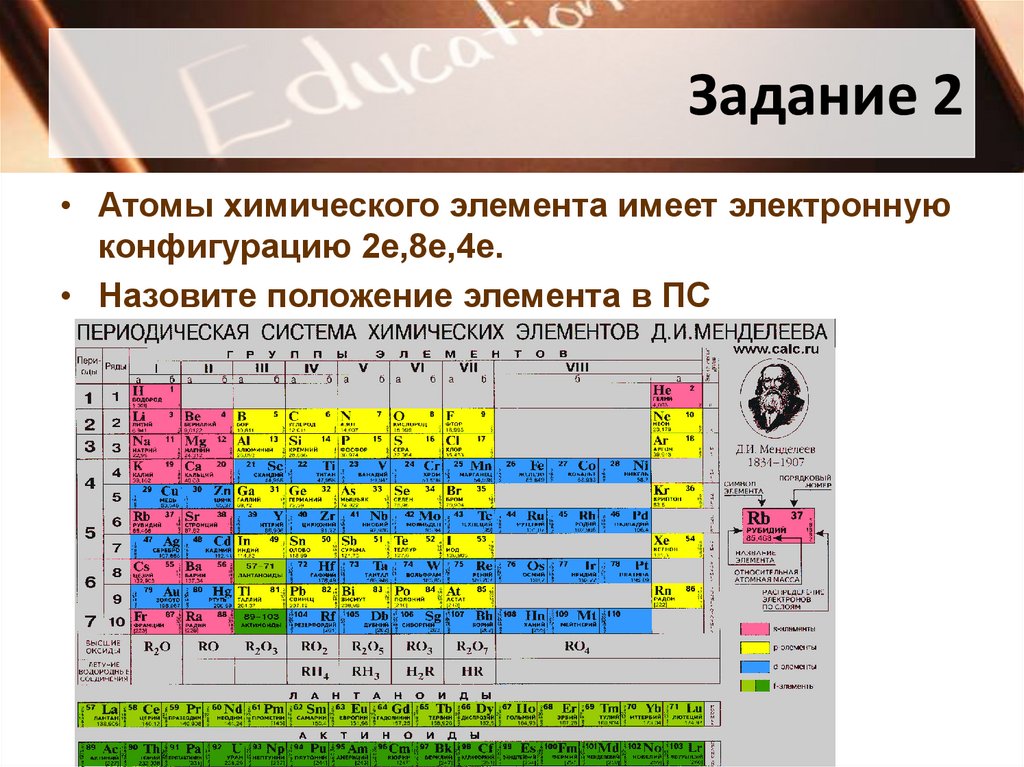
Задание 2• Атомы химического элемента имеет электронную
конфигурацию 2е,8е,4е.
• Назовите положение элемента в ПС
11.
Задание 3• Охарактеризуйте элемент № 16
• Положение в ПС
• Строение атома
• Схема строения атома
12.
• Как изменяются свойства атомовхимических элементов в группах и в
периодах Периодической системы?
13.
В периоде14.
В периоде• В периодах слева направо:
1. Заряд ядер атомов увеличивается;
2. число занятых электронами энергетических уровней в
атомах не изменяется;
3. число электронов на внешнем энергетическом уровне атомов
(валентных) увеличивается от 1 до 8;
4. радиус атомов уменьшается;
5. прочность связи электронов внешнего уровня (валент
ных) с ядром увеличивается;
6. металлические свойства атомов элементов убывают;
7. неметаллические свойства атомов элементов усиливаются.
8. Начало каждого периода совпадает с началом заполнения нового
электронного слоя.
9. Каждый период начинается элементом, атомы которого
образуют вещество — металл, а заканчивается элементом,
атомы которого образуют вещество — благородный газ.
15.
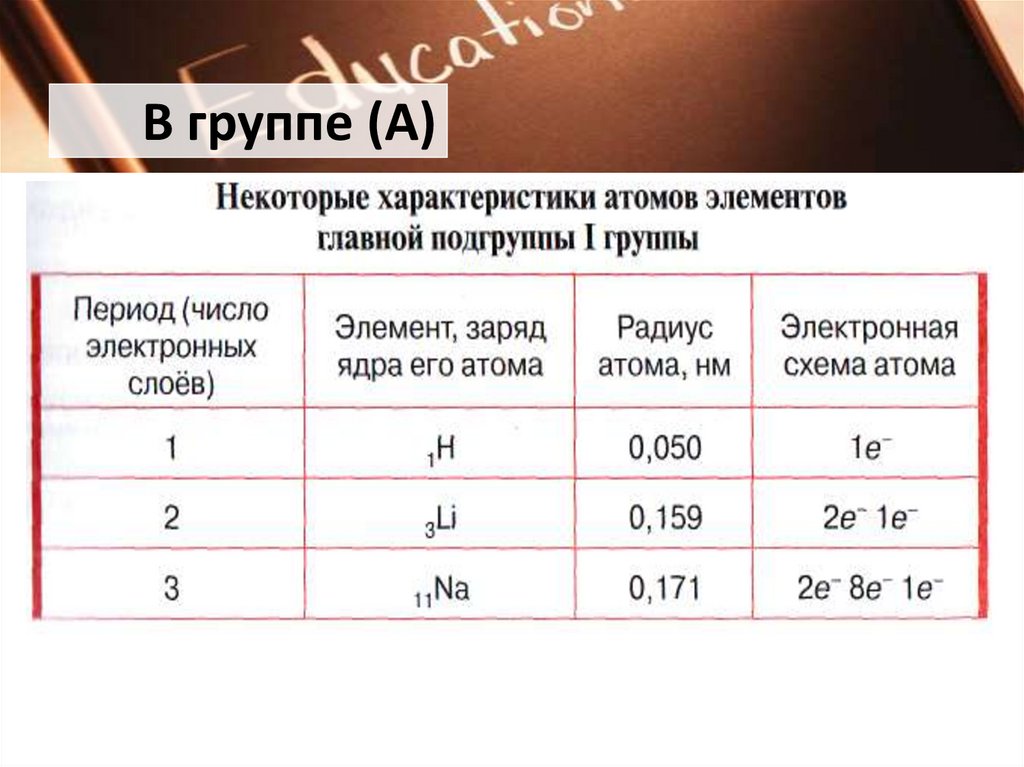
В группе (А)16.
В группе (А)В главных подгруппах сверху вниз:
• заряд ядер атомов возрастает;
• число занятых электронами энергетических уровней
увеличивается;
• радиус атомов растёт;
• число электронов на внешнем уровне не изменяется, оно
равно номеру группы;
5. прочность связи электронов внешнего уровня с ядром
уменьшается;
6. металлические свойства атомов элементов усиливаются;
7. неметаллические свойства атомов элементов ослабевают.
17.
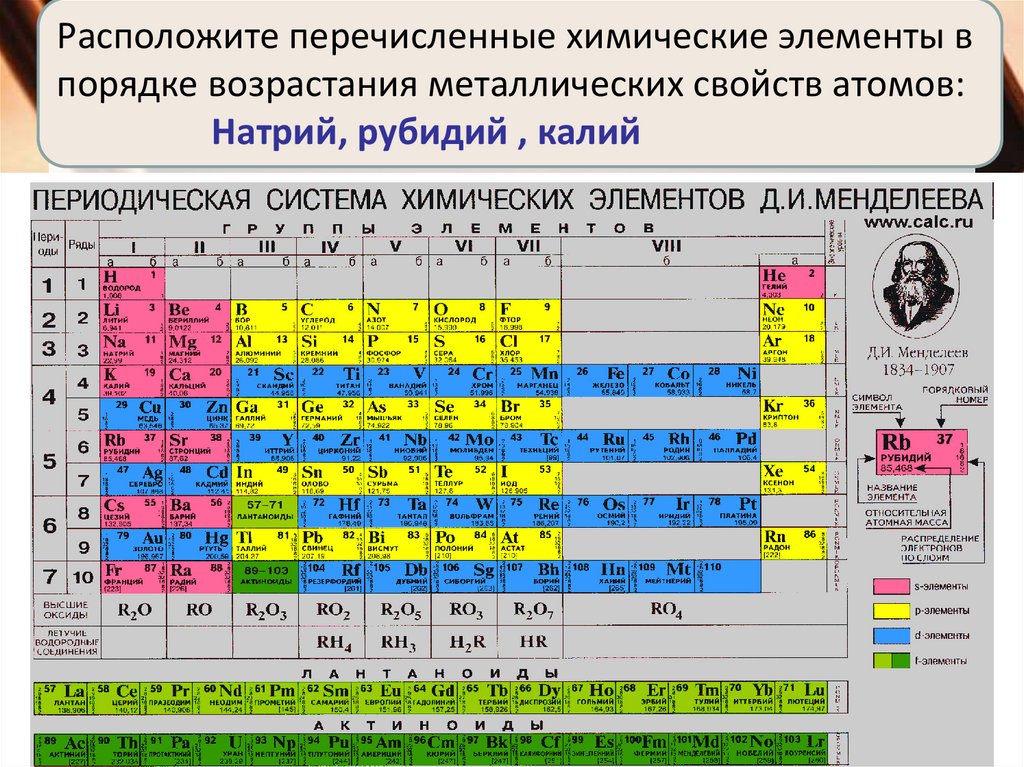
Расположите перечисленные химические элементы впорядке возрастания металлических свойств атомов:
Натрий, рубидий , калий
18.
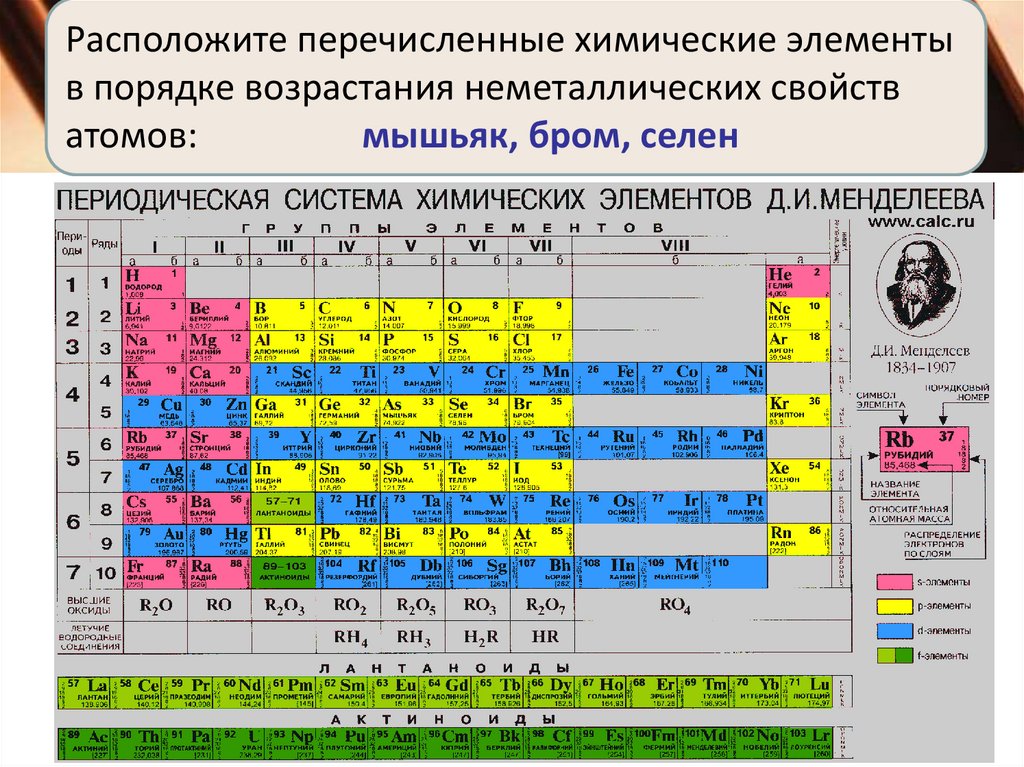
Расположите перечисленные химические элементыв порядке возрастания неметаллических свойств
атомов:
мышьяк, бром, селен
19.
Домашнее задание• § 35, 36 в. 4-5 стр. 122
в. 1-4 стр. 125











 Химия
Химия








