Похожие презентации:
Периодический закон. Периодическая система химических элементов Д.И. Менделеева
1. Периодический закон. Периодическая система химических элементов Д.И. Менделеева.
2. Открытие периодического закона
«Открытие периодическогозакона для моего отца было
не счастливым случаем, не
неожиданной удачей. Нет,
открытие закона мира
атомов было сознательным
философским устремлением»
Иван Менделеев
3.
"По-видимому,периодическому
закону будущее не
грозит разрушением,
а только надстройки
и развитие
обещает…".
4. Менделеев считал, что главной характеристикой элемента является его атомная масса
5.
1 марта (17 февраля) 1869 г.Периодический закон:
Свойства элементов, а также состав и
свойства образуемых ими простых и
сложных веществ находятся в
периодической зависимости от величин их
относительных атомных масс.
На основе периодической системы
Менделееву удалось предсказать
существование одиннадцати ещё не
открытых элементов.
6. Периодическая система –это графическое выражение периодического закона.
• Состоит из 114 хим. элементов.• Каждый элемент занимает
определенное место и имеет свой
порядковый номер
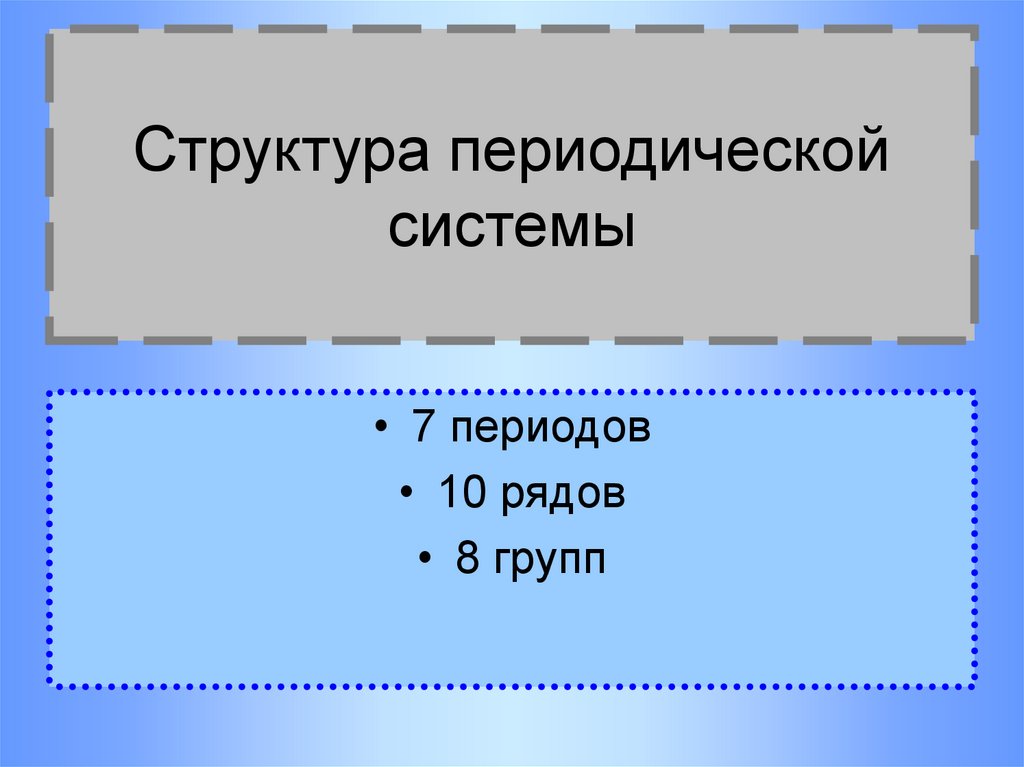
7. Структура периодической системы
• 7 периодов• 10 рядов
• 8 групп
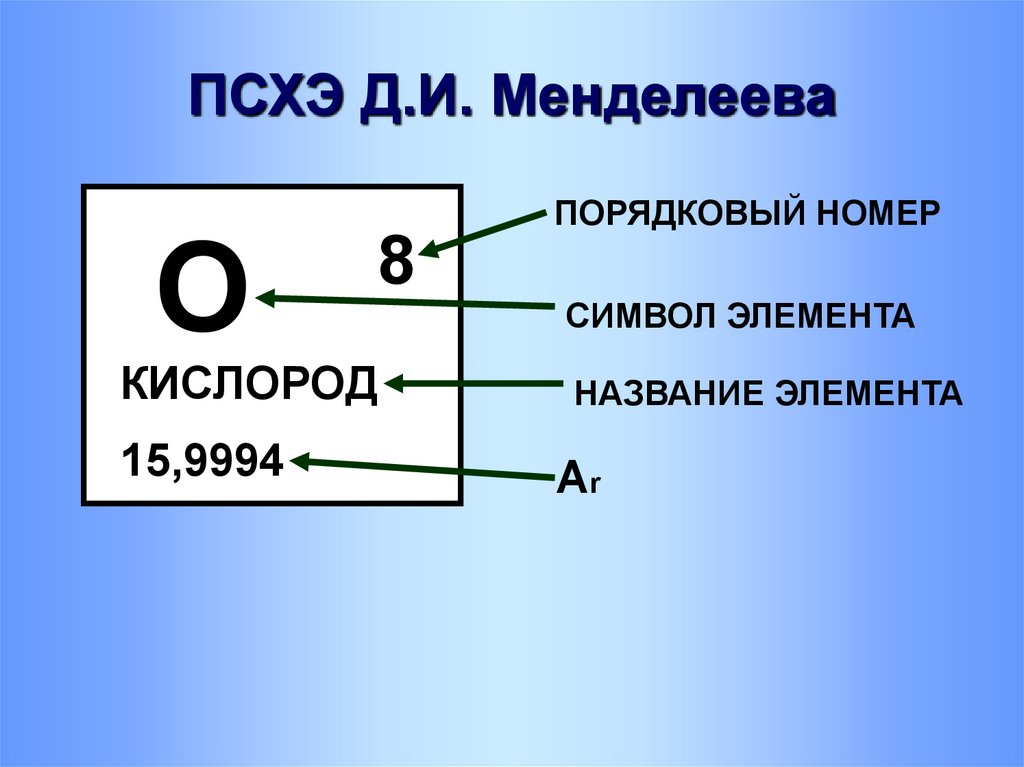
8. ПСХЭ Д.И. Менделеева
ОПОРЯДКОВЫЙ НОМЕР
8
СИМВОЛ ЭЛЕМЕНТА
КИСЛОРОД
НАЗВАНИЕ ЭЛЕМЕНТА
15,9994
Ar
9.
• Период – это горизонтальный рядхимических элементов, начинающийся
щелочным металлом и
заканчивающийся инертным газом.
• Седьмой период незавершен.
10. Период – это последовательность элементов, которая начинается щелочным металлом и заканчивается инертным газом
Исключения:• Первый период начинается водородом
• Седьмой период незавершенный
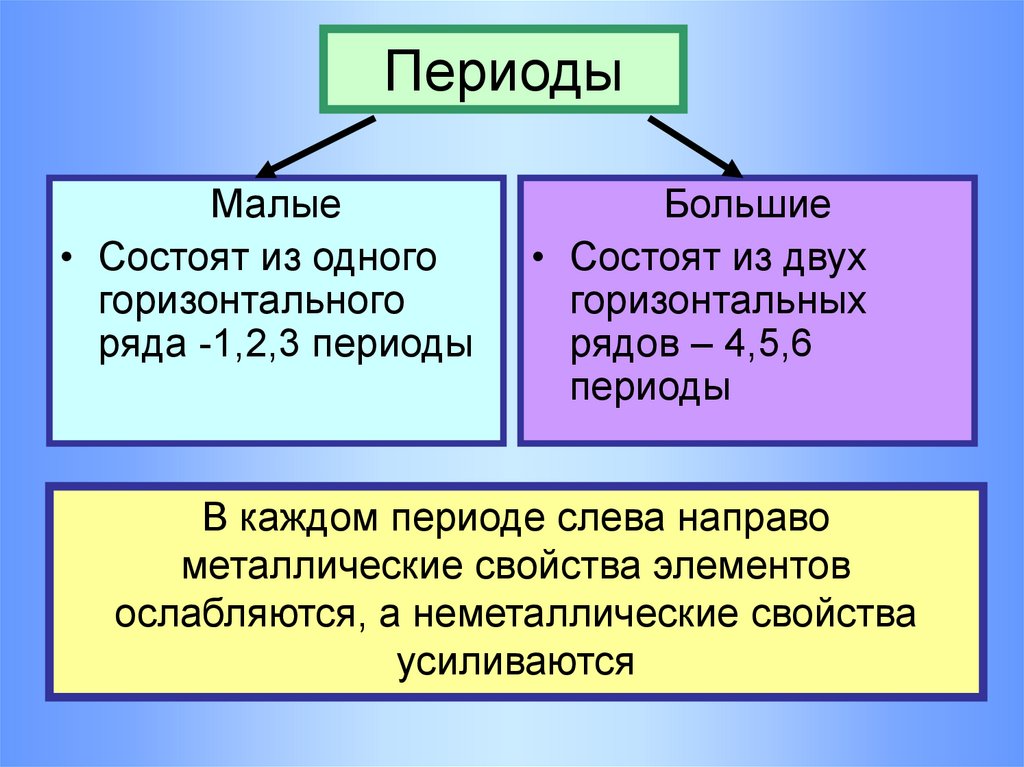
11. Периоды
Малые• Состоят из одного
горизонтального
ряда -1,2,3 периоды
Большие
• Состоят из двух
горизонтальных
рядов – 4,5,6
периоды
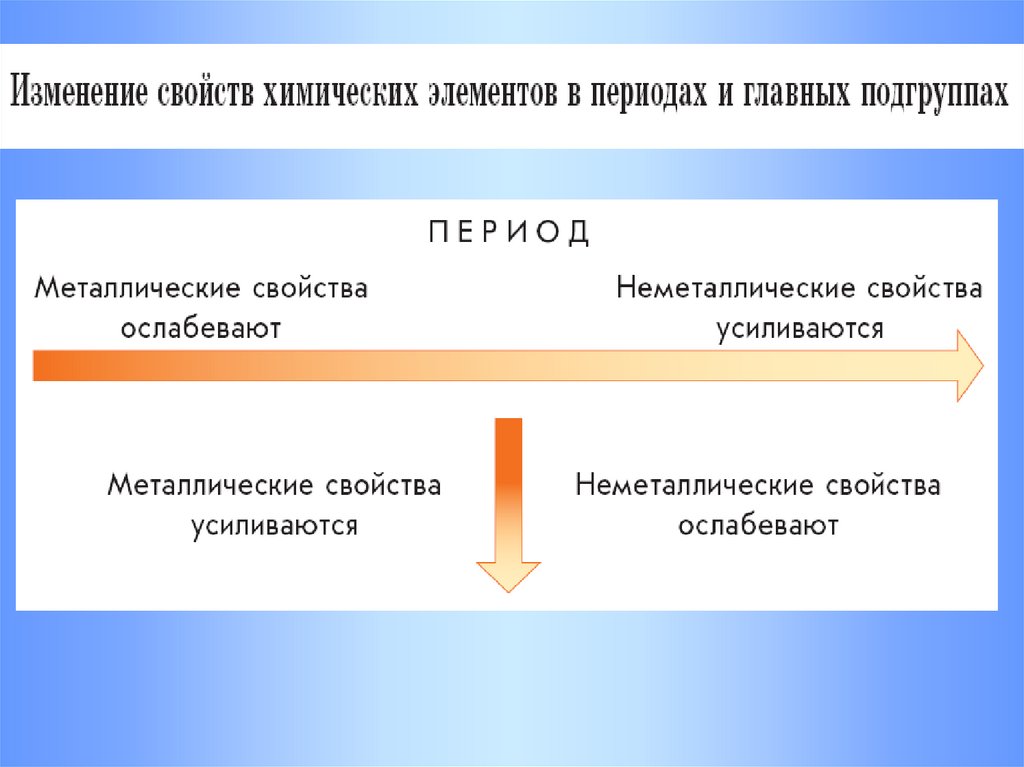
В каждом периоде слева направо
металлические свойства элементов
ослабляются, а неметаллические свойства
усиливаются
12. Группа – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и других соединениях. Эта
валентность равна номеругруппы
13. Группа
ГлавнаяСодержит элементы
малых и больших
периодов
Побочная
Содержит элементы
только больших
периодов
В главных подгруппах сверху вниз металлические
свойства усиливаются, а неметаллические свойства
ослабляются. Все элементы побочных групп являются
металлами
14.
• У элементов одной подгруппы высшаявалентность в соединениях, как
правило, равна номеру группы.
• Низшая валентность элемента V, VI или
VII группы определяется по разности
между числом 8 и номером группы.
15.
16. S - сера
Определите:• период;
• группу и подгруппу;
• высшую и низшую валентности;
• формулу и характер высшего оксида;
• формулу и характер высшего
гидроксида;
• формулу водородного соединения.












 Химия
Химия








