Похожие презентации:
Теория электролитической диссоциации. Реакции ионного обмена. Составление реакций ионного обмена
1.
Лекция № 4Тема. Теория электролитической диссоциации.
Реакции ионного обмена. Составление реакций
ионного обмена путем составления их полных и
сокращенных ионных уравнений.
Цель: сформировать понятия об электролитах и
неэлектролитах ; дать понятие о сущности реакций
ионного обмена ; познакомить обучающихся с
реакциями ионного обмена и условиями их
протекания; научиться составлять ионные уравнения;
закрепить
знания
пользоваться
таблицей
растворимости для прогнозирования возможных
химических
реакций;
совершенствование
химического языка обучающихся.
2.
ПЛАН ЛЕКЦИИ1. Что такое электролитическая диссоциация ?
2. Механизм электролитической диссоциации;
3. Электролиты и неэлектролиты;
4. Степень диссоциации;
5. Диссоциация разных групп веществ;
6. Молекулярное, полное и сокращенное ионные
уравнения;
7. Основные положения теории электролитической
диссоциации;
8. Домашнее задание.
3.
Теория электролитическойдиссоциации
Электролитическая диссоциация — это процесс, в ходе
которого молекулы электролитов взаимодействуют с
водой или другим растворителем и распадаются на
ионы.
Схема электролитической диссоциации:
KA ⇄ K+ (катион) + A- (анион).
Уравнение диссоциации на примере хлорида натрия:
NaCl ⇄ Na+ + Cl-.
4.
Механизм электролитической диссоциации5.
Сущность процесса электролитическойдиссоциации передает схема:
6.
Электролиты — это вещества,которые после диссоциации
на ионы в растворах и
расплавах проводят
электроток. Обычно в их
молекулах ионные или
полярные ковалентные связи.
Неэлектролиты — это
вещества, которые не
распадаются на ионы в
растворах и расплавах, а
значит, не обладают
проводимостью в
растворенном виде. Для них
характерны ковалентные
неполярные или
слабополярные связи.
7.
8.
Степень диссоциации (α – греческая букваальфа) - это отношение числа молекул, распавшихся на
ионы (n), к общему числу растворенных молекул (N):
9.
10.
Степень диссоциации зависит от природы электролита ирастворителя, от концентрации электролита, температуры
1.
Зависимость степени диссоциации от природы
электролита и растворителя: чем полярнее химическая связь в
молекуле электролита и растворителя, тем сильнее выражен
процесс диссоциации электролита на ионы и тем выше значение
степени диссоциации.
2.
Зависимость степени диссоциации от концентрации
электролита: с уменьшением концентрации электролита, т.е.
при разбавлении его водой, степень диссоциации всегда
увеличивается.
3. Зависимость степени диссоциации от температуры: степень
диссоциации возрастает при повышении температуры
(повышение температуры приводит к увеличению кинетической
энергии растворённых частиц, что способствует распаду
молекул на ионы).
11.
Ступенчатая диссоциацияПример 1.
Суммарное уравнение:
H3PO4 ⇄ 3H+ + PO43-.
Пример 2.
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
12.
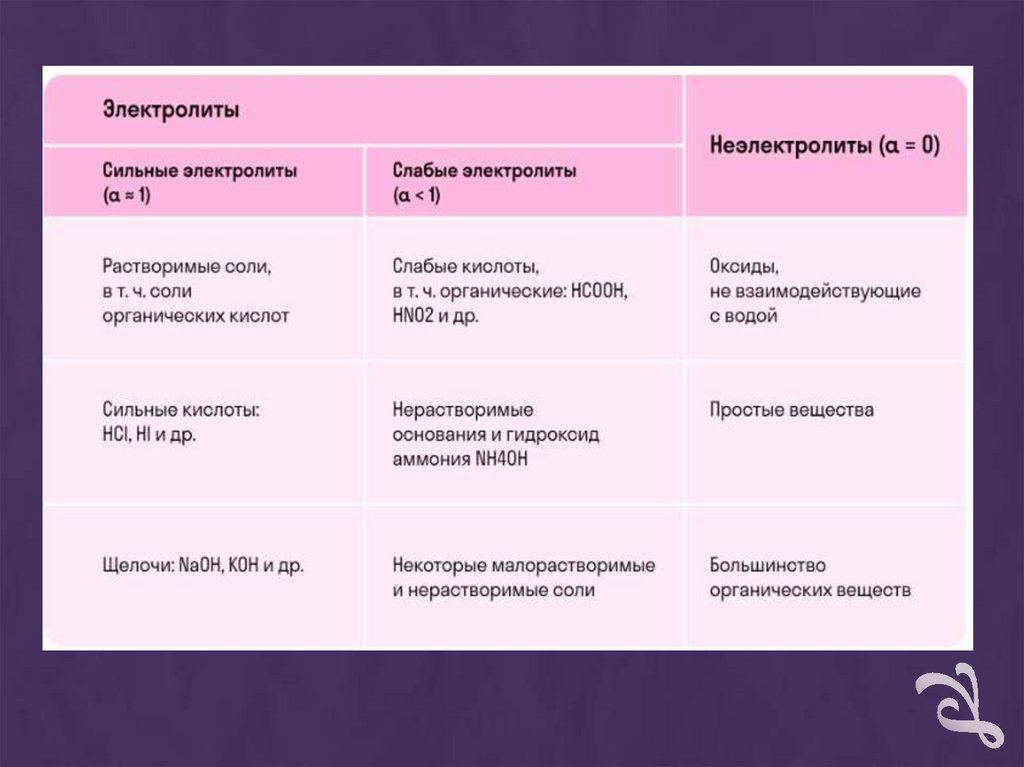
Диссоциация разныхгрупп веществ
+
13.
14.
15.
Основные положения теории электролитическойдиссоциации:
• При взаимодействии с водой или другими растворителями в
электролитах разрывается химическая связь между частицами
и они распадаются на ионы — происходит электролитическая
диссоциация.
• Под действием электротока положительно заряженные ионы
(катионы) перемещаются к отрицательно заряженному
электроду (катоду), отрицательно заряженные ионы (анионы)
— к положительно заряженному (аноду). Раствор электролита
обладает проводимостью.
• Степень диссоциации зависит от типа электролита и от
внешних условий. Для сильных электролитов она необратима,
для слабых — это обратимая реакция.
• Химические свойства электролитов соответствуют свойствам
ионов, которые образовались при диссоциации.
16.
Реакции обмена протекают между ионами,поэтому они называются реакциями ионного обмена
Реакции ионного обмена идут до конца в трех случаях
Если образуется
осадок
Если выделяется
газ
Если образуется
вода
***В остальных случаях реакции обмена являются обратимыми
17.
CuSO4 + 2NaOHNa2SO4 + Cu(OH)2
2AgNO3 + CaCl2
Ca(NO3)2 + 2AgCl
Na2CO3 + Ca(NO3)2
2NaNO3 + CaCO3
BaCl2 + K2SO4
2KCl + BaSO4
18.
CaCO3 + 2HNO3Ca(NO3)2 + H2CO3
(H2O + CO2 )
Na2SO3 + 2HCl
2NaCl + H2SO3
(H2O + SO2 )
CuS + 2HCl
CuCl2 + H2S
19.
CuO + H2SO4CuSO4 + H2O
Fe(OH)3 + 3HCl
FeCl3 + 3H2O
NaOH + HNO3
NaNO3 + H2O
20.
НЕ образуютсяобратимы
Обратимые реакции – это реакции, которые при одних и тех же условиях
протекают в двух противоположных направлениях
2NaNO3 + CaCl2
Ca(NO3)2 + 2NaCl
K3PO4 + 3NaCl
Na3PO4 + 3KCl
CuCl2 + Na2SO4
CuSO4 + 2NaCl
21.
Для реакций ионного обмена составляют полные и сокращенныеионные уравнения. При этом на ионы никогда не раскладывают :
- нерастворимые вещества (см. таблицу растворимости);
- оксиды;
- воду;
- газы
Помним, что ионы – это заряженные частицы
катионы
анионы
1) Запишем молекулярное уравнение и уравняем его:
CuSO4 + 2NaOH
Na2SO4 + Cu(OH)2
2) Разложим на ионы все, что возможно и затем сократим
одинаковые ионы в обоих частях уравнения:
Cu2+ + SO42- + 2Na+ + 2OH2Na+ + SO42- + Cu(OH)2
(полное ионное уравнение)
3) Запишем то, что получилось:
Cu2+ + 2OHCu(OH)2 (сокращенное ионное уравнение)
22.
CaCO3 + 2HNO3Ca(NO3)2 + H2CO3 (H2O + CO2 )
CaCO3 + 2H+ + 2NO3-
Ca2+ + 2NO3- + H2O + CO2
CaCO3 + 2H+
Ca2 ++ H2O + CO2
CuS + 2HCl
CuCl2 + H2S
CuS + 2H+ + 2ClCuS + 2H+
Cu2+ + 2Cl- + H2S
Cu2+ + H2S
23.
NaOH + HNO3NaNO3 + H2O
Na+ + OH- + H++ NO3OH-+ H+
K3PO4 + 3NaCl
Na+ + NO3- + H2O
H 2O
Na3PO4 + 3KCl
3K+ + PO43 -+ 3Na++ 3Cl-
3Na+ + PO43 ¯+ 3K++ 3Cl-
сокращенного ионного уравнения нет , следовательно,
у обратимых реакций нет сокращенных ионных уравнений
24.
Домашнее задание!. (письменно!)Допишите, где необходимо продукты реакции, составьте полные и
сокращенные ионные уравнения:
1) NaOH + HCl =
2) MgCl2 + Na2SO3 =
3) K2SO3 + HNO3 =
4) ZnSO4 + 2NaOH =
5) Al(OH)3 + 3HNO3 =
6) CaCO3 + 2 HCl =
Выполнять следующим образом:
1) NaOH + HCl
= NaCl
Na+ + OH- + H+ + ClOH- + H+
=
H2O
=
+ H2O
Na+ + Cl- + H2O























 Химия
Химия








