Похожие презентации:
Свойства атомов. Периодический закон и периодическая система элементов. Электронные конфигурации химических элементов
1.
Свойства атомов.Периодический закон и
периодическая система элементов
1
2.
Электронные конфигурации химических элементов№
Символ
n
l
ms
s
n+l
Электронная конфигурация
1
H
1
0
0
+½
1
1s1
2
He
1
0
0
-½
1
1s2
3
Li
2
0
0
+½
2
1s22s1
4
Be
2
0
0
-½
2
1s22s2
5
B
2
1
-1
+½
3
1s22s22p1
6
C
2
1
0
+½
3
1s22s22p2
7
N
2
1
+1
+½
3
1s22s22p3
8
O
2
1
-1
-½
3
1s22s22p4
9
F
2
1
0
-½
3
1s22s22p5
10
Ne
2
1
+1
-½
3
1s22s22p6
11
Na
3
0
0
+½
3
1s22s22p63s1
12
Mg
3
0
0
-½
3
1s22s22p63s2
13
Al
3
1
-1
+½
4
1s22s22p63s23p1
2
3.
Периодический закон Д. И. МенделееваПериодический закон Д. И. Менделеева — фундаментальный
закон, устанавливающий периодическое изменение свойств
химических элементов в зависимости от зарядов ядер их атомов.
Открыт в марте 1869 года при сопоставлении свойств известных
в то время элементов и величин атомных масс. Термин
«периодический закон» Д. И. Менделеев впервые употребил в
ноябре 1870 года, а в октябре 1871 года дал формулировку
Периодического закона: «свойства простых тел, а также формы и
свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической
зависимости от их атомного веса». Графическим (табличным)
выражением периодического закона является разработанная
Менделеевым периодическая система элементов.
Современная формулировка Периодического закона: «свойства простых веществ, а также формы и свойства соединений
элементов находятся в периодической зависимости от зарядов
ядер атомов элементов».
3
4.
В 1829 году немецкий химик Иоганн Вольфганг Деберейнерпредпринял первую попытку систематизации химических
элементов. Он заметил, что некоторые сходные по своим
свойствам элементы можно объединить по три в группы, которые
он назвал триадами
Li Ca P S Cl
Na Sr As Se Br
K Ba Sb Te I
Атомная масса среднего элемента триады близка к полусумме
(среднему арифметическому) атомных масс двух крайних элементов триады.
4
5.
56.
Джон Ньюлендс сделал попытку сопоставить химические свойстваэлементов с их атомными массами. Расположив элементы в порядке
возрастания атомных масс, Ньюлендс заметил, что сходство в свойствах
проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы.
6
7.
В 1864 году появилась первая таблица немецкого химика ЛотараМейера. В неё были включены 28 элементов, размещённые в
шесть столбцов согласно их валентностям. Мейер намеренно
ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной
массы в рядах сходных элементов.
7
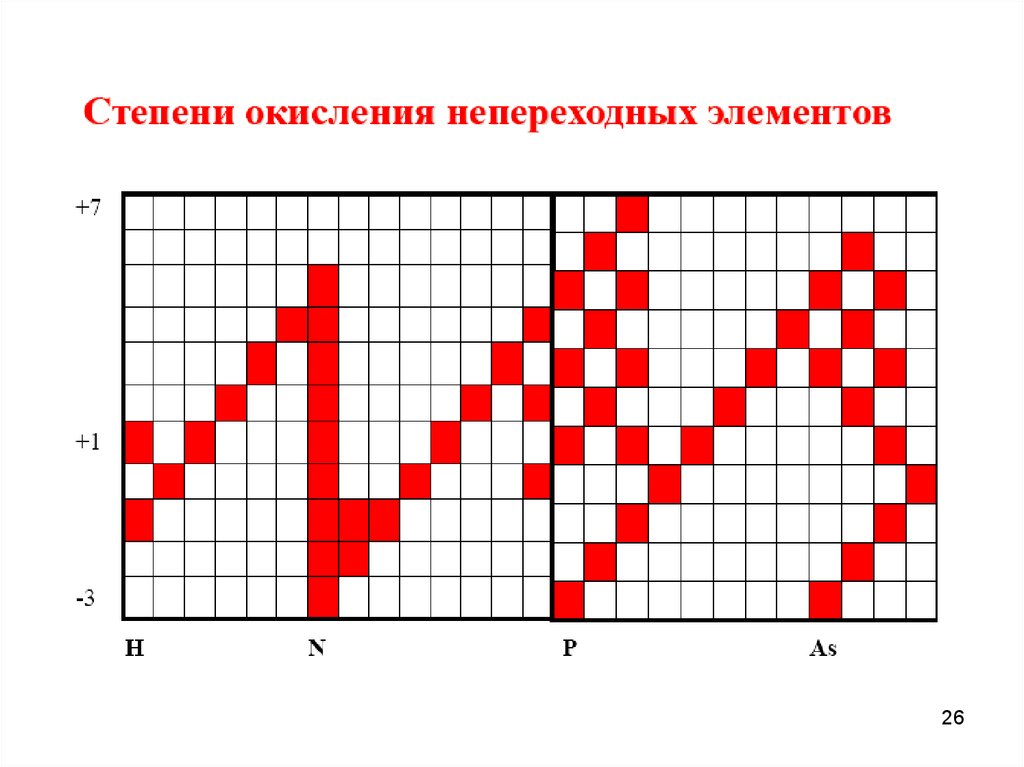
8.
89.
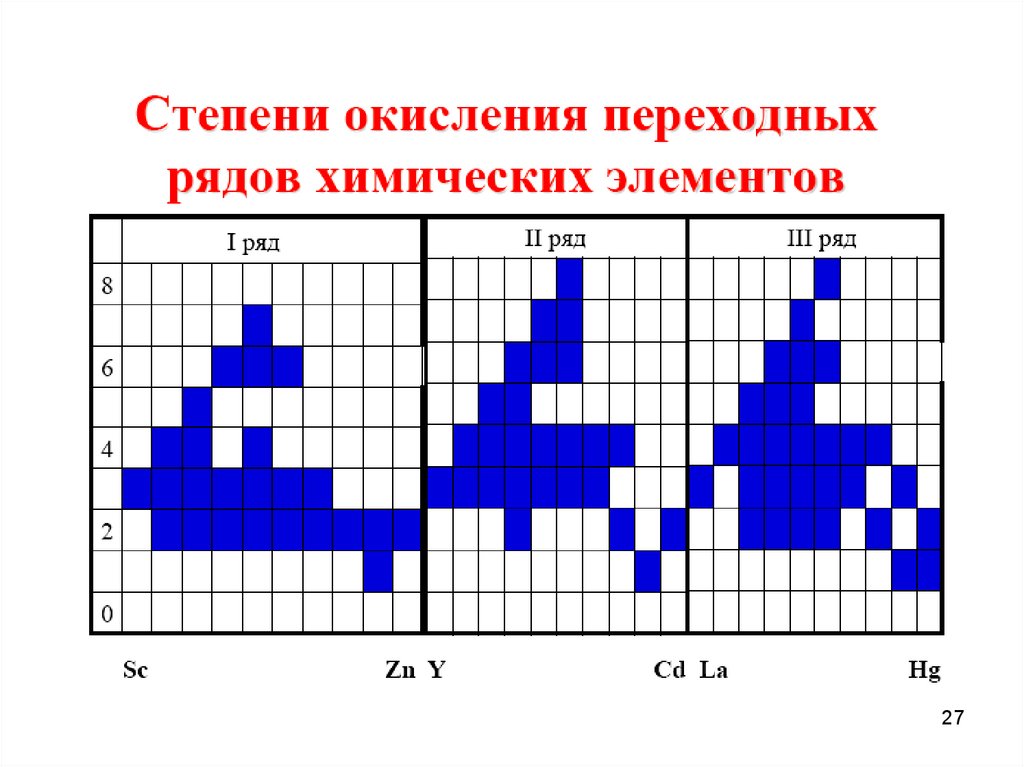
910.
1011.
1112.
1213.
1314.
1415.
1516.
1617.
1718.
1819.
1920.
2021.
2122.
2223.
Зависимость сродства к электрону атомаот атомного номера элемента
23
24.
Электроотрицательность атомовЭлектроотрицательность ( ) — фундаментальное химическое
свойство атома, количественная характеристика способности атома в
молекуле притягивать к себе общие электронные пары.
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из положения о том,
что способность атома в молекуле притягивать к себе электроны зависит
от энергии ионизации атома и его сродства к электрону, он предложил
соотношение для электроотрицательности атома
1
χ (I A EA )
2
где IA и EA энергия ионизации атома и его сродство к электрону.
Лайнус Полинг ввел собственную шкалу электроотрицательностей, в
которой максимальную имеет фтор ( F = 4,1), а минимальную — цезий
( Cs = 0,7 ).
Широко используют также шкалу Оллреда и Рокоу, в которой электроотрицательность рассчитывают по формуле
χ 0,359Z/r2 0,744
где Z - эффективный заряд ядра по Слэйтеру, r -атомный ковалентный
24
радиус.
25.
Зависимость электроотрицательности по Полингуот атомного номера элемента
25
26.
2627.
2728.
http://www.ptable.com/ - динамическая ПСЭ28
29.
Благодарю за внимание29



























 Химия
Химия








