Похожие презентации:
Химическая организация клетки. Содержание химических веществ в клетке
1. Химическая организация клетки
НеорганическиеВода
минеральные
соли
органические
2. Органические вещества клетки
БЕЛКИЖИРЫ
УГЛЕВОДЫ
НУКЛЕИНОВЫЕ КИСЛОТЫ
3. Содержание химических веществ в клетке
4. БЕЛКИ, или ПРОТЕИНЫ.
5. Белки — основной материал для построения клеток, тканей и органов организма животных
• В организме человеканасчитывается
до 100 000 белков.
6. Элементарный состав белков
• С (углерод) – 50-55%;• О (кислород) – 21-24%;
• N (азот) – 15-17% (≈ 16%);
• Н (водород) – 6-8%;
• S (сера)– 0-2%.
Азот - это постоянный компонент белков
и по его количеству можно определить
содержание белка в тканях.
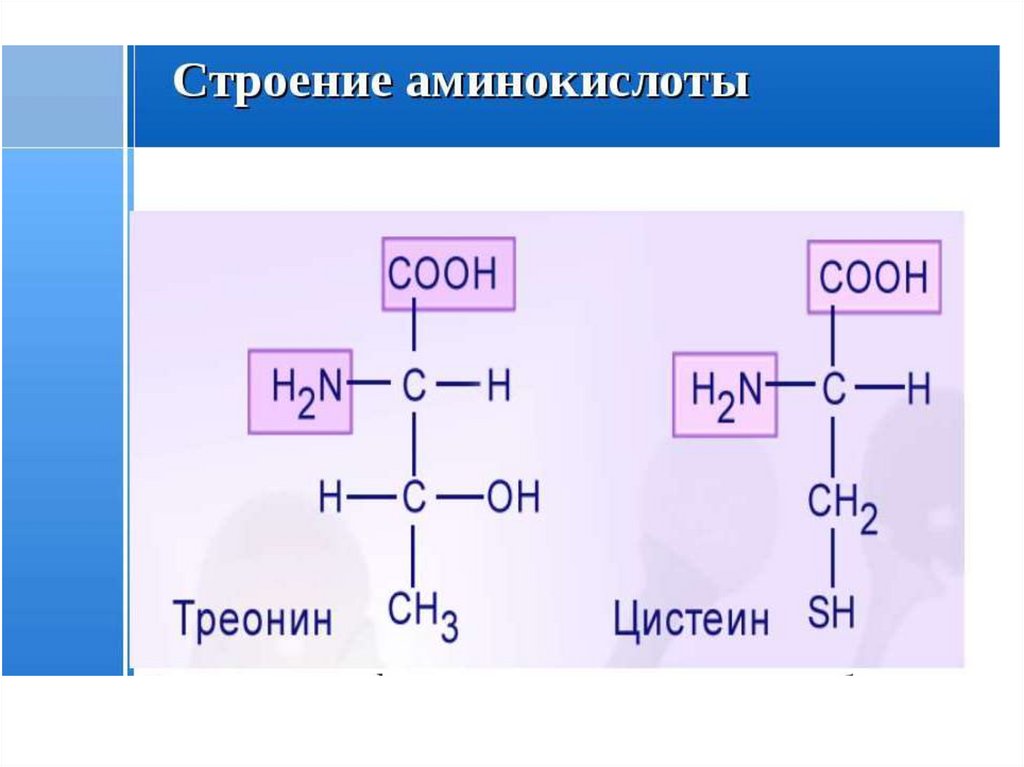
7. Белки - это очень большие молекулы, представляющие собой цепочки аминокислот.
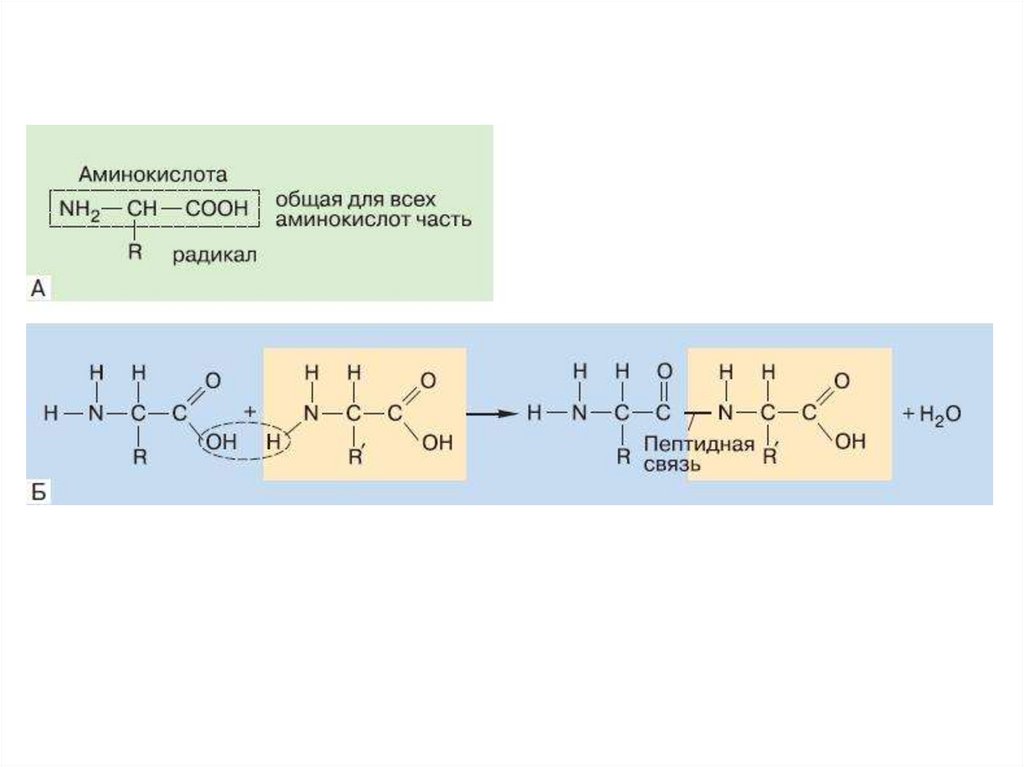
Белки состоят из аминокислот• Аминокислоты – это мономеры белка
• Известно около 170 аминокислот
• Белки строятся из 20 видов аминокислот
8. Аминокислоты
ЗаменимыеНезаменимые
Заменимые аминокислоты
могут синтезироваться в
организме.
Незаменимыми для взрослого
здорового человека являются
8 аминокислот
.
Не могут быть синтезированы в
организме.
Потребность организма
осуществляется за счет
поступления белков пищи
9.
Содержание незаменимыхаминокислот
Валин
Треонин
Изолейцин Триптофан
Лейцин
Фенилаланин
Лизин
Аргинин
Метионин
Гистидин
10.
11.
12.
13.
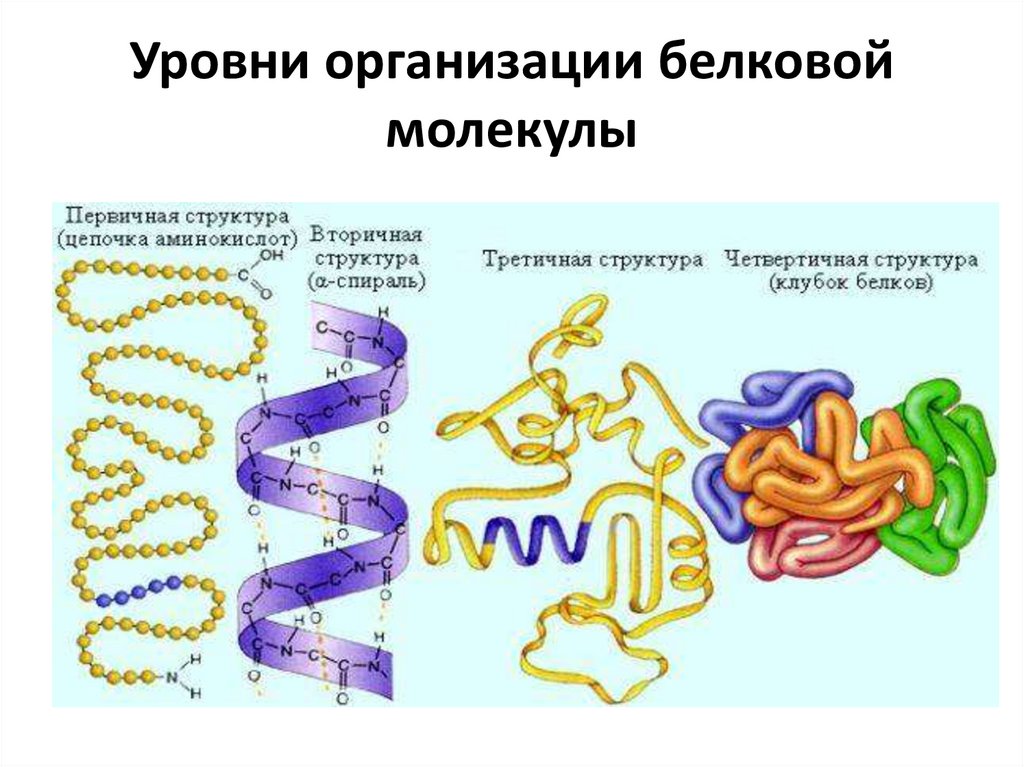
14. Уровни организации белковой молекулы
15. Заполни таблицу «Строение белка»
Название структурыбелка
Особенности
структуры
Химические
связи
Первичная
Цепочка из
аминокислот
Пептидные
связи
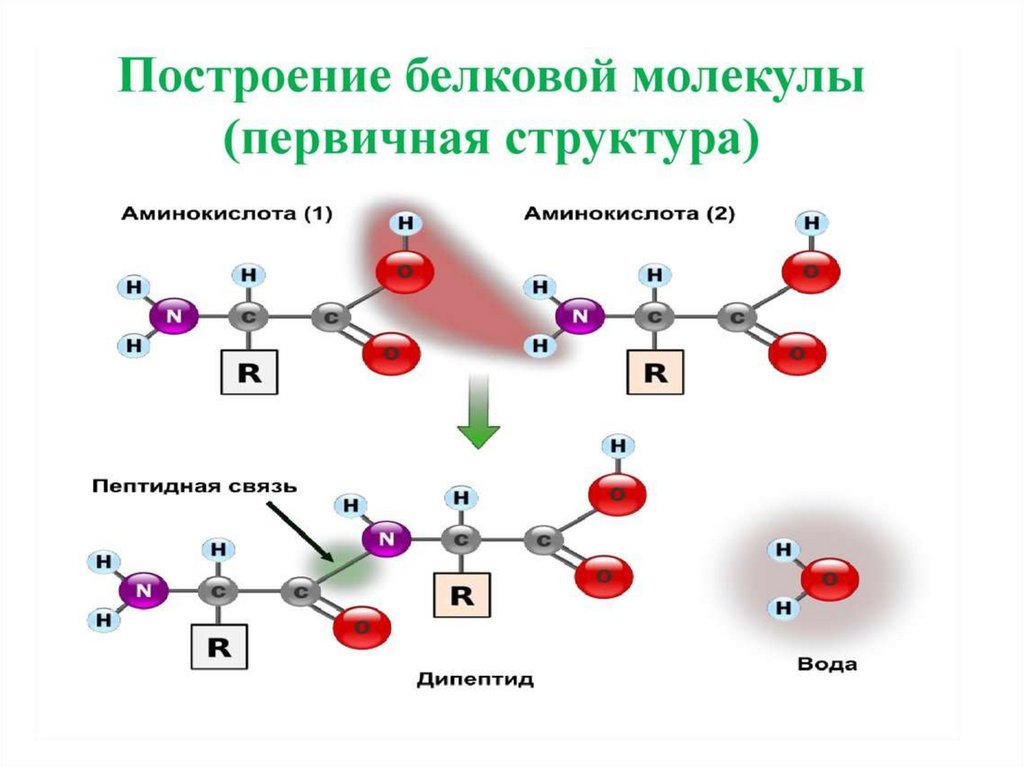
16. Первичная структура белков
• Первичная структура определеннаяпоследовательность
• аминокислотных
остатков в
полипептидной цепи.
Связи между
аминокислотами
ковалентные, а
следовательно очень
прочные
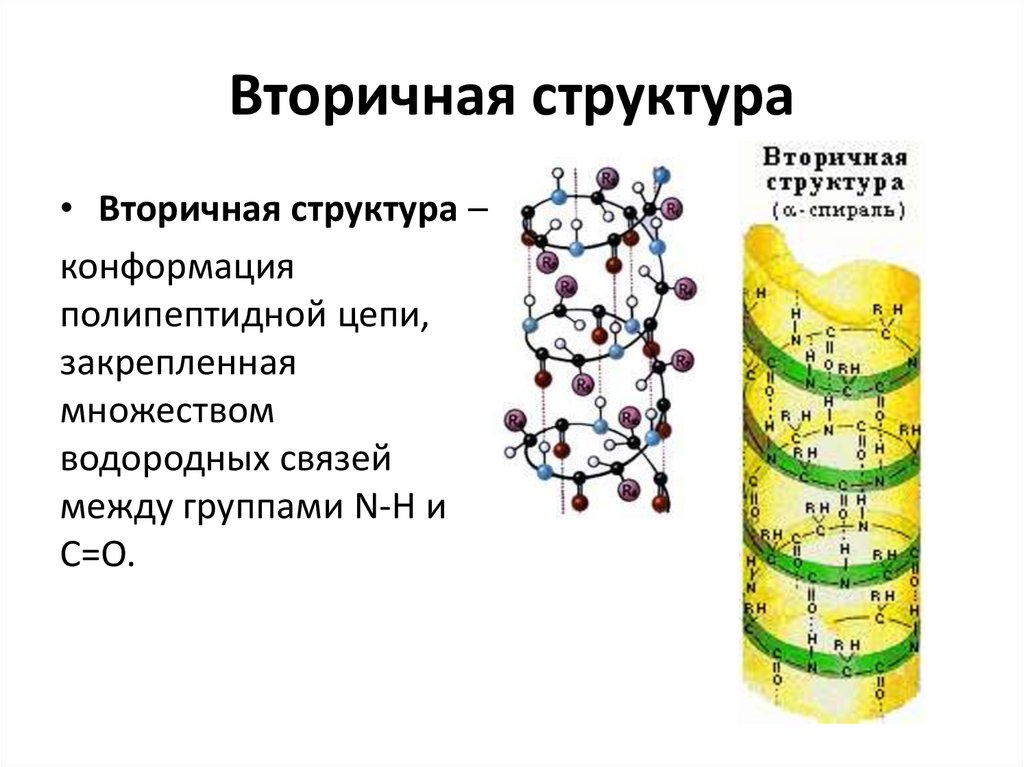
17. Вторичная структура
• Вторичная структура –конформация
полипептидной цепи,
закрепленная
множеством
водородных связей
между группами N-H и
С=О.
18. Вторичная структура
α–спиральΒ - спираль
α–спираль открыта в 30-ых
годах ХХ века Л.Полингом.
β – спираль (складчатая)– две
параллельные полипептидные
цепи, соединены между собой
с помощью водородных
связей,перпендикулярно
цепям.
α–спираль стабилизируется в
пространстве благодаря
образованию дисульфидных и
большого количества
водородных связей между
аминокислотами
полипептидной цепи оси
спирали.
Например – кератин.
Подобную структуру имеют
фибриллярные белки
(коллаген, фиброин (белок
шелка)).
19. Третичная структура
Третичная структура(глобула) - форма
закрученной спирали в
пространстве.
20.
Связи, стабилизирующиетретичную структуру:
1. электростатические силы
притяжения между R-группами,
несущими
противоположно заряженные
ионогенные группы (ионные связи);
2. водородные связи между
полярными (гидрофильными) Rгруппами;
3. гидрофобные взаимодействия
между неполярными
(гидрофобными) Rгруппами;
4. дисульфидные (ковалентные)
связи между радикалами двух
молекул цистеина. Они повышают
стабильность третичной структуры,
но в ряде белков они могут вообще
отсутствовать.
21. Четверичная структура
• Четвертичная структура агрегаты несколькихбелковых макромолекул
(белковые комплексы),
образованные за счет
взаимодействия разных
полипептидных цепей.
В стабилизации
четвертичной структуры
принимают участие те же
типы взаимодействий,
что и в стабилизации
третичной.
Надмолекулярные
белковые комплексы
могут состоять из
десятков молекул.
22. Денатурация белка
Денатурация белков – это потеря белками ихбиологических свойств из-за изменения
структуры белковой молекулы.
Денатурацию вызывают:
• физические факторы (высокая температура,
ионизирующее излучение),
•химические факторы (концентрированные
кислоты, щелочи, реакционно-активные
соединения, тяжелые металлы ).
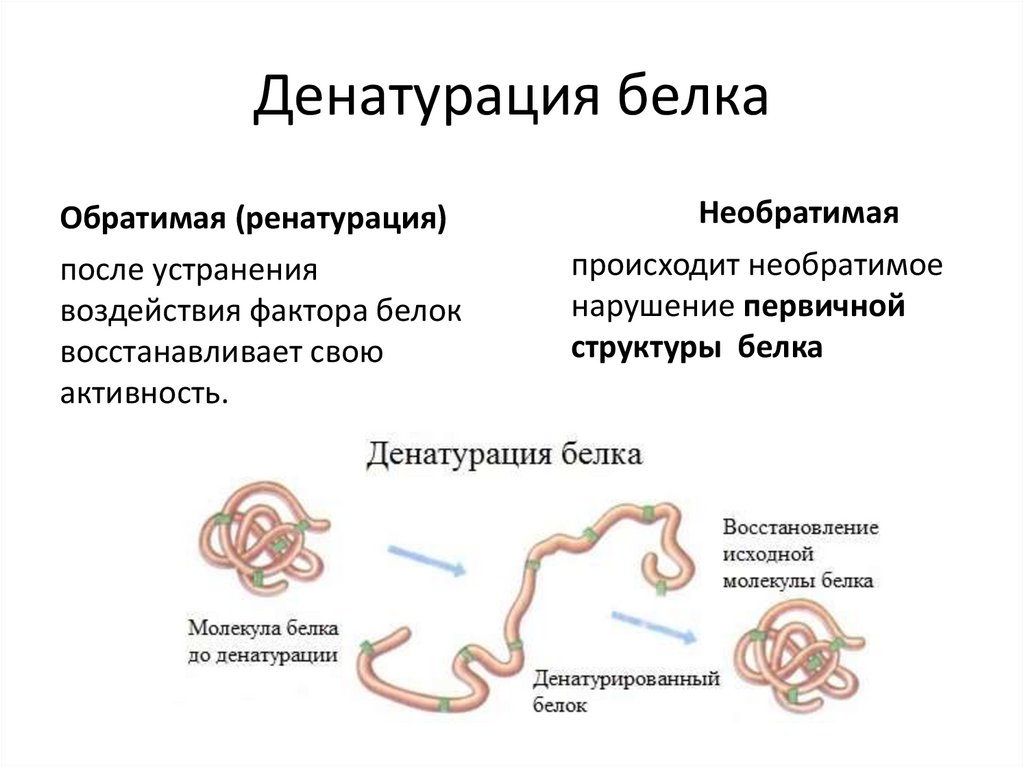
23. Денатурация белка
Обратимая (ренатурация)после устранения
воздействия фактора белок
восстанавливает свою
активность.
Необратимая
происходит необратимое
нарушение первичной
структуры белка
24. Свойства, функции белка определяются:
1. Последовательностью аминокислот2. Пространственной структурой белка
25.
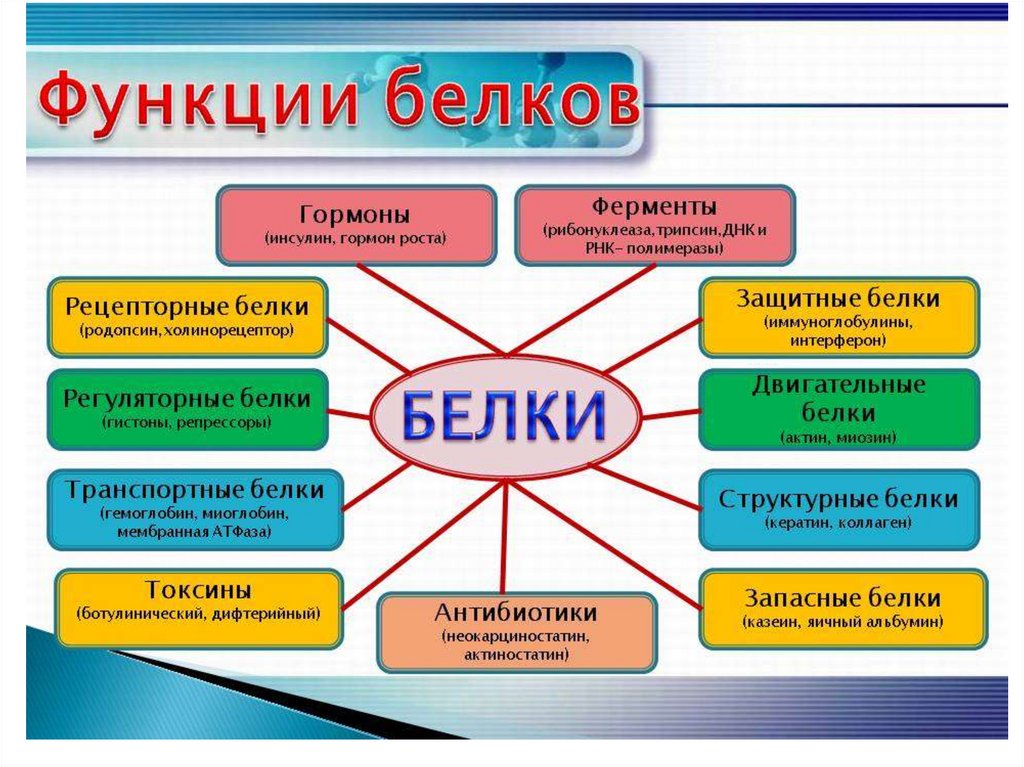
Функции белков:1.Каталитическая (ферменты: пепсин, липаза)
2. Защитная (иммуноглобулин, фибриноген)
3. Сигнальная (родопсин)
4. Транспортная (гемоглобин)
5.Структурная( коллаген, кератин)
6. Двигательная (актин, миозин)
7. Энергетическая (1гр.- 17,6 кДж)
8. Регуляторная (инсулин, гистоны)
9.Запасающая ( казеин)
26.
27.
28. Заполни таблицу «Функции белка»
Белки(по функциям)
Структурные
белки
Выполняемая функция
Примеры белков
Являются структурными
компонентами биологических
мембран и многих
внутриклеточных органелл,
главным компонентом опорных
структур организма
Коллаген хрящей и
сухожилий, эластин
соединительной ткани,
кератин волос и ногтей
29. Белки в пище человека
30. Белки в пище человека
31.
• Вставьте в текст пропущенные термины и слова.1). В состав белка входят следующие элементы:
С, Н, О, N, S
2). Белки – крупные молекулы ,органические полимеры,
мономерами которых являются
АМИНОКИСЛОТЫ
3). В состав природных белков входят
20
аминокислот,
8
из них незаменимые, т.е. синтезируются в организме и их
поступление в организм обязательно вместе с пищей.
32. Определите структуру белка
Четвертичная структураТретичная структура
Вторичная структура
Первичная структура
33.
Функции белков:1.Каталитическая (ферменты)
2. Защитная (иммуноглобулин)
3. Сигнальная(родопсин)
4. Транспортная (гемоглобин)
5.Структурная( коллаген, кератин)
6. Двигательная (актин, миозин)
7. Энергетическая (1гр.- 17,6 кДж)
8. Регуляторная (инсулин,гистоны)
9.Запасающая ( казеин)
34.
СтроительнаяБелки участвуют в образовании всех
мембран и органоидов клетки.
белок
кератин
35.
КаталитическаяВ каждой клетке имеются сотни ферментов.
Они помогают осуществлять биохимические
реакции, действуя как катализаторы.
36.
ТранспортнаяБелки связывают и переносят
различные
вещества и внутри
клетки, и по всему организму.
Например, г е м о г л о б и н
крови переносит кислород.
37.
РегуляторнаяБелки гормоны регулируют
различные физиологические
процессы.
Например, инсулин регулирует
уровень углеводов в крови.
38.
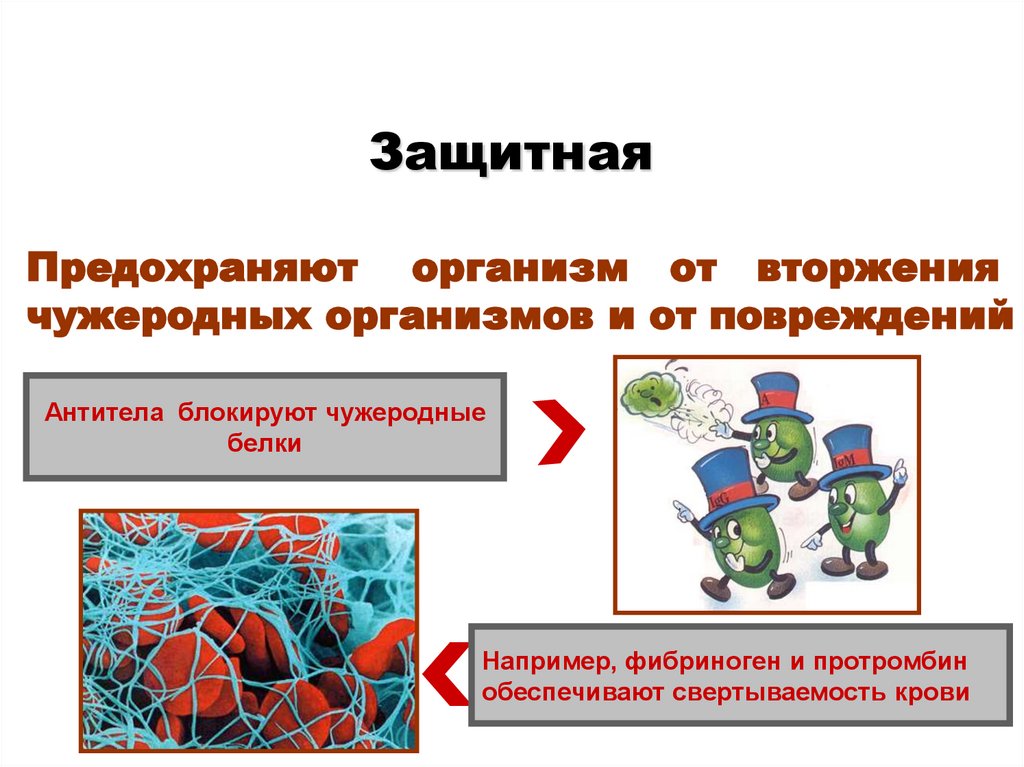
ЗащитнаяПредохраняют организм от вторжения
чужеродных организмов и от повреждений
Антитела блокируют чужеродные
белки
Например, фибриноген и протромбин
обеспечивают свертываемость крови
39.
ЭнергетическаяПри недостатке углеводов или жиров
окисляются молекулы аминокислот.
При полном расщеплении белка до конечных продуктов
выделяется энергия:
1г белка - 17.6 кДж
Но в качестве источника энергии белки используются крайне редко.
40.
Найдите три ошибки в приведённом тексте. Укажите номерапредложений, в которых они допущены, объясните их. (1)
Белки — это нерегулярные биополимеры, мономерами
которых являются нуклеотиды. (2) Остатки мономеров
соединены между собой пептидными связями. (3)
Последовательность мономеров, удерживаемая этими
связями, формирует первичную структуру белковой молекулы.
(4) Следующая структура — вторичная, удерживается слабыми
гидрофобными связями. (5) Третичная структура белка
представляет собой скрученную молекулу в виде глобулы
(шара). (6) Удерживается такая структура водородными
связями.
Ответ
1) Мономерами белков являются аминокислоты.
4) Вторичная структура удерживается водородными связями.
6) Третичная структура белка удерживается ковалентными
дисульфидными, ионными, гидрофобными и другими связями.
41.
• Почему температура выше 40 °С опасна дляжизни?
• Ответ
• Из-за высокой температуры происходит
денатурация белков организма, нарушается
обмен веществ.
42.
• Найдите ошибки в приведенном тексте, исправьте их.Укажите номера предложений, в которых сделаны
ошибки, объясните их. (1) Большое значение в строении и
жизнедеятельности организмов имеют белки. (2) Это
биополимеры, мономерами которых являются азотистые
основания. (3) Белки входят в состав плазматической
мембраны. (4) Многие белки выполняют в клетке
ферментативную функцию. (5) В молекулах белка
зашифрована наследственная информация о признаках
организма. (6) Молекулы белка и тРНК входят в состав
рибосом.
• Ответ
• 2) Мономерами белков являются аминокислоты.
5) Наследственная информация зашифрована в
нуклеиновых кислотах.
6) В состав рибосом входят молекулы белка и рРНК.
43.
Найдите три ошибки в приведённом тексте «Белки». Укажите номерапредложений, в которых сделаны ошибки, исправьте их. (1) Белки
отличаются друг от друга количеством и последовательностью мономеров.
(2) Первичная структура белка зашифрована в гене последовательностью
аминокислот. (3) Аминокислотные звенья соединяются между собой в
единую цепь водородными связями. (4) Первичная структура белка
определяет его форму, свойства и функции. (5) Вторичная структура белка
имеет вид спирали или сложной, складчатой структуры. (6) Третичная
структура имеет вид клубка, или глобулы, при этом образуются
дисульфидные, ионные и другие связи, гидрофобные взаимодействия. (7)
Четвертичная структура некоторых белков содержит атомы металлов,
например магния, в молекуле гемоглобина.
Ответ
2 - первичная структура белка зашифрована в гене последовательностью
нуклеотидов;
3 - аминокислотные звенья соединяются между собой в единую цепь
пептидными связями;
7 - молекула гемоглобина содержит атомы железа (атомы магния входят в
состав хлорофилла)
44. testedu.ru
• https://testedu.ru/test/biologiya/10klass/stroenie-i-funkczii-belkov.html45.
Среди многочисленных функций белковособое место занимает ферментативная
Наука о ферментах называется
Энзимологией, а ферменты энзимами.
Выражение И.П. Павлова
«Не все белки - ферменты, но все ферменты
белки» подчёркивают их химическую
организацию.
46. ФЕРМЕНТЫ
• Ферменты – это белковые молекулы, которыесинтезируются живыми клетками.
• С их помощью химические реакции идут с
высокой скоростью, при температуре,
подходящей для данного организма.
• То есть ферменты – это биологические
катализаторы, которые облегчают протекание
химической реакции и за счет этого увеличивают
её скорость.
47.
48. В каждой клетке насчитывается более сотни различных ферментов.
Сладковатый вкус во рту, которыйпоявляется при пережевывании
продуктов, содержащих крахмал
(например, риса или картофеля).
Появление сладкого вкуса связано с
работой фермента амилазы, которая
присутствует в слюне и расщепляет
крахмал. Крахмал является
полисахаридом, и сам по себе
безвкусный, но продукты
расщепления крахмала
(моносахариды) (мальтоза, глюкоза)
сладкие на вкус.
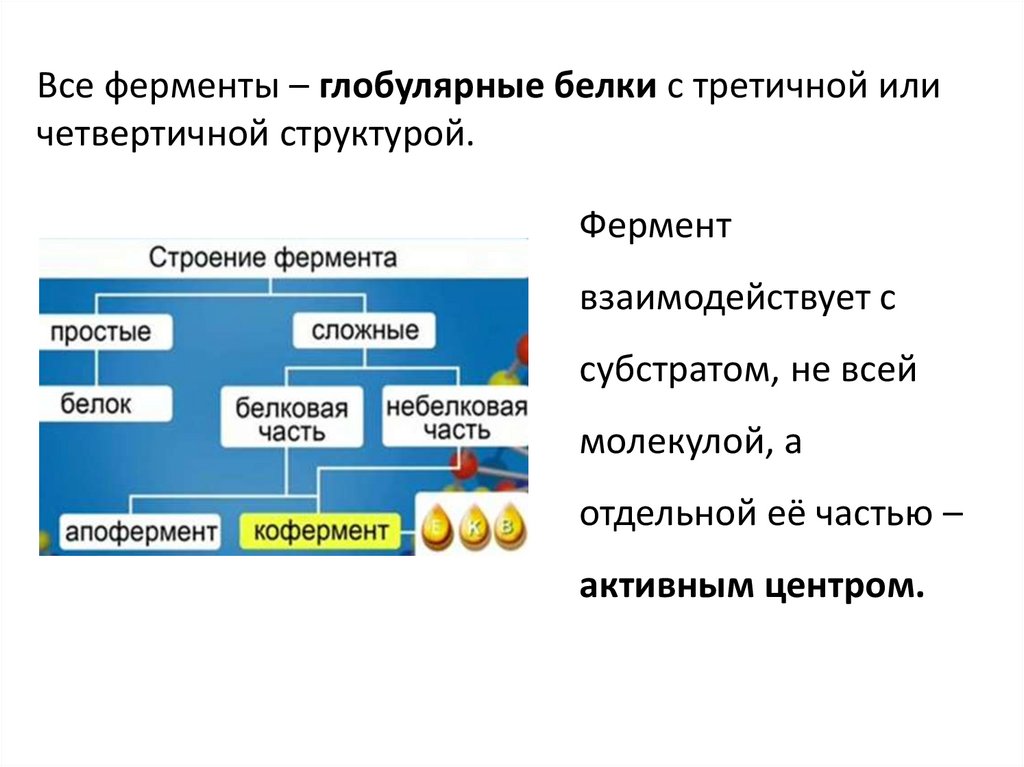
49. Все ферменты – глобулярные белки с третичной или четвертичной структурой.
Все ферменты – глобулярные белки с третичной иличетвертичной структурой.
Фермент
взаимодействует с
субстратом, не всей
молекулой, а
отдельной её частью –
активным центром.
50.
• Апофермент – белковая часть ферментовмикроорганизма, относящихся к классу
сложные белки. Небелковая часть –
кофермент. Комплекс апофермента с
кофактором – голофермент. Апофермент
при отсутствии кофермента не имеет
ферментативной активности. Состав
апофермента определяет избирательность
(специфичность) действия конкретного
фермента и возможные способы регуляции
его активности.
51. Механизм действия фермента
https://www.istockphoto.com/ru/видео/3dиллюстрация-белка-или-ферментаgm1139078591-30432285852. Механизм действия фермента
53. Механизм действия фермента
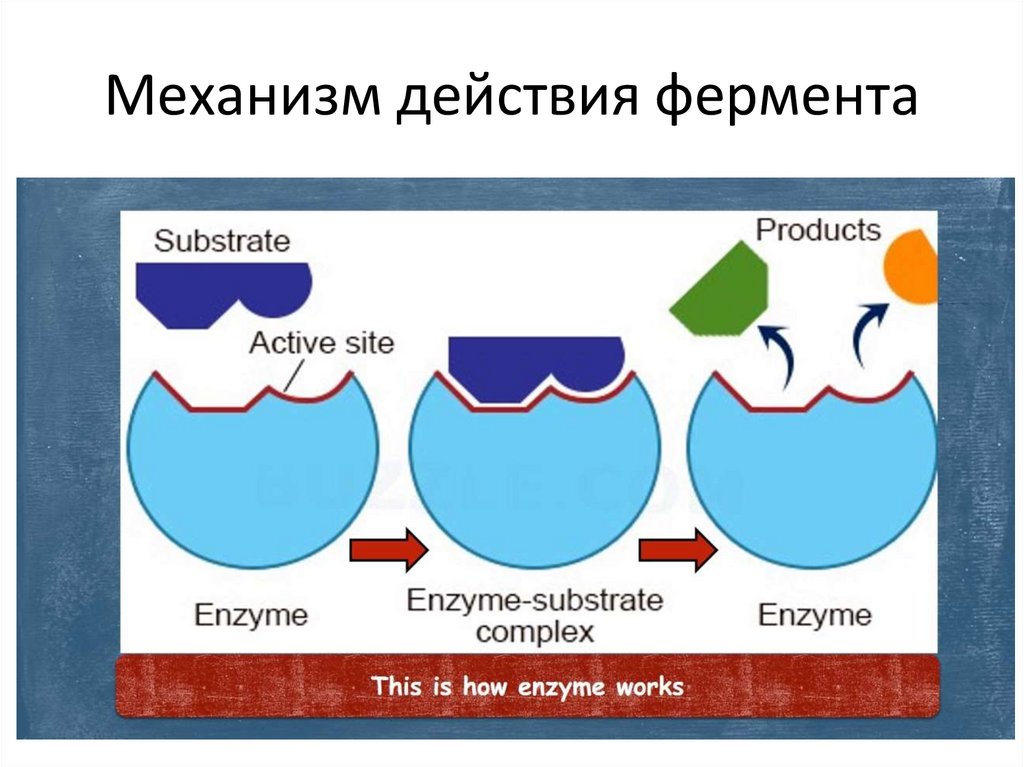
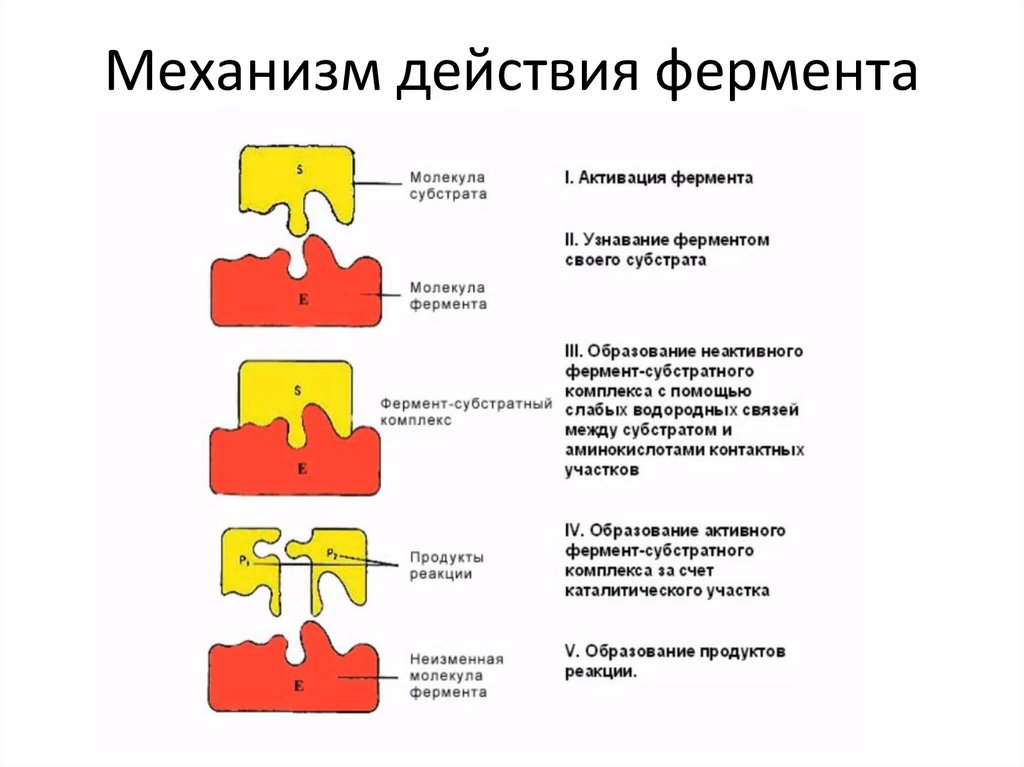
Фермент взаимодействует ссубстратом и образует
короткоживущий ферментсубстратный комплекс. По
завершении реакции, фермент-
субстратный комплекс распадается на
продукты и фермент. Фермент в итоге
не изменяется: по окончании реакции
он остается таким же, каким был до
неё, и может теперь
взаимодействовать с новой
молекулой субстрата
54. Механизм действия фермента
55. Особенностью ферментов является то, что они обладают высокой специфичностью, т. е. могут ускорять только одну реакцию или
реакцииодного типа.
В 1890 году Э. Г. Фишер предположил, что эта специфичность обусловлена
особой формой молекулы фермента, которая точно соответствует форме
молекулы субстрата. Эта гипотеза получила название «ключа и замка»,
где ключ сравнивается с субстратом, а замок – с ферментом. Гипотеза
гласит: субстрат подходит к ферменту, как ключ подходит к замку.
Избирательность действия фермента связана со строением его
активного центра.
56. Гипотеза «ключа и замка»
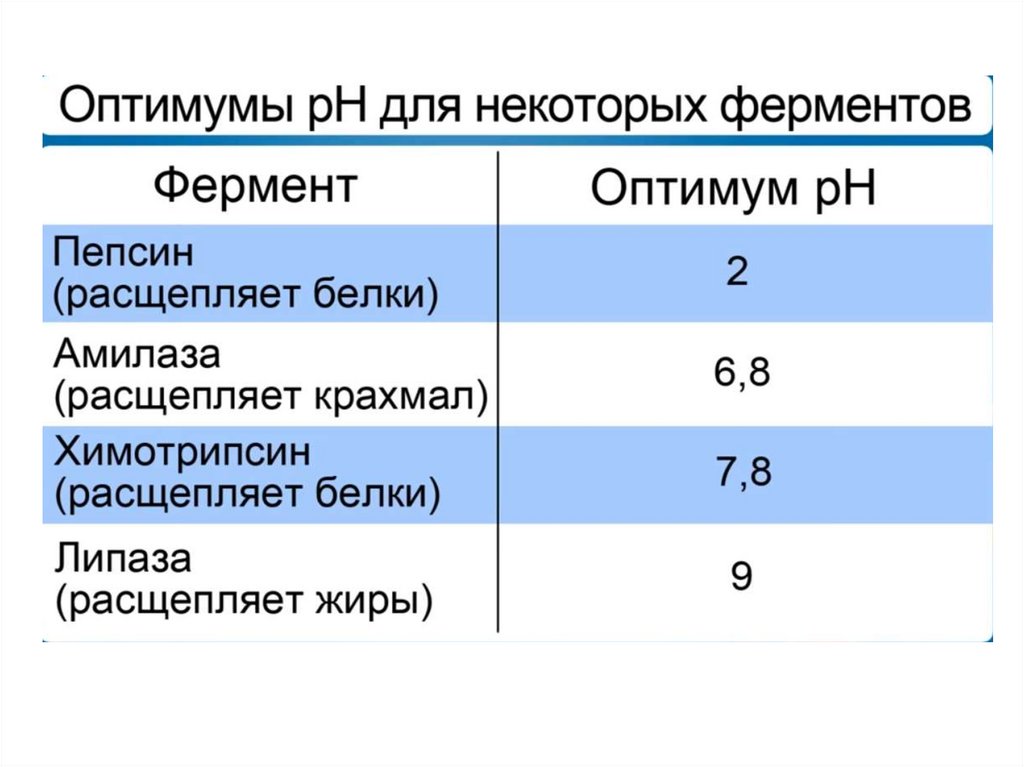
57. Активность фермента зависит:
• От температуры• От pH среды (кислотности – то есть
показателя концентрации ионов водорода).
58.
• С повышением температуры скорость химической реакциивозрастает. Температура, обеспечивающая наибольшую
активность фермента – оптимальная.
• За пределами оптимальной температуры скорость реакции
снижается вследствие денатурации белков. Когда температура
снижается, скорость химической реакции тоже падает.
• В тот момент, когда температура достигает точки замерзания,
фермент инактивируется, но при этом не денатурирует.
В большинстве случаев, ферменты работают при нейтральном
pH, т. е. при pH около 7. Но существуют ферменты, которые
работают либо в кислой и сильнокислой, либо в щелочной и
сильнощелочной среде.
Пепсин работает в сильнокислой среде и расщепляет белки.
Поскольку в желудке среда достаточно кислая, 1,5 – 2 pH, то этот
фермент работает при сильнокислой среде.
59.
60. Классификация ферментов
• Рабочее название состоит из названия субстрата,на который действует фермент, и окончания
«аза».
Вещество — лактоза, лактаза – это фермент
который его преобразует.
Сахароза (обыкновенный сахар), фермент, который
его расщепляет, – сахараза.
Ферменты, которые расщепляют протеины, носят
название протеиназы.
61.
62. Значение ферментов
Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они
расщепляют крахмал, белки и жиры. Все эти ферменты, как правило, входят в
состав комбинированных препаратов, таких как фестал и панзинорм, и
используются, в первую очередь, для лечения заболеваний желудочнокишечного тракта.
Ферменты применяют для растворения тромбов в кровеносных сосудах, при
лечении гнойных ран.
Особое место занимает энзимотерапия при лечении онкологических
заболеваний.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко
используются в пищевой промышленности.
В пищевой промышленности используется протеиназа, расщепляющая белки,
и липазы, расщепляющие жиры.
Ферменты амилазы используются в хлебопечении, виноделии и пивоварении.
Протеазы используются для смягчения мяса и при изготовлении готовых каш.
Липазы используются в производстве сыра.
Ферменты широко используются в косметической промышленности, входят в
состав кремов, некоторые ферменты входят в состав стиральных порошков.
63.
64.
• Почему ферменты слюны активны в ротовойполости, но теряют свою активность в
желудке?
• Ответ
• Ферменты слюны рассчитаны на работу в
щелочной среде (в ротовой полости
щелочная среда). Когда ферменты слюны
попадают в желудок, где среда кислая, они
денатурируют (изменяют свою форму) и
перестают подходить к своим субстратам
(углеводам пищи) как ключ к замку. Из-за
этого реакции, катализируемые ферментами
слюны, останавливаются.
65.
• Замораживание ферментов, в отличие отдействия высоких температур, не приводит
к потере их активности при возвращении в
нормальные условия. Чем это объясняется?
• Ответ
• 1) ферменты являются белками, поэтому
нагревание приводит к их необратимой
денатурации и потере активности;
2) низкие температуры вызывают
обратимую денатурацию белков, и в
нормальных условиях они восстанавливают
свою структуру и активность
66.
• Чем отличаются ферменты от неорганическихкатализаторов?
• Ответ
1) Ферменты – вещества белковой природы.
2) Каждый фермент ускоряет только одну
химическую реакцию.
3) Ферменты ускоряют химические реакции в
сотни тысяч и миллионы раз. Это намного
быстрее, чем при использовании
неорганического катализатора.
4) Ферменты активны только при определенных
условиях – температуре и кислотности среды, не
повреждающих структуру белка.
67.
68.
69. Углеводы
• Углеводы — обширная группа органическихсоединений, входящих в состав всех живых
организмов.
• В составе углеводов химические элементы:
С, Н, О
глюкоза C₆H₁₂O₆ - самый
распространённый углевод
70. Классификация углеводов
71. Растворимые углеводы, или сахара
Обычно имеют сладкий вкус и кристаллическоестроение. Это:
• свекловичный или тростниковый сахар, или
сахароза
• виноградный сахар, или глюкоза (греч. glykys —
сладкий);
• плодовый сахар, или фруктоза (лат. fructus —
плод);
• молочный сахар, или лактоза (лат. lac— молоко)
72. Нерастворимые углеводы, или полисахариды
Мономер полисахаридов - ГЛЮКОЗАНе имеют сладкого вкуса и кристаллического
строения.
Например:
Крахмал
Целлюлоза
Хитин
Гликоген
73. Углеводы в пище человека
• Легкоусваиваемые углеводы74. Углеводы в пище человека
Трудноусваиваемыеуглеводы
Неусваиваемые
углеводы
75.
76.
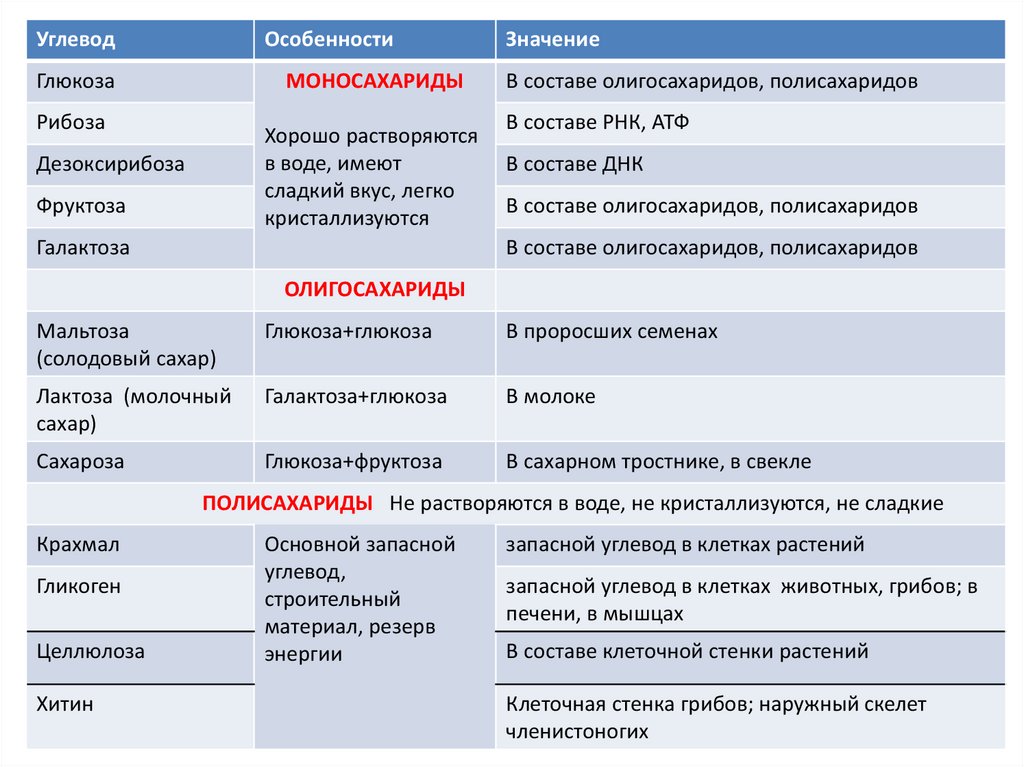
УглеводОсобенности
Глюкоза
МОНОСАХАРИДЫ
Рибоза
Хорошо растворяются
в воде, имеют
сладкий вкус, легко
кристаллизуются
Дезоксирибоза
Фруктоза
Галактоза
Значение
В составе олигосахаридов, полисахаридов
В составе РНК, АТФ
В составе ДНК
В составе олигосахаридов, полисахаридов
В составе олигосахаридов, полисахаридов
ОЛИГОСАХАРИДЫ
Мальтоза
(солодовый сахар)
Глюкоза+глюкоза
В проросших семенах
Лактоза (молочный
сахар)
Галактоза+глюкоза
В молоке
Сахароза
Глюкоза+фруктоза
В сахарном тростнике, в свекле
ПОЛИСАХАРИДЫ Не растворяются в воде, не кристаллизуются, не сладкие
Крахмал
Гликоген
Целлюлоза
Хитин
Основной запасной
углевод,
строительный
материал, резерв
энергии
запасной углевод в клетках растений
запасной углевод в клетках животных, грибов; в
печени, в мышцах
В составе клеточной стенки растений
Клеточная стенка грибов; наружный скелет
членистоногих
77.
78.
1.Какие вещества называются углеводами?2.Какой состав имеют молекулы углеводов?
3.По какому признаку углеводы делятся на
моно- и полисахариды? Каковы их
свойства?
4.Какие функции выполняют углеводы в
живых организмах?
79. ЛИПИДЫ
80.
Липиды – обширная группа жироподобныхвеществ, нерастворимых в воде.
О
СН2
О
С
О
R1
СН
О
С
О
R2
СН2
О
С
R3
Глицериновая
основа
Радикалы высших
жирных кислот
81.
Свойства липидов:1. Не растворяются в воде, но хорошо
растворяются в органических
растворителях (бензин, эфир, хлороформ)
2. Низкая теплопроводность
3. Окисляются с выделением воды
82.
КЛАССИФИКАЦИЯЖИРОВ
ПО
ПРОИСХОЖДЕНЮ
РАСТИТЕЛЬНЫЕ
ЖИВОТНЫЕ
ПОДСОЛНЕЧНОЕ
ЛЬНЯНОЕ
РАПСОВОЕ
ОЛИВКОВОЕ
СЛИВОЧНОЕ МАСЛО
ЖИВОТНОЕ САЛО
РЫБИЙ ЖИР
83. Полиненасыщенные жирные кислоты
• Компоненты некоторых жиров не могутсинтезироваться в организме человека и
должны обязательно поступать с пищей.
• Препятствуют развитию атеросклероза,
повышают устойчивость к инфекционным
заболеваниям.
• Пищевая ценность жира определяется
наличием незаменимых жирных кислот, а
также витаминов А, Е, D.
84.
Незаменимые жирные кислоты содержатся впродуктах
85. Липиды. Классификация.
• Нейтральные жиры (глицерин +жирныекислоты)
• Воски (высокомолекулярный спирт +жирные
кислоты)
• Фосфолипиды (спирт + жирные кислоты +
остаток фосфорной кислоты)
• Стероиды (в основе 4 бензольных кольца)
86.
энергетическаяструктурная
1г жира Q
Функции
жиров
РЕГУЛЯТОРНАЯ
38,9 кДж энергии
защитная
терморегуляция
запасающая
87.
в косметикеглицерин
Пищевой
продукт
лекарство
Применение
жиров
олифа
мыло
стеарин
маргарин
88.
1. Какие вещества относятся к липидам?2. Какое строение имеет большинство липидов?
3. Какими свойствами обладают липиды?
4. В каких клетках (тканях, органах) растений и
животных содержится больше всего липидов?
5. Многие животные, обитающие в условиях
холодного климата, имеют толстую подкожную
жировую клетчатку. Некоторые обитатели степей и
пустынь также усиленно запасают подкожный жир.
Какие функции выполняют жиры в организме этих
животных?
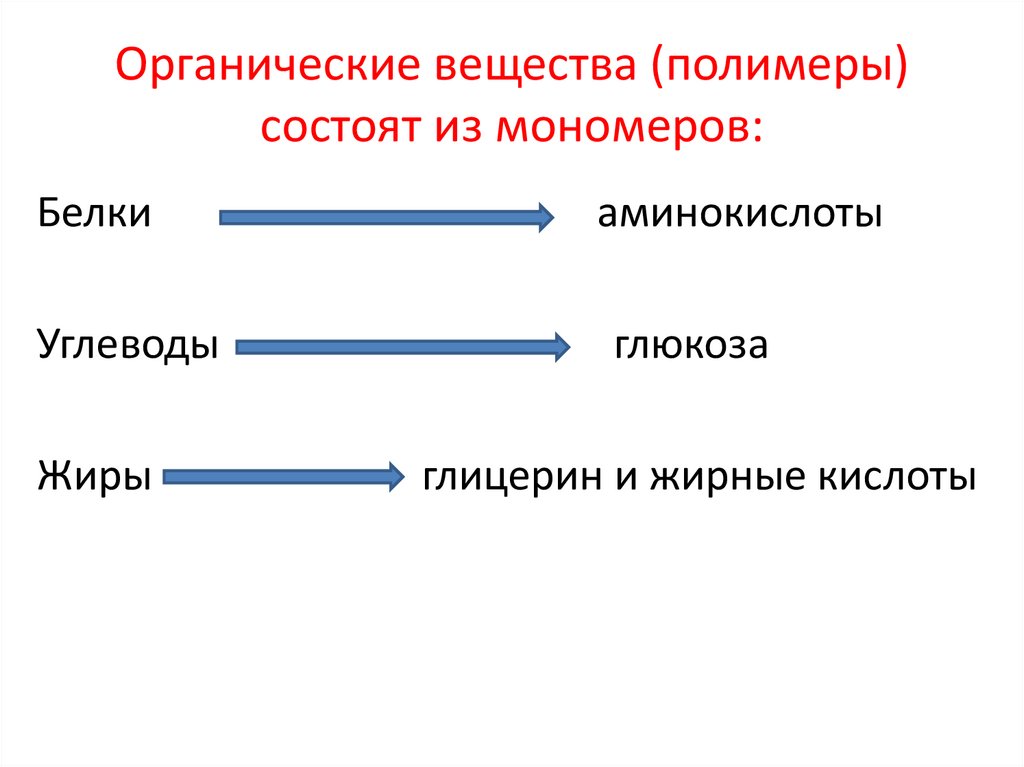
89. Органические вещества (полимеры) состоят из мономеров:
Белкиаминокислоты
Углеводы
глюкоза
Жиры
глицерин и жирные кислоты










































































 Биология
Биология








