Похожие презентации:
Окислительно - восстановительные реакции
1.
Окислительно-восстановительные реакции1. Степень окисления.
2. Окислительно-восстановительные реакции (ОВР).
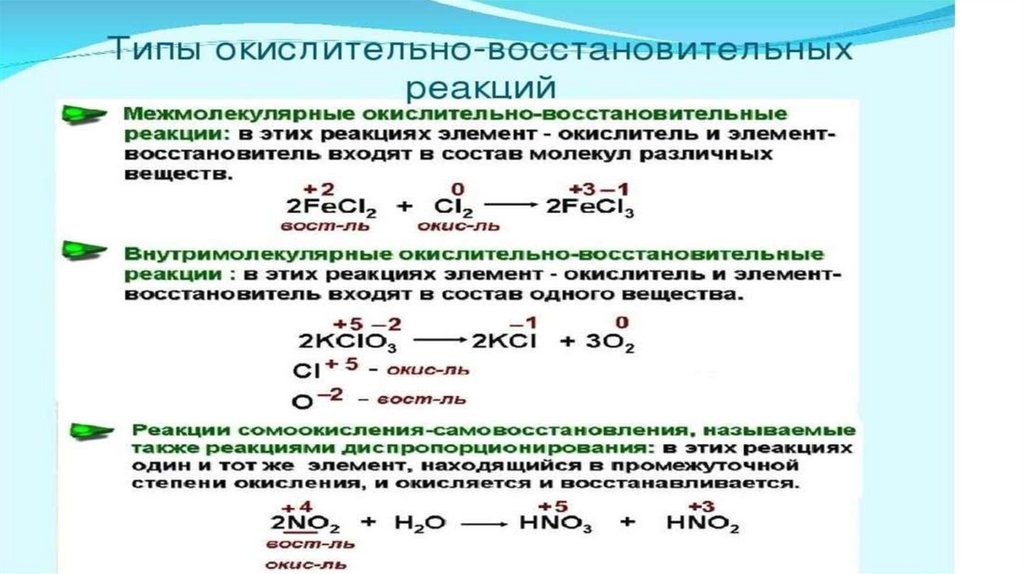
3. Классификация окислительно-восстановительных реакций.
4. Подбор коэффициентов по методу полуреакций
2.
Степень окисления – это условный заряд атома в молекуле,вычисленный исходя из предположения, что соединение состоит
только из ионов. Для расчета степеней окисления элемента в
соединениях выработаны простые и удобные эмпирические
правила. Рассмотрим их.
1. В простых веществах степени окисления атомов равны нулю (О20,
Zn0).
2. Постоянную степень окисления имеют щелочные металлы (+1),
щелочно-земельные металлы (+2), фтор (-1).
3. Степень окисления водорода в соединениях +1 (кроме гидридов
активных металлов), кислорода в соединениях -2 (кроме пероксидов и
фторидов).
4. Степень окисления иона элемента равна заряду иона.
5. Высшая степень окисления элементов равна номеру группы
периодической системы Д.И. Менделеева, в которой находится
данный элемент.
6. Низшая степень окисления металлов равна нулю, а неметаллов –
номеру группы в ПСХЭ за вычетом восьми.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
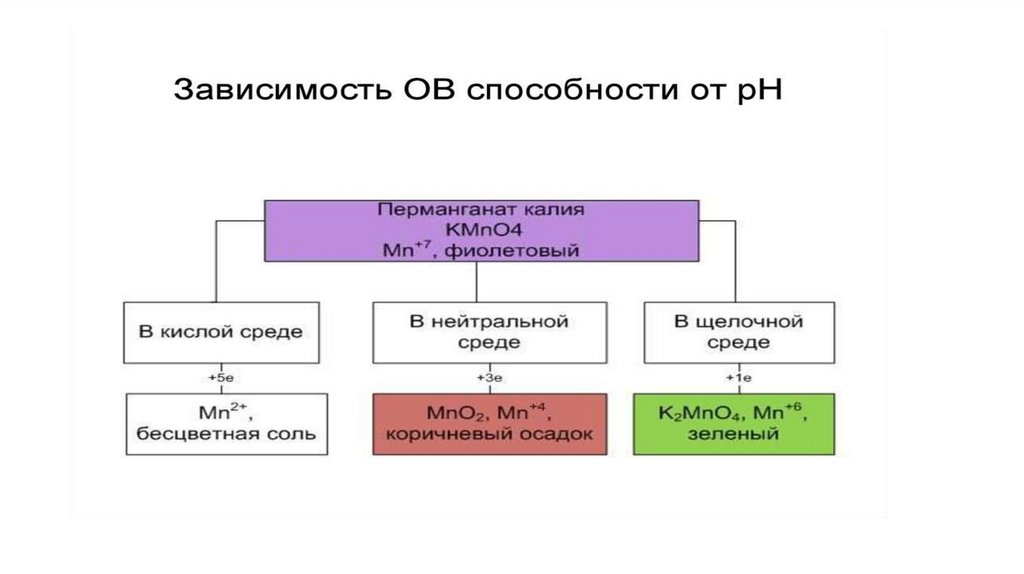
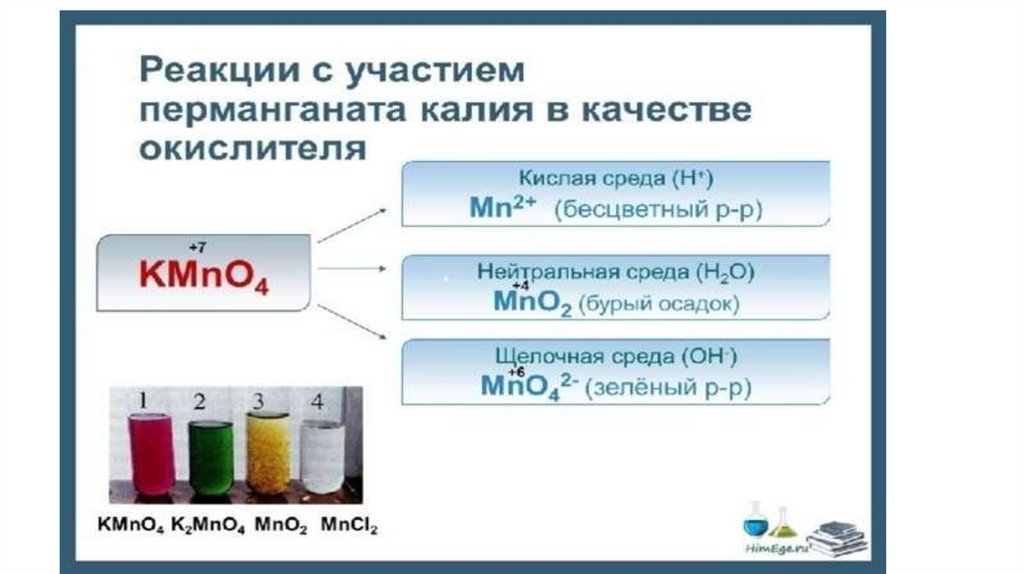
pH < 7• K2Cr2O7 + H2O2 + H2SO4 → Cr2(SO4)3 + O2 + K2SO4 + H2O
18.
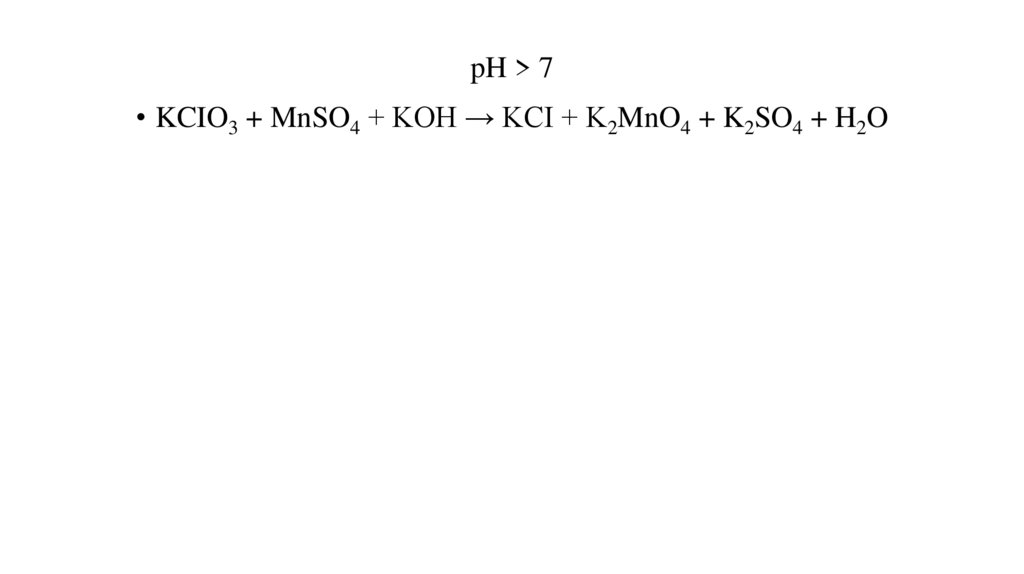
pH > 7• KCIO3 + MnSO4 + KOH → KCI + K2MnO4 + K2SO4 + H2O
19.
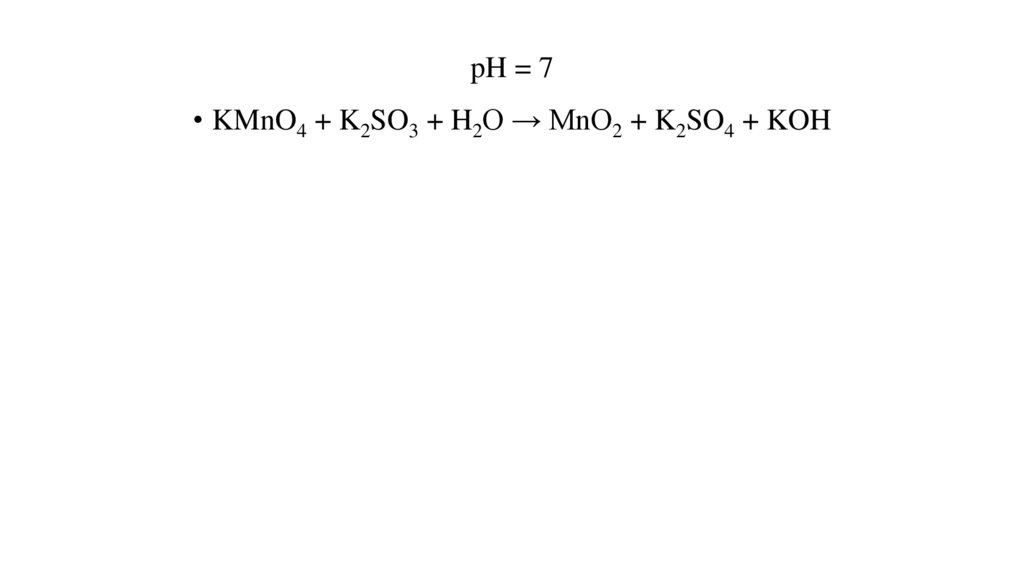
pH = 7• KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + KOH










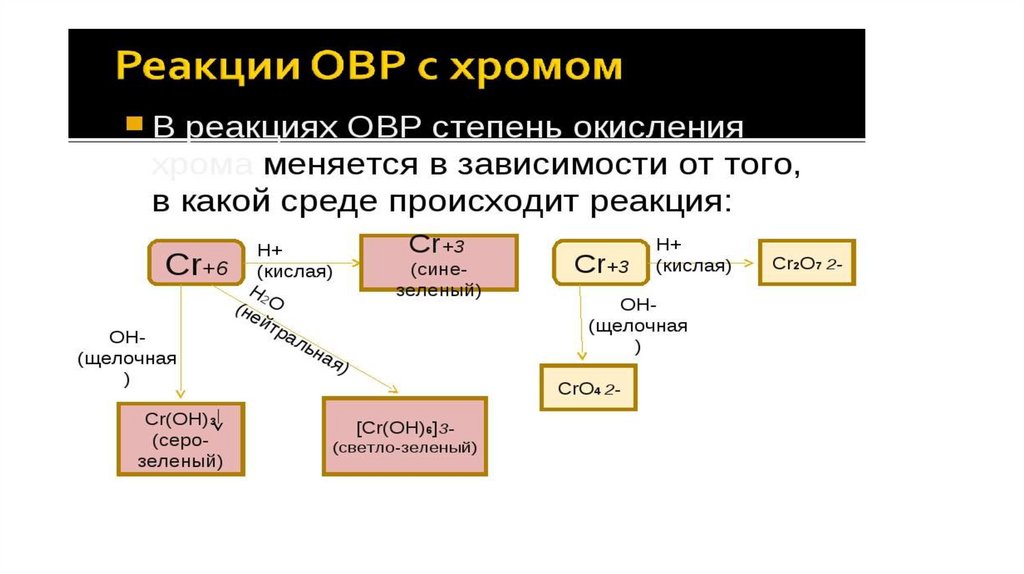
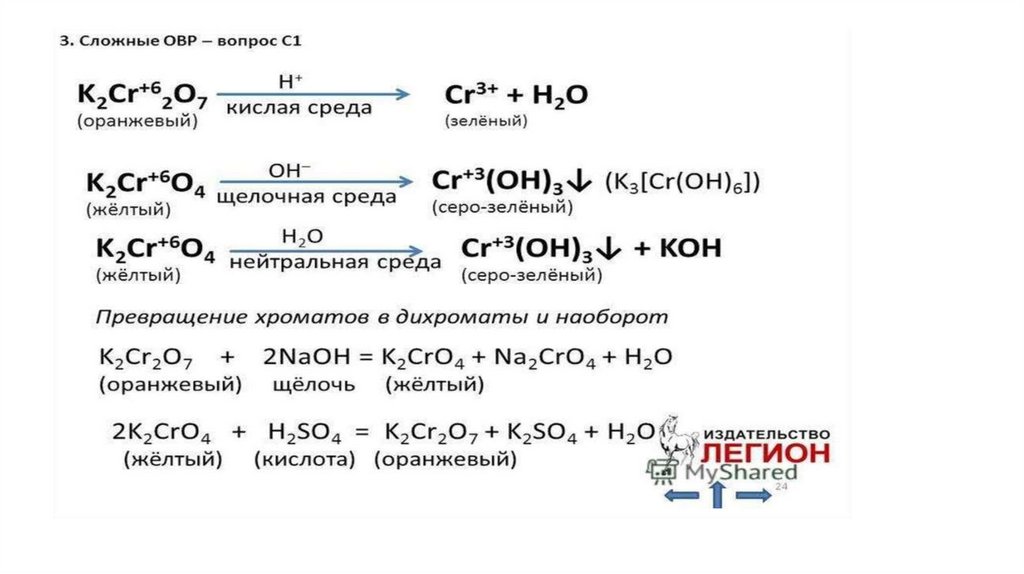
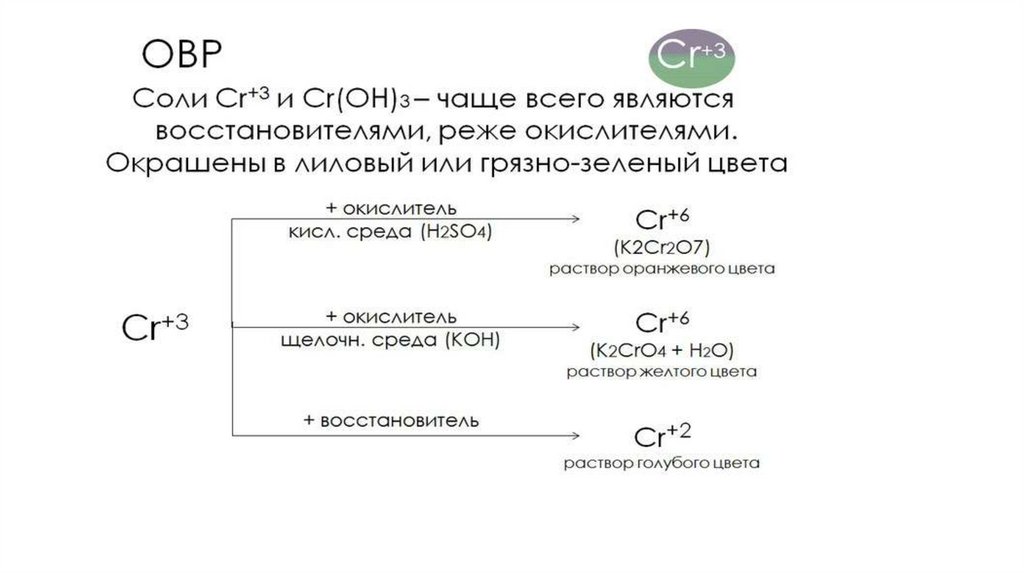


 Химия
Химия