Похожие презентации:
Бериллий, магний и щёлочноземельные металлы
1.
2.
3. ТЕМА УРОКА???
4.
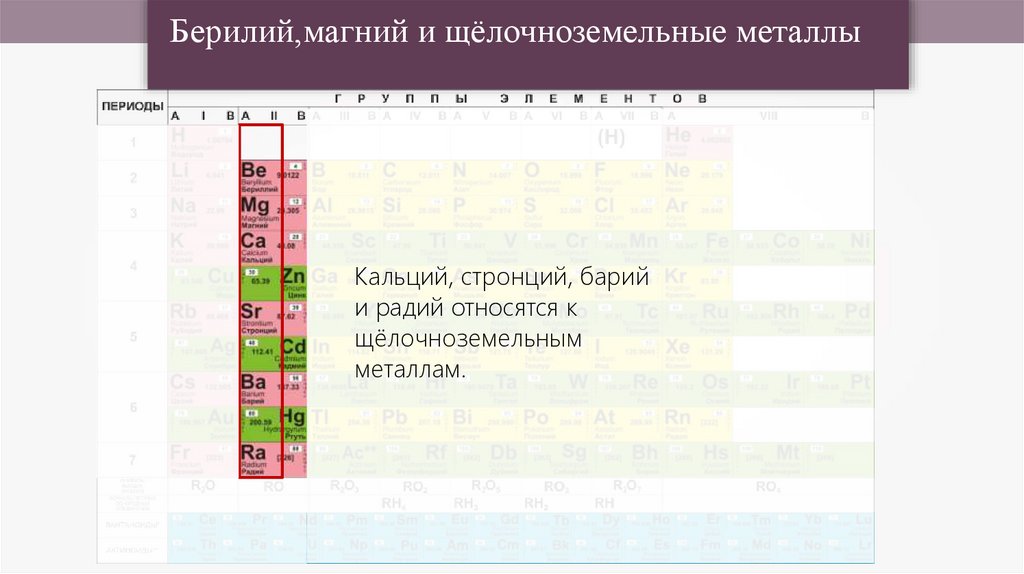
Берилий,магний и щёлочноземельные металлыКальций, стронций, барий
и радий относятся к
щёлочноземельным
металлам.
5. МЕТАЛЛЫ II ГРУППЫ главной подгруппы
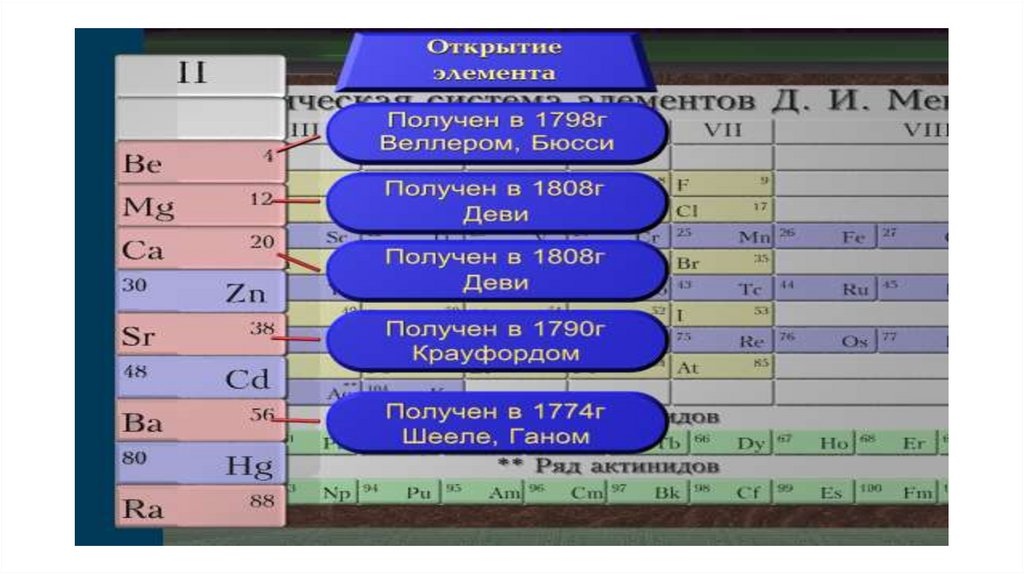
ПЛАН:1.Немного об истории…
2.Распространение в природе.
3.Общая характеристика IIА группы.
4.Физические свойства.
5.Химические свойства ЩЗМ
6.Характеристика кальция
• Содержание в организме. Физические свойства.
• Химические свойства. Получение и применение.
6.
7.
8.
9.
10. Общая характеристика IIА группы
• Что общего в строении атомов?• Чем отличаются?
• Как изменяются металлические свойства с
возрастанием порядкового номера?
• Чем являются при химических взаимодействиях?
• Какую степень окисления имеют во всех
соединениях?
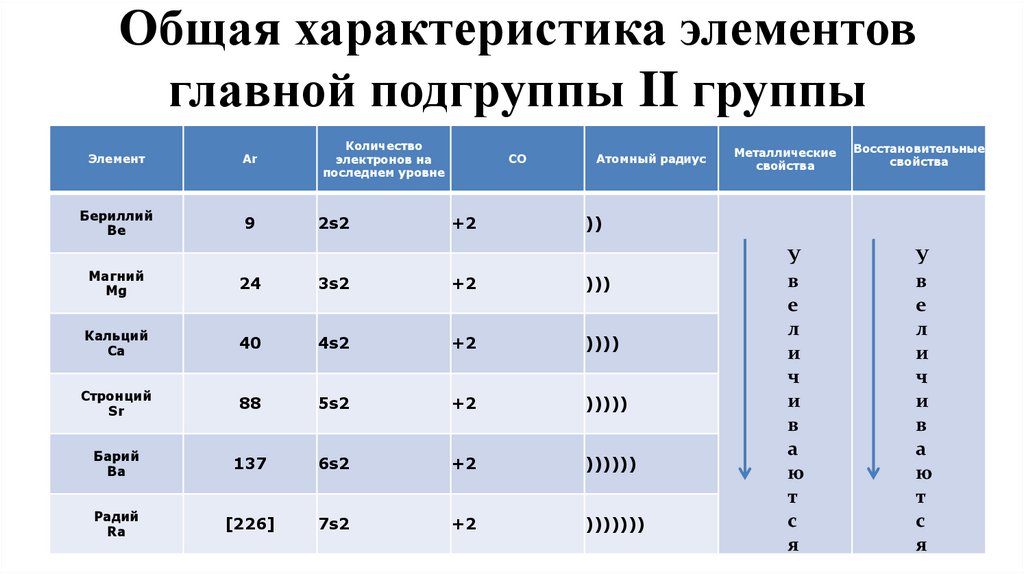
11. Общая характеристика элементов главной подгруппы II группы
ЭлементAr
Количество
электронов на
последнем уровне
Бериллий
Be
9
2s2
СО
+2
Атомный радиус
Металлические
свойства
Восстановительные
свойства
))
Магний
Mg
24
3s2
+2
)))
Кальций
Ca
40
4s2
+2
))))
Стронций
Sr
88
5s2
+2
)))))
Барий
Ba
137
6s2
+2
))))))
Радий
Ra
[226]
7s2
+2
)))))))
У
в
е
л
и
ч
и
в
а
ю
т
с
я
У
в
е
л
и
ч
и
в
а
ю
т
с
я
12.
• Ве - амфотерный металл,• Mg – металл,
• Сa, Sr,Ba - щёлочноземельные металлы
• Ra –радиоактивный элемент
13. Общая характеристика элементов главной подгруппы II группы
Одинаковое строение внешнего электронного слояЭлементы проявляют Степень Окисления +2
Атомы элементов являются сильными восстановителями, т.к
содержат 2 электрона на внешнем энергетическом уровне,
которые отдают при взаимодействиями с другими элементами.
С увеличением № элементов увеличивается атомный радиус,
увеличивается число электронных слоев, следовательно
возрастает легкость отдачи электронов. Восстановительные
свойства увеличиваются в группе сверху вниз.
14.
DePiepPtyx
Chemicalinterest
Бериллий
Магний
15.
PtyxChemicalinterest
Барий
Магний
16.
Alchemist-hpСтронций
Jurii
Кальций
17. Физические свойства
Серебристо-белые, стронций имеет золотистыйцвет, с металлическим блеском, твердые, хрупкие,
низкая пластичность , быстро окисляются на
воздухе, поэтому их хранят в керосине.
Хорошо проводят электрический ток.
Плотность возрастает от Ве к Ra, температура
плавления от Ве к Ra уменьшается.
Образуют соединения с ионной связью.
18. Химические свойства элементов II группы главной подгруппы
Химические свойства элементов II группыглавной подгруппы
1.С кислородом
2M+O2=2MO (оксид)
2.С галогенами
M+Cl2=MCl2 (хлорид)
3.С серой
M+S=MS (сульфид)
4.С азотом
3M+N2=M3N2 (нитрид)
5.С водородом
M+H2=MH2 (гидрид)
6.С водой
M+2H2O=M(OH)2+H2
19. КАЛЬЦИЙ
CaКАЛЬЦИЙ
20.
Кальций21.
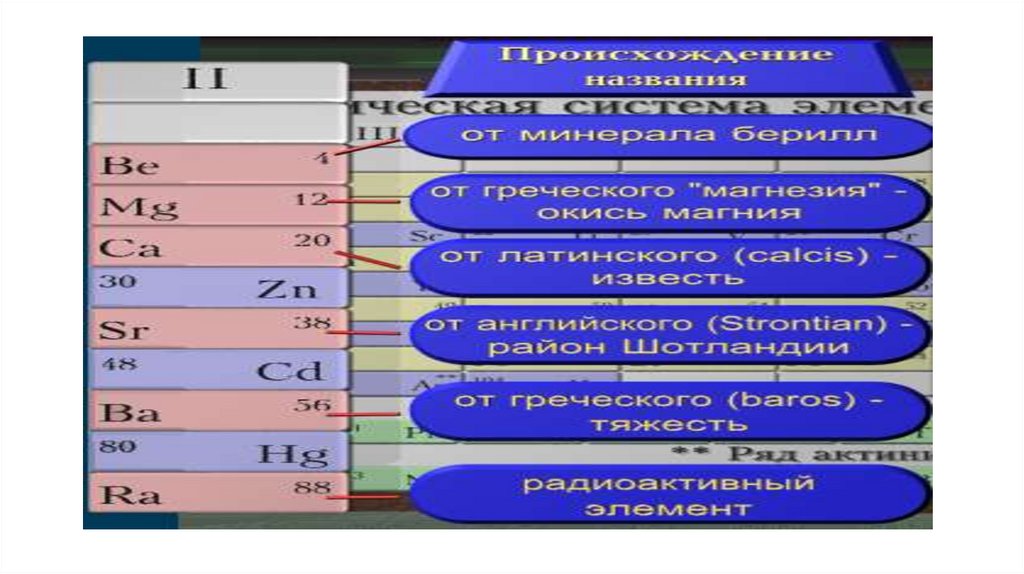
В латинском языкеслово «calcis» обозначает
известь и сравнительно
мягкие, легко
обрабатываемые камни, в
первую очередь мел и
мрамор. От этого слова и
произошло название
элемента №20.
Содержание
кальция в
организме
человека
достигает 2 %.
22. ФИЗИЧЕСКИЕ СВОЙСТВА
1.Имеет металлическую кристаллическую решётку.2.Серебристо-белого цвета.
3.Мягкий, но тверже щелочных.
4.Плотность – 1,54 г/см3=> легкий.
5.Температура плавления + 8450
6.Хранят под слоем керосина.
23. Химические свойства кальция
Кальций взаимодействует с простыми веществами – неметаллами:1. С фтором реагирует на холоду
Са + F2 →
2.С хлором и бромом при нагревании до 4000
Са + Cl2 →
3.При нагревании на воздухе или в кислороде воспламеняется, давая основный оксид
Са + О2 →
Mg + О2 →
4.Трудно вступает в реакции с азотом и фосфором
Са + N2 →
Са + Р →
5.Взаимодействуя с сухим водородом, образует гидрид
1.
Са + Н2 →
24. Химические свойства
6.Взаимодействие со сложными веществами:• с водой, с образованием водорода:
Ca + H2O →
• с кислотами: (кроме концентрированной HNO3)
Ca + H2SO4 →
7.Подобно алюминию, кальций и магний способны восстанавливать редкие
металлы из их оксидов:
Са + V2О5 →
кальцийтермия
Mg + TiO2 →
магнийтермия
25. Получение и применение.
• В промышленности кальций получают двумя способами:• 1.Нагреванием брикетированной смеси СаО и порошка Al
при 1200˚С в вакууме 0,01-0,02 мм.рт.ст. Выделяющиеся по
реакции:6CaO+2Al=3CaO*Аl2O3+3Ca пары кальция
конденсируются на холодной поверхности;
• 2.Электролизом расплава CaCl2 и KCl
CaCl2 = Са + Cl2↑
2 KCl = 2К + Cl2↑
26. Справедливы ли следующие утверждения?
•Щелочноземельные металлы занимают IIА группу ПСХЭД.И.Менделеева.
•На внешнем уровне атома магния содержится один электрон.
•Восстановительные свойства кальция выражены слабее, чем у
калия.
•При горении все щелочноземельные металлы образуют оксиды.
•Кальций используют для производства проводов.
•Щелочноземельные металлы – это малоактивные простые
вещества.
27. Домашнее задание:
§ 15, стр.96-98,упр.1, стр.106























 Химия
Химия








