Похожие презентации:
Комплементарное взаимодействие между белками и лигандами: иммунная система и иммуноглобулины
1.
Комплементарное взаимодействие между белками илигандами: иммунная система
и иммуноглобулины
This presentation is prepared by Ali Tilek
2.
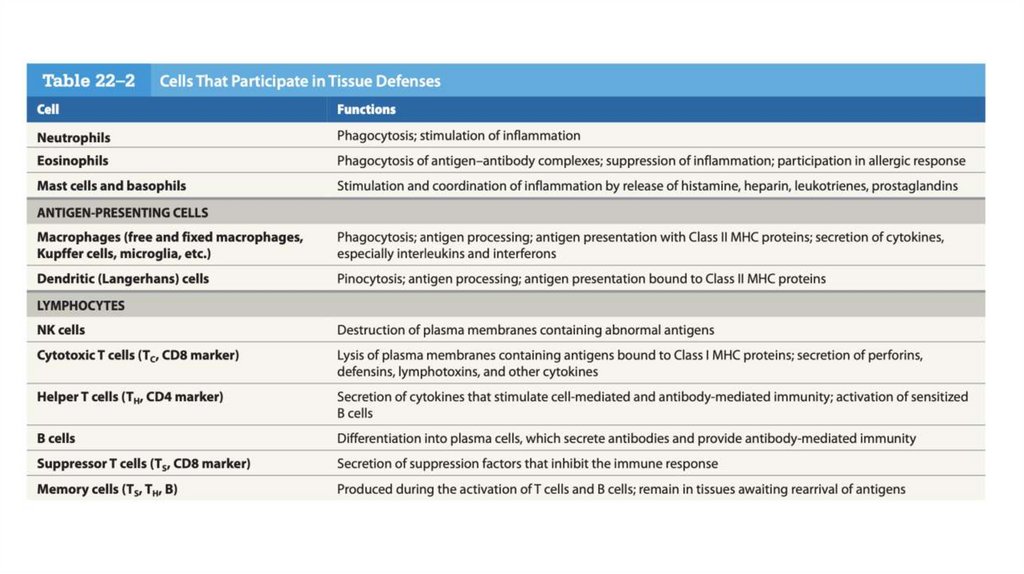
• У всех позвоночных есть иммунная система, способная различать«свои» и «чужие» молекулы, а затем уничтожить те, что
воспринимаются как «чужие».
• Иммунитет складывается из действия двух взаимодополняющих
систем — гуморальной и клеточной.
• Гуморальный иммунитет (от лат. humor — жидкий) направлен
против бактериальных инфекций и внеклеточных вирусов (тех, что
попадают в жидкости организма), но может также реагировать на
введение в организм и отдельных белков.
• Клеточный иммунитет разрушает хозяйские клетки, пораженные
вирусом, а также уничтожает некоторых паразитов и чужеродные
ткани.
3.
• Главным элементом гуморального иммунитета являютсярастворимые белки, называемые антителами или
иммуноглобулинами (Ig). Иммуноглобулины связываются с
бактериями, вирусами и крупными чужеродными молекулами,
которые должны быть уничтожены. Иммуноглобулины,
составляющие до 20% белков крови, образуются в В-клетках (Влимфоцитах), называемых так потому, что они окончательно
созревают в костном мозге (англ. bone marrow).
• Главным элементом клеточного иммунитета являются
определенные Т-клетки (Т-лимфоциты, чье название
происходит от тимуса, где они заканчивают свое созревание), а
именно цитотоксические Т-клетки (ЦТЛ), или клетки-киллеры.
(T-рецепторы)
• Кроме цитотоксических Т-клеток существуют Т-клеткипомощники, или Т-хелперы (ТН). Их функция состоит в
образовании растворимых сигнальных белков цитокинов, к
которым, в частности, относятся интерлейкины.
4.
5.
• В организме человека может вырабатываться более 108 различных антител,каждое из которых отличается определенной специфичностью.
• Такое необычайное разнообразие делает возможным узнавание и
связывание практически любой химической структуры на поверхности
вирусов или чужеродных клеток.
• Любые молекулы или патогены, способные вызвать иммунный ответ,
называются антигенами. Антигеном может быть вирус, клеточная стенка
бактерии, отдельный белок или другая макромолекула.
• Каждое антитело и каждый Т-клеточный рецептор связываются лишь с одной
конкретной молекулярной структурой антигена, называемой эпитопом.
• Иммунная система не реагирует на небольшие молекулы, которые являются
обычно промежуточными или конечными продуктами клеточного
метаболизма. Молекулы с молекулярной массой менее 5000, как правило, не
вызывают иммунного ответа
6.
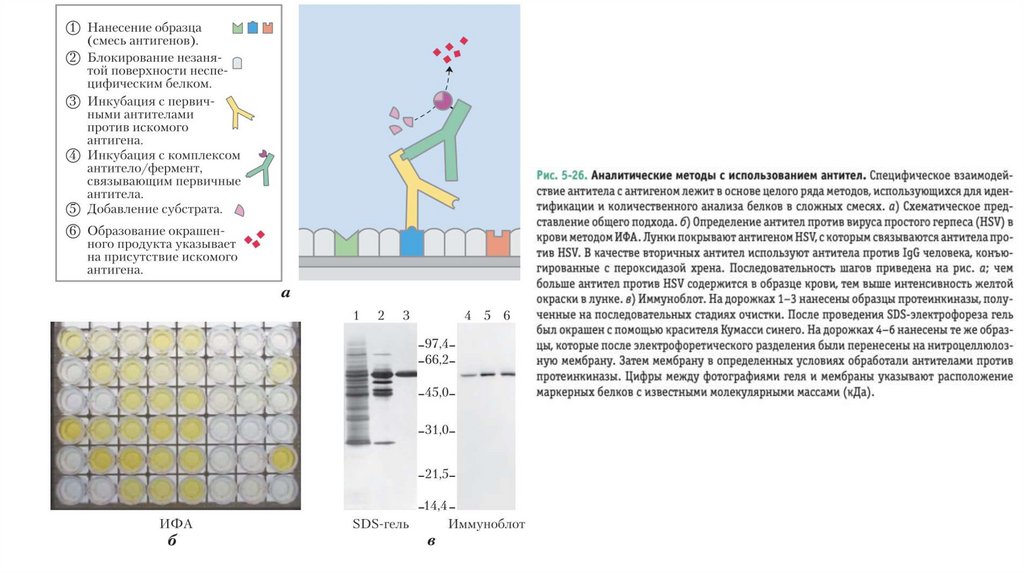
• Однако в лабораторных условиях небольшие молекулыможно присоединить с помощью ковалентной связи к
крупным белкам, и этот комплекс в целом будет вызывать
иммунный ответ. Такие малые молекулы называются
гаптенами. Антитела, образующиеся в ответ на введение в
организм комплекса белка с гаптеном, способны
связываться и со свободными гаптенами. Подобные
антитела иногда используют для разработки аналитических
тестов, о которых речь пойдет дальше, или в качестве
каталитических антител
7.
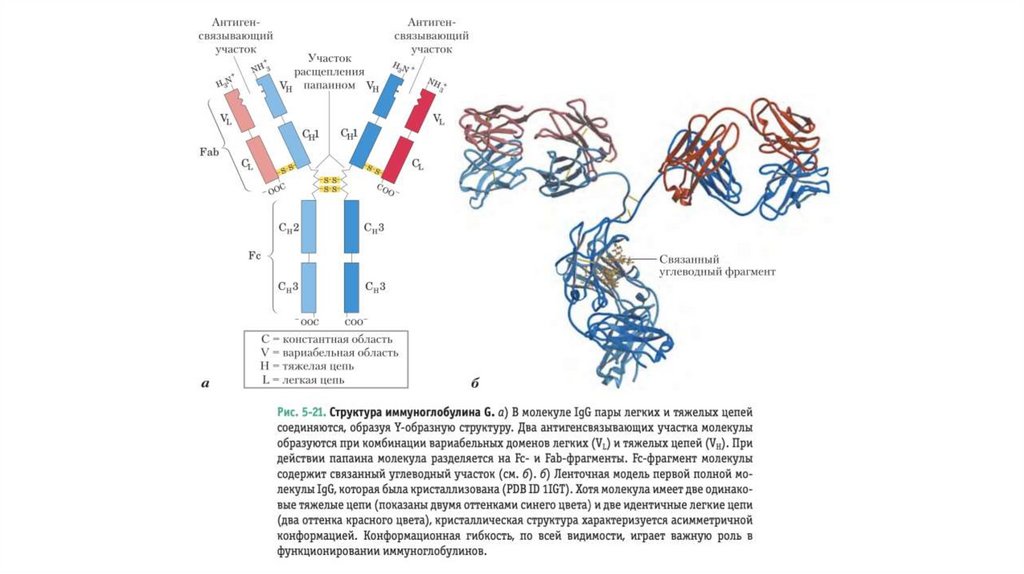
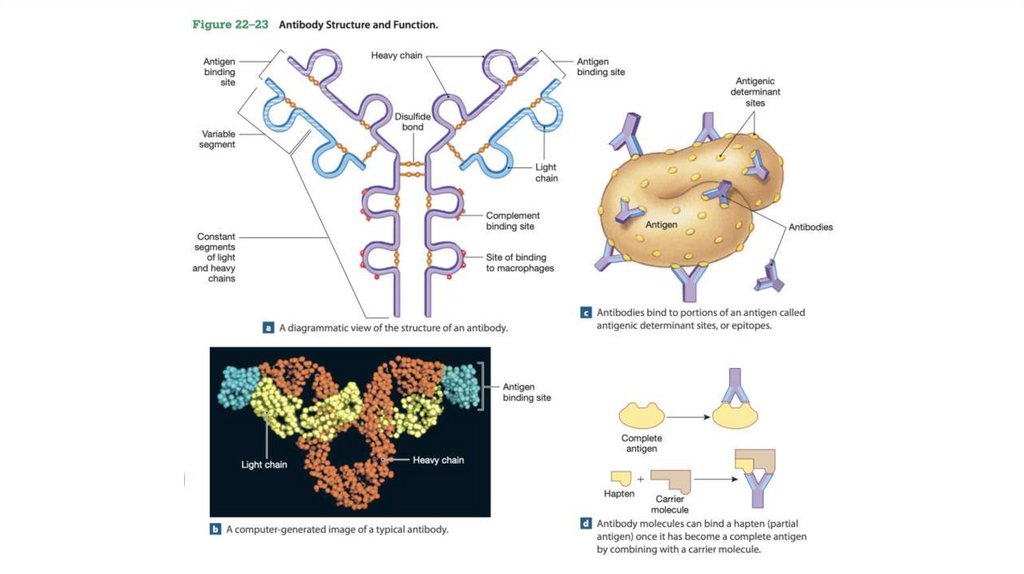
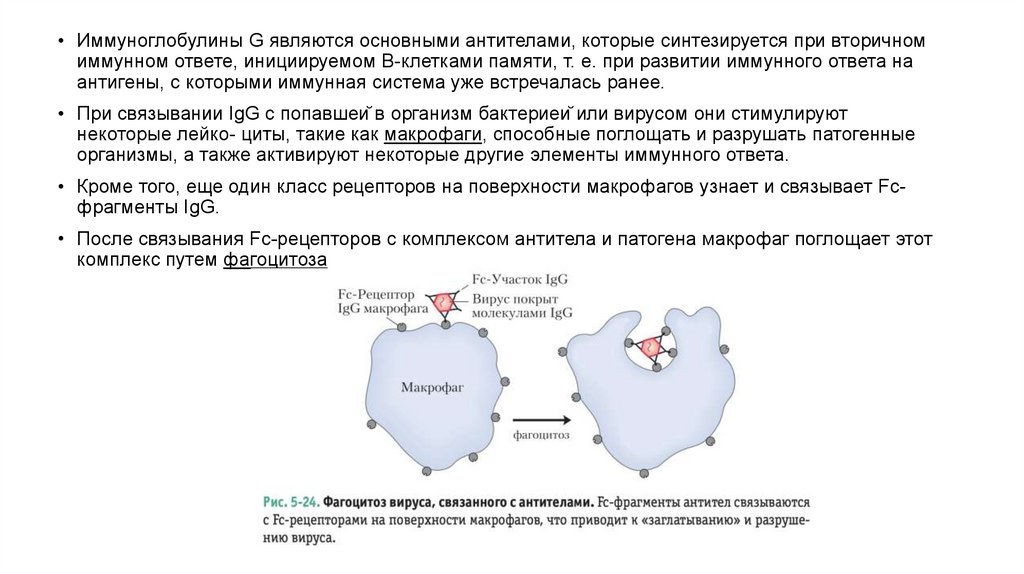
Антитела имеют два идентичных центра связыванияантигена
• Основной класс антител представлен иммуноглобулинами G (IgG); в сыворотке крови на
них при- ходится значительная доля от всего белка
• Молекулы IgG построены из четырех полипептидных цепей — двух больших, называемых
тяжелыми цепями, и двух легких цепей, которые связаны между собой нековалентными
связями и дисульфидными мостиками в крупный комплекс с молекулярной массой 150 000.
• Тяжелые цепи IgG взаимодействуют между собой на одном конце молекулы, а затем
разделяются, и каждая цепь взаимодействует с одной легкой цепью, в результате чего
молекула имеет Y-образную структуру
• Протеазы могут расщеплять молекулу иммуноглобулина в местах «шарниров», отделяющих
«ствол» IgG от его «ветвей». Расщепление папаином приводит к разделению «ствола»,
называемого Fc-фрагментом, поскольку он обычно легко кристаллизуется (от англ.
crystallized fragment), и двух «ветвей», называемых Fab-фрагментами (от англ. antigenbinding fragment). На каждом из Fab-фрагментов есть по одному участку связывания
антигена.
8.
9.
10.
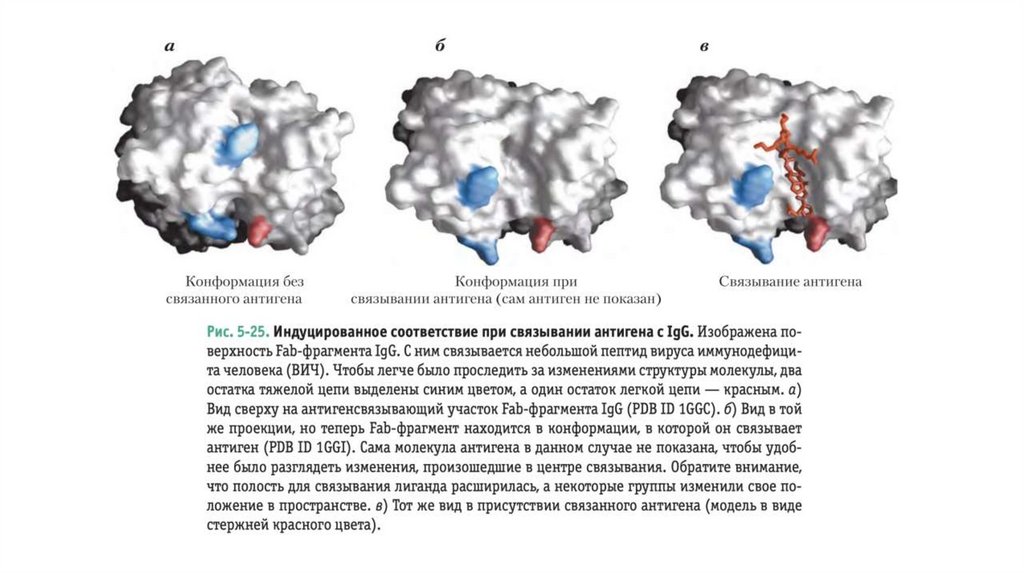
• Структура иммуноглобулинов была впервыеопределена Джеральдом Эдельманом и Родни
Портером.
• Каждая цепь иммуноглобулина содержит четко
идентифицируемые домены, причем
некоторые из них обладают одинаковой
структурой во всех типах IgG, а другие
различаются.
• Консервативные (константные) домены несут
характерные структурные мотивы, называемые
иммуноглобулиновой складчатостью,
которые встречаются во всех белках с βструктурой
• Три константных домена есть в каждой
тяжелой цепи, а один — в легкой цепи. Как
тяжелые, так и легкие цепи несут по одному
вариабельному домену, в которых
наблюдается максимальное коли- чество
аминокислотных замен. Вместе вариабельные
домены тяжелых и легких цепей образуют
центр связывания антигена
11.
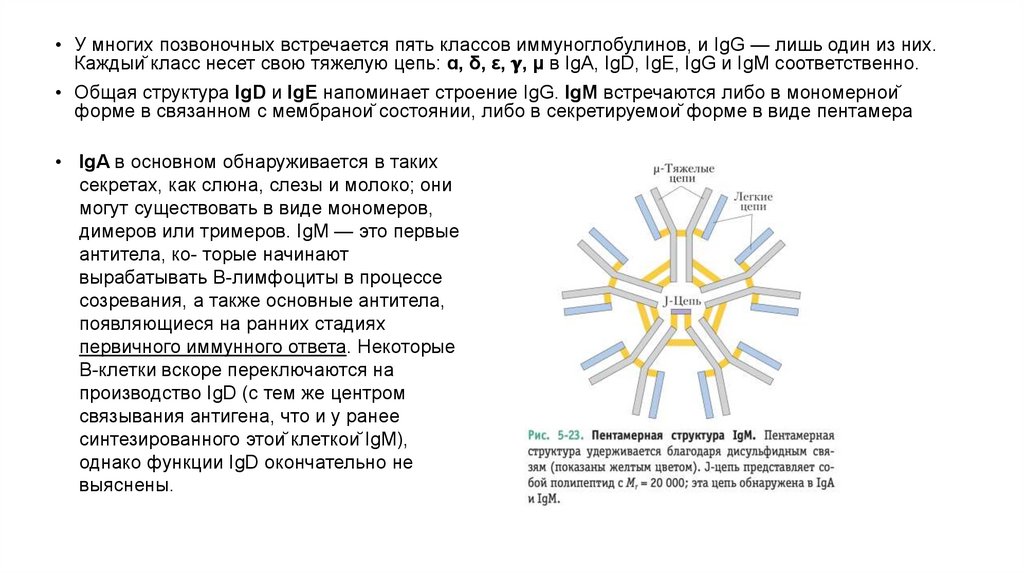
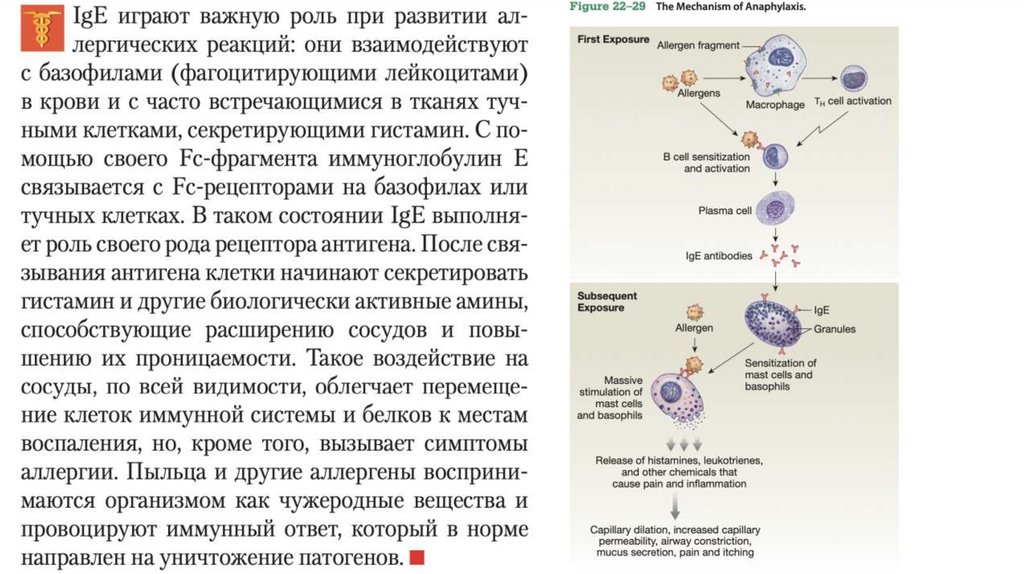
• У многих позвоночных встречается пять классов иммуноглобулинов, и IgG — лишь один из них.Каждый класс несет свою тяжелую цепь: ɑ, δ, ε,























 Биология
Биология