Похожие презентации:
Воздух – смесь различных газов. Охрана воздуха
1.
Воздух –смесь различных газов.
Охрана воздуха.
2. 1. Воздух-смесь газов.
Воздух окружает нас повсюду.Воздух – это смесь различных газов.
Основные газы воздуха – азот и
кислород.
Больше всего в воздухе азота – 78%.
Он выделяется из земной коры в
результате деятельности микроорганизмов.
В смеси различных газов кислород
составляет 21%.
В оставшийся 1% входят углекислый
газ, водород, неон, гелий, озон и прочие
газы.
Содержание водяного пара неодинаково.
3. 2.Анализ практической работы
Определим загрязненность воздуха сажей –продуктом неполного сгорания топлива.
Отобрали пробы снега в трех разных местах: возле дома, в парке, возле
котельной
4. Результаты измерений
Масса фильтра – 0,6 г.Масса фильтра с частицами вещества, взятого
вместе со снегом:
- возле дома – 0,7 г
- около котельной – 0,9 г
- в парке - 0,78 г.
Результаты опыта показали, что даже в нашем
населенном пункте происходит загрязнение
воздуха, хоть и не значительное. По результатам
исследования воздух больше загрязнен возле
котельной, чем в частном секторе.
5. Отфильтрованная снеговая вода
В паркеВозле котельной
Возле дома
6. Заключение.
1.Воздух – это смесь газов:- азот - 78%
- кислорода -21%
- углекислый газ, водород, неон, гелий, озон и
прочие газы - 1%
2. Нам всем следует изменить свое отношение к природе, понять
свое
место. Многие, если не все, проблемы связаны с нашей
экологической
безграмотностью. И первоочередная задача состоит в том, что
необходимо информировать человечество о экологических,
природоохранительных знаниях, способствовать формированию их
экологической культуры. Но это можно сделать лишь при личной
заинтересованности человека, при достаточном уровне его культуры
и
ответственности за свою и чужие жизни.
7.
8. Положение кислорода в ПСХЭ Менделеева Электронное строение.
2 период, VI-А группаРодоначальник главной подгруппы VI группы.
«Халькогены» - рождающие руды
(O,S,Se,Te,Po)
O
8
15,9994
[He]2s22p4
Кислород
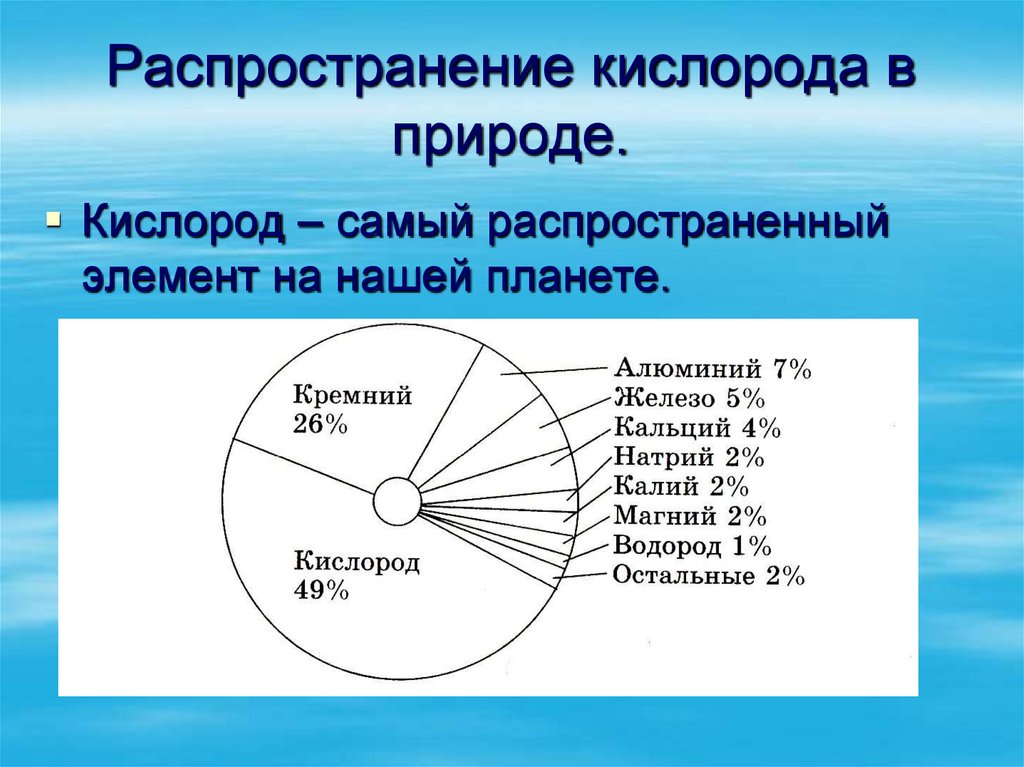
9. Распространение кислорода в природе.
Кислород – самый распространенныйэлемент на нашей планете.
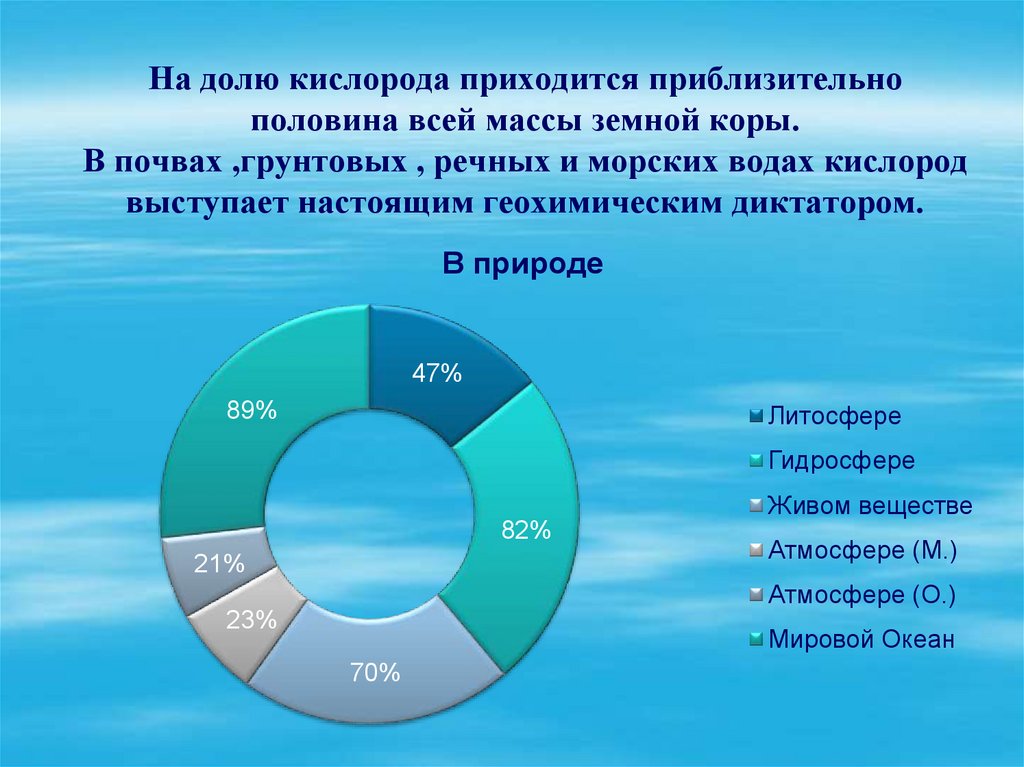
10. На долю кислорода приходится приблизительно половина всей массы земной коры. В почвах ,грунтовых , речных и морских водах
кислородвыступает настоящим геохимическим диктатором.
В природе
47%
89%
Литосфере
Гидросфере
Живом веществе
82%
21%
Атмосфере (М.)
Атмосфере (О.)
23%
Мировой Океан
70%
11. Физические свойства кислорода.
Газ без цвета, запаха и вкуса;В жидком состоянии имеет светлоголубую окраску, в твердом – синюю;
В воде газообразный кислород
растворим лучше, чем азот и водород.
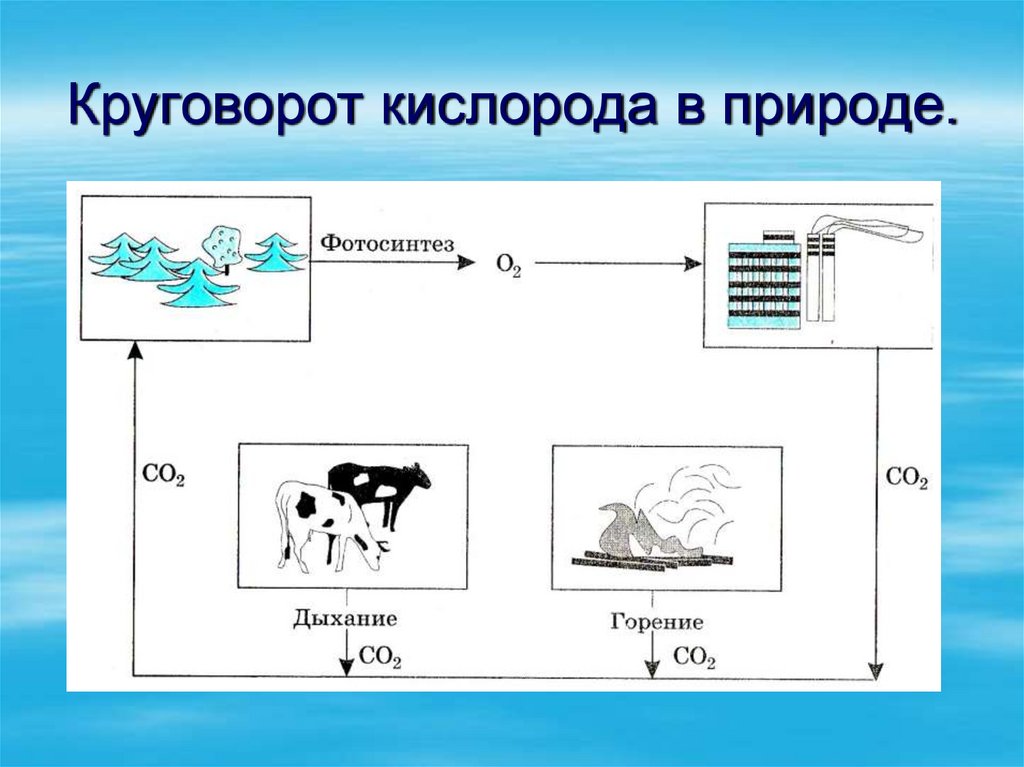
12. Круговорот кислорода в природе.
13.
14. Открытие кислорода.
Кислород был полученим многими способами:
прокаливанием оксида
ртути (как это сделали
Пристли и Лавуазье),
нагреванием карбоната
ртути и карбоната
серебра и т.д.
Несомненно, Шееле
первым (1772) «держал
в руках» чистый
кислород.
15.
16.
Джозеф Пристли(Joseph Priestley,
1733-1804)
2 HgO
=
2 Hg
оксид ртути
нагреван
ие
ртуть
+
O2
кислород
17. Антуан Лавуазье (Lavoisier, Antoine Laurent, 1743-1794)
Повторив опыты Пристли,Лавуазье заключил, что
атмосферный воздух состоит из
смеси «жизненного» (кислород)
и «удушливого» (азот) воздуха
и объяснил процесс горения
соединением веществ с
кислородом.
В начале 1775 г. Лавуазье
сообщил, что газ, получаемый
после нагревания красной
окиси ртути, представляет
собой «воздух как таковой без
изменений (за исключением
того, что)... он оказывается
более чистым, более
пригодным для дыхания».
18.
Кислород образует два аллотропных веществаО2 – кислород
О3 - озон
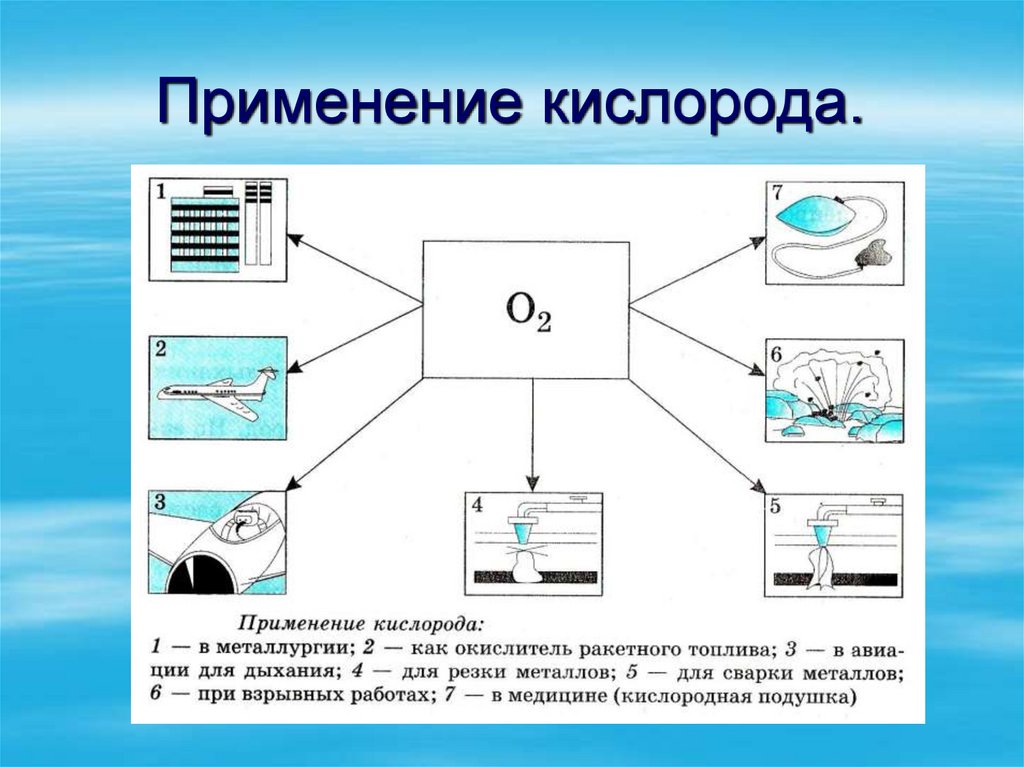
19. Способы получения и собирания кислорода.
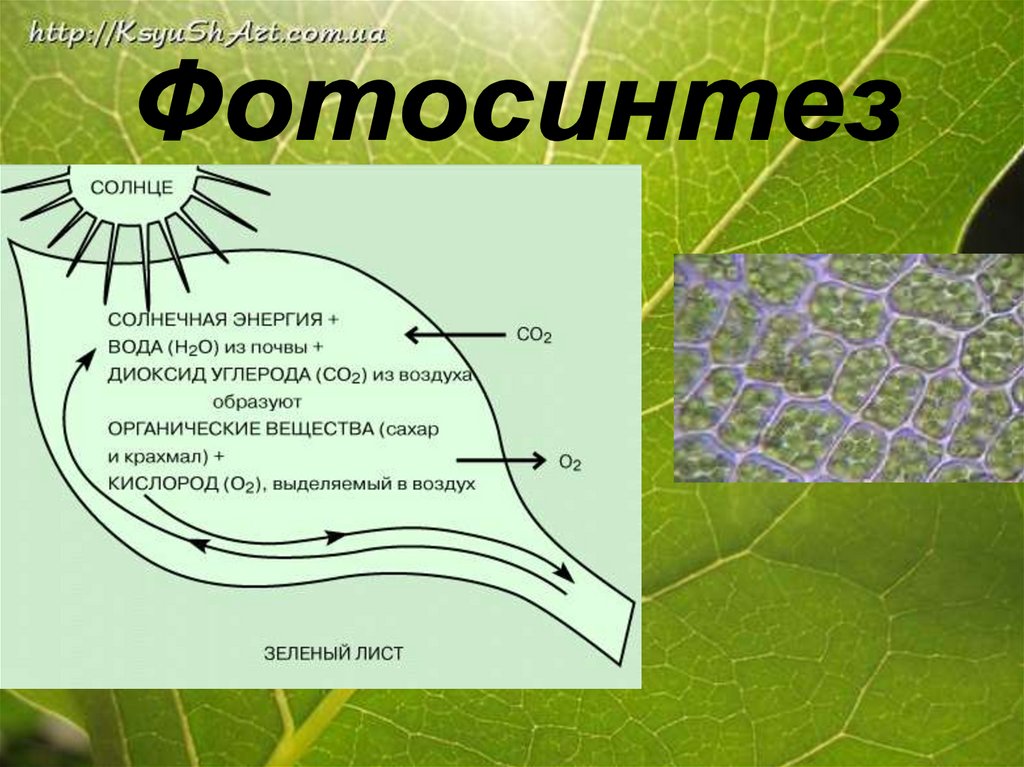
А) В природе:1.Кислород в природе образуется в
процессе фотосинтеза.
6СО2 +6Н2О
С6Н12О6 +6O2
2. Во время грозы: 3O2 2O3
20. Получение кислорода в лаборатории.
Чаще всего кислород получают нагреванием таких веществ (в составкоторых кислород входит в связанном виде), как перманганат калия
(марганцовка), хлорат калия (бертолетова соль), нитрат калия
(селитра), пероксид водорода:
2 KMnO4
=
K2MnO4
пермангана нагрева манганат
т калия
ние
калия
2 KClO3
хлорат калия
+
MnO2
диоксид
марга
нца
=
2 KCl
нагревание
хлорид
калия
+
+
O2
кислор
од
3 O2
кислород
21.
2 KNO3нитрат калия
=
нагревание
2 KNO2
нитрит калия
+
O2
кислород
2 H 2O2
пероксид
водорода
=
2 H2O
+
O2
катализатор
кислород
22.
Способы получения исобирания кислорода.
Д) некоторых высших оксидов:
4CrO3= 2Cr2O3 + 3О2;
2PbO2 = 2PbO + О2;
3MnO2 = Mn3O4 + О2.
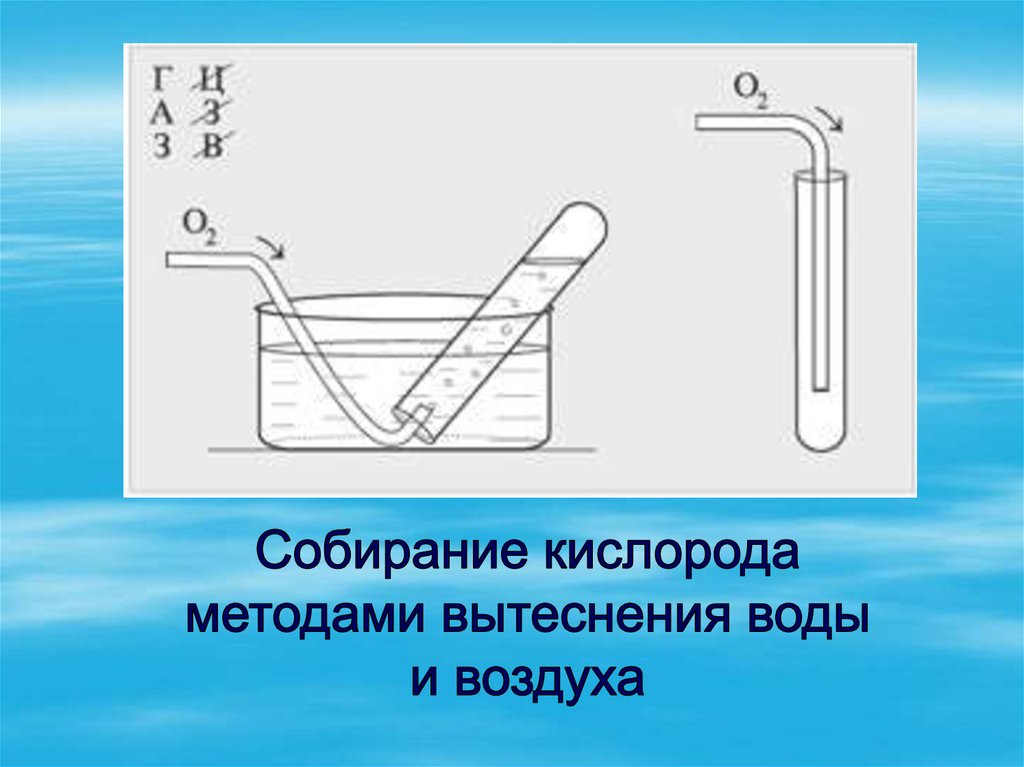
23. Способы собирания
вытеснение водывытеснение
воздуха




















 Химия
Химия








