Похожие презентации:
Сера и её соединения. Положение серы в ПСХЭ
1.
20.11.24Тема урока: «Сера и её
соединения»
2.
Положение серы в ПСХЭСера – химический
элемент III периода, VI
A группы
Порядковый номер – 16
Атомная масса – 32,066
3.
Сера в природе•В
свободном
виде
(самородная сера);
•В
виде
соединений:
органических
и
неорганических
(сульфиды, сульфиты и
сульфаты);
• В составе каменного угля,
нефти и газа.
4.
• Самородная сера,серный колчедан FeS2,
медный
колчедан
CuFeS2,
свинцовый
блеск PbS с цинковой
обманкой ZnS
• Ангидрит
CaSO4,
гипс CaSO4∙2H2O и
гипс пластинчатый
5.
Физические свойства серы• Агрегатное состояние
ТВЕРДОЕ
КРИСТАЛЛИЧЕСКОЕ
• Цвет ЖЕЛТЫЙ
• Запах БЕЗ ЗАПАХА
• Растворимость в воде
НЕ РАСТВОРЯЕТСЯ
• Растворимость в сероуглероде
ХОРОШО РАСТВОРЯЕТСЯ
• Теплопроводность
НЕТ
• Электропроводность НЕТ
6.
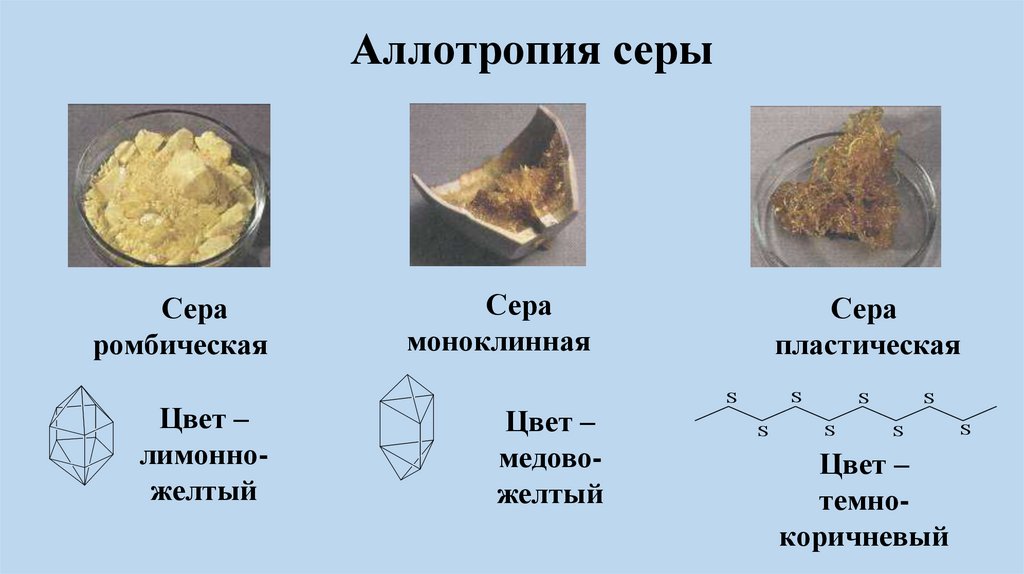
Аллотропия серыСера
ромбическая
Цвет –
лимонножелтый
Сера
моноклинная
Цвет –
медовожелтый
Сера
пластическая
S
S
S
S
S
S
S
Цвет –
темнокоричневый
S
7.
Химические свойства серыРеагирует с неметаллами
(искл. азот N2 и иод I2):
S + O2 = SO2
оксид серы (IV)
H2 + S = H2S
сероводород
8.
Химические свойства серыРеагирует с металлами
(искл. золото Аu, платина Рt):
2Na + S = Na2S – сульфид натрия
Fe + S = FeS
2Al + 3S = Al2S3
Нg + S = HgS
(демеркуризация)
9.
Химические свойства серыРеагирует со сложными веществами:
S + 2H2SO4(конц.) = 3SO2 + 2H2O
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
3S + 2KClO3 = 2KCl + 3SO2
10.
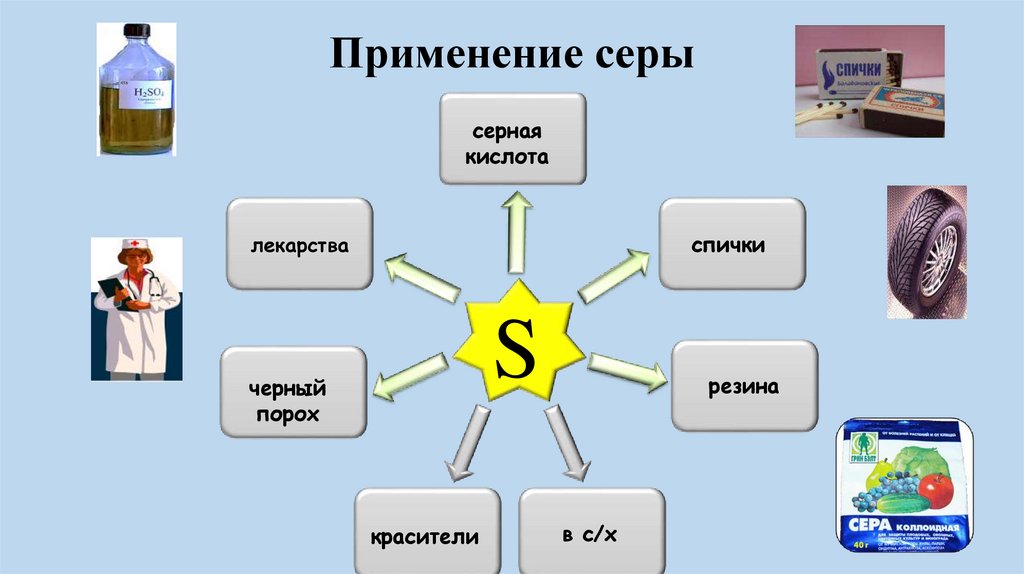
Применение серысерная
кислота
спички
лекарства
S
черный
порох
красители
резина
в с/х
11.
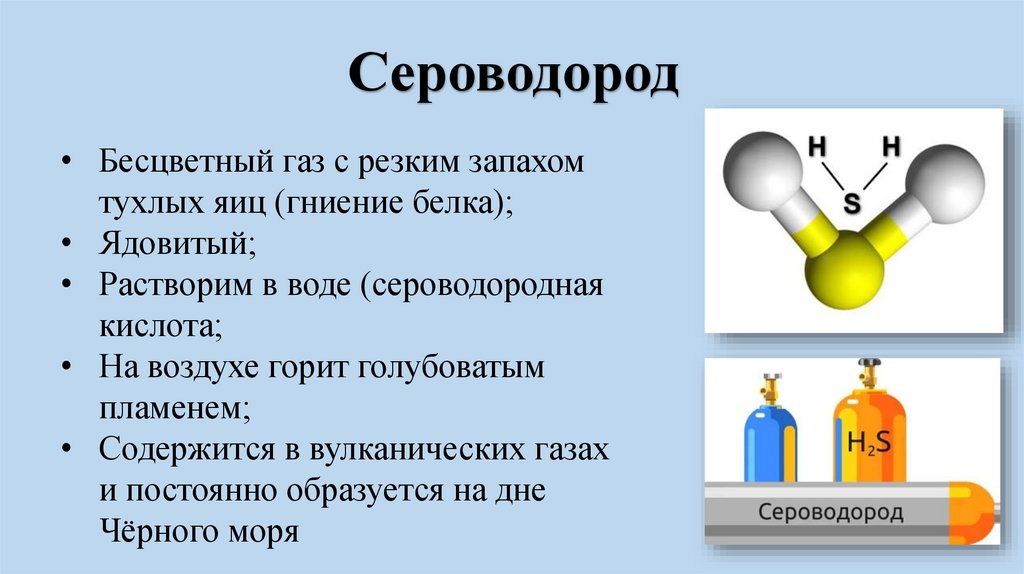
Сероводород• Бесцветный газ с резким запахом
тухлых яиц (гниение белка);
• Ядовитый;
• Растворим в воде (сероводородная
кислота;
• На воздухе горит голубоватым
пламенем;
• Содержится в вулканических газах
и постоянно образуется на дне
Чёрного моря
12.
Оксиды серыХарактеристи
SO2
ка
Название
Оксид серы(IV), сернистый
газ,
диоксид серы
Физические Бесцветный газ с резким
свойства
удушливым запахом, хорошо
растворим в воде.
SO3
Оксид серы (VI),
серный ангидрид,
триоксид серы
При 0 С белое
твердое вещество, при
t=16,8 С переходит в
жидкое состояние, а
при t=44,7 С - в
газообразное, хорошо
растворяется
13.
SO2Химические Кислотный оксид
свойства
SO2+H2O
H2SO3
SO2+CaO
CaSO3
SO2+2NaOH
Na2SO3+H2O
SO3
Кислотный оксид
SO3+H2O
H2SO4
SO3+CuO CuSO4
SO3+2KOH K2SO4+H2O
Кислотные свойства
сильнее, чем у SO2.
В ОВР только окислитель
14.
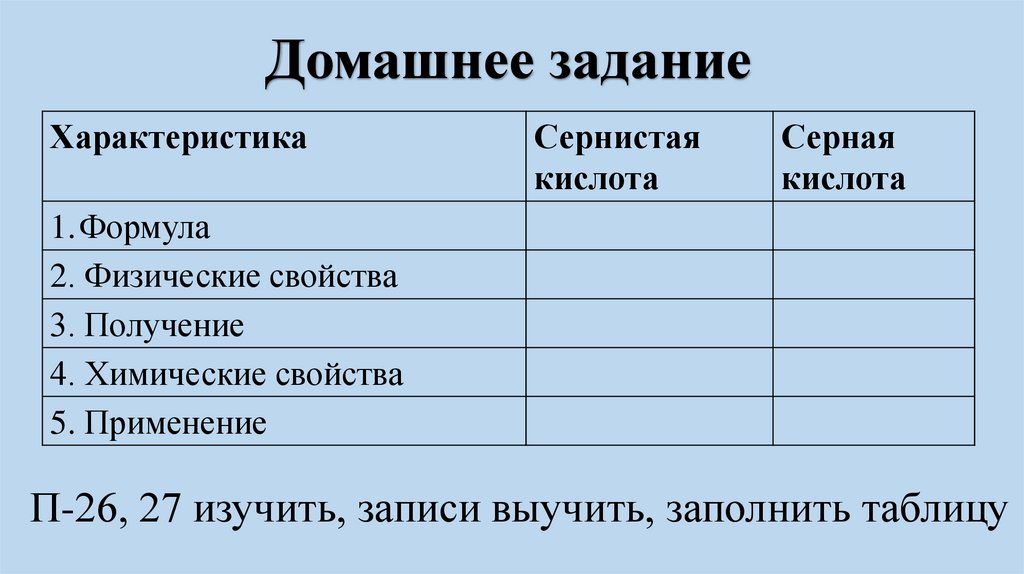
Домашнее заданиеХарактеристика
Сернистая
кислота
Серная
кислота
1.Формула
2. Физические свойства
3. Получение
4. Химические свойства
5. Применение
П-26, 27 изучить, записи выучить, заполнить таблицу










 Химия
Химия








