Похожие презентации:
Физические и химические свойства кислорода (реакции окисления, горение). Понятие об оксидах
1.
Ильина И.В., руководитель ЦДОШ, учитель химииМБОУ «Средняя общеобразовательная школа №27
имени А.А. Дейнеки» г. Курска
E-mail мой: ilina.irina71@mail.ru
2. Физические и химические свойства кислорода (реакции окисления, горение). Понятие об оксидах
L/O/G/O3. Кислород – химический элемент
Химический знакО
Химическая формула:
О2
Относительная атомная масса:
Ar = 16
Относительная молекулярная масса:
Мr = 32
Молярная масса:
М = 32 г/ моль
Валентность:
II
4. Историческая справка
Китайцы описали кислород ещев VIII веке до нашей эры;
В
Европе
изобретатель
подводной
лодки
Корнелиус
Дреббель еще в начале XVII века
выделил кислород, выяснил его
роль в дыхании и использовал
это открытие в своей подводной
лодке.
Однако
результаты
этих
исследований
были
засекречены
из-за
их
военной направленности, и
поэтому
они
не
были
известны современникам
5. М.В. Ломоносов
В 1750 году М.В. Ломоносов наосновании своих опыт ов доказал, чт о в
сост ав
воздуха
входит
вещест во,
окисляющее мет алл.
Карл Шееле
В 1771 году исследовал
сложный сост ав воздуха.
и доказал
1772 году впервые в ист ории сумел
получит ь в лаборат ории чист ый «огневой
воздух"
В
6.
Джозеф ПристлиВ 1774 году описал свойст ва
«дефлогист ированного
воздуха» (кислорода), нагревая
оксид рт ут и, собирая
солнечные лучи при помощи
увеличит ельного ст екла
7.
Антуан ЛавуазьеИ все-т аки главная фигура в
ист ории от крыт ии кислорода –
великий
французский
химик
Ант уан
Лоран
Лавуазье,
объяснивший
смысл
опыт ов,
проведенных
эт ими
учеными.
Включил новый элемент в список
прост ых вещест в и дал ему
название
Oxygenium
–
«рождающий кислоты»;
Выяснил роль кислорода в
процессах
горения,
обжига
мет аллов и дыхания.
8.
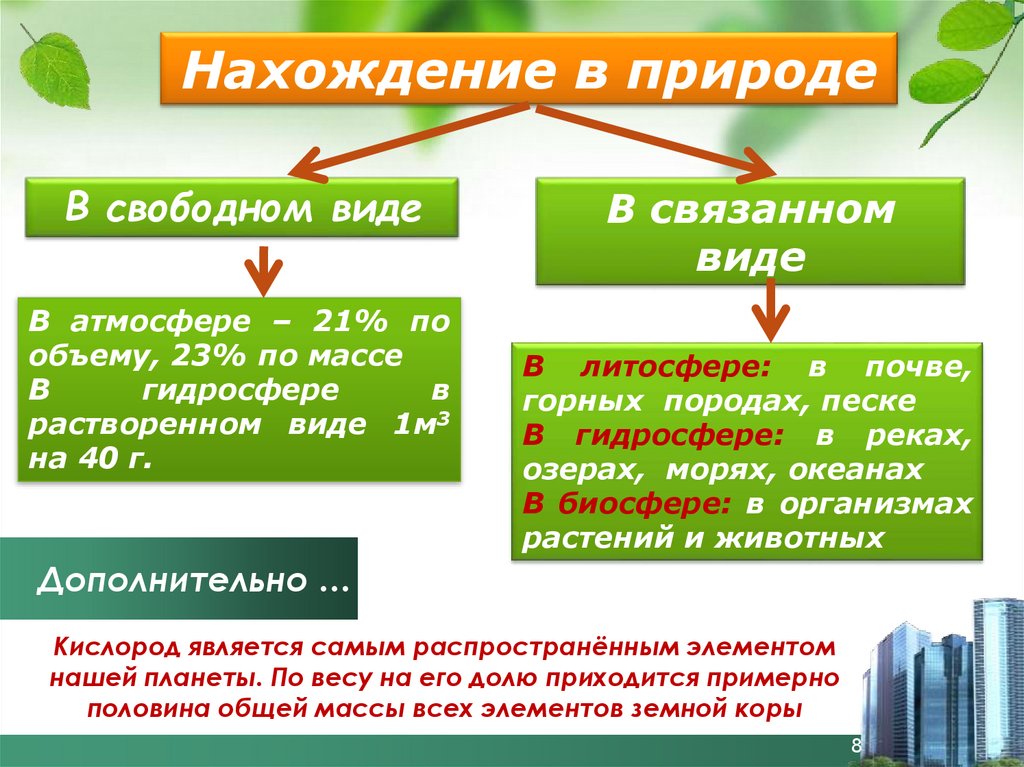
Нахождение в природеВ свободном виде
В атмосфере – 21% по
объему, 23% по массе
В
гидросфере
в
растворенном виде 1м3
на 40 г.
В связанном
виде
В литосфере: в почве,
горных породах, песке
В гидросфере: в реках,
озерах, морях, океанах
В биосфере: в организмах
растений и животных
Дополнительно …
Кислород является самым распространённым элементом
нашей планеты. По весу на его долю приходится примерно
половина общей массы всех элементов земной коры
8
9.
Если химического элемента наЗемле много, следовательно
этот элемент очень важен. А
важность кислорода
определяется его свойствами
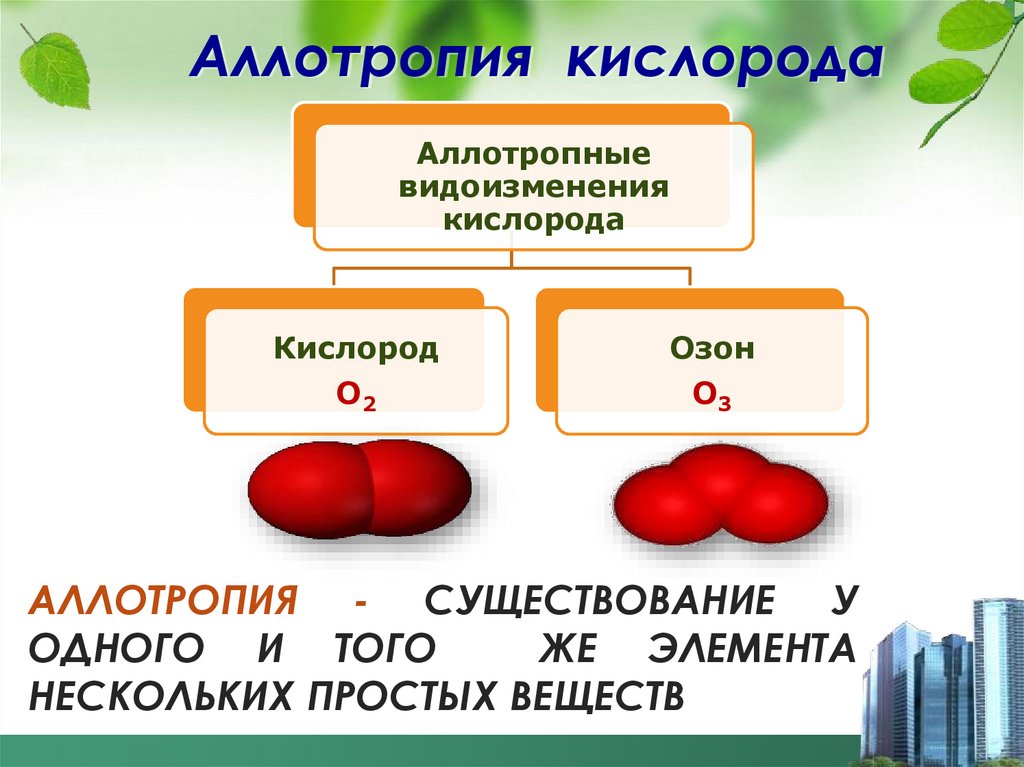
10. Аллотропия кислорода
Аллотропныевидоизменения
кислорода
Кислород
Озон
О2
О3
АЛЛОТРОПИЯ - СУЩЕСТВОВАНИЕ У
ОДНОГО И ТОГО
ЖЕ ЭЛЕМЕНТА
НЕСКОЛЬКИХ ПРОСТЫХ ВЕЩЕСТВ
11. Физические свойства
1)2)
3)
4)
5)
газ, без цвета, вкуса и
запаха;
немного тяжелее воздуха;
плохо растворяется в
воде;
жидкий кислород (темп.
кипения −182,98 °C) это
бледно-голубая жидкость;
твердый кислород (темп.
плавления −218,79 °C) —
синие кристаллы;
6) поддерживает
процессы дыхания и
горения
жидкий кислород
Твёрдый
кислород
12. Физические свойства озона
1)при обычных условиях голубой газ;
2)
тяжелее воздуха;
3)
растворимость в воде в 10 раз
выше, чем у кислорода;
4)
жидкий озон (темп. Кипения −111,9
°C) темно-синего цвета;
5)
твердый озон (темп. плавления
−251,4°C)
—
тёмно-синие,
практически чёрные кристаллы;
6)
запах — резкий,
«металлический».
специфический
Озон (от др.-греч. ὄζω —
пахну)
13. Сравнение свойств кислорода и озона
КислородОзон
Химическая формула
О2
О3
Молекулярная масса
32
48
Агрегатное состояние
газ
газ
Элементы
сравнения
Цвет
без цвета
голубоватый цвет
Запах
без запаха
Запах свежести
Плотность
1,43 г/л
2,14 г/л
Температура кипения
- 183° С
- 112° С
Химическая активность
активен
очень активен
14. Химические свойства
• Взаимодействие веществ с кислородомназывается реакцией горения.
С неметаллами
C + O2 CO2
S + O2 SO2
2H2 + O2 2H2O
С металлами
2Mg + O2 2MgO
2Cu + O2 –t 2CuO
Со сложными веществами
4FeS2 + 11O2 2Fe2O3 + 8SO2
2H2S + 3O2 2SO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
Оксиды
–
это
сложные
вещества,
состоящие из двух элементов, один из
которых кислород.
15. Дописать и уравнить:
1. Ca + O2 →2. H2 + O2 →
3. Si
+ O2 →
4. N2 + O2 →
5. С2H6 + O2 →
16. Вычеркните неверное суждение
Сложное вещество.При обычных условиях бесцветный газ.
В природе встречается только в составе
сложных веществ.
Газ, имеющий запах.
Поддерживает горение.
Легче воздуха.
Входит в состав минералов, горных
пород, песка, воды.
При обычных условиях жидкость.
Входит в состав воздуха.
Образуется в природе в процессе
фотосинтеза.
17.
Домашнее задание1. Параграф 13
2. Упражнения 1, 2 (из презентации)
3. Задача 1 (из презентации)
Пишите в электронный журнал или на мою почту.
E-mail: ilina.irina71@mail.ru
18.
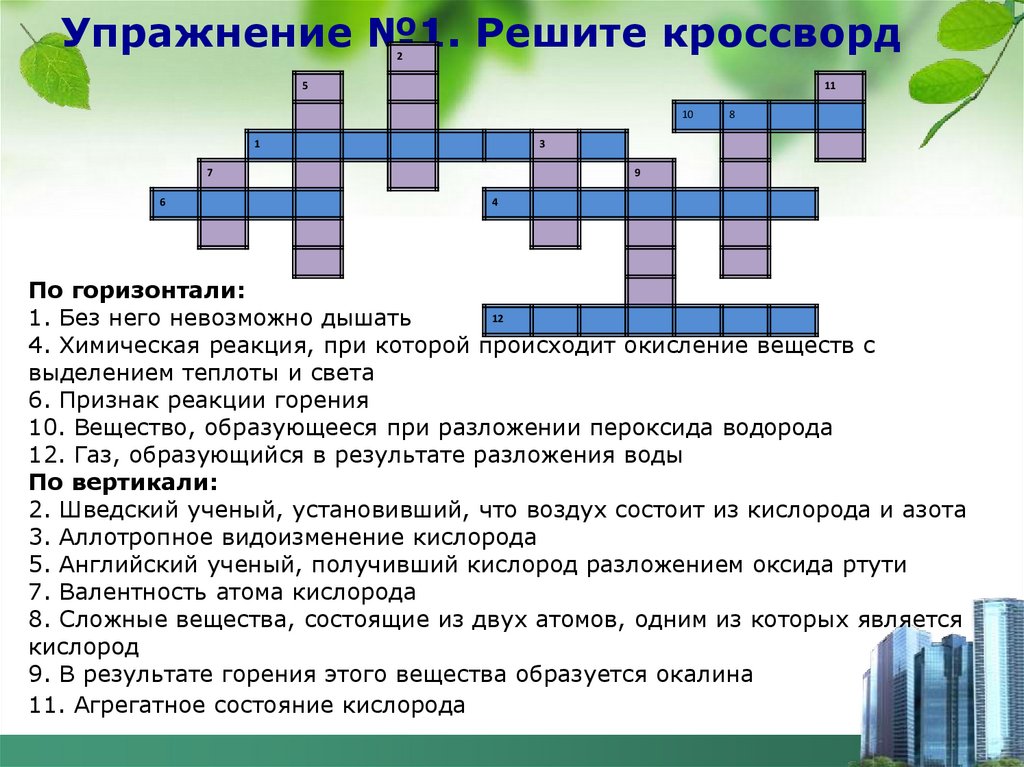
Упражнение №1. Решите кроссворд2
5
11
10
1
3
7
6
8
9
4
По горизонтали:
12
1. Без него невозможно дышать
4. Химическая реакция, при которой происходит окисление веществ с
выделением теплоты и света
6. Признак реакции горения
10. Вещество, образующееся при разложении пероксида водорода
12. Газ, образующийся в результате разложения воды
По вертикали:
2. Шведский ученый, установивший, что воздух состоит из кислорода и азота
3. Аллотропное видоизменение кислорода
5. Английский ученый, получивший кислород разложением оксида ртути
7. Валентность атома кислорода
8. Сложные вещества, состоящие из двух атомов, одним из которых является
кислород
9. В результате горения этого вещества образуется окалина
11. Агрегатное состояние кислорода
19. Упражнение №2. Допишите уравнения реакций и расставьте коэффициенты.
А) … + O2 → As2O3Б) Li + O2 →…
В) Mg + … → MgO
Г) … + O2 → NO
Д) Be + O2 → …
Задача №1. Сколько (в кг) кислорода
необходимо для полного сгорания 60 кг
метана СН4
















 Химия
Химия








