Похожие презентации:
Физикохимия дисперсных систем
1.
ФИЗИКОХИМИЯДИСПЕРСНЫХ СИСТЕМ
1
2.
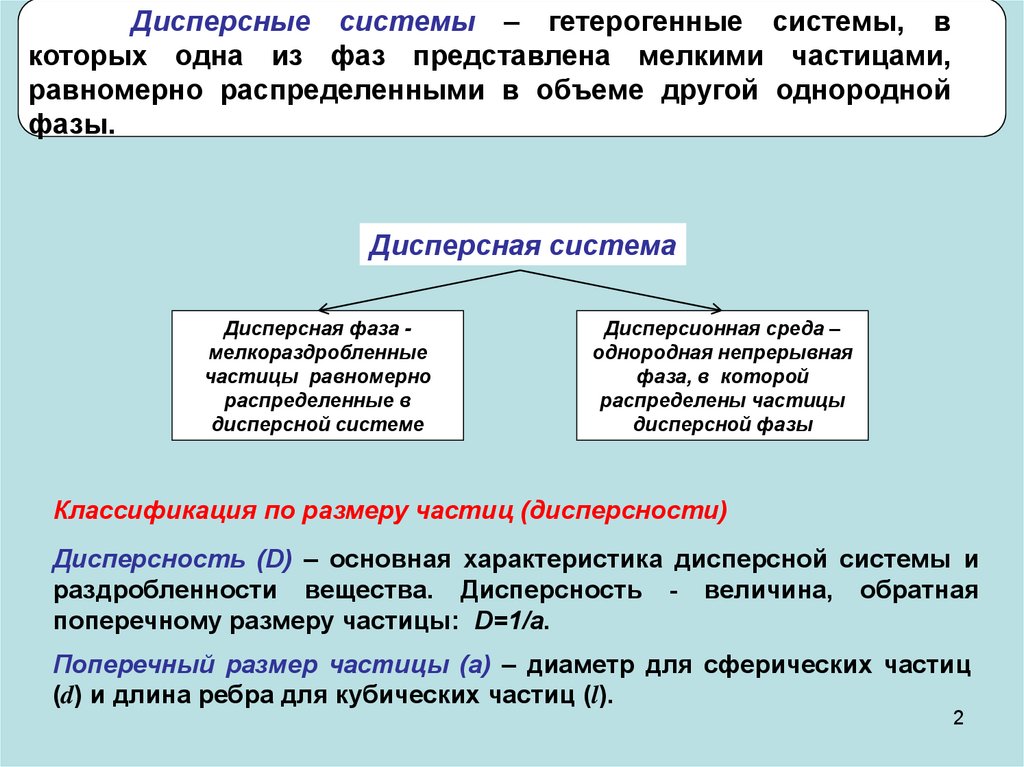
Дисперсные системы – гетерогенные системы, вкоторых одна из фаз представлена мелкими частицами,
равномерно распределенными в объеме другой однородной
фазы.
Дисперсная система
Дисперсная фаза мелкораздробленные
частицы равномерно
распределенные в
дисперсной системе
Дисперсионная среда –
однородная непрерывная
фаза, в которой
распределены частицы
дисперсной фазы
Классификация по размеру частиц (дисперсности)
Дисперсность (D) – основная характеристика дисперсной системы и
раздробленности вещества. Дисперсность - величина, обратная
поперечному размеру частицы: D=1/a.
Поперечный размер частицы (а) – диаметр для сферических частиц
(d) и длина ребра для кубических частиц (l).
2
3.
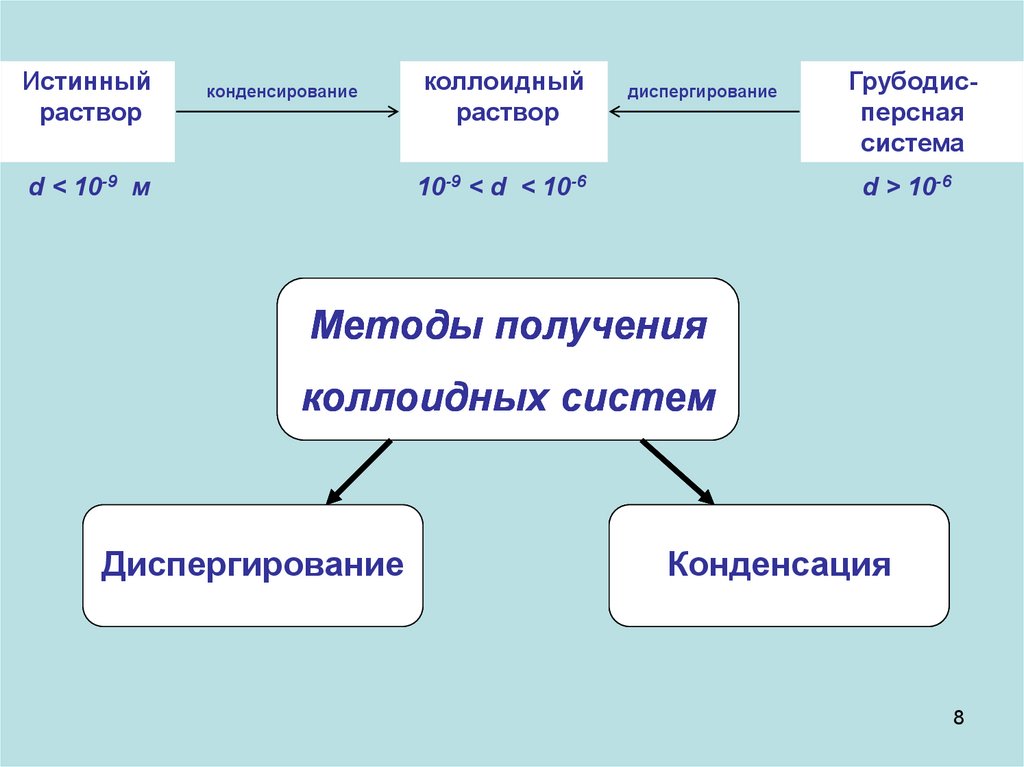
По дисперсности системы подразделяют:а. грубодисперсные
(микрогетерогенные) (грубые взвеси,
суспензии, эмульсии, пены, аэрозоли, порошки) с размером частиц
10-4 – 10-7 м.
Признаки: мутные – отражают свет, частицы не проходят через
бумажный фильтр и видны в оптический микроскоп.
б. коллоидно-дисперсные (ультрамикрогетерогенные) (золи) с
размером частиц 10-7 – 10-9 м.
Признаки: прозрачные, опалесцируют (рассеивают свет) при
боковом освещении, частицы проходят через бумажный фильтр,
но не проходят через животные и растительные мембраны.
в.
молекулярно-дисперсные
(истинные
растворы
низкомолекулярных веществ) с размером частиц 10-9 – 10-10 м.
Признаки: прозрачные, частицы проходят через бумажный фильтр
и растительные мембраны. Гомогенные системы.
3
4.
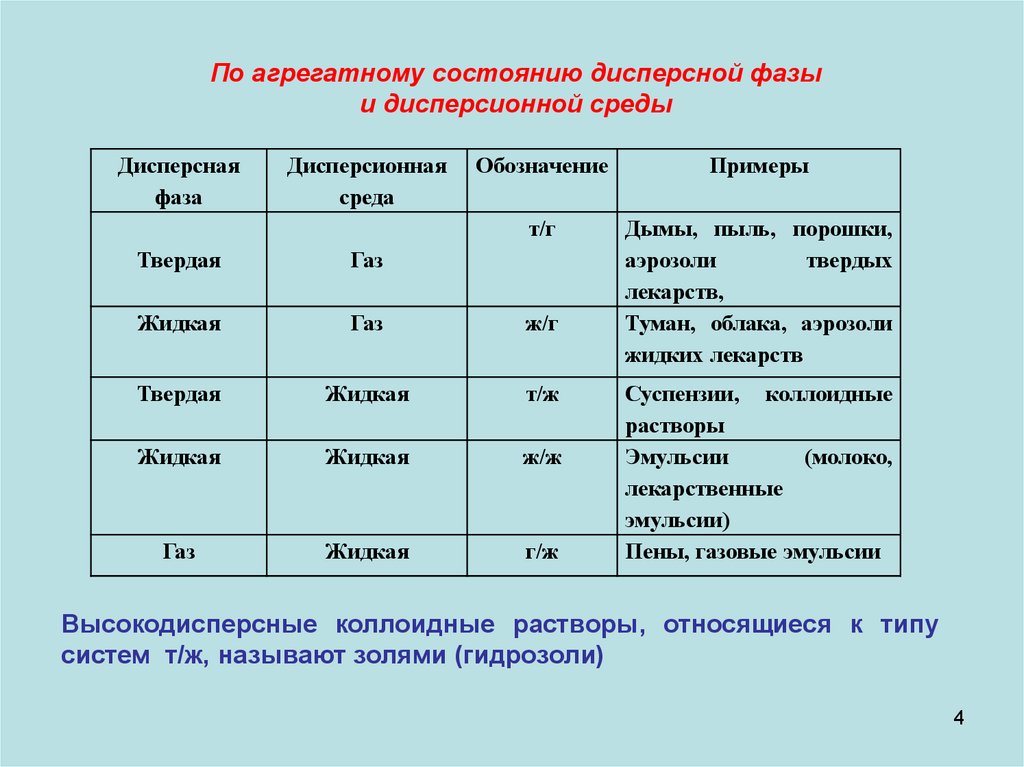
По агрегатному состоянию дисперсной фазыи дисперсионной среды
Дисперсная
фаза
Дисперсионная
среда
Обозначение
Примеры
т/г
Дымы, пыль, порошки,
аэрозоли
твердых
лекарств,
Туман, облака, аэрозоли
жидких лекарств
Твердая
Газ
Жидкая
Газ
ж/г
Твердая
Жидкая
т/ж
Жидкая
Жидкая
ж/ж
Газ
Жидкая
г/ж
Суспензии, коллоидные
растворы
Эмульсии
(молоко,
лекарственные
эмульсии)
Пены, газовые эмульсии
Высокодисперсные коллоидные растворы, относящиеся к типу
систем т/ж, называют золями (гидрозоли)
4
5.
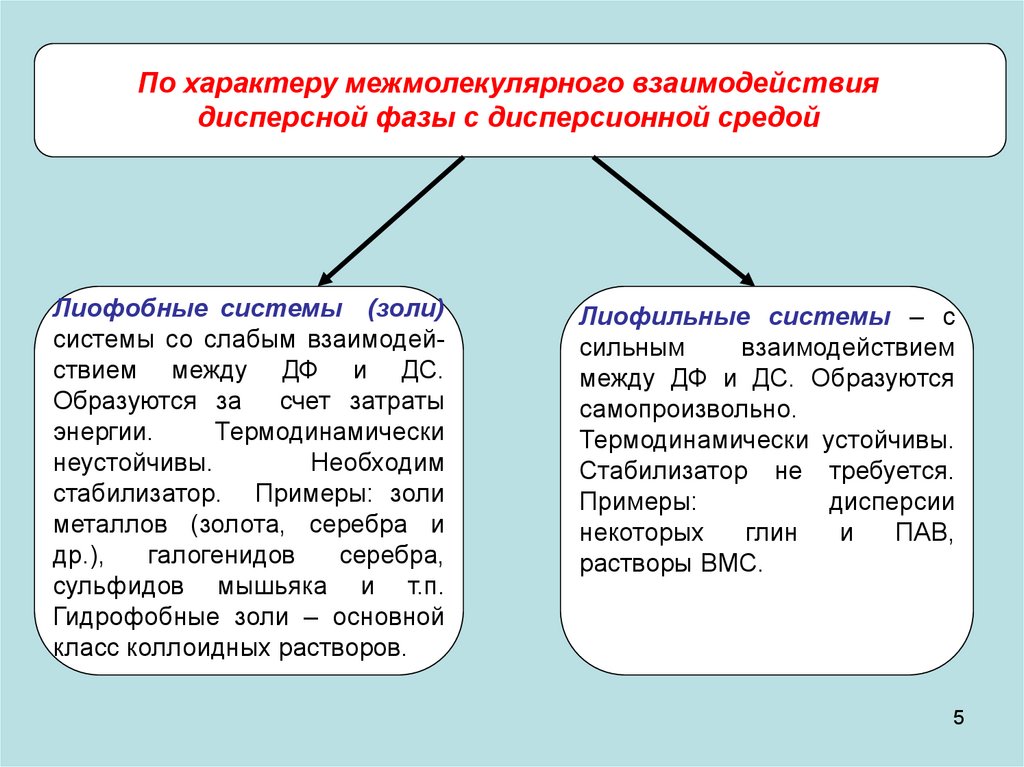
По характеру межмолекулярного взаимодействиядисперсной фазы с дисперсионной средой
Лиофобные системы (золи)
системы со слабым взаимодействием между ДФ и ДС.
Образуются за счет затраты
энергии.
Термодинамически
неустойчивы.
Необходим
стабилизатор. Примеры: золи
металлов (золота, серебра и
др.),
галогенидов
серебра,
сульфидов мышьяка и т.п.
Гидрофобные золи – основной
класс коллоидных растворов.
Лиофильные системы – с
сильным
взаимодействием
между ДФ и ДС. Образуются
самопроизвольно.
Термодинамически устойчивы.
Стабилизатор не требуется.
Примеры:
дисперсии
некоторых
глин
и
ПАВ,
растворы ВМС.
5
6.
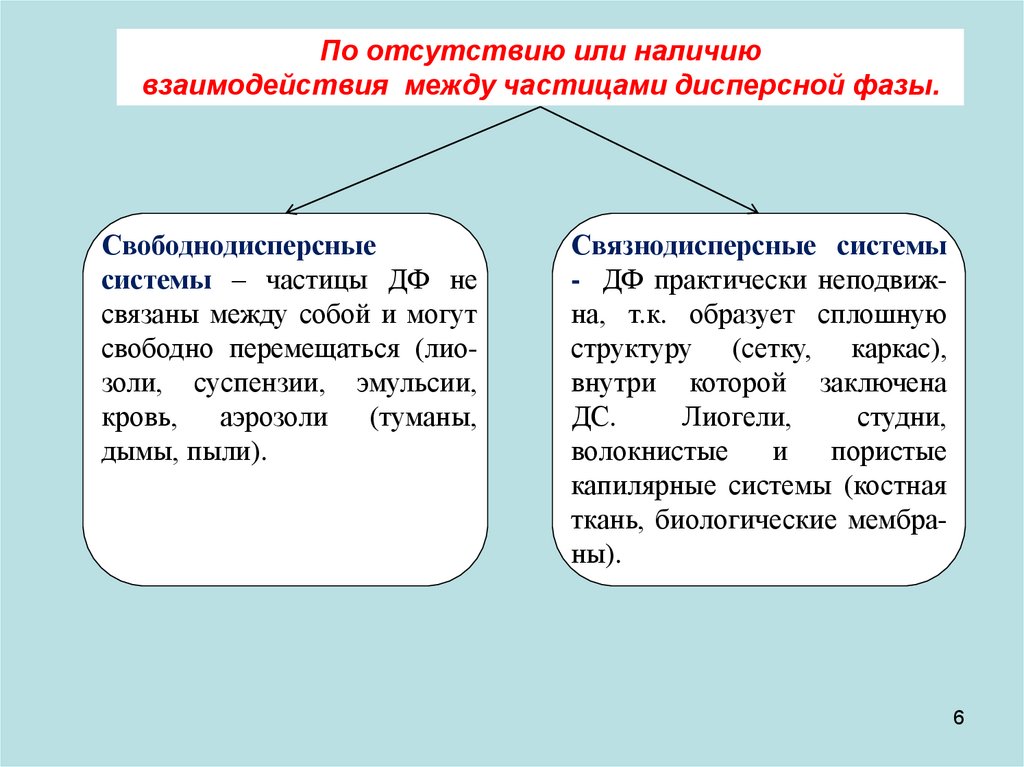
По отсутствию или наличиювзаимодействия между частицами дисперсной фазы.
Свободнодисперсные
системы – частицы ДФ не
связаны между собой и могут
свободно перемещаться (лиозоли, суспензии, эмульсии,
кровь, аэрозоли (туманы,
дымы, пыли).
Связнодисперсные системы
- ДФ практически неподвижна, т.к. образует сплошную
структуру (сетку, каркас),
внутри которой заключена
ДС.
Лиогели,
студни,
волокнистые
и
пористые
капилярные системы (костная
ткань, биологические мембраны).
6
7.
Особенности коллоидных систем1. Избыточная поверхностная энергия Gs
При
увеличении
дисперсности
увеличивается
удельная
поверхность частиц дисперсной фазы, большая часть всех молекул
или атомов находится на поверхности раздела фаз в
несимметричном силовом поле, что приводит к возникновению
избыточной поверхностной энергии.
Gs S
2. Термодинамическая неустойчивость
3. Невоспроизводимость (индивидуальность)
4. Способность к структурообразованию
7
7
8.
Истинныйраствор
конденсирование
d < 10-9 м
коллоидный
раствор
диспергирование
10-9 < d < 10-6
Грубодисперсная
система
d > 10-6
Методы получения
коллоидных систем
Диспергирование
Диспергирование
Конденсация
8
9.
Диспергационные методы1. измельчение крупных образцов вещества до частиц
дисперсных размеров;
2. химический состав и агрегатное состояние вещества
не меняется;
3. затрачивается внешняя работа;
4. используют для получения грубодисперсных систем –
производство цемента (1 млрд.т в год), измельчении
руд полезных ископаемых, помол муки и т.д.
9
10.
Физические конденсационные методы1. Метод конденсации из паров – образование тумана в
газовой фазе при понижении температуры.
Образование тумана, облаков, производство H2SO4, H3PO4.
2. Метод замены растворителя – в истинном растворе
какого-либо вещества хороший растворитель заменяется на плохой
для данного вещества. Так, например, можно получить коллоидный
раствор серы, добавляя к истинному раствору серы в этаноле воду.
Или, разбавляя одеколон или духи водой.
10
11.
Химические конденсационные методы1. Реакции восстановления (получение золей Au, Ag, Pt).
Восстановление аурата натрия формальдегидом.
2NaAuO2 + 3HCOH + Na2CO3 = 2Au + 3HCOONa + NaHCO3 + H2O
2. Реакции обмена.
Получение золя иодида серебра.
AgNO3 + KI(изб.) = AgI↓ + KNO3
3. Реакции гидролиза
Получение золя гидроксида железа.
FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl
11
12.
Метод пептизацииПептизация – метод, основанный на переводе в
коллоидный
раствор
свежеполученных
осадков,
первичные размеры которых уже имеют размеры
высокодисперсных систем.
Суть метода: свежевыпавший рыхлый осадок
переводят в золь путем обработки пептизаторами
(растворами электролитов, ПАВ, растворителем).
Пептизации способствуют перемешивание и
нагревание.
12
13.
Строение коллоидных мицеллМицелла – гетерогенная микросистема, которая состоит из
микрокристалла дисперсной фазы, окруженного сольватированными
ионами стабилизатора.
Внутренняя часть мицеллы - агрегат, состоящий из большого
числа молекул или атомов.
Агрегат электронейтрален, но адсорбирует на своей поверхности
ионы из раствора – потенциалопределяющие ионы .
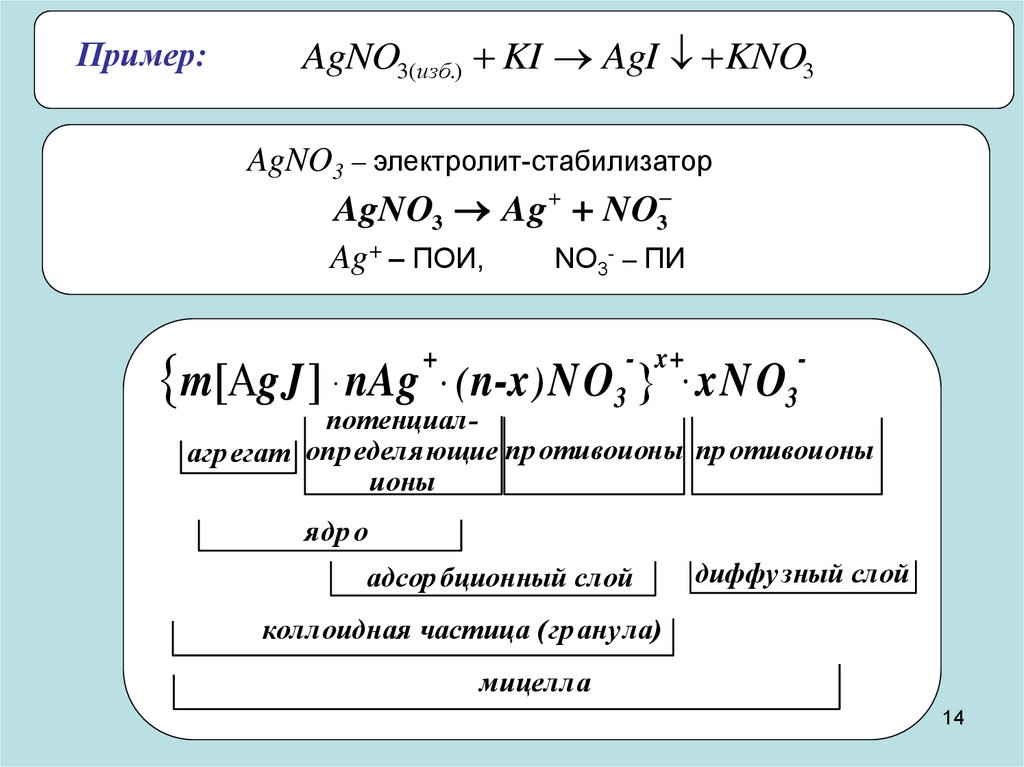
Правило Панета-Фаянса:
«На твердой поверхности агрегата в первую очередь
адсорбируются ионы, которые:
•входят в состав агрегата;
•способны достраивать кристаллическую решетку агрегата;
•образуют малорастворимое соединение с ионами агрегата;
•изоморфны с ионами агрегата.»
13
14.
Пример:AgNO3(изб.) KI AgI KNO3
AgNO3 – электролит-стабилизатор
AgNO3 Ag NO3
Ag+ – ПОИ,
m gJ nAg
+
.(
NO3- – ПИ
- x+
.
3
3
n-x ) N O xN O
потенциалагр егат определяющие пр отивоионы пр отивоионы
ионы
ядр о
адсор бционный слой
диффузный слой
коллоидная частица (гр анула)
мицелла
14
15.
m AgI nI (n x) K xKx
В мицелле с ионным стабилизатором, как во всякой
гетерогенной системе, в которой на границе раздела имеется
ДЭС, различают два потенциала: межфазный (φмф) и
электрокинетический или ς-потенциал (дзета- потенциал).
Межфазным потенциалом называется потенциал ДЭС на
границе раздела между твердой и жидкой фазами в мицелле (ядро
и диффузный слой противоионов).
Электрокинетическим потенциалом называется потенциал на
границе скольжения между адсорбционной и диффузной частями
ДЭС мицеллы
Значение межфазного потенциала зависит от природы твердой
фазы,
а
также
от
заряда
и
концентрации
потенциалопределяющих ионов, адсорбированных на твердой
фазе.
16.
Свойства коллоидных растворов1. Молекулярно-кинетические
- свойства, связанные с тепловым
движением частиц: броуновское движение, диффузия, осмос. Эти
свойства зависят от размера и массы частиц дисперсной фазы
(броуновское движение, диффузия), а также от числа частиц в единице
объема системы (осмотическое давление).
МКС в коллоидных растворах выражены менее интенсивно, чем в
истинных растворах.
2. Оптические .
Специфическим свойством коллоидных
способность рассеивать свет.
растворов
является
их
3. Способность к электрофорезу - явление перемещения частиц ДФ
относительно неподвижной ДС под действием внешнего электрического
поля.
Причина электрофореза - наличие двойного электрического слоя
(ДЭС) на поверхности частиц ДФ.
16
17.
Методы очистки дисперсных системДиализ – процесс очистки коллоидных растворов от ионов и
молекул низкомолекулярных примесей чистый растворитель через
полупроницаемую мембрану.
Электродиализ – диализ в условиях наложения постоянного
электрического поля, под действием которого катионы и анионы
приобретают направленное движение к электродам ( что ускоряет
очистку). ЭД эффективен при малых концентрациях удаляемого
вещества.
Ультрафильтрация – электродиализ под давлением (гемодиализ).
17
18.
Устойчивость дисперсных систем – способность дисперснойфазы сохранять состояние равномерного распределения частиц
дисперсной фазы во всем объеме дисперсионной среды.
Различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц
дисперсной фазы находиться во взвешенном состоянии и не оседать под
действием сил тяжести.
Агрегативная
устойчивость характеризует способность частиц
дисперсной фазы противодействовать их слипанию
между собой и
сохранять неизменным свои размеры.
Разрушение коллоидных растворов начинается с коагуляции.
Коагуляция – процесс разрушения коллоидных систем за счет
слипания частиц, образования более крупных агрегатов с потерей
устойчивости и последующим разделением фаз.
18
19.
Коагуляция золей электролитамиПравила электролитной коагуляции
• Все электролиты при определенной концентрации могут
вызвать коагуляцию золя.
• Правило знака заряда: коагуляцию золя вызывает тот ион
электролита, знак заряда которого противоположен заряду
коллоидной частицы.
Этот ион называют ионом-коагулятором.
• Каждый электролит по отношению к коллоидному
раствору обладает порогом коагуляции (коагулирующей
способностью).
19
20.
Порог коагуляции (Спк) – наименьшая концентрацияэлектролита, достаточная для того, чтобы вызвать коагуляцию
Vэл Cэл
золя
Cпк
Vкр Vэл
Коагулирующая способность (γ) – величина, обратная
порогу коагуляции
1
C пк
Коагулирующее действие электролита на коллоидные
растворы с ионнным стабилизатором подчиняется правилу
Шульце-Гарди:
коагуляцию коллоидных растворов вызывают любые ионы,
которые имеют заряда, противоположный заряду гранул.
Коагулирующее действие ионов (γ) тем сильнее, чем выше заряд
иона-коагулятора.
20
21.
Коагулирующее действие иона-коагулятора прямо пропорционально егозаряду в шестой степени:
f (z6 )
Na Ca 2 Al 3 Th 4
возрастание коагулирующей способности
21















 Химия
Химия








