Похожие презентации:
Кислород
1.
Кислород«Dum spiro spero» (Пока дышу, надеюсь...),
- гласит латынь
1
2.
Дыхание – это синоним жизни,а источник жизни на Земле – кислород.
« Кислород –
Яков Берцелиус
это вещество,
вокруг
которого
вращается
земная
химия…»
3.
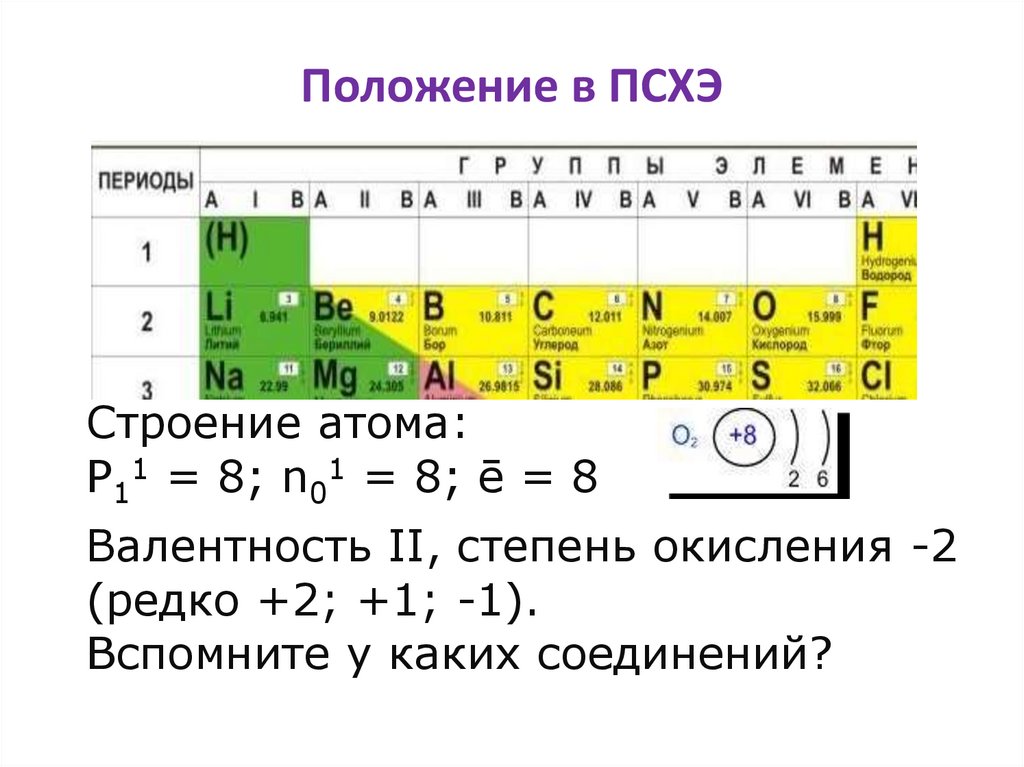
Положение в ПСХЭСтроение атома:
P11 = 8; n01 = 8; ē = 8
Валентность II, степень окисления -2
(редко +2; +1; -1).
Вспомните у каких соединений?
4.
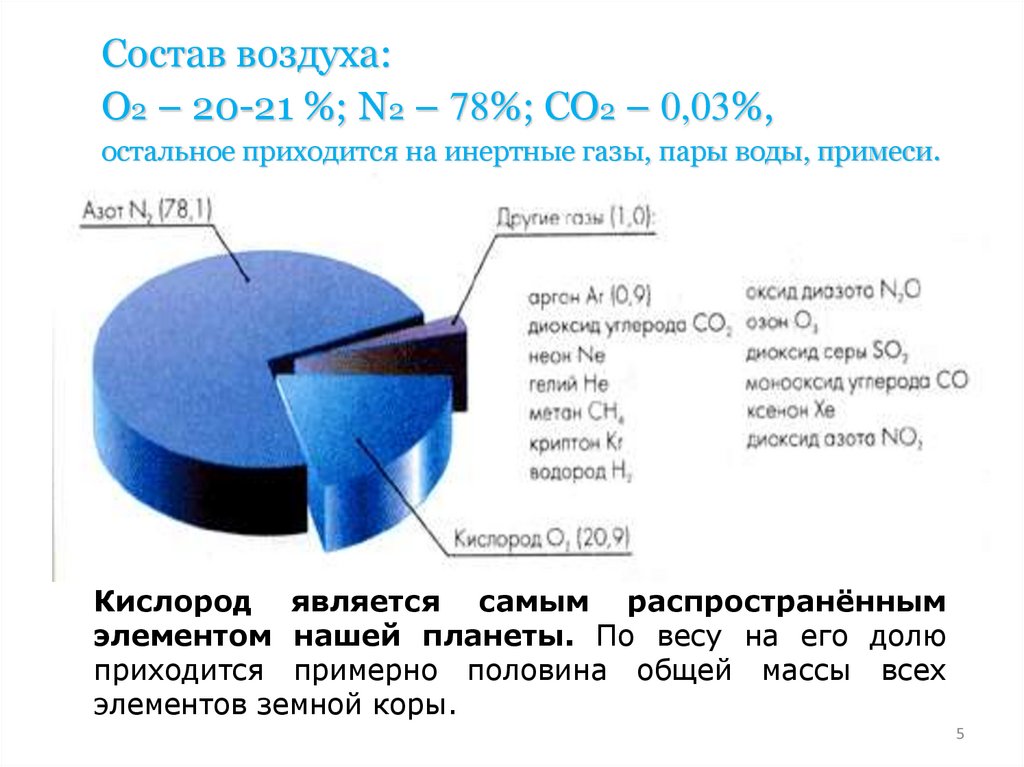
Распространённость в природе5.
Состав воздуха:О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
Кислород является самым распространённым
элементом нашей планеты. По весу на его долю
приходится примерно половина общей массы всех
элементов земной коры.
5
6.
Физические свойства:6
7.
Способы полученияВпервые кислород получил
Джозеф Пристли (англ.) 1 августа 1774 г.
2HgO t˚C = 2Hg + O2↑
он назвал газ – «воздух»
1. В промышленности:
1) Электролиз воды:
2H2O эл. ток = 2H2↑ + O2↑
2) Перегонка жидкого воздуха:
ВОЗДУХ давление, t=-183˚C O2 (голубая жидкость)
В
настоящее время в промышленности
кислород получают из воздуха.
8.
Способы получения2. В лаборатории:
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C = K2MnO4 + MnO2 + O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2 = 2H2O + O2↑
3) Разложение бертолетовой соли (хлорат калия):
2KClO3 t˚C , MnO2= 2KCl + 3O2↑
4) В озонаторе (в лаборатории)
или во время грозы (в природе):
3O2 2O3
9.
Озон. АллотропияПод воздействием солнечного излучения или электрического
разряда
может
происходить
реакция:
3О2 = 2О3
В результате образуется озон . Он отличается от обычного
кислорода составом молекулы (О3) и свойствами. Вспомните
какими?
Чем по отношению друг к другу и к химическому элементу
кислороду являются простые вещества кислород и озон?
• Содержание озона в воздухе:
• Летом- до 7*10-9% (по объему),
• зимой- до 2*10-10%
• В атмосфере максимальная его концентрация на высоте 20-25
км , где озон образует слой, защищающий Землю от УФ- лучей.
В чем причина образования «озоновых дыр»?
10.
Способы собираниявытеснение воды
вытеснение воздуха
Кислород малорастворим в воде и тяжелее воздуха,
поэтому его можно собирать двумя способами:
- вытеснением воды;
- вытеснением воздуха (кислород будет собираться
на дне сосуда).
Полученный кислород можно
обнаружить на дне сосуда
тлеющей лучинкой – она вспыхнет.
11.
Химические свойства1. Окисление (горение):
С кислородом
реагируют все
элементы,
кроме Au, Pt,
He, Ne и Ar, во
всех реакциях
(кроме
взаимодействия
со фтором)
кислород окислитель.
Например, Железо сгорает в кислороде при
температур е с треском и разбрасыванием
искр:
3Fe + 2O2 = FeO· Fe2O3(железная окалина Fe3O4)
12.
Химические свойстваС неметаллами, как правило, реагирует с
образованием
оксида
с
ближайшей
валентностью, при нагревании (за исключением
гелия, неона, аргона).
Например,
S + О2 = SO2
N2 + О2= 2NО
2С + О2 = 2СО
или
С + О2 = СО2 (зависит от количества кислорода)
13.
Химические свойстваСо многими сложными соединениями, например с
оксидом азота (II) он реагирует уже при комнатной
температуре:
2NО + О2 = 2NО2.
Сероводород, реагируя с кислородом при
нагревании, дает серу:
2Н2S + О2 = 2S+ 2Н2О
или оксид серы (IV):
2Н2S + ЗО2 = 2SО2 + 2Н2О
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
14.
15.
Почему кислорода на планетене становится меньше?
В природе кислород образуется в процессе фотосинтеза,
который происходит в зелёных растениях на свету. В целях
сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных
насаждений.
Рисунок 111 стр. 183
16.
ПрименениеПрименение кислорода основано на его свойствах:
кислород поддерживает горение и дыхание.
Горение: сварка металлов, металлургия, в ракетных
двигателях.
Дыхание: медицина, авиация, «работа под водой».
Рисунок 115 стр. 187














 Химия
Химия








