Похожие презентации:
Кристаллическое строение металлов
1.
КРИСТАЛЛИЧЕСКОЕСТРОЕНИЕ МЕТАЛЛОВ
доцент. Г.Б.Мирадуллаева
2.
ПЛАН1. Кристаллическое строение металлов, виды
кристаллических решёток.
2. Анизотропия металлов,
изотропность, аллотропия.
3. Процессы первичной и вторичной
кристаллизации.
4. Система, компонент. Фаза,
механические смеси, твердые растворы.
3.
ВСЯКОЕ ВЕЩЕСТВО МОЖЕТ НАХОДИТЬСЯ В 3-ХАГРЕГАТНЫХ СОСТОЯНИЯХ :
ТВЕРДОМ, ЖИДКОМ, ГАЗООБРАЗНОМ .
Т.О жидкое состояние является промежуточным между твердым и газообразным.
НО! При соответствующих условиях возможен непосредственный переход из
твердого состояния в газообразное без расплавления – этот переход называется
сублимацией
4.
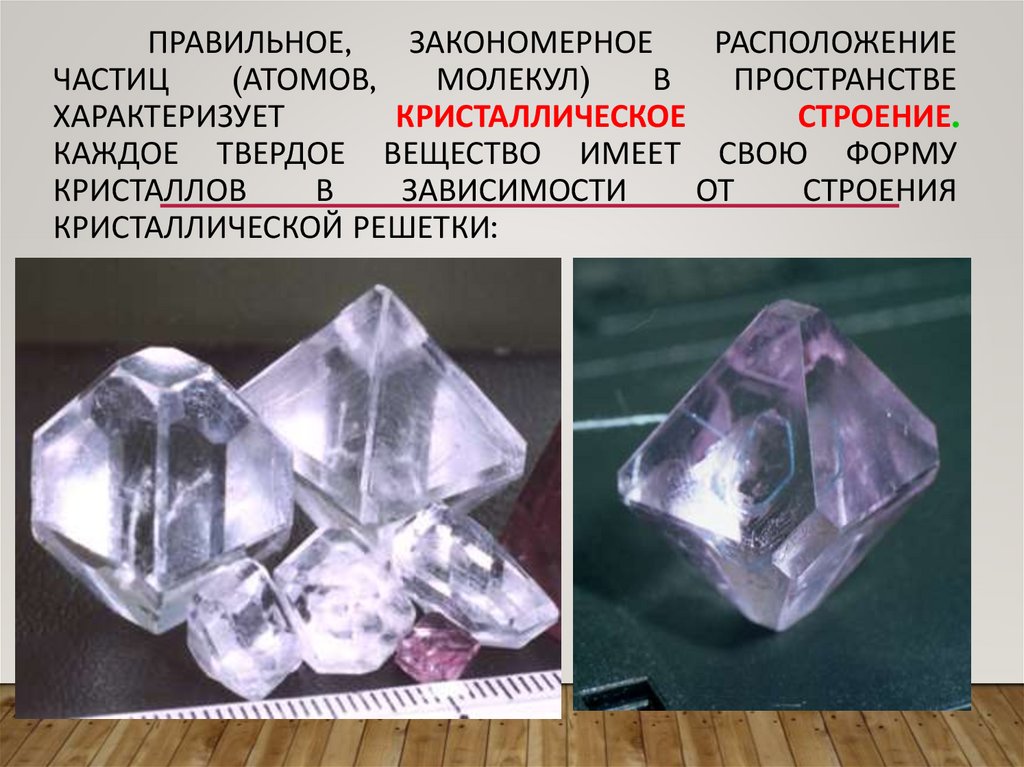
ПРАВИЛЬНОЕ,ЗАКОНОМЕРНОЕ
РАСПОЛОЖЕНИЕ
ЧАСТИЦ
(АТОМОВ,
МОЛЕКУЛ)
В
ПРОСТРАНСТВЕ
ХАРАКТЕРИЗУЕТ
КРИСТАЛЛИЧЕСКОЕ
СТРОЕНИЕ.
КАЖДОЕ ТВЕРДОЕ ВЕЩЕСТВО ИМЕЕТ СВОЮ ФОРМУ
КРИСТАЛЛОВ
В
ЗАВИСИМОСТИ
ОТ
СТРОЕНИЯ
КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ:
5.
Твердые тела• Сохраняют объём и форму
• Плохо сжимаются
• Плохо растягиваются
• Имеют дальний порядок в расположении
частиц
6.
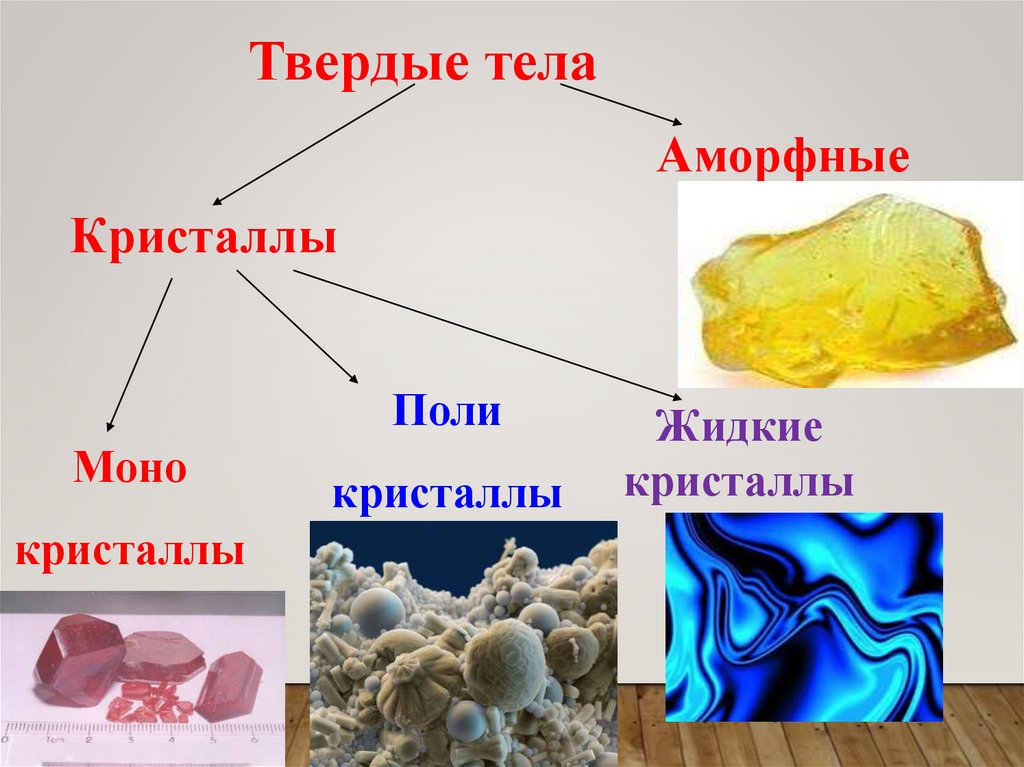
Твердые телаАморфные
Кристаллы
Поли
Моно
кристаллы
кристаллы
Жидкие
кристаллы
7.
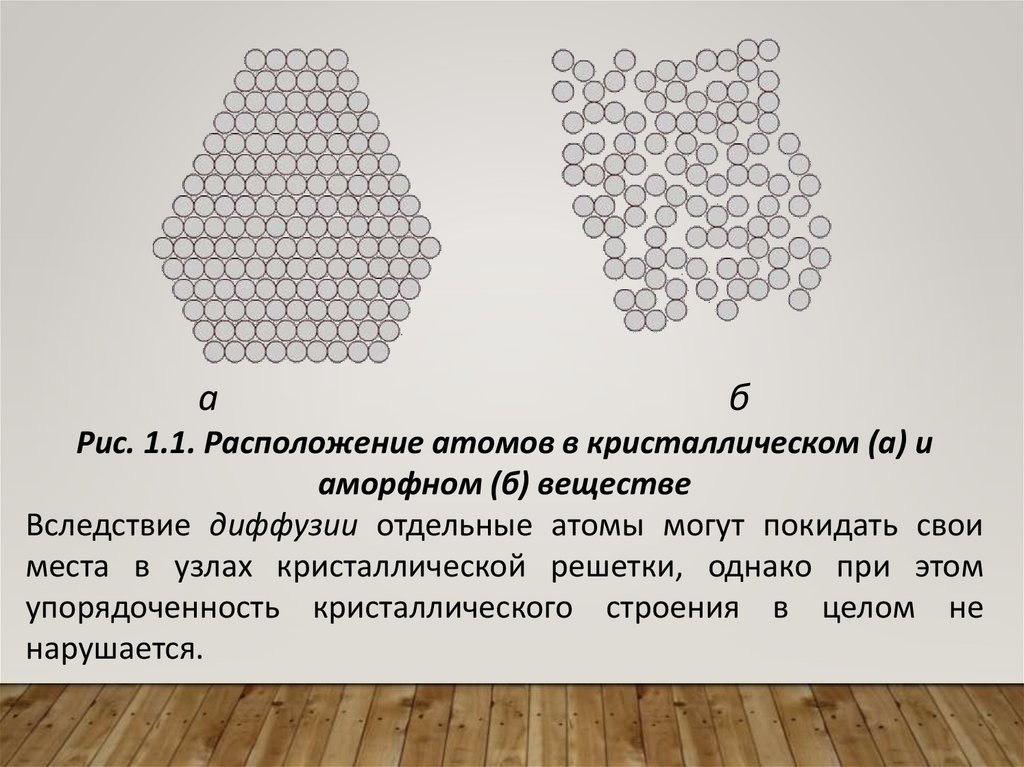
аб
Рис. 1.1. Расположение атомов в кристаллическом (а) и
аморфном (б) веществе
Вследствие диффузии отдельные атомы могут покидать свои
места в узлах кристаллической решетки, однако при этом
упорядоченность кристаллического строения в целом не
нарушается.
8.
МОНОКРИСТАЛЛЫ(КРИСТАЛЛИТЫ)
• Твердые тела, иногда обладающие правильной
геометрической формой.
• Главный признак: периодически повторяющаяся
внутренняя структура во всем объеме (каменная соль,
кварц, алмаз, турмалин и т.д.)
• Основное свойство: анизотропия, т.е. различие
свойств кристалла по разным направлениям
9.
ПОЛИКРИСТАЛЛЫ• Твердые тела, состоящие из отдельных, беспорядочно
расположенных, сросшихся между собой зеренкристаллитов.
• В соседних зернах кристаллические решетки повернуты
относительно друг друга на некоторый угол.
• Поликристаллы изотропны, т.е. имеют одинаковые
свойства по всем направлениям.
10.
Атомы совершают относительно своего среднегоположения колебания с частотой около 1013 Гц.
Амплитуда
этих
колебаний
пропорциональна
температуре.
Благодаря упорядоченному расположению атомов
в пространстве, их центры можно соединить
воображаемыми прямыми линиями. Совокупность
таких
пересекающихся
линий
представляет
пространственную решетку, которую называют
кристаллической решеткой.
Внешние
электронные
орбиты
атомов
соприкасаются, так что плотность упаковки атомов в
кристаллической решетке весьма велика.
11.
В металлах и металлических сплавах атомынаходятся в узлах пространственных кристаллических решеток.
В процессе кристаллизации металлов и сплавов могут
образовываться кристаллические решетки разного типа
12.
Элементарная ячейка – элементобъёма из минимального числа атомов,
многократным переносом которого в
пространстве можно построить весь
кристалл.
13.
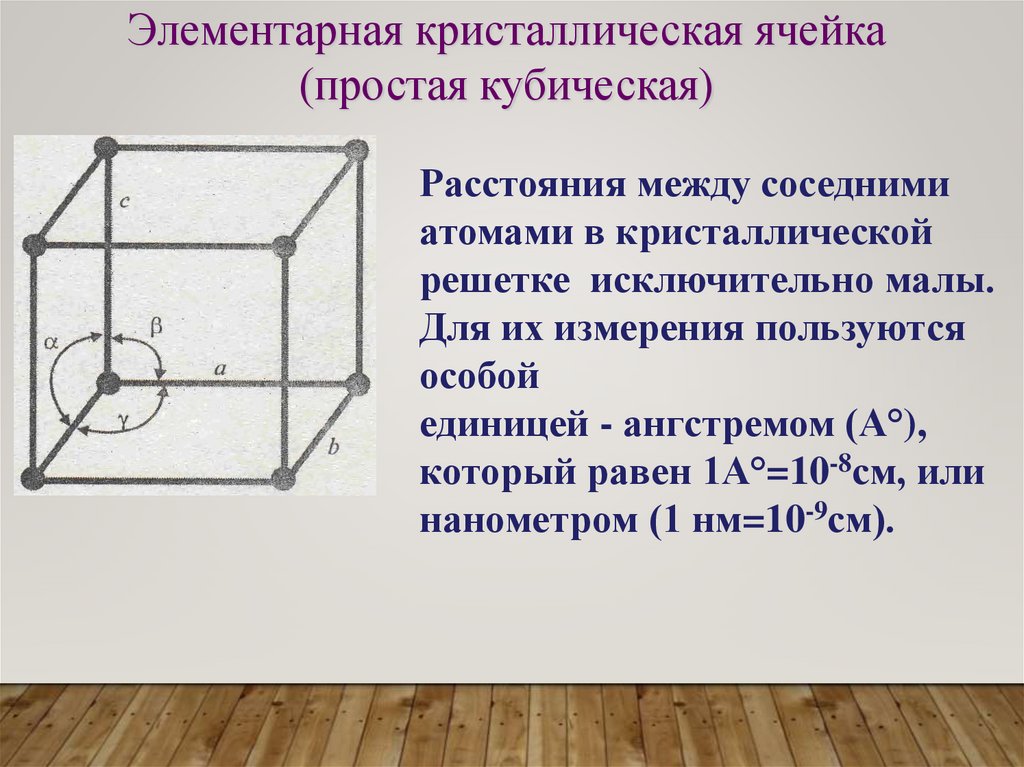
Элементарная кристаллическая ячейка(простая кубическая)
Расстояния между соседними
атомами в кристаллической
решетке исключительно малы.
Для их измерения пользуются
особой
единицей - ангстремом (А°),
который равен 1А°=10-8см, или
нанометром (1 нм=10-9см).
14.
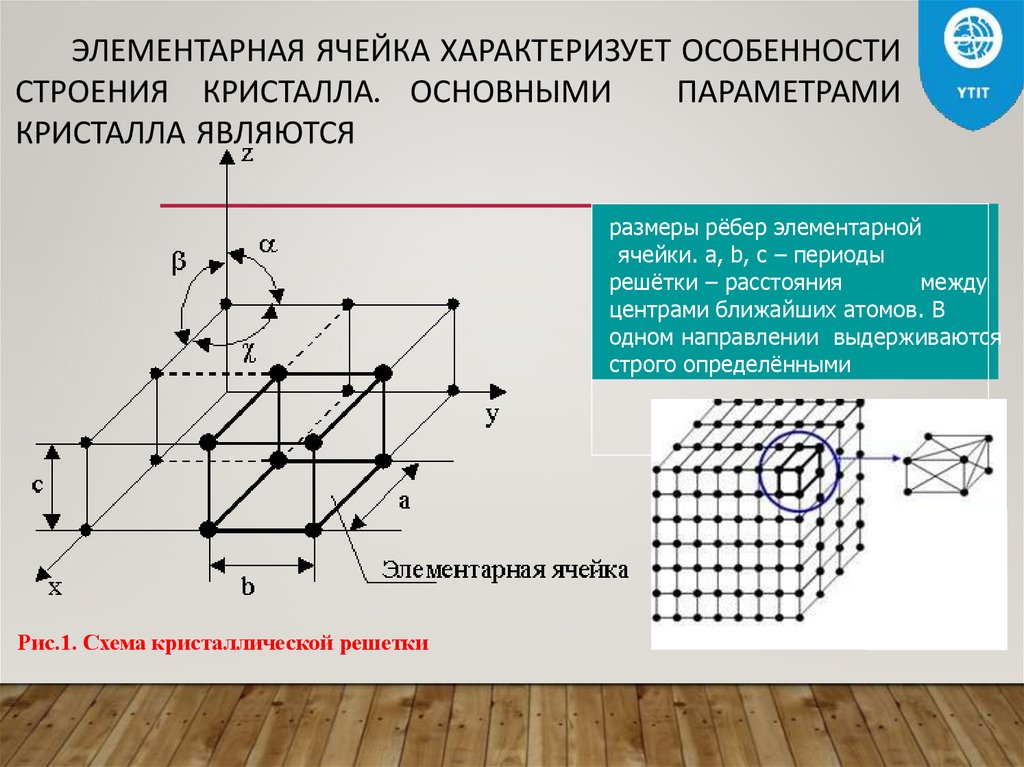
ЭЛЕМЕНТАРНАЯ ЯЧЕЙКА ХАРАКТЕРИЗУЕТ ОСОБЕННОСТИСТРОЕНИЯ КРИСТАЛЛА. ОСНОВНЫМИ
ПАРАМЕТРАМИ
КРИСТАЛЛА ЯВЛЯЮТСЯ
размеры рёбер элементарной
ячейки. a, b, c – периоды
решётки – расстояния
между
центрами ближайших атомов. В
одном направлении выдерживаются
строго определёнными
Рис.1. Схема кристаллической решетки
15.
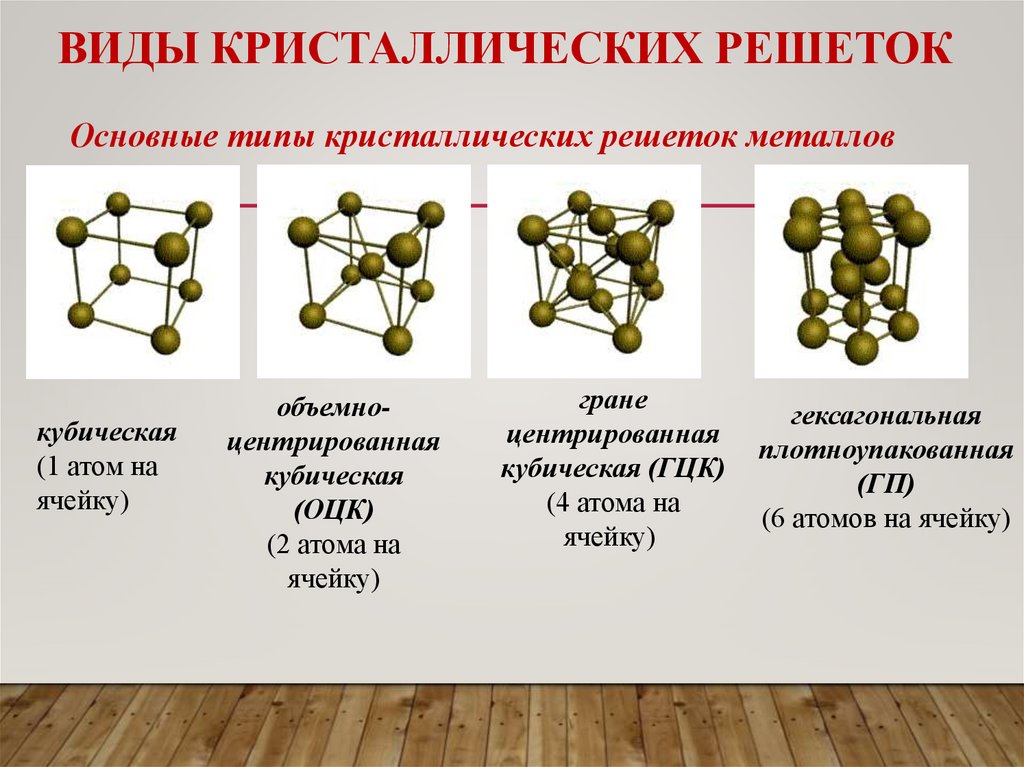
ВИДЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОКОсновные типы кристаллических решеток металлов
кубическая
(1 атом на
ячейку)
объемноцентрированная
кубическая
(ОЦК)
(2 атома на
ячейку)
гране
центрированная
кубическая (ГЦК)
(4 атома на
ячейку)
гексагональная
плотноупакованная
(ГП)
(6 атомов на ячейку)
16.
17.
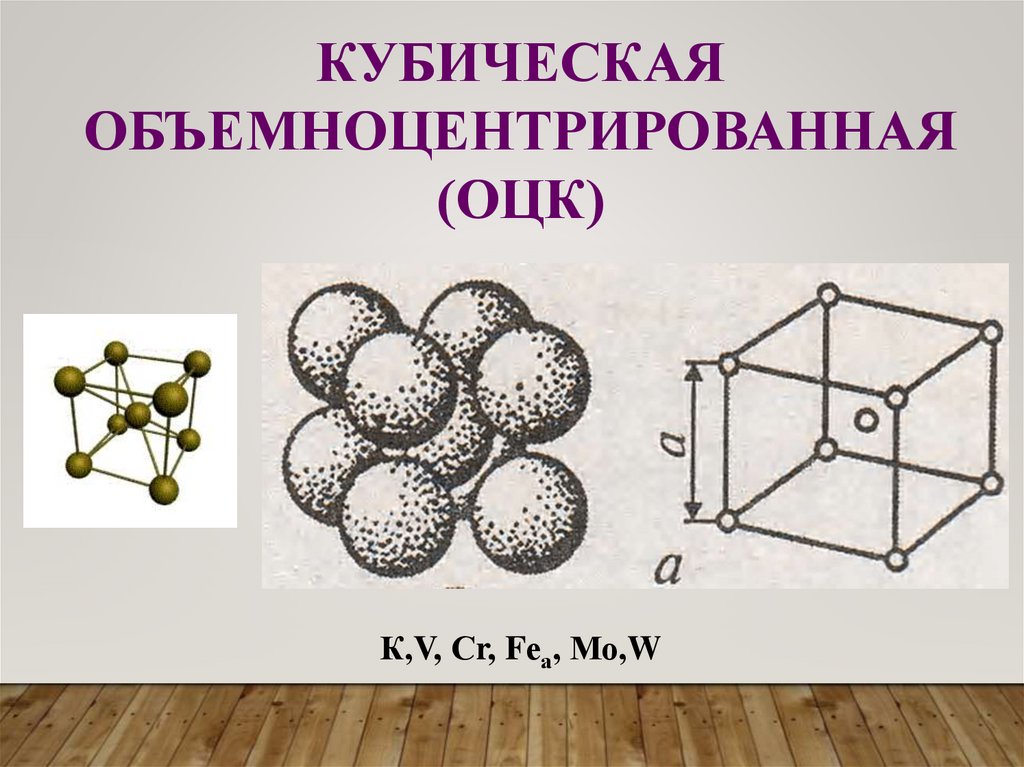
КУБИЧЕСКАЯОБЪЕМНОЦЕНТРИРОВАННАЯ
(ОЦК)
К,V, Сr, Fеа, Мо,W
18.
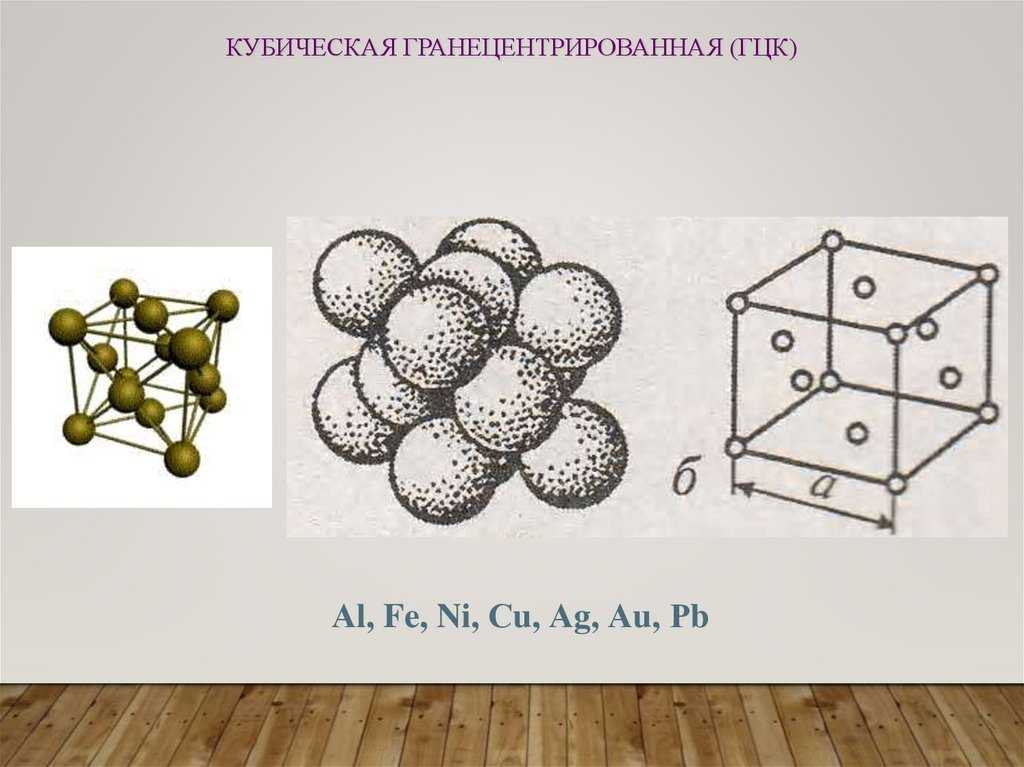
КУБИЧЕСКАЯ ГРАНЕЦЕНТРИРОВАННАЯ (ГЦК)Аl, Fe, Ni, Сu, Аg, Аu, Рb
19.
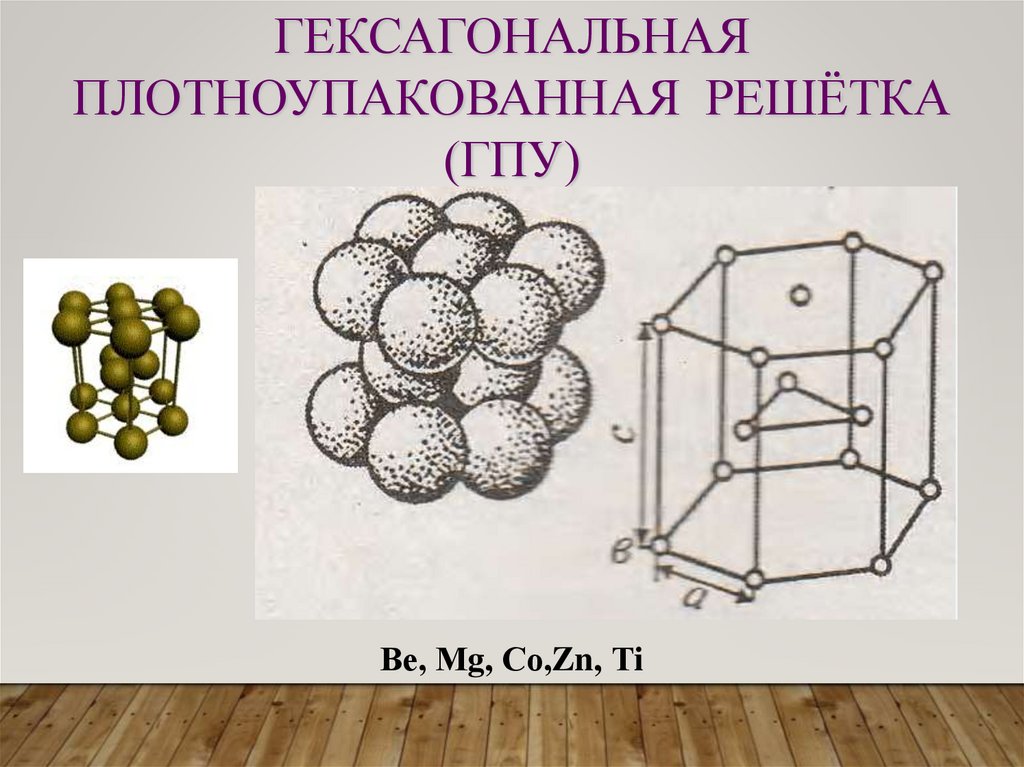
ГЕКСАГОНАЛЬНАЯПЛОТНОУПАКОВАННАЯ РЕШЁТКА
(ГПУ)
Ве, Мg, Со,Zn, Тi
20.
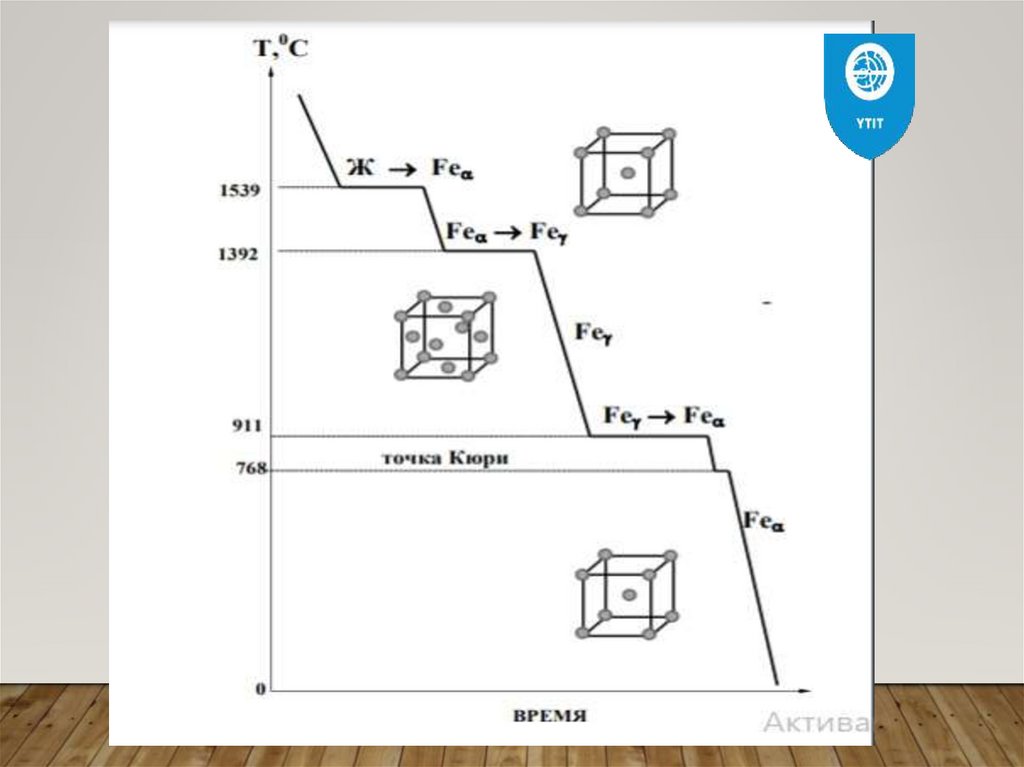
Некоторые металлы испытываютявление полиморфизма (аллотропия
(железо, марганец, кобальт, олово, никель,
цинк)), т.е. металлы имеют различные
кристаллические
структуры,
переходящие из одной в другую
при
изменении температуры и давления,
однако
основное
значение
при
полиморфном превращении имеет
температура
21.
22.
23.
Разные аллотропические формы одного и того жеметалла принято обозначать буквами греческого
алфавита в виде индексов. Примером
аллотропического видоизменения в зависимости от
температуры является железо (Fe).
Превращение одной модификации в другую
протекает
при
постоянной
температуре
и
сопровождается
тепловым
эффектом.
Форма
устойчивая при самой низкой температуре для
данного элемента обозначается
буквой
греческого
алфавита у основного обозначения металла
24.
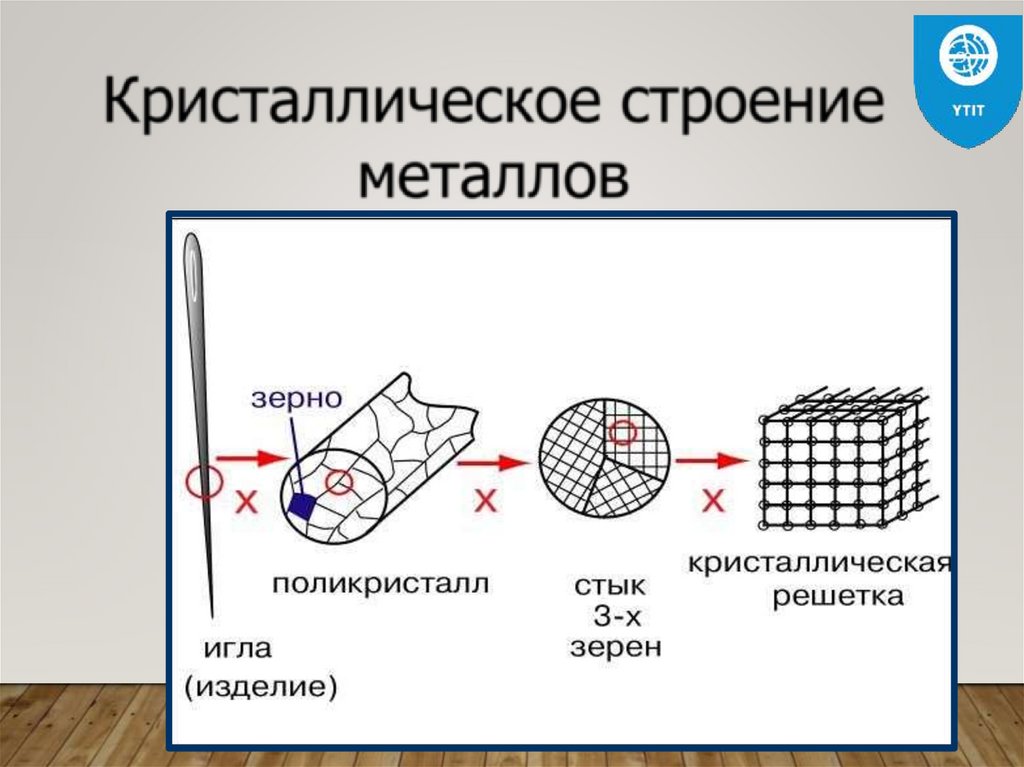
СТРОЕНИЕ РЕАЛЬНЫХ МЕТАЛЛОВМеталлы и сплавы, полученные в обычных
условиях, состоят из большого количества
кристаллов,
то
есть,
имеют
поликристаллическое строение. Эти кристаллы
называются зернами.
Они имеют неправильную форму и
различно ориентированы в пространстве.
Каждое зерно имеет свою
ориентировку
кристаллической
решетки,
отличную
от
ориентировки соседних зерен, вследствие чего
свойства реальных металлов усредняются, и
явления анизотропии не наблюдается
25.
26.
металловМеталлические изделия являются поликристаллами
27.
28.
29.
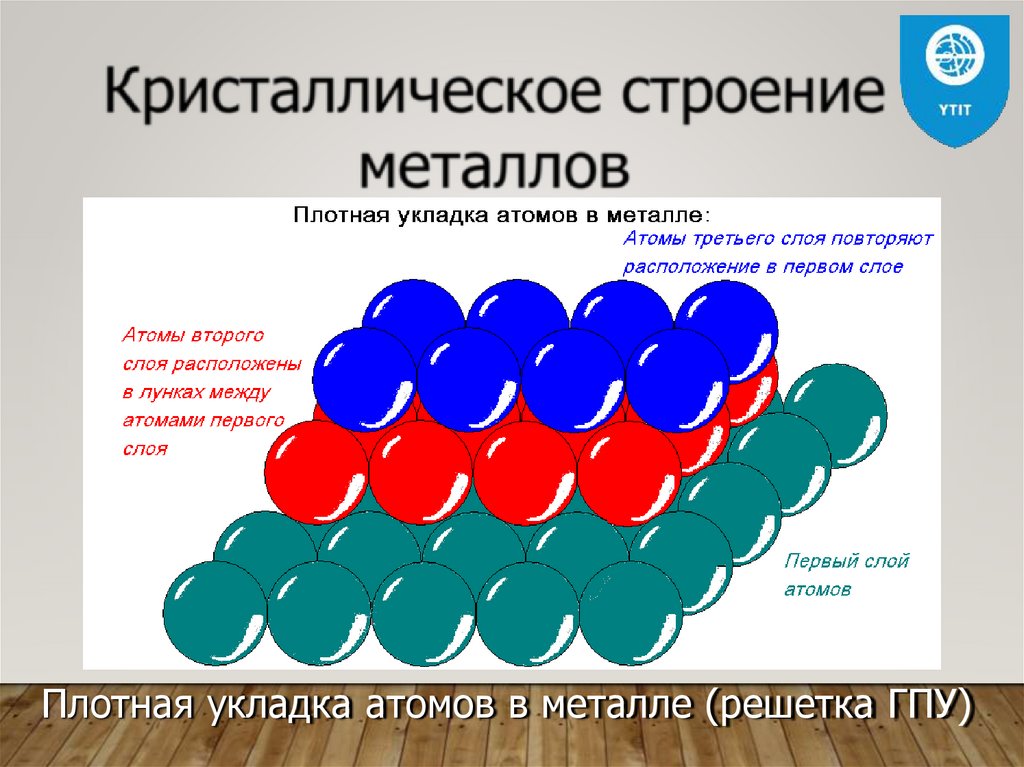
Плотная укладка атомов в металле (решетка ГПУ)30.
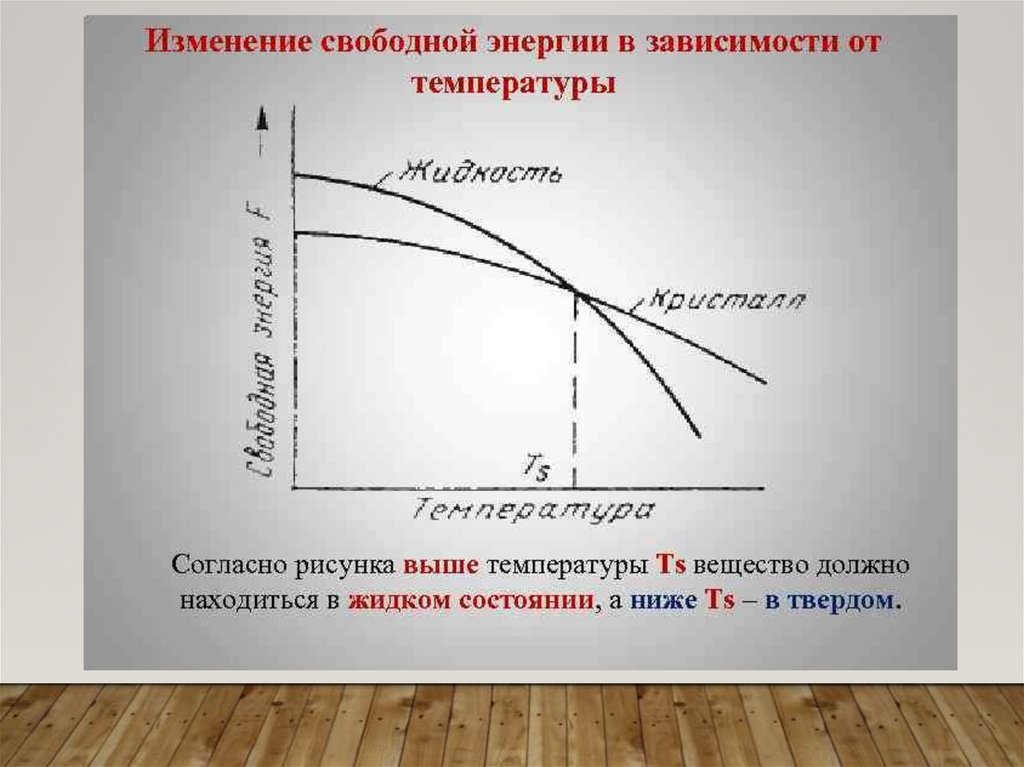
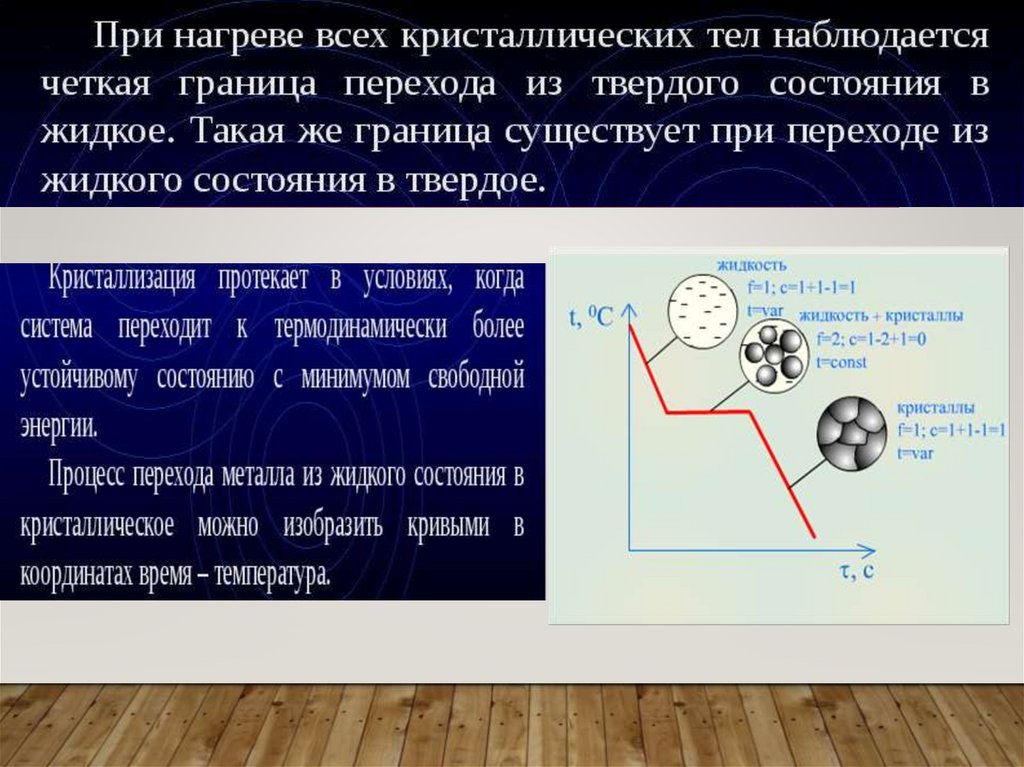
КРИСТАЛЛИЗАЦИЯВ чистых металлах, при
определенных темпера турах
происходит
изменение агрегатного
состояния:
• Твердое вещество
сменяется жидким
при температуре
плавления;
• Жидкое переходит в
газообразное
при температуре
кипения
31.
32.
33.
34.
35.
НА ПРИМЕРЕ КРИСТАЛЛИЗАЦИИ ВОДЫ МОЖНО РАССМОТРЕТЬЗОНЫ КРИСТАЛЛИЗАЦИИ И РАЗЛИЧИЕ ОТВОДА ТЕПЛА
36.
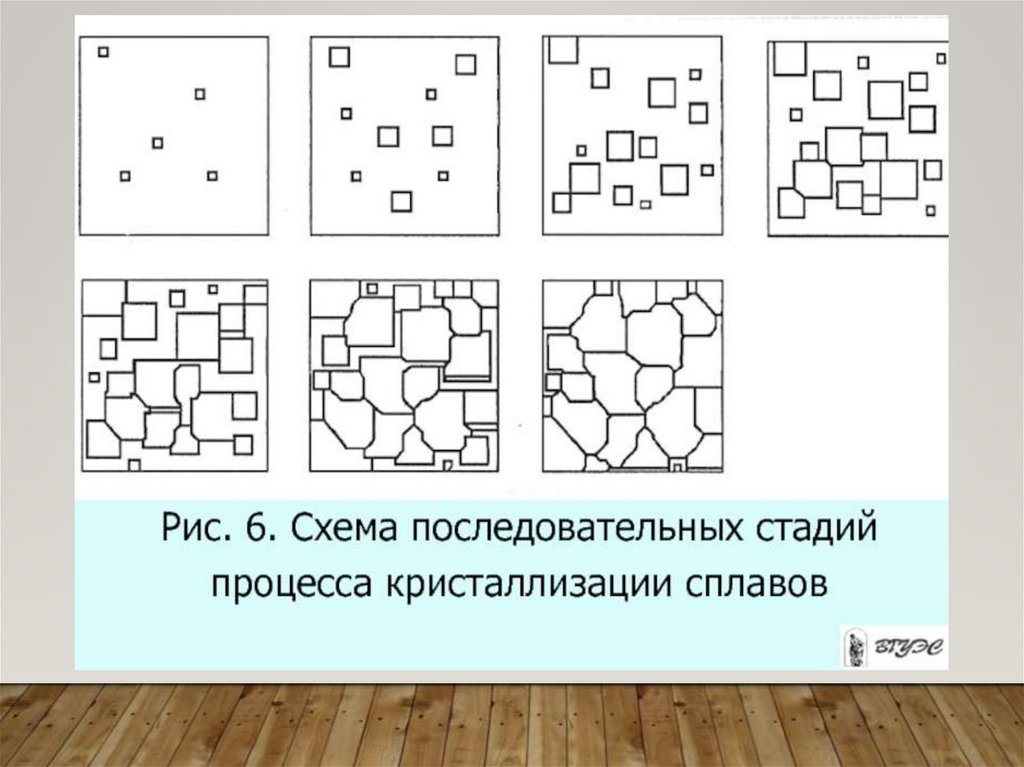
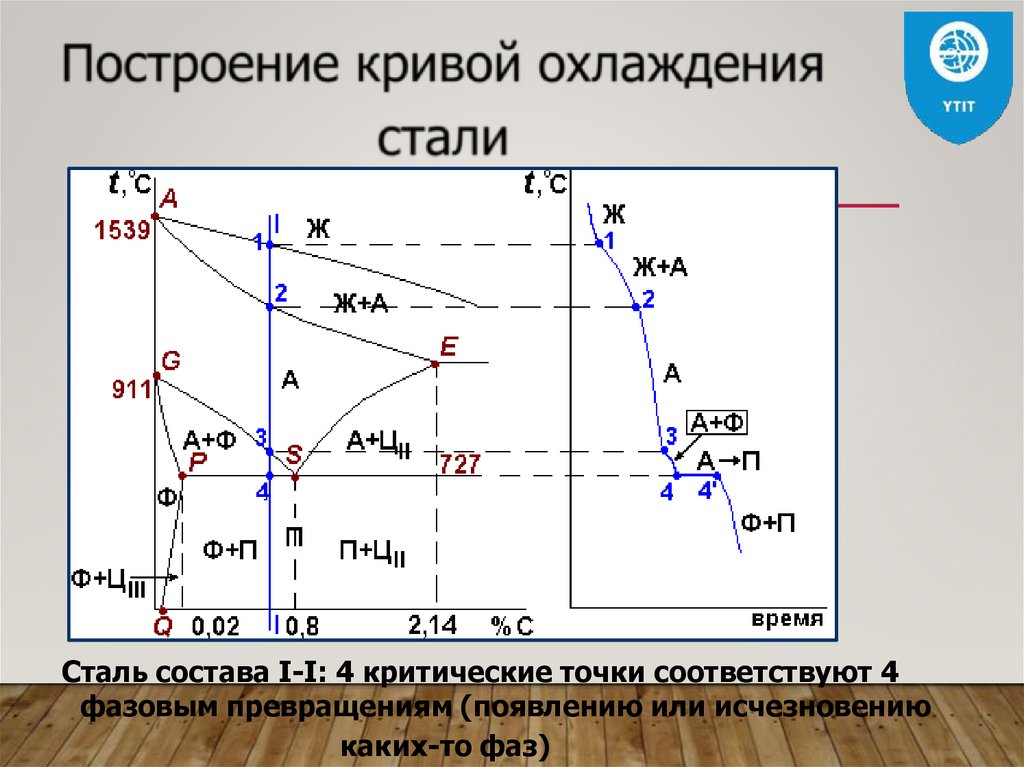
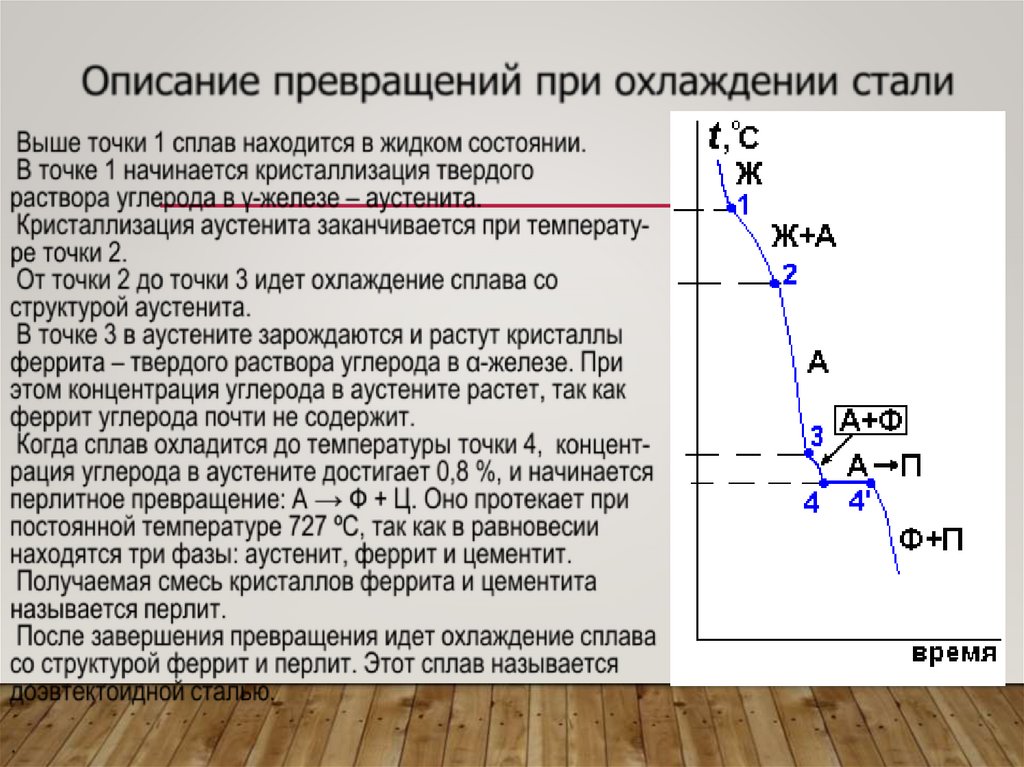
Сталь состава I-I: 4 критические точки соответствуют 4фазовым превращениям (появлению или исчезновению
каких-то фаз)
37.
38.
39.
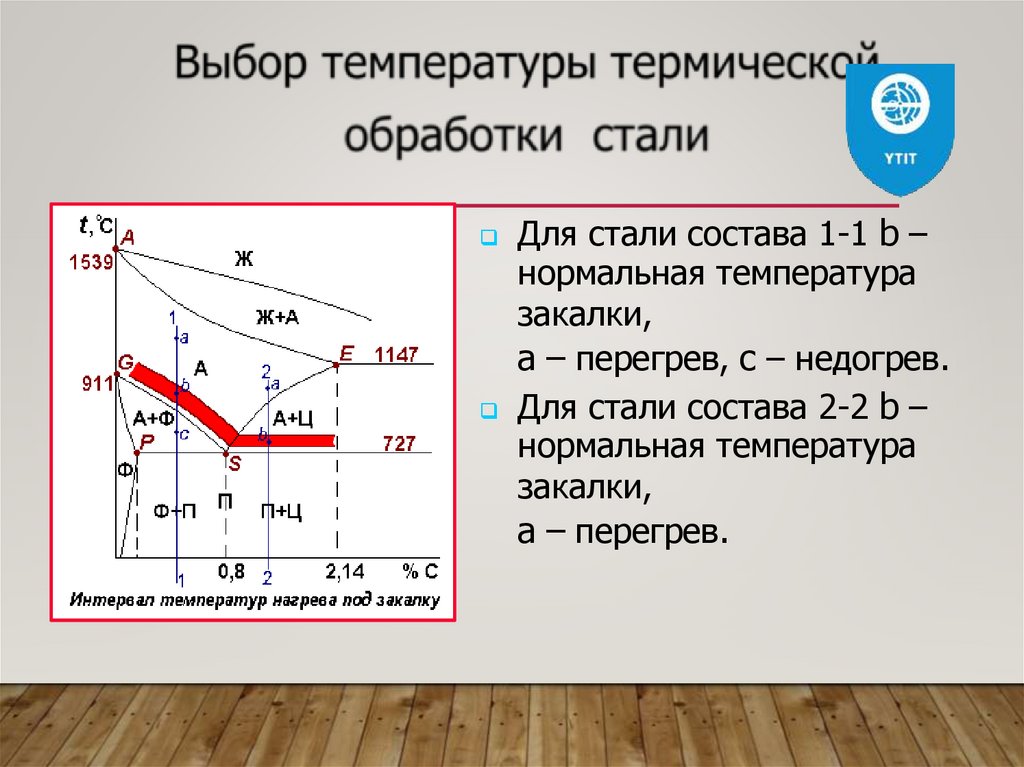
Для стали состава 1-1 b –нормальная температура
закалки,
a – перегрев, c – недогрев.
Для стали состава 2-2 b –
нормальная температура
закалки,
a – перегрев.
40.
Опишите различия атомной и/или молекулярной структуры междукристаллическими и некристаллическими материалами.
Изобразите единичную ячейку гранецентрированной кубической,
объемно-центрированной
кубической
и
гексагональной
плотноупакованных кристаллических структур.
Выведите соотношение между длинами граней единичной ячейки и
атомными радиусами гра- нецентрированной и объемноцентрированной кубическими ячейками в кристалле.
Рассчитайте плотности металлов с гранецен- трированной и
объемно-центрированной кубическими ячейками, если известны
размеры ячеек.
Изобразите и опишите единичные ячейки кристаллической
структуры хлористого натрия, хлористого цезия, цинковой обманки,
алмаза, флюорита, перовскита. Сделайте это также для атомной
структуры графита и силикатного стекла.
Для заданного химического состава керамики и известных ионных
радиусов ее компонент опишите, какой должна быть
кристаллическая структура вещества.
41.
Определите понятия об изотропии и анизотропии исходя из свойств
материала Если даны три целочисленных индекса направлений,
укажите направления, соответствующие трем индексам в
кристаллографической ячейке.
Определите индексы Миллера для некоторой плоскости,
проведенной внутри единичной кристаллографической ячейки.
Опишите,
каким
образом
могут
быть
образованы
гранецентрированная
и
гексагональная
атомных плоскостей. Сделайте это на примере кристаллической
структуры хлористого натрия, исходя из представления об анионах,
лежащих в плотноупакованных плоскостях.
Опишите
различия
между
монокристаллами
и
поликристаллическим материалом.























 Химия
Химия








