3-практика Структура металлов
1.
3-практикаСтруктура металлов
2.
Кристаллические структурыВсе металлы и сплавы в твердом состоянии являются
кристаллическими телами, т.е. они остаются твердыми и сохраняют
формы и размеры до вполне определенной температуры (Тпл), после
которой они переходят в жидкое состояние. Кристаллические тела
характеризуются упорядоченным расположением в пространстве
элементарных частиц (атомов), из которых они состоят, т.е.
кристаллической решеткой. Кристаллическую решетку вещества можно
представить как мысленно проведенные в пространстве в направлении 3-х
осей координат прямые линии, соединяющие ближайшие атомы и
проходящие через их центры.
Другими словами, кристаллическая
решетка-это воображаемая пространственная решетка, в узлах которой
располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объёма из минимального числа атомов,
многократным переносом которого в пространстве можно построить весь
кристалл.
3.
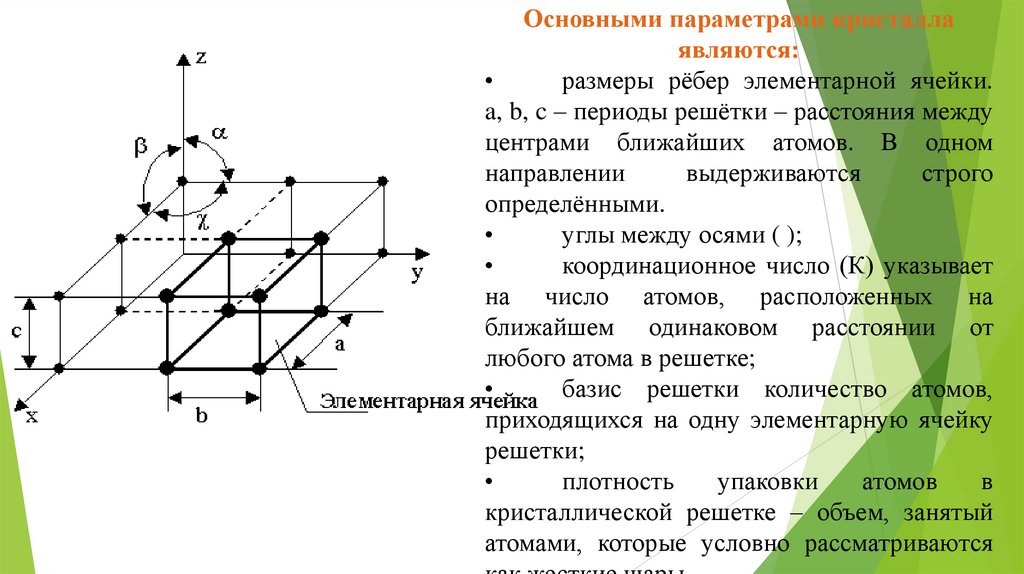
Основными параметрами кристаллаявляются:
размеры рёбер элементарной ячейки.
a, b, c – периоды решётки – расстояния между
центрами ближайших атомов. В одном
направлении
выдерживаются
строго
определёнными.
углы между осями ( );
координационное число (К) указывает
на число атомов, расположенных на
ближайшем одинаковом расстоянии от
любого атома в решетке;
базис решетки количество атомов,
приходящихся на одну элементарную ячейку
решетки;
плотность
упаковки
атомов
в
кристаллической решетке – объем, занятый
атомами, которые условно рассматриваются
4.
Основными типами кристаллических решётокОсновными типами кристаллических решёток являются:
Объемно - центрированная кубическая (ОЦК), атомы располагаются в
вершинах куба и в его центре (V, W, Ti, )
1.
Гранецентрированная кубическая (ГЦК), атомы располагаются в вершинах
куба и по центру каждой из 6 граней (Ag, Au, )
2.
3.
Гексагональная, в основании которой лежит шестиугольник:
- простая – атомы располагаются в вершинах ячейки и по центру 2 оснований
(углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней
плоскости (цинк).
-
5.
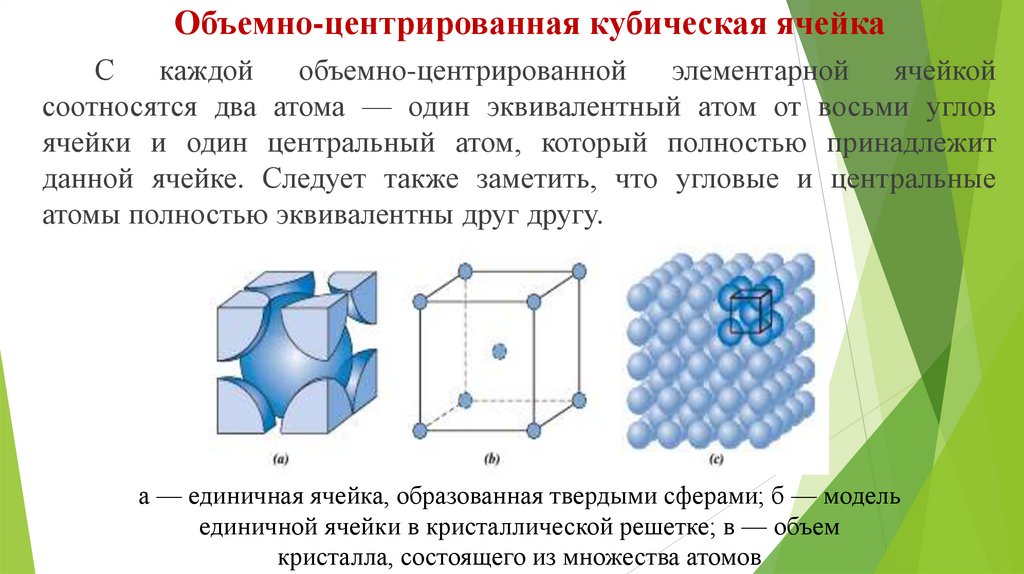
Объемно-центрированная кубическая ячейкаС каждой объемно-центрированной элементарной ячейкой
соотносятся два атома — один эквивалентный атом от восьми углов
ячейки и один центральный атом, который полностью принадлежит
данной ячейке. Следует также заметить, что угловые и центральные
атомы полностью эквивалентны друг другу.
а — единичная ячейка, образованная твердыми сферами; б — модель
единичной ячейки в кристаллической решетке; в — объем
кристалла, состоящего из множества атомов
6.
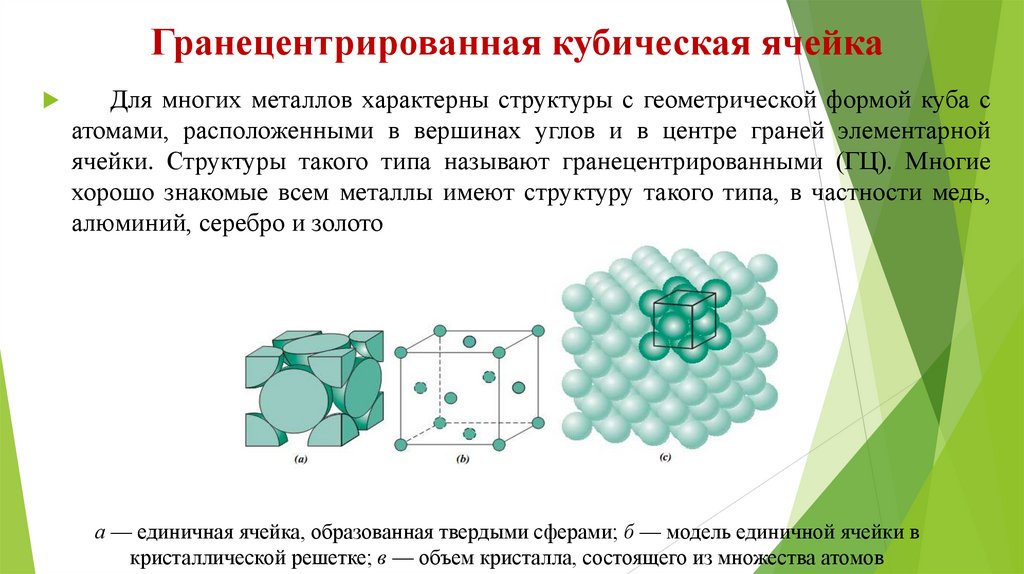
Гранецентрированная кубическая ячейкаДля многих металлов характерны структуры с геометрической формой куба с
атомами, расположенными в вершинах углов и в центре граней элементарной
ячейки. Структуры такого типа называют гранецентрированными (ГЦ). Многие
хорошо знакомые всем металлы имеют структуру такого типа, в частности медь,
алюминий, серебро и золото
а — единичная ячейка, образованная твердыми сферами; б — модель единичной ячейки в
кристаллической решетке; в — объем кристалла, состоящего из множества атомов
7.
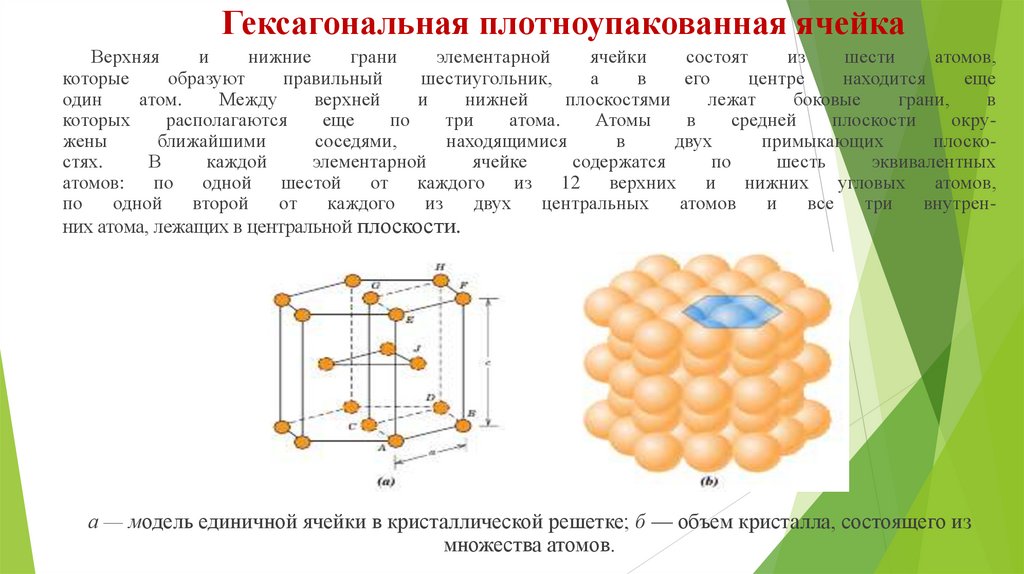
Гексагональная плотноупакованная ячейкаВерхняя
и
нижние
грани
элементарной
ячейки
состоят
из
шести
атомов,
которые
образуют
правильный
шестиугольник,
а
в
его
центре
находится
еще
один
атом.
Между
верхней
и
нижней
плоскостями
лежат
боковые
грани,
в
которых
располагаются
еще
по
три
атома.
Атомы
в
средней
плоскости
окружены
ближайшими
соседями,
находящимися
в
двух
примыкающих
плоскостях.
В
каждой
элементарной
ячейке
содержатся
по
шесть
эквивалентных
атомов:
по
одной
шестой
от
каждого
из
12
верхних
и
нижних
угловых
атомов,
по
одной
второй
от
каждого
из
двух
центральных
атомов
и
все
три
внутренних атома, лежащих в центральной плоскости.
а — модель единичной ячейки в кристаллической решетке; б — объем кристалла, состоящего из
множества атомов.
8.
Определение количество атомов, принадлежащих решёткеИногда необходимо определить число атомов, составляющих каждую
элементарную ячейку. В зависимости от расположения атомов следует, какая их часть
принадлежит данной ячейке. например, атомы в углах ячейки куба, стороны которой
находятся в центре, принадлежат еще восьми таким же ячейкам одновременно, а
атомы в ее центре принадлежат одновременно только двум ячейкам. Количество
атомов в ячейке определяется по следующей формуле:
Nj
Ne
N Ni
2
8
где : Ni – количество внутренних атомов в ячейке;
Nj – число атомов на сторонах ячейки;
Ne – число атомов в углах ячейки..
9.
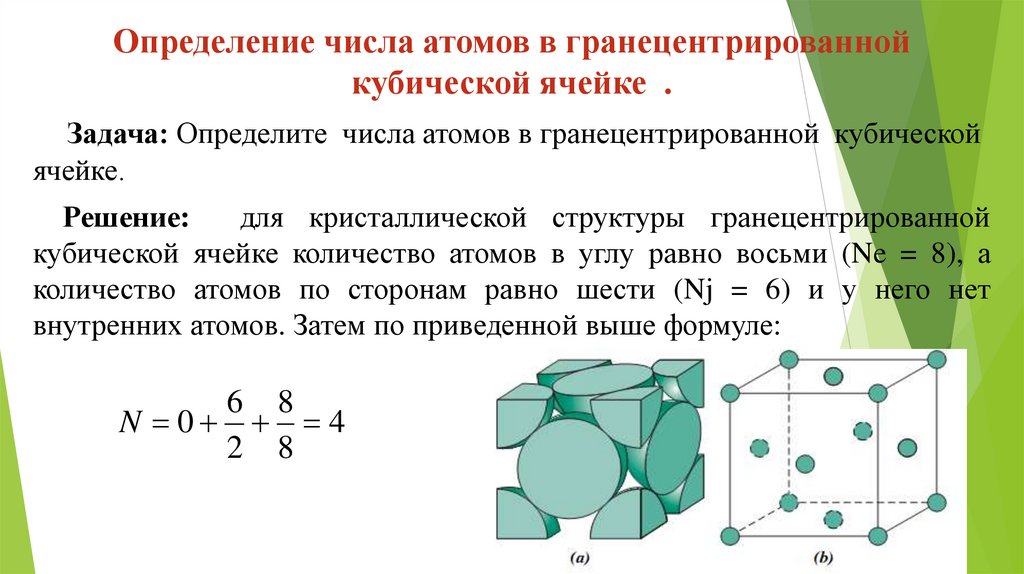
Определение числа атомов в гранецентрированнойкубической ячейке .
Задача: Определите числа атомов в гранецентрированной кубической
ячейке.
Решение:
для кристаллической структуры гранецентрированной
кубической ячейке количество атомов в углу равно восьми (Ne = 8), а
количество атомов по сторонам равно шести (Nj = 6) и у него нет
внутренних атомов. Затем по приведенной выше формуле:
6 8
N 0 4
2 8
10.
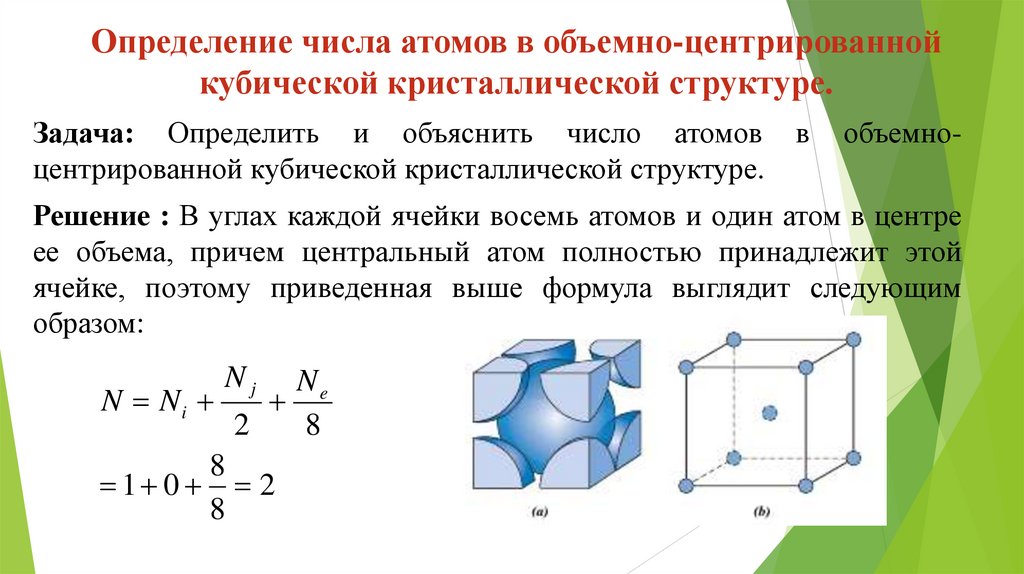
Определение числа атомов в объемно-центрированнойкубической кристаллической структуре.
Задача: Определить и объяснить число атомов
центрированной кубической кристаллической структуре.
в
объемно-
Решение : В углах каждой ячейки восемь атомов и один атом в центре
ее объема, причем центральный атом полностью принадлежит этой
ячейке, поэтому приведенная выше формула выглядит следующим
образом:
Nj
Ne
N Ni
2
8
8
1 0 2
8
11.
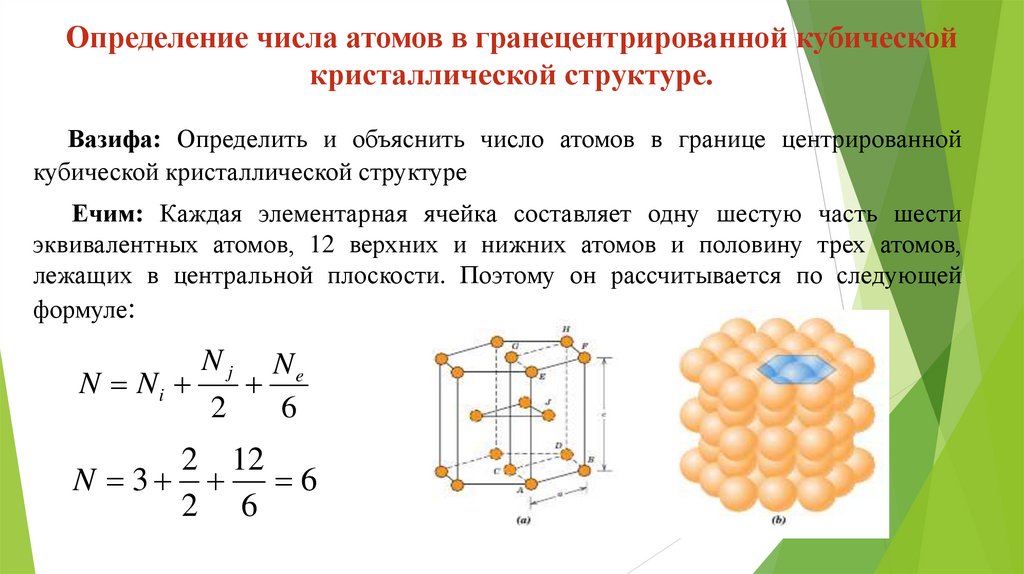
Определение числа атомов в гранецентрированной кубическойкристаллической структуре.
Вазифа: Определить и объяснить число атомов в границе центрированной
кубической кристаллической структуре
Ечим: Каждая элементарная ячейка составляет одну шестую часть шести
эквивалентных атомов, 12 верхних и нижних атомов и половину трех атомов,
лежащих в центральной плоскости. Поэтому он рассчитывается по следующей
формуле:
Nj
Ne
N Ni
2
6
2 12
N 3
6
2 6
12.
,Определение объема элементарной гранецентрированной
кубической ячейки
Задача: рассчитать объём элементарной кубической ячейки.
Решение: Схема элементарной граница центрированной кубической ячейки
показана на рисунке, где также указаны размеры..
Атомы касаются друг друга по диагонали грани, длина которой,
следовательно составляет ,4R
Поскольку единичная ячейка представляет собой куб,
его объём равен а3, где а – длина ребра куба.
Тогда можно записать равенство:
à 2 à 2 (4 R) 2
Его решение относительно а дает :
a 2R 2
Объём граница центрированной элементарной ячейки Vc может быть вычислен
по формуле :
3
3
3
VC a (2R 2 ) 16R
2
13.
Определение коэффициента плотности упаковки атомов в элементарнойгранецентрированной кубической ячейке
Задача: показать, что коэффициент плотности упаковки атомов в элементарной
гранецентрированной кубической ячейки равен 0,74.
Решение : Коэффициент упаковки атомов (КУА) определяется как отношение объемов
твердых сфер к объему единичной ячейки:
КУА =
общий объём сфер
Обём единичной ячейки
Обе величины, выходящие в эту формулу, могут быть выражены через атомный
радиус R
Поскольку объем сферы выражается как 4/3πR3 , и поскольку в элементарную
гранецентрированную ячейку входят четыре атома, общий объем сфер составляет:
4
16
VS 4 R 3
R 3
3
3
Из решения рассмотренной задачи следует, что : VC 16R3 2
Тогда коэффициент упаковки атомов составляет: :
16 3
R
VS
KTK
3 3
0,74
VC 16 R 2
14.
ПЛОТНОСТЬ МЕТАЛЛОВ. РАСЧЕТЕсли известна кристаллическая структура металла, то можно рассчитать
теоретическое значение его плотности p с помощью следующей формулы:
где:
nA
p
VC N A
n – число атомов, входящих в элементарную ячейку;
А – атомный вес;
VC – объем элементарной ячейки;
NА – число Авагадро (6,02·1023 атом/моль).
15.
Теоретический расчет плотности медиЗадача: Атомный радиус меди составляет 0,128 нм. Медь образует
гранецентрированную ячейку, атомный вес меди — 63,5 г/моль. Рассчитать
плотность меди.
Решение; Для решения используется формула (3.5). Поскольку кристаллическая
структура элементарной ячейки — гранецентрированная, отсюда следует, что число
атомов, приходящееся на одну ячейку, равно 4. Атомный вес меди АCu = 63,5 г/моль.
Величина объема элементарной ячейки была определена в задаче 3.1. Для
3
16
R
2 где атомный радиус R = 0,128
гранецентрированной ячейки она составляет,
нм.
16.
линг
лл
урас
ом
и
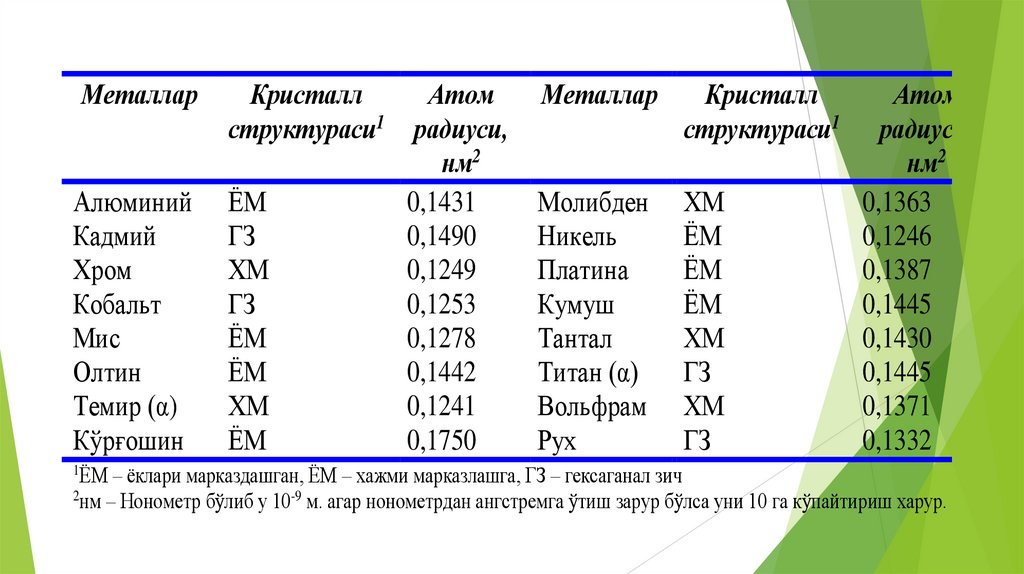
Металлар
Алюминий
Кадмий
Хром
Кобальт
Мис
Олтин
Темир (α)
Кўрғошин
Кристалл
Атом
структураси1 радиуси,
нм2
ЁМ
0,1431
ГЗ
0,1490
ХМ
0,1249
ГЗ
0,1253
ЁМ
0,1278
ЁМ
0,1442
ХМ
0,1241
ЁМ
0,1750
Металлар
Кристалл
структураси1
Молибден
Никель
Платина
Кумуш
Тантал
Титан (α)
Вольфрам
Рух
ХМ
ЁМ
ЁМ
ЁМ
ХМ
ГЗ
ХМ
ГЗ
Атом
радиуси,
нм2
0,1363
0,1246
0,1387
0,1445
0,1430
0,1445
0,1371
0,1332
1ЁМ – ёклари марказдашган, ЁМ – хажми марказлашга, ГЗ – гексаганал зич
2нм – Нонометр бўлиб у 10-9 м. агар нонометрдан ангстремга ўтиш зарур бўлса уни 10 га кўпайтириш харур.








 Химия
Химия