Похожие презентации:
Подгруппа углерода
1. Подгруппа углерода
2. Подгруппа углерода
Положение в ПСХЭХарактеристика
Подгруппа углерода, в
которую входят углерод,
кремний,
германий,
олово и
свинец,
является
главной подгруппой 4
группы Периодической
системы.
История
открытия
химических элементов
IVA группы.
3. Подгруппа углерода
ХарактеристикаНа внешней электронной оболочке
атомов этих элементов имеется 4
электрона
и
их
электронную
конфигурацию в общем виде можно
записать так: ns2np2, где n - это номер
периода, в котором расположен
химический элемент. При переходе
сверху
вниз
по
группе
неметаллические
свойства
ослабляются,
а
металлические
возрастают, поэтому углерод и
кремний - это неметаллы, а олово и
свинец проявляет свойства типичных
металлов.
Образуя
ковалентные
полярные связи с атомами водорода,
C и Si проявляют формальную
степень окисления -4, а с более
активными неметаллами (N, O, S) и
галогенами
проявляют степени окисления +2 и +4.
4.
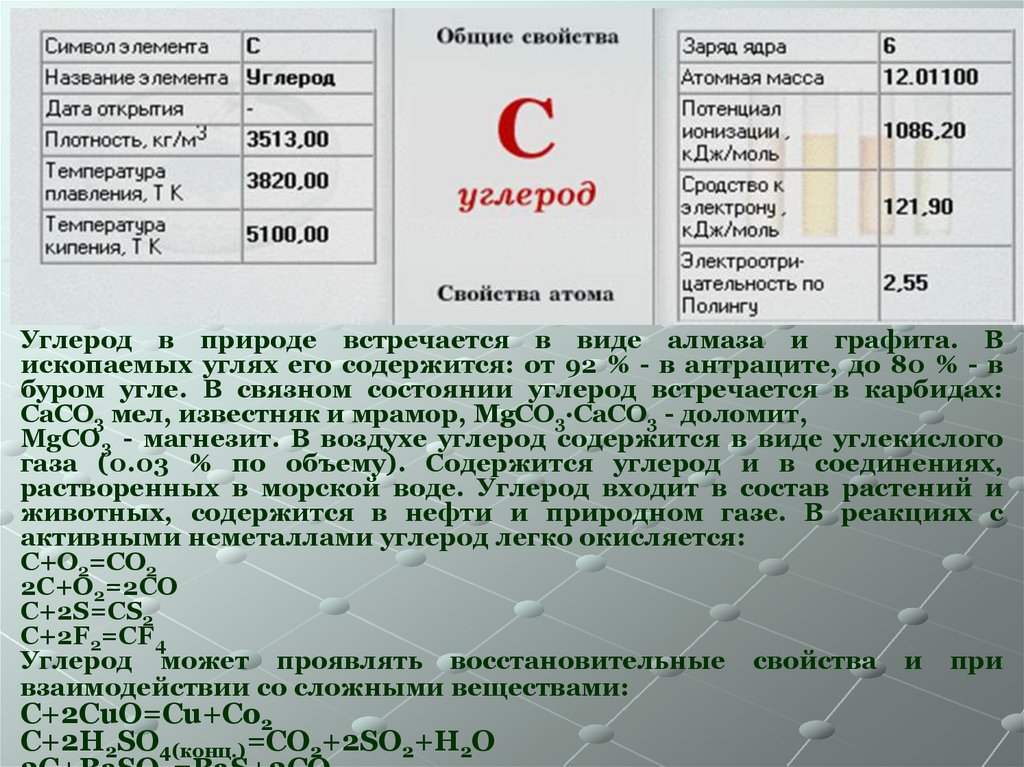
Углерод в природе встречается в виде алмаза и графита. Вископаемых углях его содержится: от 92 % - в антраците, до 80 % - в
буром угле. В связном состоянии углерод встречается в карбидах:
CaCO3 мел, известняк и мрамор, MgCO3·CaCO3 - доломит,
MgCO3 - магнезит. В воздухе углерод содержится в виде углекислого
газа (0.03 % по объему). Содержится углерод и в соединениях,
растворенных в морской воде. Углерод входит в состав растений и
животных, содержится в нефти и природном газе. В реакциях с
активными неметаллами углерод легко окисляется:
C+O2=CO2
2C+O2=2CO
C+2S=CS2
C+2F2=CF4
Углерод может проявлять восстановительные свойства и при
взаимодействии со сложными веществами:
C+2CuO=Cu+Co2
C+2H2SO4(конц.)=CO2+2SO2+H2O
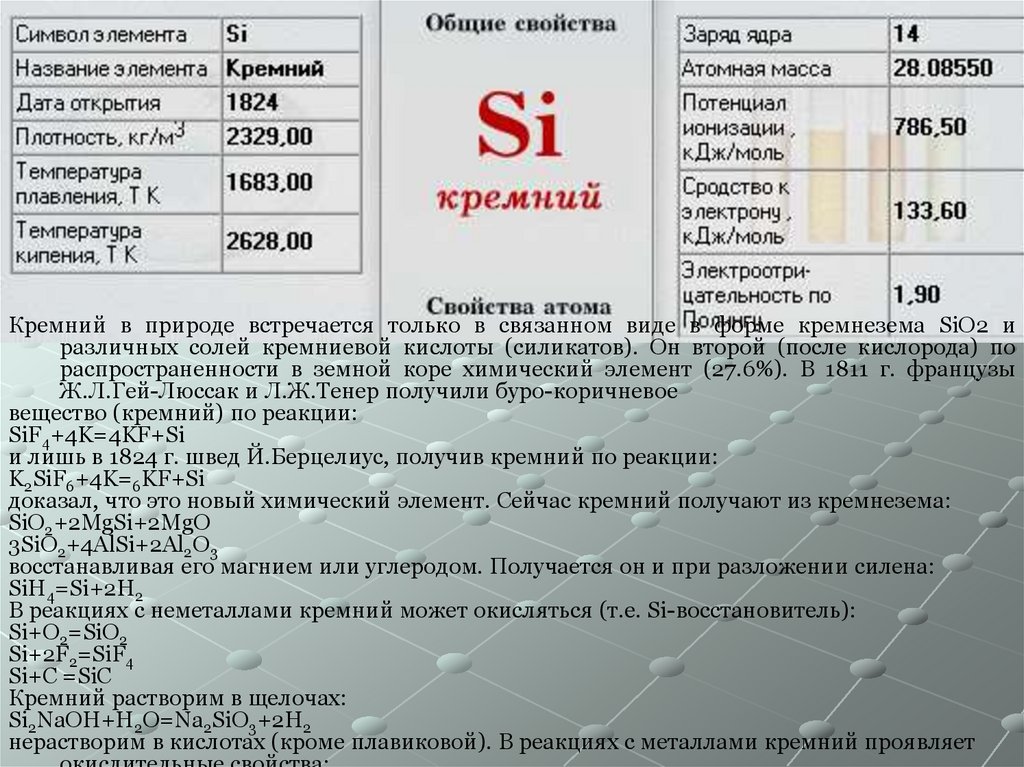
5.
Кремний в природе встречается только в связанном виде в форме кремнезема SiO2 иразличных солей кремниевой кислоты (силикатов). Он второй (после кислорода) по
распространенности в земной коре химический элемент (27.6%). В 1811 г. французы
Ж.Л.Гей-Люссак и Л.Ж.Тенер получили буро-коричневое
вещество (кремний) по реакции:
SiF4+4K=4KF+Si
и лишь в 1824 г. швед Й.Берцелиус, получив кремний по реакции:
K2SiF6+4K=6KF+Si
доказал, что это новый химический элемент. Сейчас кремний получают из кремнезема:
SiO2+2MgSi+2MgO
3SiO2+4AlSi+2Al2O3
восстанавливая его магнием или углеродом. Получается он и при разложении силена:
SiH4=Si+2H2
В реакциях с неметаллами кремний может окисляться (т.е. Si-восстановитель):
Si+O2=SiO2
Si+2F2=SiF4
Si+C =SiC
Кремний растворим в щелочах:
Si2NaOH+H2O=Na2SiO3+2H2
нерастворим в кислотах (кроме плавиковой). В реакциях с металлами кремний проявляет
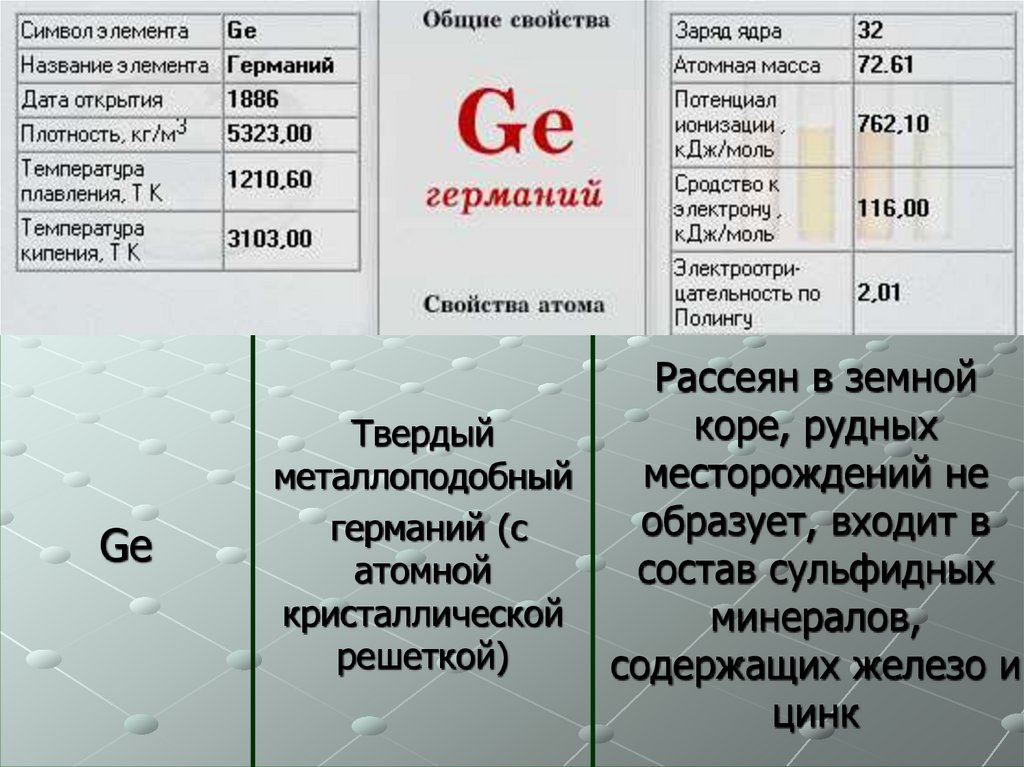
6.
GeРассеян в земной
коре, рудных
Твердый
месторождений не
металлоподобный
образует, входит в
германий (с
атомной
состав сульфидных
кристаллической
минералов,
решеткой)
содержащих железо и
цинк
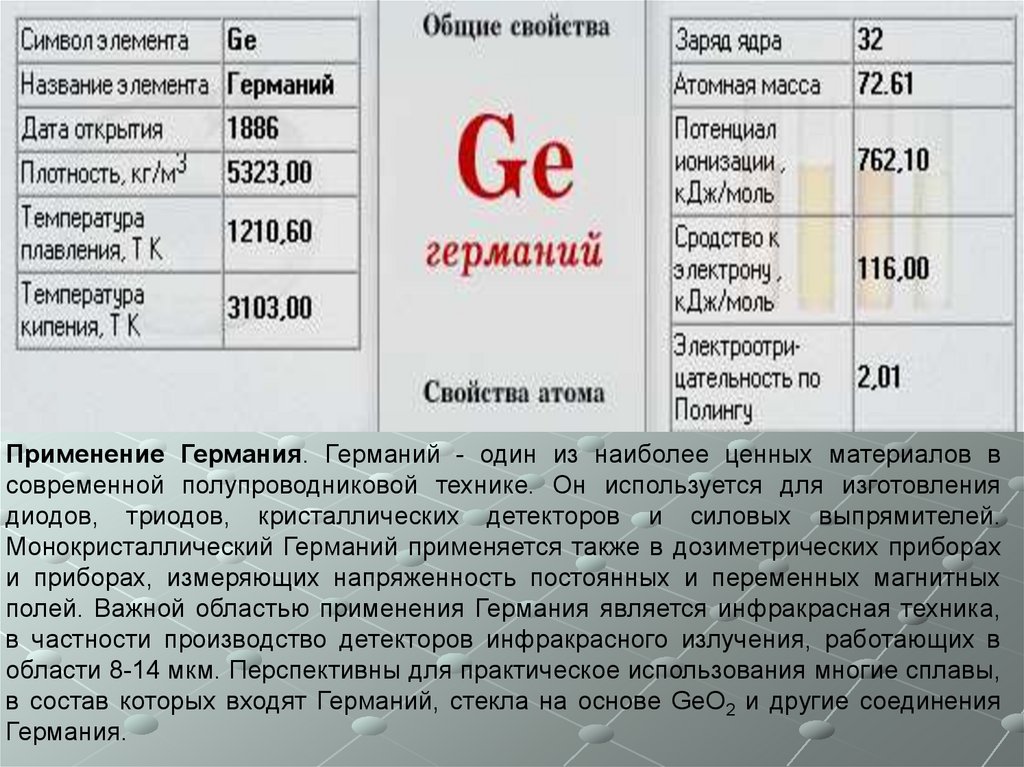
7.
Применение Германия. Германий - один из наиболее ценных материалов всовременной полупроводниковой технике. Он используется для изготовления
диодов, триодов, кристаллических детекторов и силовых выпрямителей.
Монокристаллический Германий применяется также в дозиметрических приборах
и приборах, измеряющих напряженность постоянных и переменных магнитных
полей. Важной областью применения Германия является инфракрасная техника,
в частности производство детекторов инфракрасного излучения, работающих в
области 8-14 мкм. Перспективны для практическое использования многие сплавы,
в состав которых входят Германий, стекла на основе GeO2 и другие соединения
Германия.
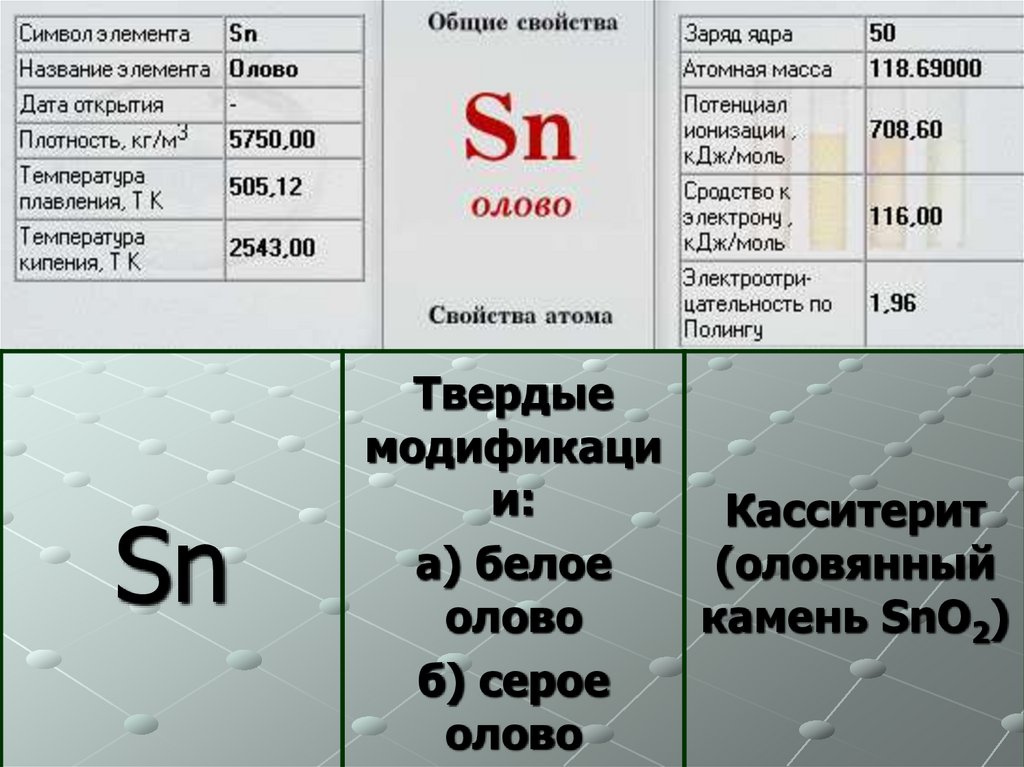
8.
SnТвердые
модификаци
и:
Касситерит
а) белое
(оловянный
олово
камень SnO2)
б) серое
олово
9.
Применение Олова. До 40% Олово идет на лужениеконсервной жести, остальное расходуется на производство
припоев, подшипниковых и типографских сплавов. Оксид
SnO2 применяется для изготовления жаростойких эмалей и
глазурей. Соль - станнит натрия Na2SnO3·3H2O используется в
протравном
крашении
тканей.
Кристаллический
SnS2("сусальное
золото")
входит
в
состав
красок,
имитирующих позолоту. Станнид ниобия Nb3Sn - один из
наиболее используемых сверхпроводящих материалов.
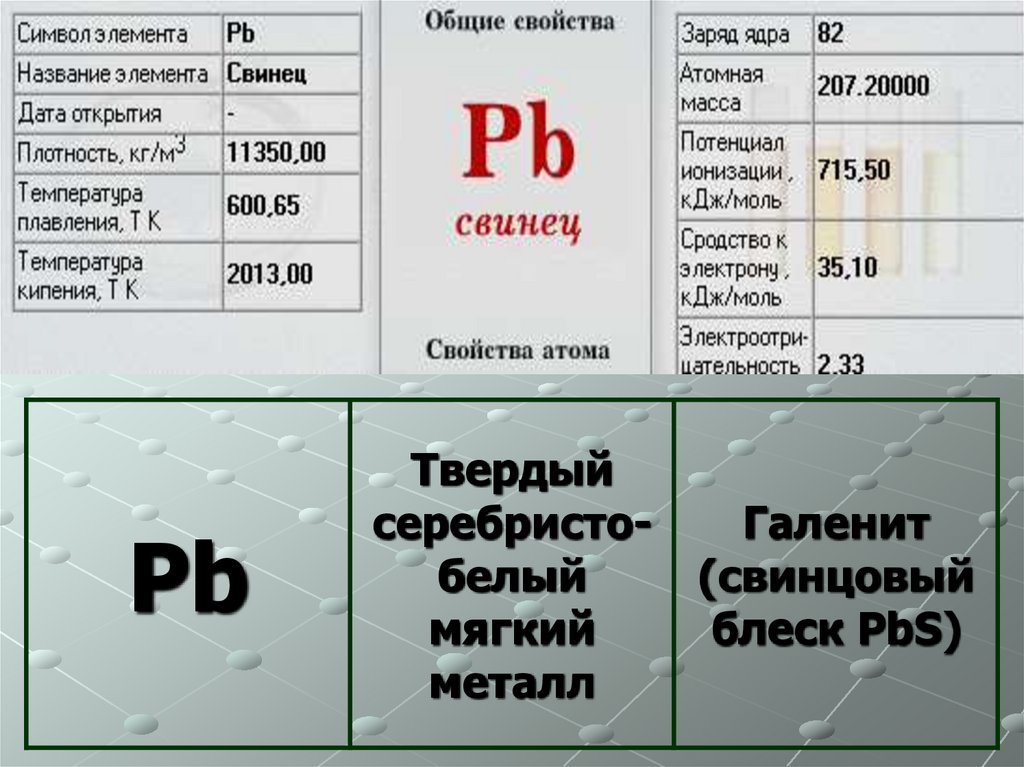
10.
PbТвердый
серебристобелый
мягкий
металл
Галенит
(свинцовый
блеск PbS)
11.
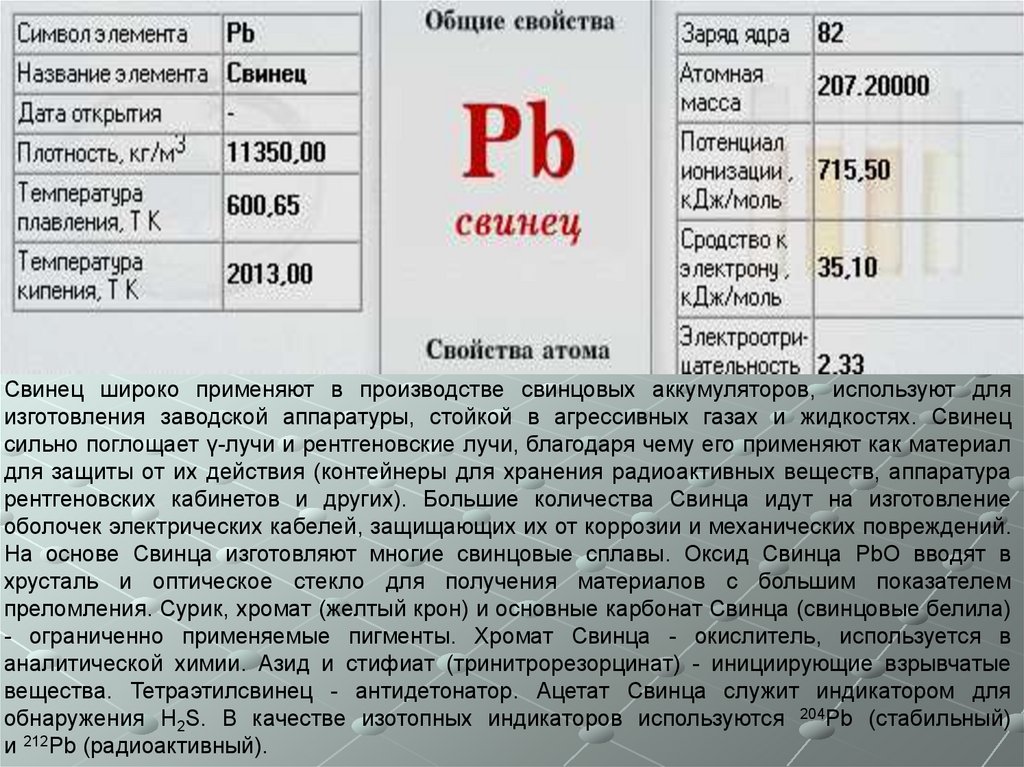
Свинец широко применяют в производстве свинцовых аккумуляторов, используют дляизготовления заводской аппаратуры, стойкой в агрессивных газах и жидкостях. Свинец
сильно поглощает γ-лучи и рентгеновские лучи, благодаря чему его применяют как материал
для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура
рентгеновских кабинетов и других). Большие количества Свинца идут на изготовление
оболочек электрических кабелей, защищающих их от коррозии и механических повреждений.
На основе Свинца изготовляют многие свинцовые сплавы. Оксид Свинца РbО вводят в
хрусталь и оптическое стекло для получения материалов с большим показателем
преломления. Сурик, хромат (желтый крон) и основные карбонат Свинца (свинцовые белила)
- ограниченно применяемые пигменты. Хромат Свинца - окислитель, используется в
аналитической химии. Азид и стифиат (тринитрорезорцинат) - инициирующие взрывчатые
вещества. Тетраэтилсвинец - антидетонатор. Ацетат Свинца служит индикатором для
обнаружения H2S. В качестве изотопных индикаторов используются 204Рb (стабильный)
и 212Рb (радиоактивный).
12. Углерод
13. Положение в таблице Менделеева
УглеродCarbogenium - 6ой
элемент в таблице
Менделеева.
Он
располагается
в
главной подгруппе
четвертой
группы,
втором
периоде.
Углерод-типичный
неметалл.
14. Нахождение в природе
В настоящее время известно более миллионасоединений углерода с другими элементами. Их
изучение составляет целую науку – органическую
химию. В тоже время за изучение свойств чистого
углерода ученые взялись сравнительно недавно около 20 лет назад.
• Углерод в природе встречается в виде алмаза и графита.
• В ископаемых углях его содержится: от 92 % - в антраците, до
80 % - в буром угле.
• В связном состоянии углерод встречается в карбидах: CaCO3
мел, известняк и мрамор, MgCO3·CaCO3 - доломит,MgCO3 магнезит.
• В воздухе углерод содержится в виде углекислого газа (0.03 %
по объему).
• Содержится углерод и в соединениях, растворенных в морской
воде.
• Углерод входит в состав растений и животных, содержится в
нефти и природном газе
15. Нахождение в природе
Углеродзанимает
17-е
место
по
распространенности в земной коре – 0,048%.
Но несмотря на это, он играет огромную роль
в живой и неживой природе.
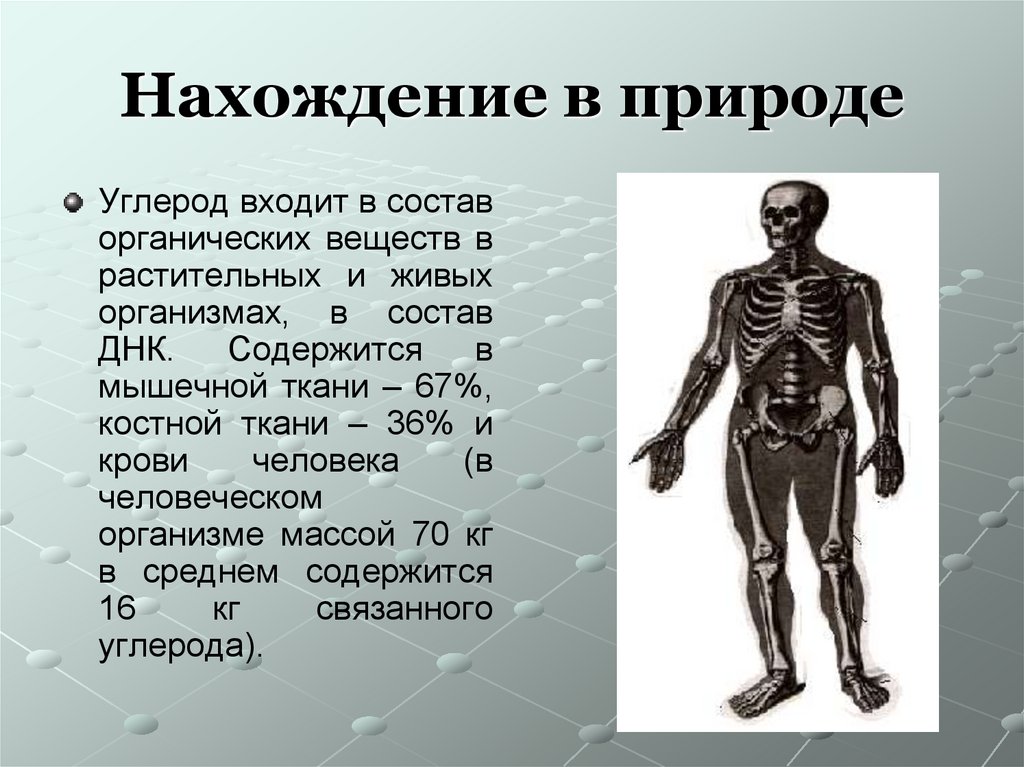
16. Нахождение в природе
Углерод входит в составорганических веществ в
растительных и живых
организмах, в состав
ДНК.
Содержится
в
мышечной ткани – 67%,
костной ткани – 36% и
крови
человека
(в
человеческом
организме массой 70 кг
в среднем содержится
16
кг
связанного
углерода).
17. Свободный углерод
В свободном виде углерод встречаетсяв
нескольких
аллотропных
модификациях – алмаз, графит, карбин,
крайне
редко
фуллерены.
В
лабораториях
также
были
синтезированы
многие
другие
модификации:
новые
фуллерены,
нанотрубки, наночастицы и др.
18.
Алмаз19.
Графит20.
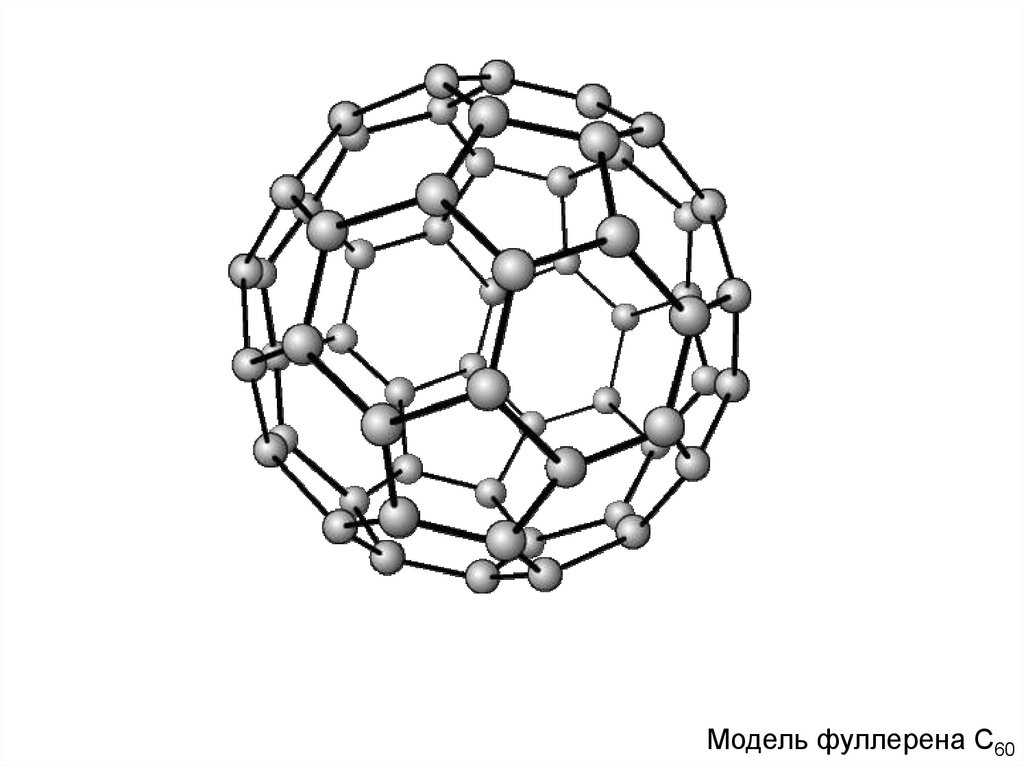
МодельфуллеренаС
С60
Модель
фуллерена
60
21. Все это - чистый углерод
22. Алмаз
Структура алмазаАлмаз
Алмаз – бесцветное,
прозрачное,
сильно
преломляющее
свет
вещество.
Алмаз
тверже всех найденных
в природе веществ, но
при
этом
довольно
хрупок. Он настолько
тверд, что оставляет
царапины
на
большинстве
материалов.
23. Алмаз
Плотность алмаза – 3,5г/см3,
tплав=3730С,
tкип=4830оС.
Алмаз
можно
получить
из
графита при p > 50 тыс.
атм. и tо = 1200оC В
алмазе
каждый
4-х
валентный
атом
углерода
связан
с
другим
атомом
углерода ковалентной
связью и количество
таких
связанных
в
каркас
атомов
чрезвычайно велико.
24. Алмаз
Непрерывнаятрехмерная
сетка ковалентных связей,
которая
характеризуется
большой
прочностью,
определяет многие свойства
алмаза, так то плохая теплои электропроводимость, а
также
химическая
инертность. Алмазы очень
редки и ценны, их вес
измеряется в каратах (1
карат=200мг).
Ограненный
алмаз
называют
бриллиантом.
Знаменитый бриллиант «Кохинор»
25. Что такое карат?
В Аравийской пустыне растет дерево Caratina silikva,косточки плодов которого весят ровно = 0,2 грамм.
Этот точный вес косточки имеют всегда, в любой год и
на любом дереве. Древние ювелиры использовали в
качестве гирек именно эти косточки.
26. Искусственно ограненные алмазы - бриллианты
27. Исторические алмазы:
28. Крупнейшие месторождения
29.
30. Графит
Структура графитаГрафит – устойчивая
при
нормальных
условиях аллотропная
модификация углерода,
имеет серо-черный цвет
и металлический блеск,
кажется жирным на
ощупь, очень мягок и
оставляет
черные
следы на бумаге.
31. Графит
Атомыуглерода
в
графите расположены
отдельными
слоями,
образованными
из
плоских
шестиугольников.
Каждый атом углерода
на плоскости окружен
тремя
соседними,
расположенными вокруг
него в виде правильного
треугольника.
32. Графит
Графитхарактеризуется
меньшей
плотностью
и
твердостью, а также графит
может
расщепляться
на
тонкие чешуйки. Чешуйки
легко прилипают к бумаге –
вот почему из графита
делают
грифели
карандашей. В пределах
шестиугольников возникает
склонность к металлизации,
что
объясняет
хорошую
тепло- и электропроводность
графита,
а
также
его
металлический блеск.
Графитовый
электрод
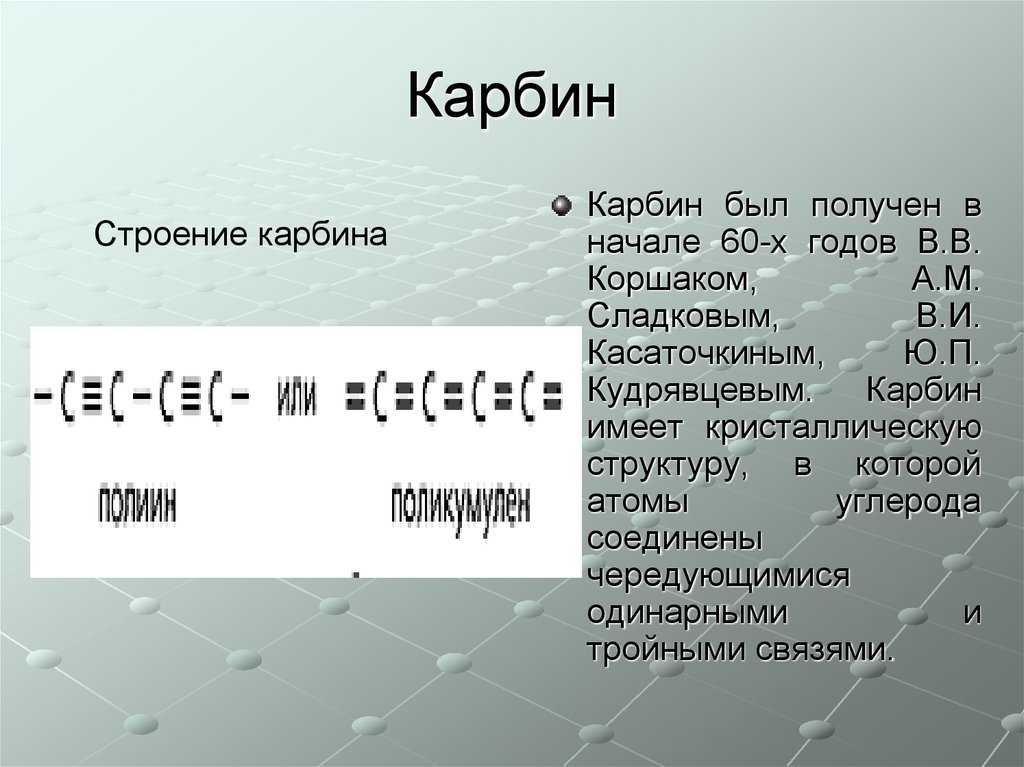
33. Карбин
Строение карбинаКарбин был получен в
начале 60-х годов В.В.
Коршаком,
А.М.
Сладковым,
В.И.
Касаточкиным,
Ю.П.
Кудрявцевым.
Карбин
имеет кристаллическую
структуру, в которой
атомы
углерода
соединены
чередующимися
одинарными
и
тройными связями.
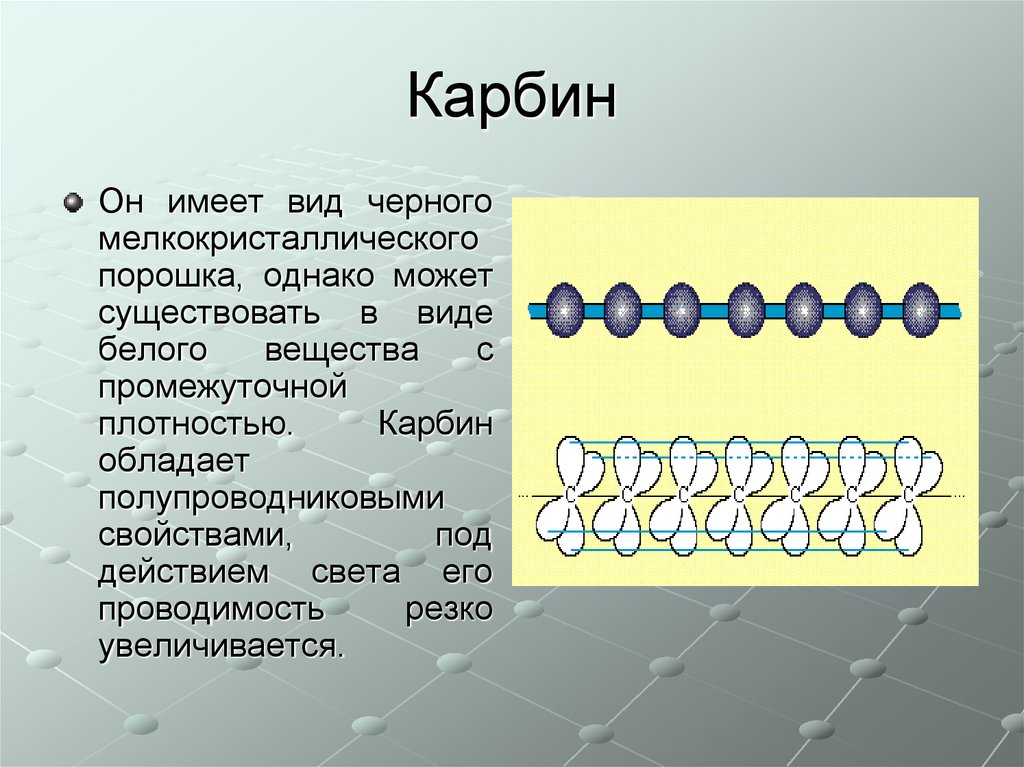
34. Карбин
Он имеет вид черногомелкокристаллического
порошка, однако может
существовать в виде
белого
вещества
с
промежуточной
плотностью.
Карбин
обладает
полупроводниковыми
свойствами,
под
действием света его
проводимость
резко
увеличивается.
35. Карбин
Засчет
существования
различных типов связи и
разных
способов
укладки
цепей из углеродных атомов в
кристаллической
решетке,
физические свойства карбина
могут меняться в широких
пределах. Позднее карбин был
найден в природе в виде
вкраплений
в
природном
графите, содержащемся в
минерале чаоит, а также в
метеоритном веществе.
Метеорит содержащий вкрапления карбина
36. Фуллерены
Фуллерен С70Фуллерены
–
класс
химических соединений,
молекулы
которых
состоят
только
из
углерода, число атомов
которого четно, от 32 и
более
500,
они
представляют
по
структуре
выпуклые
многогранники,
построенные
из
правильных пяти- и
шестиугольников.
37. Фуллерены
Происхождениетермина
"фуллерен"
связано
с
именем
американского
архитектора
Ричарда
Букминстера Фуллера,
конструировавшего
полусферические
архитектурные
конструкции,
состоящие
из
шестиугольников
и
пятиугольников.
Купол Фуллера
38. Фуллерены
В начале 70-х годов физхимик–органик Е.Осавапредположил
существование
полой,
высокосимметричной молекулыС60, со структурой в
виде усеченного икосаэдра, похожей на футбольный
мяч. Чуть позже (1973 г.) российские ученые Д.А.
Бочвар и Е.Г. Гальперин сделали первые
теоретические квантово-химические расчеты такой
молекулы и доказали ее стабильность.
Первый способ получения и выделения твердого
кристаллического фуллерена был предложен в 1990
г. В.Кречмером и Д.Хафманом с коллегами в
институте ядерной физики в г. Гейдельберге
(Германия).
39. Фуллерены
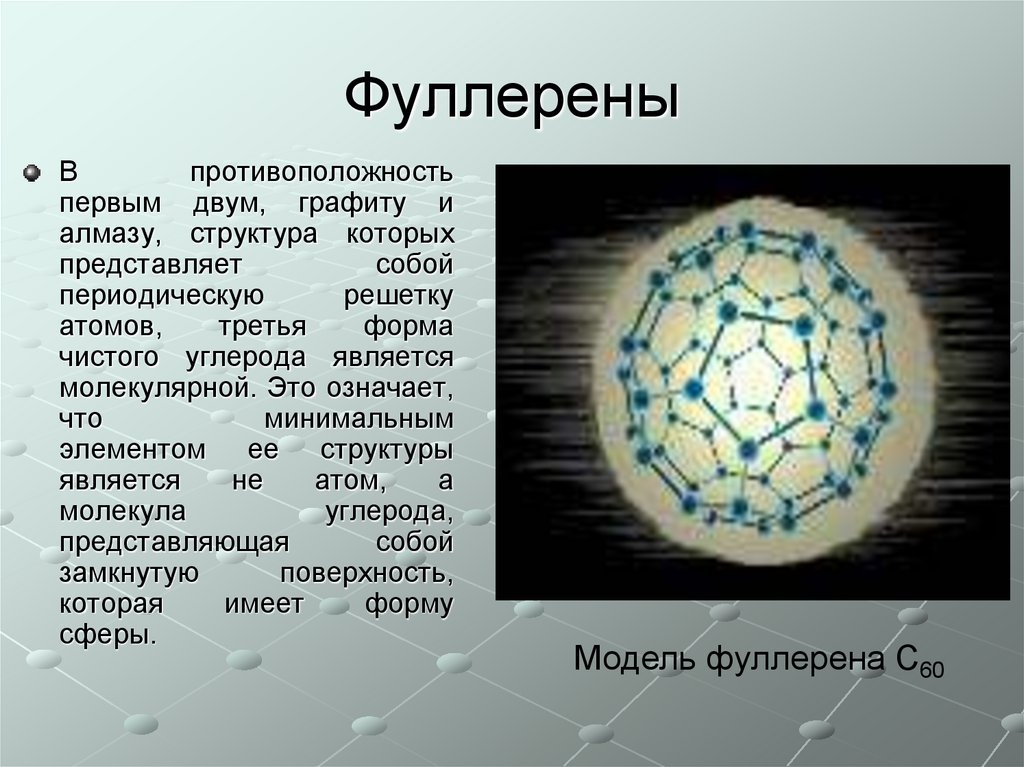
Впротивоположность
первым двум, графиту и
алмазу, структура которых
представляет
собой
периодическую
решетку
атомов,
третья
форма
чистого углерода является
молекулярной. Это означает,
что
минимальным
элементом ее структуры
является
не
атом,
а
молекула
углерода,
представляющая
собой
замкнутую
поверхность,
которая
имеет
форму
сферы.
Модель фуллерена С60
40. Фуллерены
В фуллеренеплоская
сетка шестиугольников
(графитовая сетка) свернута и сшита в замкнутую
сферу.
При
этом
часть
шестиугольников
преобразуется
в
пятиугольники.
Образуется
структура – усеченный икосаэдр. Каждая вершина
этой фигуры имеет трех ближайших соседей. Каждый
шестиугольник граничит с тремя шестиугольниками и
тремя пятиугольниками, а каждый пятиугольник
граничит только с шестиугольниками.
Фуллерены с n< 60 оказались неустойчивыми, хотя
из чисто топологических соображений наименьшим
возможным фуллереном является правильный
додекаэдр С20.
41. Фуллерены
Молекулы фуллеренов, вкоторых атомы углерода
связаны между собой как
одинарными, так и двойными
связями,
являются
трехмерными
аналогами
ароматических
структур.
Обладая
высокой
электроотрицательностью,
они выступают в химических
реакциях
как
сильные
окислители. Присоединяя к
себе радикалы различной
химической
природы,
фуллерены
способны
образовывать широкий класс
химических
соединений,
обладающих
различными
физико-химическими
свойствами.
42. Фуллерены
Кристалл фуллерита имеет плотность 1,7 г/см3, чтозначительно меньше плотности графита (2,3 г/см3) и
алмаза (3,5 г/см3 ). Молекула С60 сохраняет
стабильность в инертной атмосфере аргона вплоть
до температур порядка 1700 К. В присутствии
кислорода при 500 К наблюдается значительное
окисление с образованием СО и CO2. При комнатной
температуре окисление происходит при облучении
фотонами с энергией 0,55 эВ. что значительно
ниже энергии фотонов видимого света (1,54 эВ).
Поэтому чистый фуллерит необходимо хранить в
темноте.
43. Фуллерены
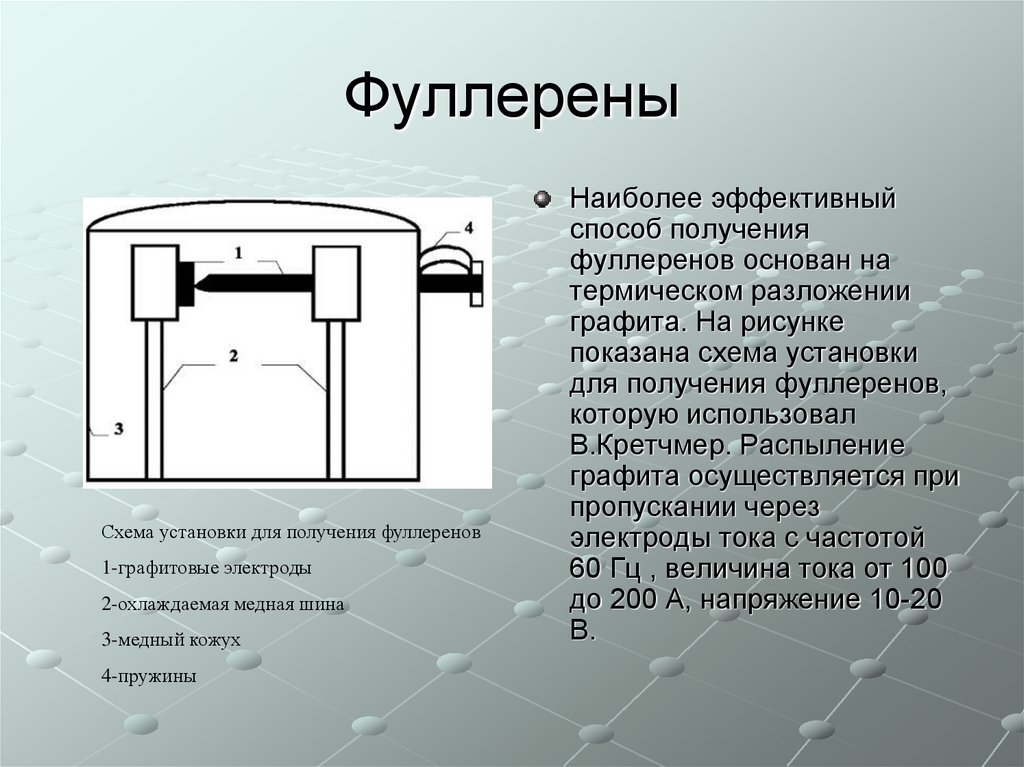
Схема установки для получения фуллеренов1-графитовые электроды
2-охлаждаемая медная шина
3-медный кожух
4-пружины
Наиболее эффективный
способ получения
фуллеренов основан на
термическом разложении
графита. На рисунке
показана схема установки
для получения фуллеренов,
которую использовал
В.Кретчмер. Распыление
графита осуществляется при
пропускании через
электроды тока с частотой
60 Гц , величина тока от 100
до 200 А, напряжение 10-20
В.
44. Фуллерены
Регулируя натяжение пружины, можно добиться, чтобыосновная часть подводимой мощности выделялась в
дуге, а не в графитовом стержне. Камера
заполняется гелием, поверхность медного кожуха,
охлаждаемого водой, покрывается продуктом
испарения графита, т.е. графитовой сажей.
Если получаемый порошок соскоблить и выдержать в
течение нескольких часов в кипящем толуоле, то
получается темно-бурая жидкость. При выпаривании
ее во вращающемся испарителе получается
мелкодисперсный порошок, в нем содержится до
10% фуллеренов С60 (90%) и С70 (10%).
45. Нанотрубки
Наряду со сфероидальнымиуглеродными
структурами,
могут образовываться также
и
протяженные
цилиндрические структуры,
так называемые нанотрубки,
которые
отличаются
широким
разнообразием
физико-химических свойств.
Идеальная нанотрубка
представляет собой
свернутую в цилиндр
графитовую плоскость,
выложенную правильными
шестиугольниками, в
вершинах которых
расположены атомы
углерода.
Строение нанотрубки
46. Нанотрубки
На рисунке представленаидеализированная
модель
однослойной
нанотрубки.
Такая трубка заканчивается
полусферическими
вершинами,
содержащими
наряду
с
правильными
шестиугольниками, также по
шесть
правильных
пятиугольников.
Наличие
пятиугольников на концах
трубок
позволяет
рассматривать
их
как
предельный случай молекул
фуллеренов,
длина
продольной оси которых
значительно превышает их
диаметр.
47. Нанотрубки
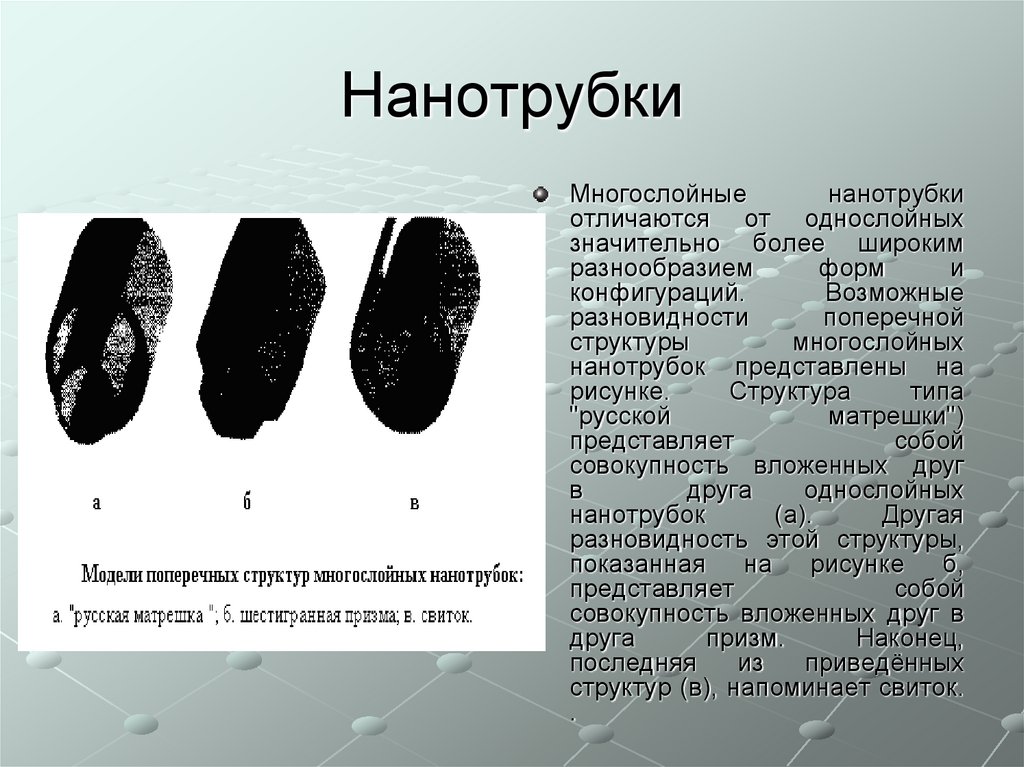
Многослойныенанотрубки
отличаются от однослойных
значительно более широким
разнообразием
форм
и
конфигураций.
Возможные
разновидности
поперечной
структуры
многослойных
нанотрубок представлены на
рисунке.
Структура
типа
"русской
матрешки")
представляет
собой
совокупность вложенных друг
в
друга
однослойных
нанотрубок
(а).
Другая
разновидность этой структуры,
показанная на рисунке б,
представляет
собой
совокупность вложенных друг в
друга
призм.
Наконец,
последняя
из
приведённых
структур (в), напоминает свиток.
.
48. Нанотрубки
Нанотрубка может быть получена из протяжённыхфрагментов графита, которые далее скручиваются в
трубку. Для образования протяжённых фрагментов
необходимы специальные условия нагрева графита.
Оптимальные
условия
получения
нанотрубок
реализуются в дуговом разряде при использовании
графита в качестве электрода. Однослойные
нанотрубки образуются при добавлении в анод
небольшой примеси Fe, Co, Ni, Cd (т. е. добавлением
катализаторов).
Кроме
того,
однослойные
нанотрубки
получаются
при
окислении
многослойных нанотрубок. С целью окисления
многослойные
нанотрубоки
обрабатываются
кислородом при умеренном нагреве, либо кипящей
азотной кислотой. Окисление позволяет снять
верхние слои с многослойной трубки и открыть её
концы.
49. Нанотрубки
В основе многих технологических применений нанотрубок лежиттакое их свойство, как высокая удельная поверхность (в случае
однослойной нанотрубки около 600 кв. м. на 1/г), что открывает
возможность их использования в качестве пористого материала
в фильтрах и т.д. Такие свойства нанотрубки, как ее малые
размеры, меняющаяся в значительных пределах в зависимости
от условий синтеза, электропроводность, механическая
прочность
и
химическая
стабильность,
позволяют
рассматривать нанотрубку в качестве основы будущих
элементов микроэлектроники. Расчетным путем доказано, что
введение в идеальную структуру нанотрубки в качестве
дефекта пары пятиугольник–семиугольник изменяет ее
электронные свойства. Нанотрубка с внедренным в нее
дефектом может рассматриваться как металл-полупроводник,
который,
в
принципе,
может
составить
основу
полупроводникового элемента рекордно малых размеров.
50. Наночастицы
В процессе образования фуллеренов из графитаобразуются также наночастицы. Это замкнутые
структуры, подобные фуллеренам, но значительно
превышающие их по размеру. В отличие от
фуллеренов, они также как и нанотрубки могут
содержать несколько слоев., имеют структуру
замкнутых, вложенных друг в друга графитовых
оболочек. В наночастицах, аналогично графиту,
атомы внутри оболочки связаны химическими
связями, а между атомами соседних оболочек
действует слабое ван-дер-ваальсово
взаимодействие. Обычно оболочки наночастиц
имеют форму близкую к многограннику. В структуре
каждой такой оболочки, кроме шестиугольников, как
в структуре графита, есть 12 пятиугольников,
наблюдаются дополнительные пары из пяти и
семиугольников.
51. Другие формы углерода
Известны и другие формы углерода, такиекак уголь, кокс и сажа. Но все эти формы
являются композитами, то есть смесью
малых фрагментов графита и алмаза.
Сажа
52. Адсорбция
53.
54. Соединения углерода
55.
56.
57.
58.
59.
60.
61.
62.
63. Соединения углерода:
СО- оксид углерода (II), угарный газ.СО2 – оксид углерода (IV),углекислый газ.
H2CO3 – угольная кислота.
Соли карбонаты
Соли гидрокарбонаты.
Дать характеристику, записать
соответствующие уравнения реакций.
Д/З-Подготовиться к лабораторной работе.

















































 Химия
Химия








