Похожие презентации:
Основные соединения серы. Сероводород
1. Основные соединения серы
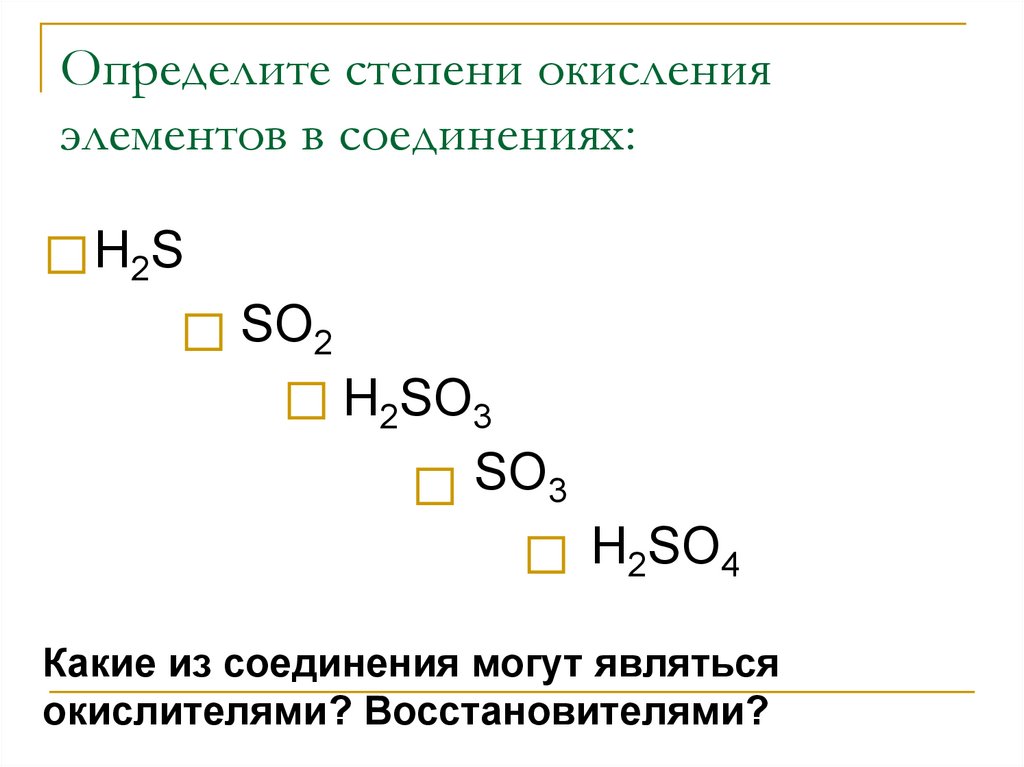
Сероводород2. Определите степени окисления элементов в соединениях:
Н2SSO2
Н2SO3
SO3
Н2SO4
Какие из соединения могут являться
окислителями? Восстановителями?
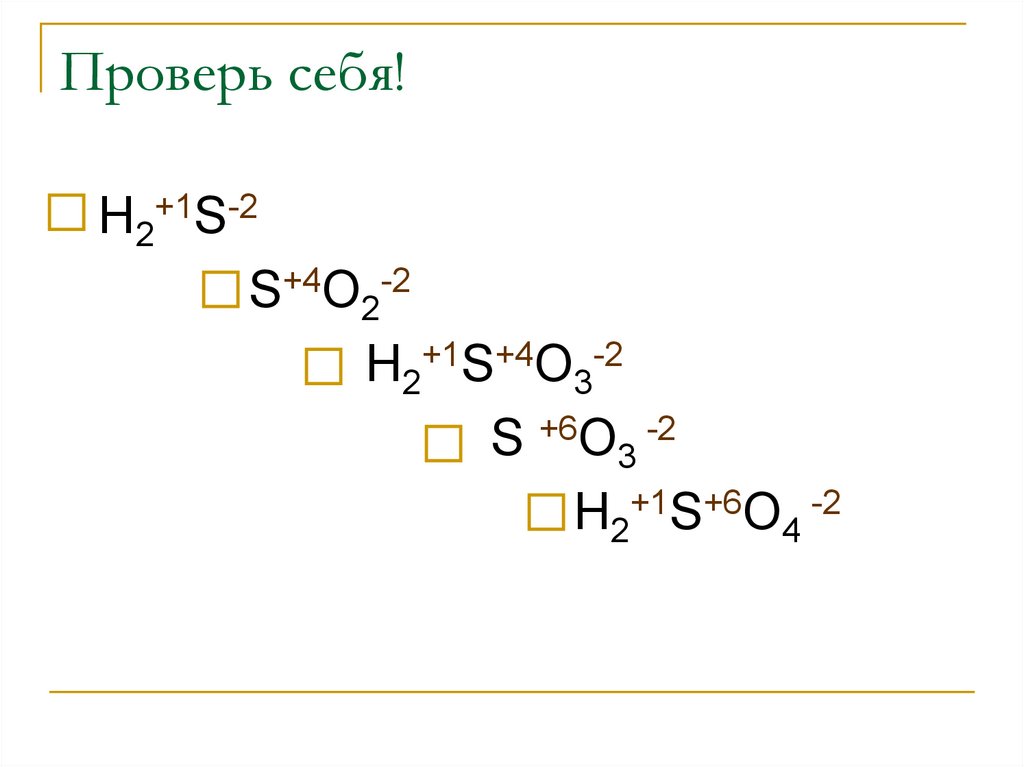
3. Проверь себя!
Н2+1S-2S+4O2-2
Н2+1S+4O3-2
S +6O3 -2
Н2+1S+6O4 -2
4. Сероводород Н2S
СероводородН 2S
Физические свойства:
Бесцветный газ с запахом тухлых яиц,
ядовит.
Предельно допустимая концентрация в
воздухе 0,01%
Cероводородные источники
Минеральных вод Пятигорска:
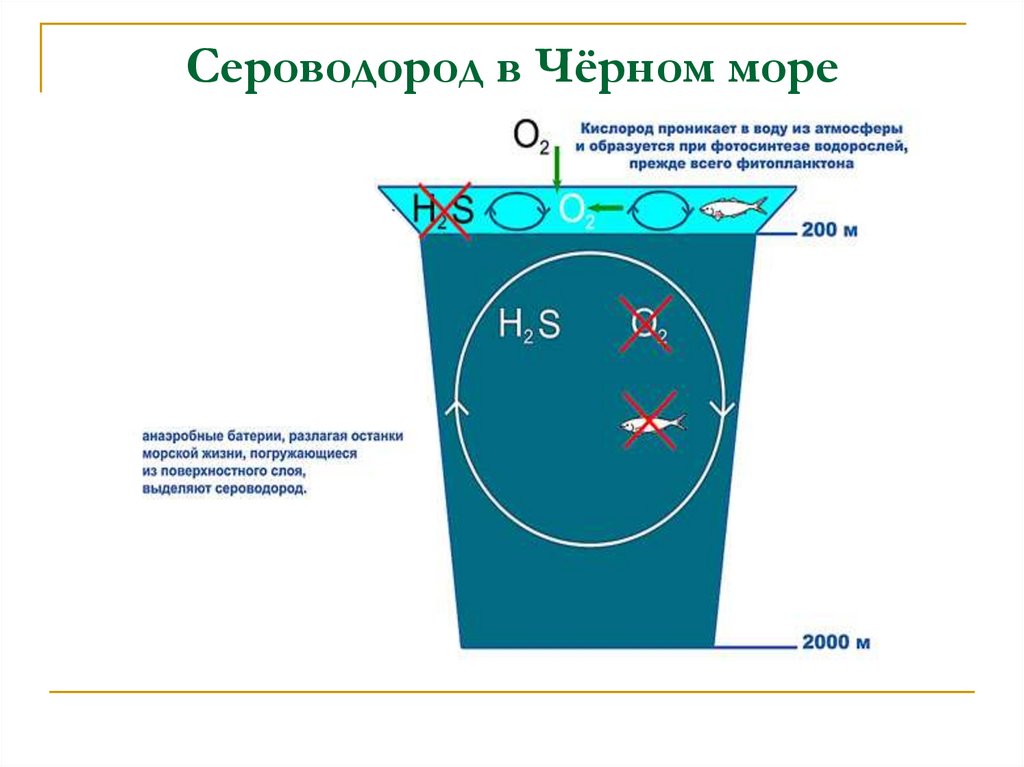
5. Сероводород в Чёрном море
6. Н2S - сероводород
Химические свойства:1.Реакция взаимодействия с кислородом
Вариант -1.
Н2S
+
O2 → S↓ + Н2O
недостаток
Вариант -2.
Н2S
+ O2 → SО2+ Н2O
избыток
7. Проверь себя!
Н2S-2 – восстановительВариант -1.
2Н2S-2 + O20 = 2S0↓ + 2Н2O-2
Вариант -2.
2Н2S-2 + 3O20= 2S+4О2+ 2Н2O-2
8. Н2S -2 - восстановитель
-2Н2S - восстановитель
2. Реакция взаимодействия
с растворами галогенов:
Н2S + I2 = S↓ + НI
йод
Уравнять, расставить степени окисления
9. Н2S – сероводородная кислота
Неустойчивая, на свету мутнеет.Почему?
НS- гидросульфид-ион
S2- сульфид- ион
Качественная реакция на сульфид-ион
2+ 2-
Cu+ S ⟶ CuS↓
2+
2-
Pb + S ⟶ PbS↓
ЧЕРНЫЕ ОСАДКИ
10. Cоли: гидросульфиды и сульфиды В природе – 200 минералов-сульфидов
Сульфиды свинца (галенит или свинцовыйблеск РbS),
ртути (киноварь HgS),
железа (пирит или железный колчедан
FeS2)
цинка ( cфалерит ZnS)
11. Основные соединения серы
Оксиды серы12. «Последний день Помпеи»
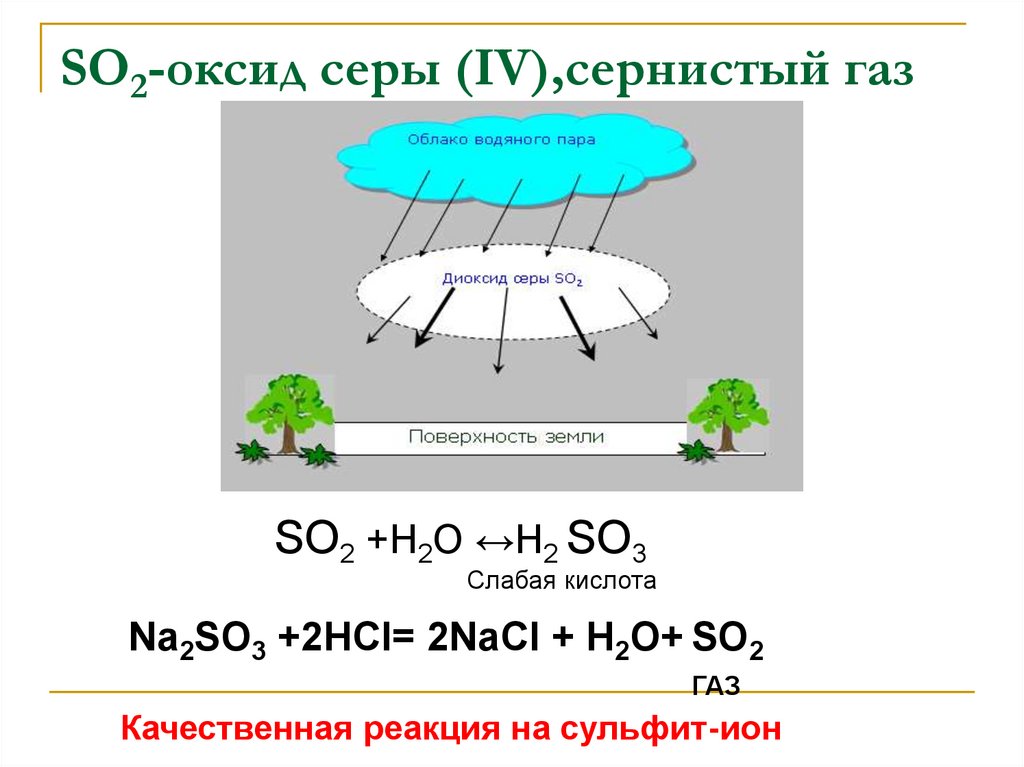
К. П. Брюллов13. SO2-оксид серы (IV),сернистый газ
14. SO2-оксид серы (IV),сернистый газ
Физические свойства:бесцветный газ с резким запахом, ядовит.
Предельно допустимая концентрация в
воздухе 0,03 %
Получение.
S+O2 = SO2 ↑
15. Химические свойства:
SO21.Реакция взаимодействия с кислородом
(получение SO3)
SO2 + O2= SO3
УРАВНЯТЬ! (кислотный, бесцветная
жидкость)
2. Реакция взаимодействия с углеродом
S+4O2 +С0 =S0 +СO2
16. SO2-оксид серы (IV),сернистый газ
SО2 +Н2О ↔Н2 SО3Слабая кислота
Na2SО3 +2НСl= 2NaСl + Н2О+ SО2
ГАЗ
Качественная реакция на сульфит-ион
17. SO3 – оксид серы (VI), кислотный оксид
SO3- бесцветная жидкостьS+6O3 + Н2О =Н2 S+6O4
Серная кислота
Тяжёлая маслянистая
жидкость без цвета и
запаха, с кислым
«медным» вкусом.
18. Основные соединения серы
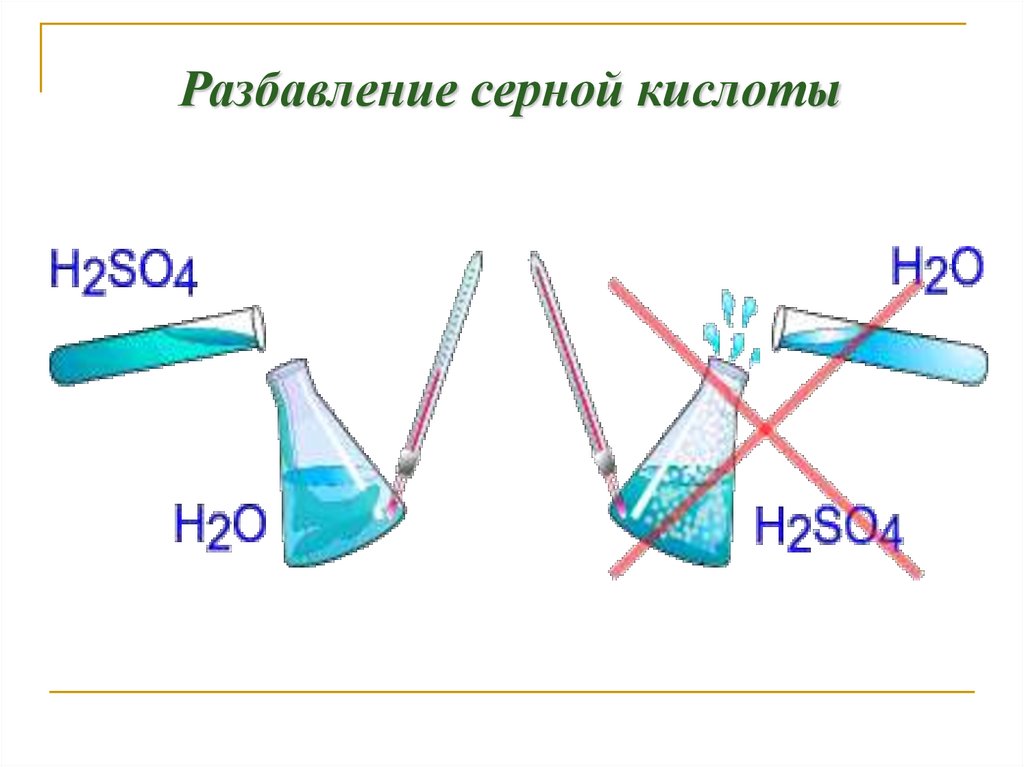
Серная кислота19.
Разбавление серной кислоты20.
Составить уравнения по схемам ,заменив значок металла намагний или цинк. В 4 уравнении берем соль карбонат или
сульфид.
21. Свойства концентрированной серной кислоты
22.
Свойства концентрированной сернойкислоты
Органические вещества обугливаются !!!
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
23.
Концентрированная серная кислотаокисляет металлы
при взаимодействии с металлами (кроме Au, Pt)
может восстанавливаться до SO2, S или H2S
(без нагревания не реагируют также Fe, Al, Cr пассивируются):
2Ag + 2H2SO4 → Ag2SO4 + SO2+ 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S + 4H2O
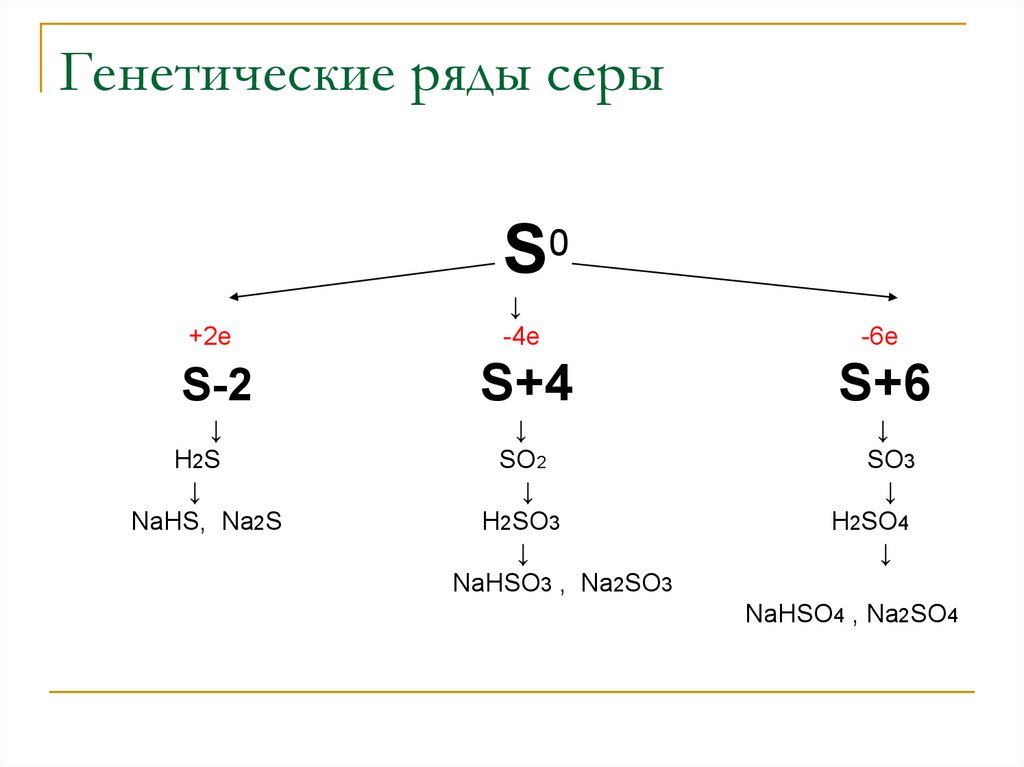
24. Генетические ряды серы
S0+2e
↓
-4e
-6e
S-2
S+4
S+6
↓
H2S
↓
NaHS, Na2S
↓
SO2
↓
Н2SO3
↓
NaНSО3 , Na2SО3
↓
SO3
↓
H2SO4
↓
NaНSО4 , Na2SО4
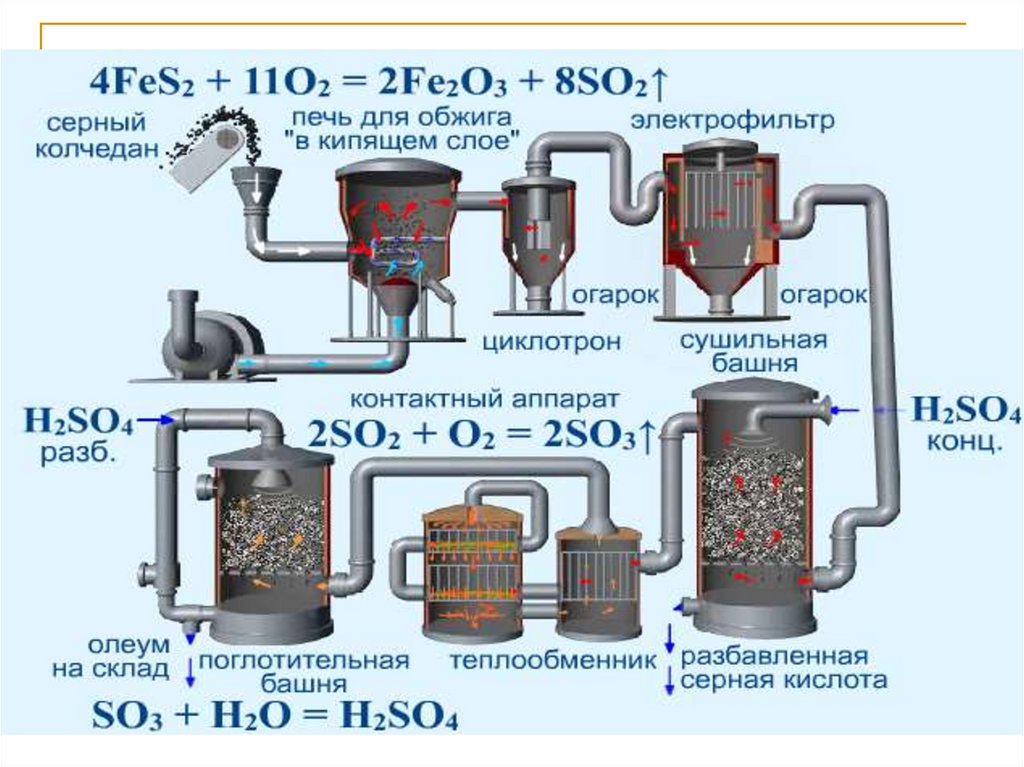
25.
Получение серной кислотыFeS2
S
H2S
SO2 → SO3 → H2SO4
Пирит
Серный колчедан



















 Химия
Химия








