Похожие презентации:
Сложные белки
1.
Сложные белки2.
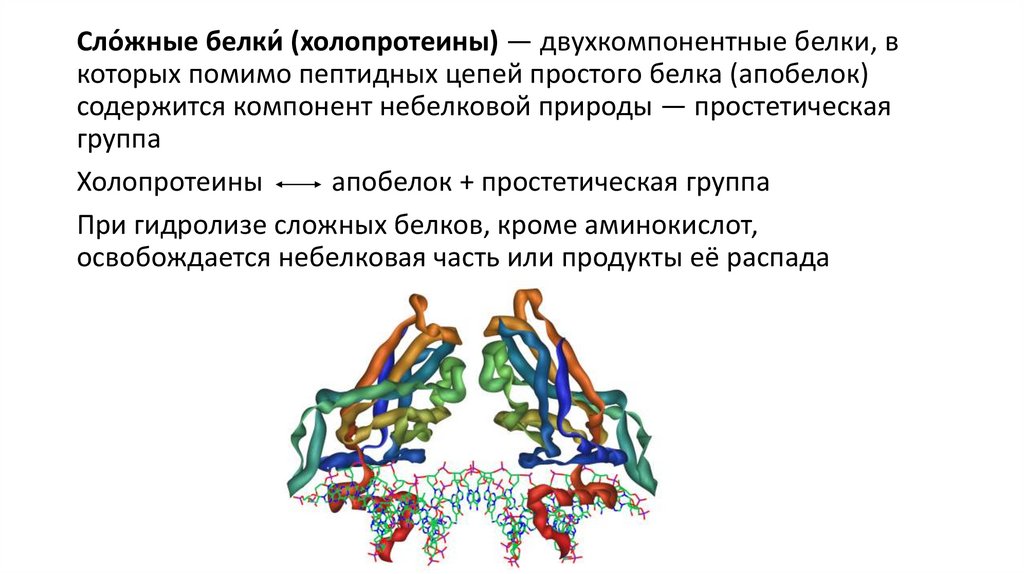
Сло́жные белки́ (холопротеины) — двухкомпонентные белки, вкоторых помимо пептидных цепей простого белка (апобелок)
содержится компонент небелковой природы — простетическая
группа
Холопротеины
апобелок + простетическая группа
При гидролизе сложных белков, кроме аминокислот,
освобождается небелковая часть или продукты её распада
3.
4.
Классификация сложных белковВ зависимости от химической природы простетической группы различают:
• Гликопротеины (содержат углеводы).
• Липопротеины (содержат липиды).
• Фосфопротеины (содержат фосфорную кислоту).
• Хромопротеины (содержат окрашенную простетическую группу).
• Металлопротеины (содержат ионы различных металлов).
• Нуклеопротеины (содержат нуклеиновые кислоты).
5.
ГликопротеиныГликопротеины – сложные белки, содержащие, помимо простого белка
или пептида, группу гетероолигосахаридов.
К типичным гликопротеинам относят большинство белковых гормонов,
секретируемые в жидкие среды организма вещества, мембранные
сложные белки, все антитела (иммуноглобулины), белки плазмы крови,
молока, овальбумин, интерфероны, факторы комплемента, группы
крови, рецепторные белки и др.
Из этого далеко не полного перечня гликопротеинов видно, что все они
выполняют специфические функции:
• Обеспечивают клеточную адгезию
• Молекулярное и клеточное узнавание
• Антигенную активность опухолевых клеток
• Оказывают защитное и гормональное, а также антивирусное действие
6.
Связь между углеводнымикомпонентами и белковой
частью в гликопротеинах
ковалентно-гликозидная, через ОН группы серина, треонина,
или -NH группу лизина,
аспарагина, глутамина.
7.
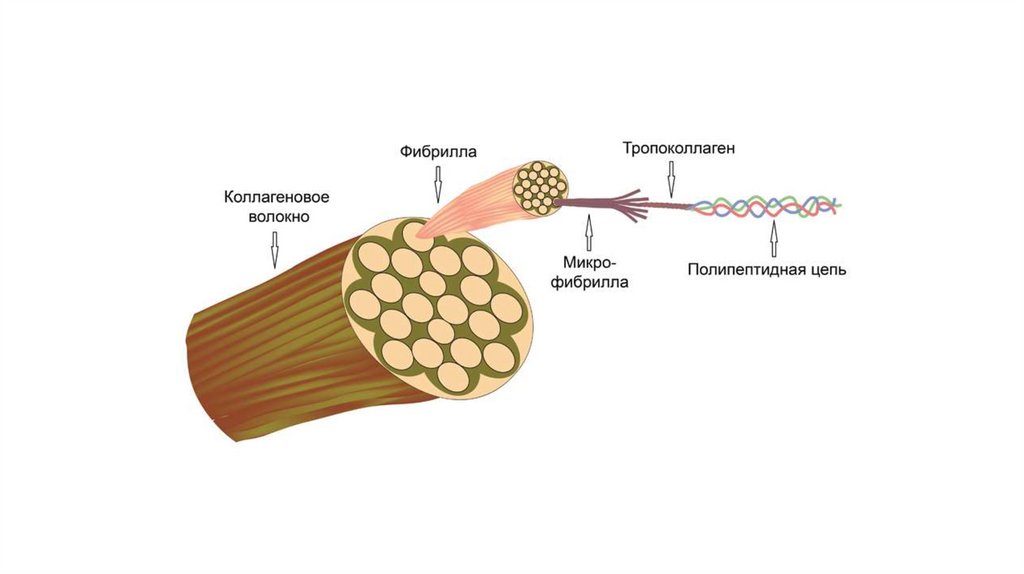
КоллагенКоллаген – основной фибриллярный белок межклеточного
матрикса соединительной ткани. Общим для всех коллагенов
является наличие участков с последовательностью гли-про-х, где в
качестве х присутствует остаток какой- либо аминокислоты (ала,
лиз и др.), а часть остатков пролина и лизина гидроксилированы.
Пространственная структура коллагена представлена тремя
полипептидными цепями, закрученными вокруг общей оси. Такая
структура называется тропоколлаген. Формируя фибриллы,
молекулы тропоколлагена (тримеры) располагаются ступенчато,
смещаясь относительно друг друга на одну четверть длины, что
придает фибриллам характерную исчерченность.
8.
9.
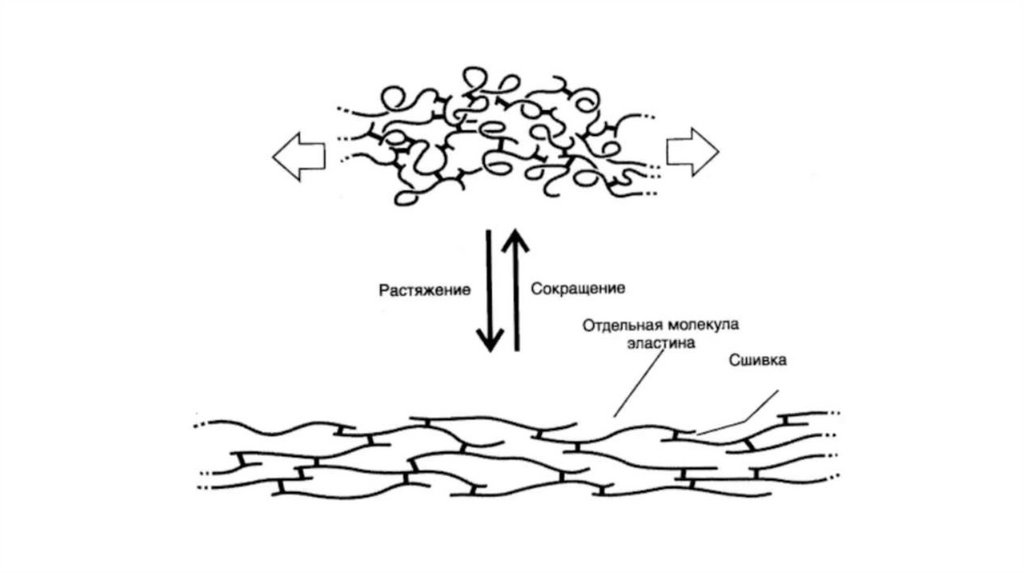
ЭластинЭластин - гликопротеин, содержащий около 27% глицина, 19%
аланина, 10% валина, 4,7% лейцина. Наличие большого количества
гидрофобных радикалов препятствует созданию стабильной
глобулы, в результате полипептидные цепи эластина не формируют
регулярные вторичную и третичную структуры.
Способность эластина растягиваться и сжиматься объясняется тем,
что при нагрузке гидрофобные взаимодействия, поддерживающие
пространственную структуру молекулы, легко разрушаются, а затем
восстанавливаются. Ковалентные сшивки при этом удерживают
структуру от разрыва.
10.
11.
ИнтерфероныИнтерфероны – это ингибиторы размножения многих типов
вирусов. Открыто несколько типов интерферонов (α, β и γ),
некоторые из них получены методами генетической инженерии.
Это сравнительно небольшие сложные белки с мол. массой у
разных видов животных и человека от 25000 до 38000–40000). Они
образуются в клетке в ответ на внедрение вирусной нуклеиновой
кислоты, ограничивая вирусную агрессию (инфекцию).
12.
ИммуноглобулиныИммуноглобулины, или антитела, также относятся к классу
гликопротеинов, выполняют защитную функцию, обезвреживая
поступающие в организм чужеродные вещества – антигены любой
химической природы. Синтезируются иммуноглобулины
плазматическими клетками, образовавшимися из лимфоцитов.
Различают 5 классов иммуноглобулинов: IgG, IgM, IgA, IgD и IgE.
13.
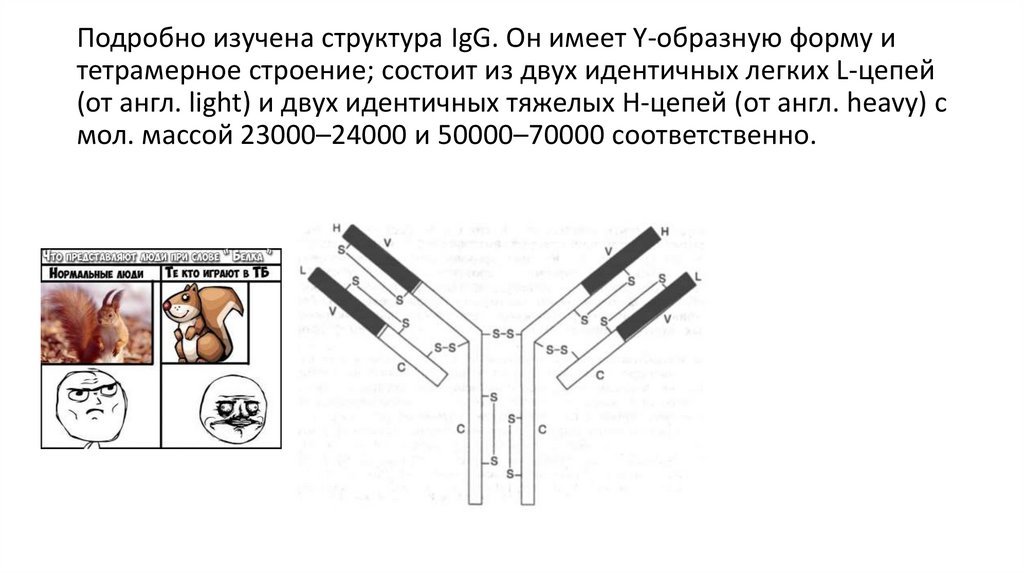
Подробно изучена структура IgG. Он имеет Y-образную форму итетрамерное строение; состоит из двух идентичных легких L-цепей
(от англ. light) и двух идентичных тяжелых Н-цепей (от англ. heavy) с
мол. массой 23000–24000 и 50000–70000 соответственно.
14.
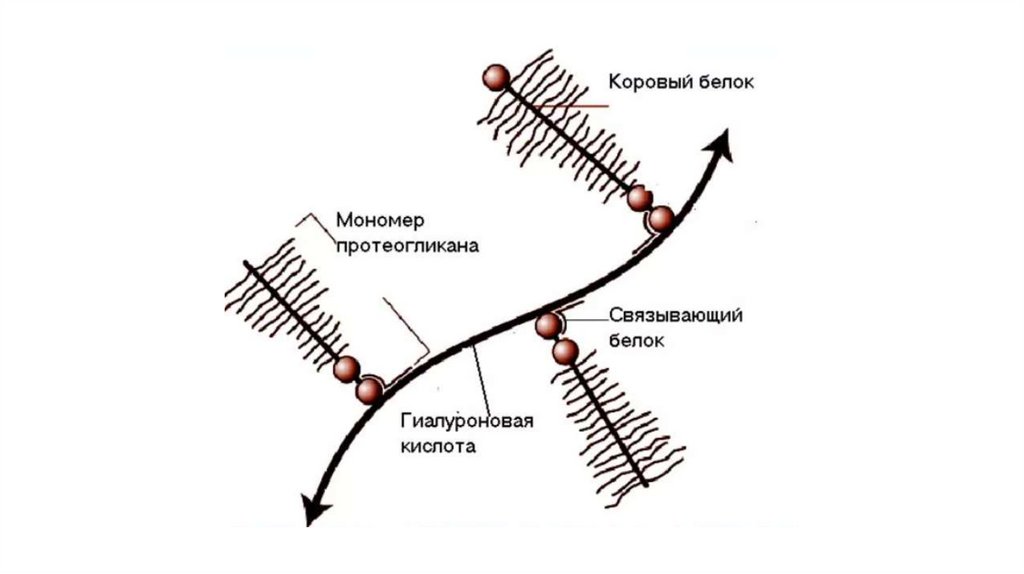
ПротеогликаныПомимо гликопротеинов, различают также протеогликаны,
состоящие из белка и гликозаминогликанов (прежнее название
мукополисахариды)
Типичными гликозаминогликанами являются гиалуроновая
кислота, хондроитинсульфат и гепарин
15.
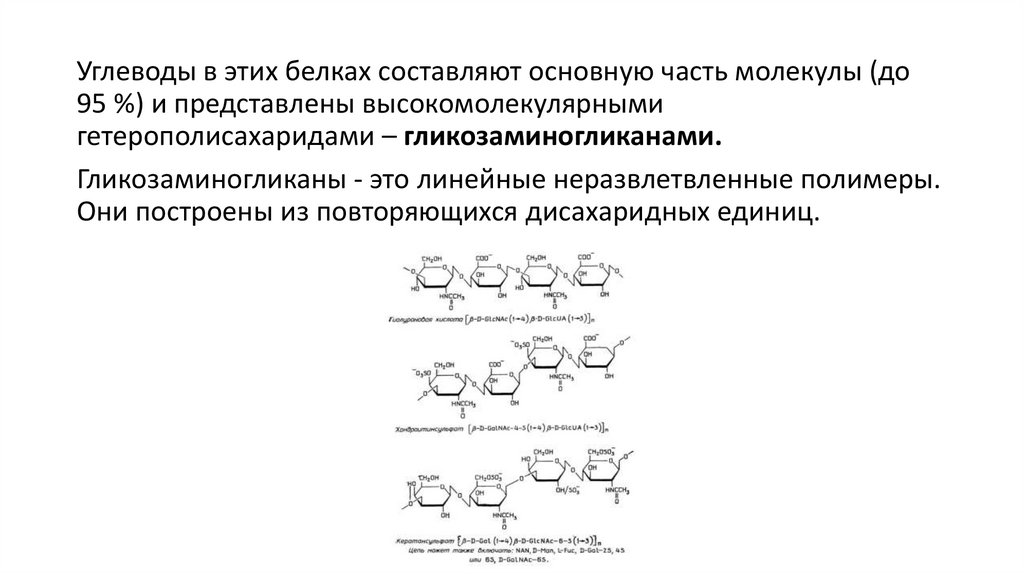
Углеводы в этих белках составляют основную часть молекулы (до95 %) и представлены высокомолекулярными
гетерополисахаридами – гликозаминогликанами.
Гликозаминогликаны - это линейные неразвлетвленные полимеры.
Они построены из повторяющихся дисахаридных единиц.
16.
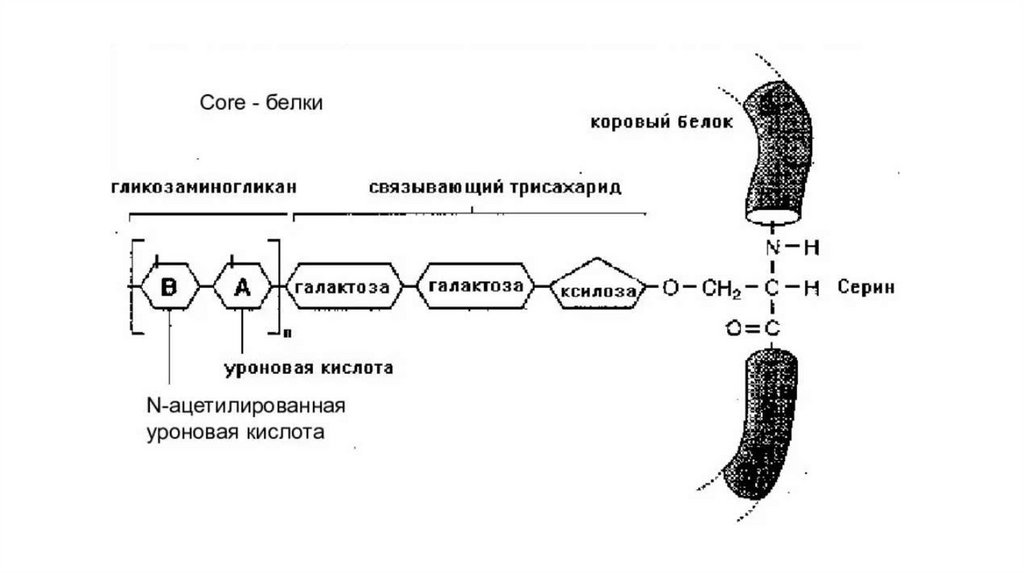
Углеводы и белки в молекулах протеогликанов связаныгликозидными связями через -ОН серина, треонина и - NH2
лизина, аспарагина и глутамина.
Молекулы протеогликанов прекрасно гидратируются благодаря
большому количеству функциональных ионизированных групп.
Этим объясняется их эластичность, растяжимость, слизистый
характер. Они способны также связывать ионы Nа+, поэтому они
участвуют в регуляции водно-солевого обмена.
17.
18.
19.
ЛипопротеиныЭтот класс сложных белков состоит из белка и простетической группы,
представленной каким-либо липидом. В частности, в составе
липопротеинов открыты нейтральные жиры, свободные жирные
кислоты, фосфолипиды, эфиры холестерина.
Липопротеины широко распространены в природе: в растениях, тканях
животных и у микроорганизмов – и выполняют разнообразные
биологические функции. Они входят в состав клеточной мембраны и
внутриклеточных биомембран ядра, митохондрий, микросом
(структурированные липопротеины), а также присутствуют в свободном
состоянии (главным образом в плазме крови). К липопротеинам
относятся, кроме того, тромбопластический белок. Установлено, что
липопротеины участвуют в структурной, комплексной организации
миелиновых оболочек, нервной ткани, фоторецепторной и электроннотранспортной систем, палочек и колбочек сетчатки и др.
20.
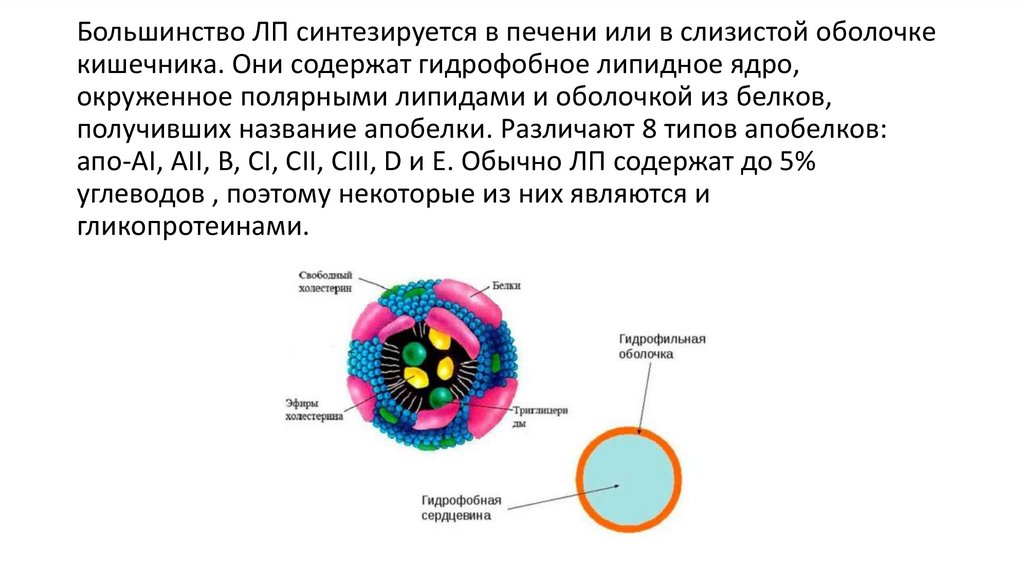
Большинство ЛП синтезируется в печени или в слизистой оболочкекишечника. Они содержат гидрофобное липидное ядро,
окруженное полярными липидами и оболочкой из белков,
получивших название апобелки. Различают 8 типов апобелков:
апо-AI, АII, В, CI, СII, CIII, D и Е. Обычно ЛП содержат до 5%
углеводов , поэтому некоторые из них являются и
гликопротеинами.
21.
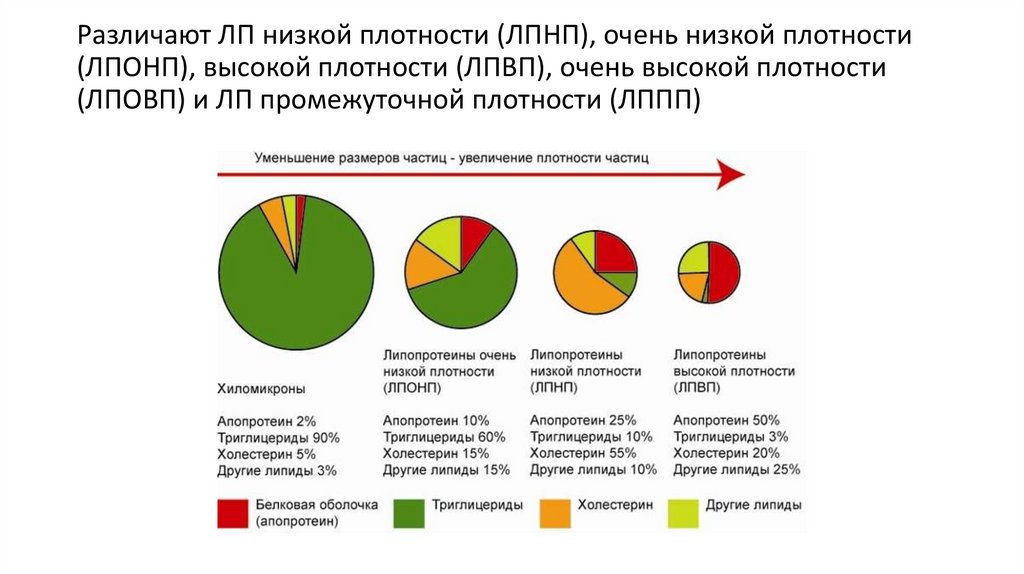
Различают ЛП низкой плотности (ЛПНП), очень низкой плотности(ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности
(ЛПОВП) и ЛП промежуточной плотности (ЛППП)
22.
В стабилизации молекул структурных и свободных липопротеиновучаствуют нековалентные силы:
• Гидрофобные - между гидрофильными радикалами жирных
кислот и гидрофобными радикалами аминокислот.
• Ионные - электростатические связи между ионизированными
группами молекул аминокислот и фосфолипидов
23.
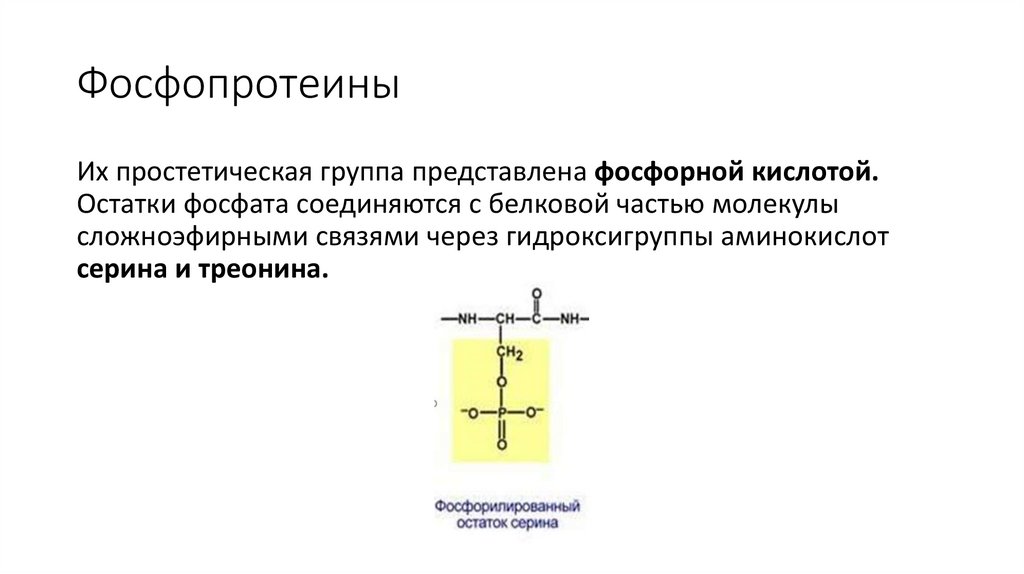
ФосфопротеиныИх простетическая группа представлена фосфорной кислотой.
Остатки фосфата соединяются с белковой частью молекулы
сложноэфирными связями через гидроксигруппы аминокислот
серина и треонина.
24.
К фосфопротеинам относят:• казеины - белки молока
• вителлины - яичного желтка
• овальбумин - белок куриного яйца
Большое количество фосфопротеинов содержится в клетках ЦНС.
Многие важные ферменты клетки активны только в
фосфорилированной форме.
Фосфопротеины являются источником энергетического и
пластического материала.
25.
МеталлопротеиныМеталлопротеины кроме белка содержат ионы одного или
нескольких металлов. Ионы металлов соединены
координационными связями с функциональными группами белка.
26.
Пример металлопротеинов:• ферритин, трансферрин - Fe;
• алкогольдегидрогеназа - Zn;
• цитохромоксидаза - Cu;
• протеиназы - Mg, К;
• АТФ-аза - Na, К, Са, Мg.
Как правило, металлопротеины – это ферменты. Ионы металлов
выполняют следующие функции:
• являются активным центром фермента;
• служат мостиком между активным центром фермента и
субстратом, сближают их;
• служат акцепторами электронов на определенной стадии
ферментативной реакции.
27.
НуклеопротеиныЭто сложные белки, небелковым компонентом которых являются
нуклеиновые кислоты - ДНК (дезоксирибонуклеиновая кислота)
или РНК (рибонуклеиновая кислота).
В составе белковых компонентов нуклеопротеинов очень много
положительно заряженных аминокислот - аргинина и лизина,
поэтому их можно отнести к поликатионам (гистоны).
Молекулы нуклеиновых кислот заряжены отрицательно, поэтому
они образуют с положительно заряженными белковыми
компонентами ионные связи.
28.
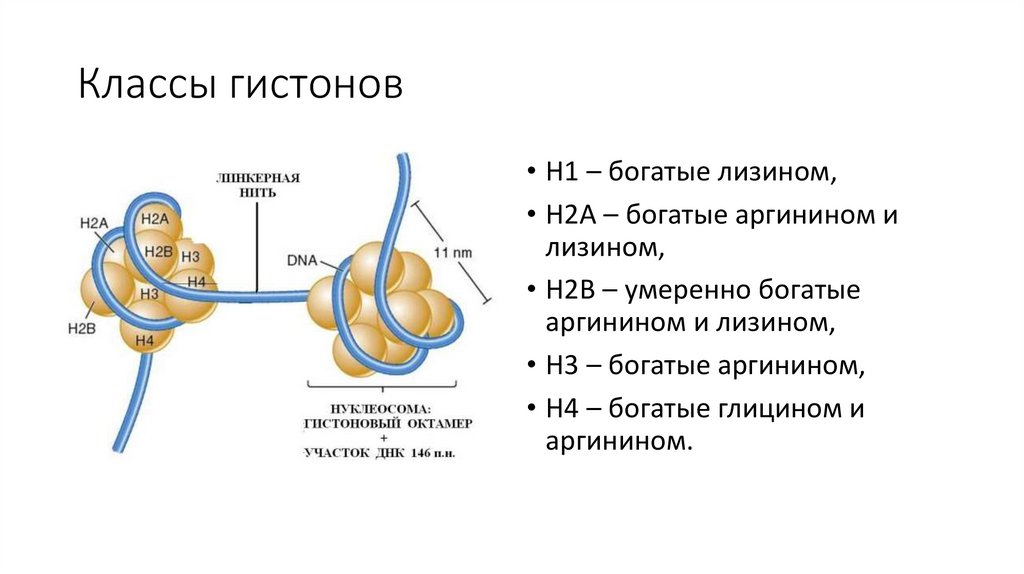
Классы гистонов• H1 – богатые лизином,
• Н2А – богатые аргинином и
лизином,
• Н2В – умеренно богатые
аргинином и лизином,
• Н3 – богатые аргинином,
• Н4 – богатые глицином и
аргинином.
29.
30.
ХромопротеиныСостоят из простого белка, связанного с каким-либо окрашенным
соединением небелкового характера, например производные
каротина, изоаллоксазина, порфиринов и др.
Эти белки обладают высокой биологической активностью. Одни из
них участвуют в окислительно-восстановительных реакциях,
другие - в процессе фотосинтеза, третьи - в переносе кислорода
и диоксида углерода и т.д.
31.
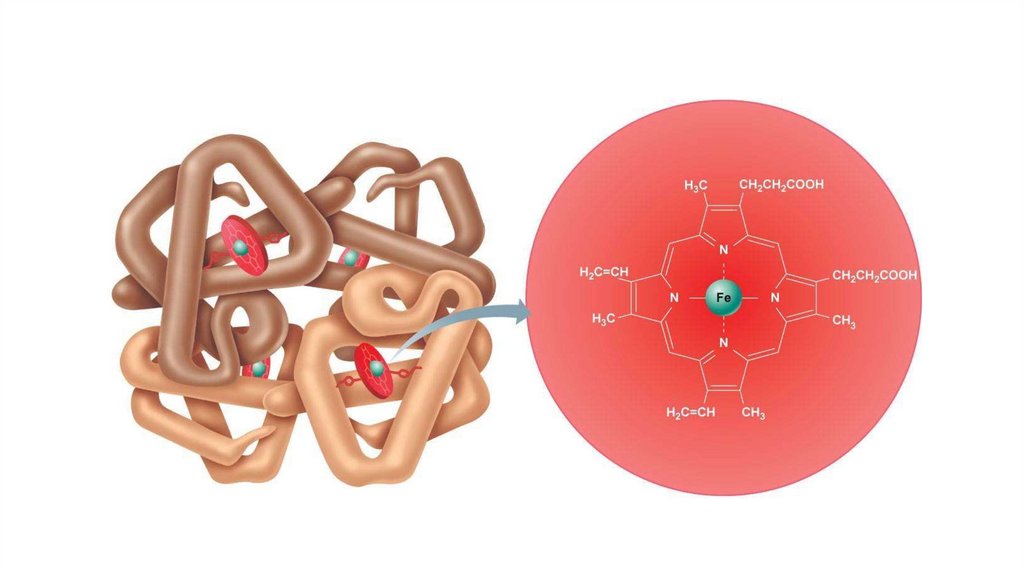
ГемоглобинГемоглобин - белок, играющий важную роль в дыхательной
функции крови теплокровных (транспорт кислорода и диоксида
углерода). Молекула гемоглобина состоит из белка глобина и
небелковой группы гема.
Гемоглобин - тетрамерный белок состоит из двух α-субъединиц и
двух β-субъединиц, каждая из которых содержит небелковую часть
- гем.
32.
33.
Кооперативный эффектГемоглобин осуществляет транспорт кислорода из легких к тканям.
При присоединении кислорода к одной из субъединиц
гемоглобина происходит изменение ее третичной структуры, что
вызывает целый ряд структурных перестроек в соседних
субъединицах. В результате присоединение последующих молекул
кислорода к остальным субъединицам происходит с каждым разом
все более эффективно. В тканях наблюдается обратная
закономерность, которая способствует равномерному
распределению кислорода. Совместное влияние протомеров
олигомерного белка на его свойства называется кооперативным
эффектом.
34.
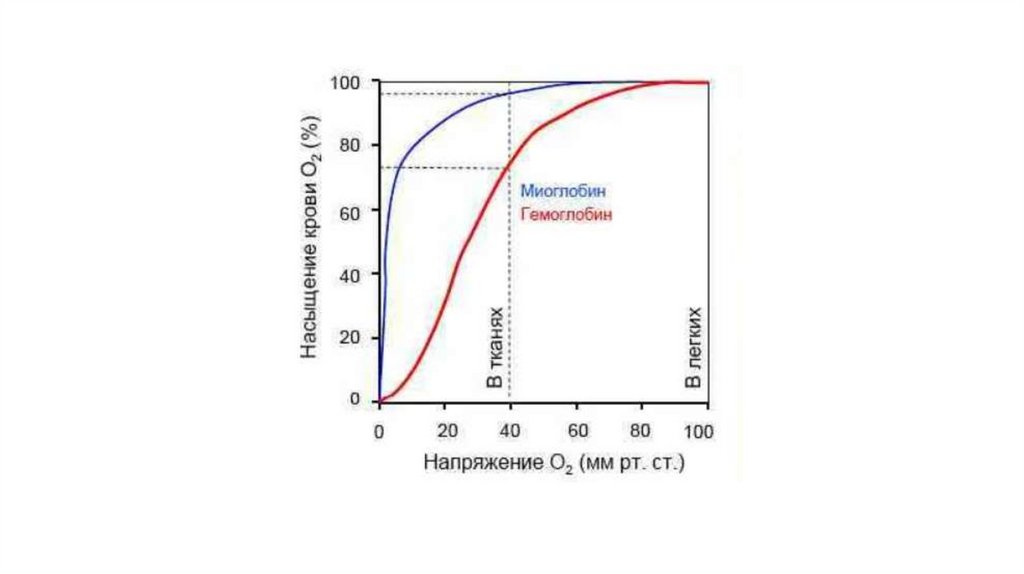
МиоглобинСубъединицы гемоглобина имеют третичную структуру, очень
схожую с мономерным белком миоглобином, который принимает
кислород от гемоглобина в мышцах и отдает его при гипоксии.
Процесс насыщения миоглобина кислородом описывает простая
гиперболическая кривая. Сродство миоглобина к кислороду выше,
чем у гемоглобина. Действительно, миоглобин получает кислород
от гемоглобина, то есть при одном и том же парциальном
давлении гемоглобин должен кислород отдавать, а миоглобин
связывать.
35.
36.
Эффект БораВ тех тканях и органах, где происходит активное потребление кислорода, происходят
интенсивные окислительные процессы и выделяется значительное количество углекислого
газа. Под действием фермента карбоангидразы углекислый газ взаимодействует с водой с
образованием нестойкой угольной кислоты.
Угольная кислота легко диссоциирует на протоны и бикарбонат ионы. Таким образом, при
активном потреблении кислорода происходит локальное закисление среды. Присоединение
протонов к бкоковой части молекулы гемоглобина снижает его сродство к О2 и усиливает
поступление О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином
при повышении концентрации Н+ называют эффектом Бора.
37.
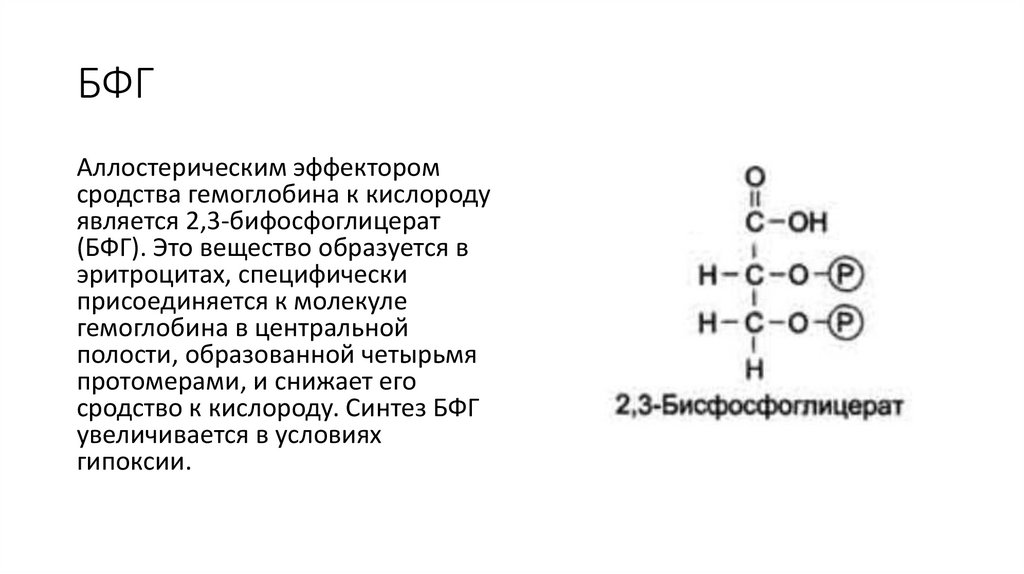
БФГАллостерическим эффектором
сродства гемоглобина к кислороду
является 2,3-бифосфоглицерат
(БФГ). Это вещество образуется в
эритроцитах, специфически
присоединяется к молекуле
гемоглобина в центральной
полости, образованной четырьмя
протомерами, и снижает его
сродство к кислороду. Синтез БФГ
увеличивается в условиях
гипоксии.
38.
39.
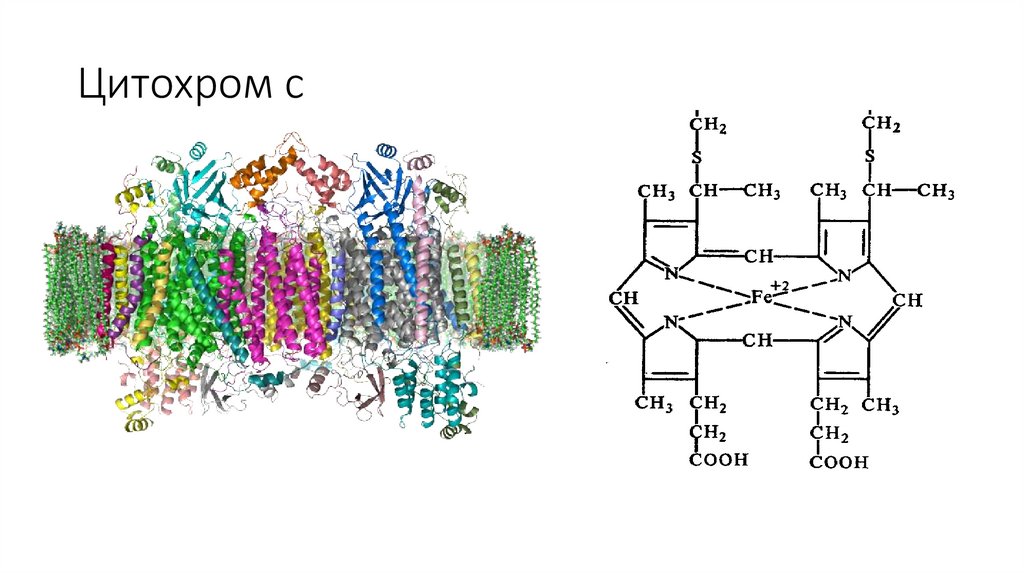
ЦитохромыЦитохромы (гемопротеины) — это небольшие глобулярные белки (в
первом приближении их структура может быть представлена в виде
шара или вытянутого эллипсоида), которые содержат ковалентно
связанный гем, расположенный во внутреннем кармане, образованном
аминокислотными остатками.
Цитохромы присутствуют во всех клетках организмов. В клетках
эукариот они локализованы в митохондриальных мембранах.
Цитохромы катализируют окислительно-восстановительные реакции.
Известно около 30 видов цитохромов. Все они содержат гем в качестве
простетической группы и различаются структурами боковых и
полипептидных цепей. В зависимости от типа гема выделяют 8 классов
цитохромов. В зависимости от спектров поглощения, цитохромы делят
на группы a, b, c.























 Биология
Биология








