Похожие презентации:
Регуляция активности ферментов
1.
Регуляция активностиферментов
2.
Среди множества ферментов, катализирующих химическиереакции в клетках, объектами регуляции являются немногие из
них. Они получили название регуляторных, или ключевых. Как
правило, ключевые ферменты:
• катализируют неравновесные (необратимые) реакции;
• находятся в самом начале метаболического пути и(или) на
развилке нескольких путей;
• являются самыми медленными лимитирующими ферментами,
определяющими скорость потока субстратов через весь
метаболический путь.
3.
Возможность изменения скорости ферментативной реакции поддействием разнообразных веществ, влияющих на активность
ферментов, является отличительной особенностью ферментов как
биологических катализаторов. Такие вещества называют
регуляторами, или эффекторами.
Все способы регуляции скорости ферментативных реакций в
организме человека можно разделить на две большие группы,
включающие:
• изменение каталитической активности «имеющихся в наличии»
молекул фермента; происходит быстро
• изменение количества молекул фермента (или факторов, их
регулирующих) происходит медленно
4.
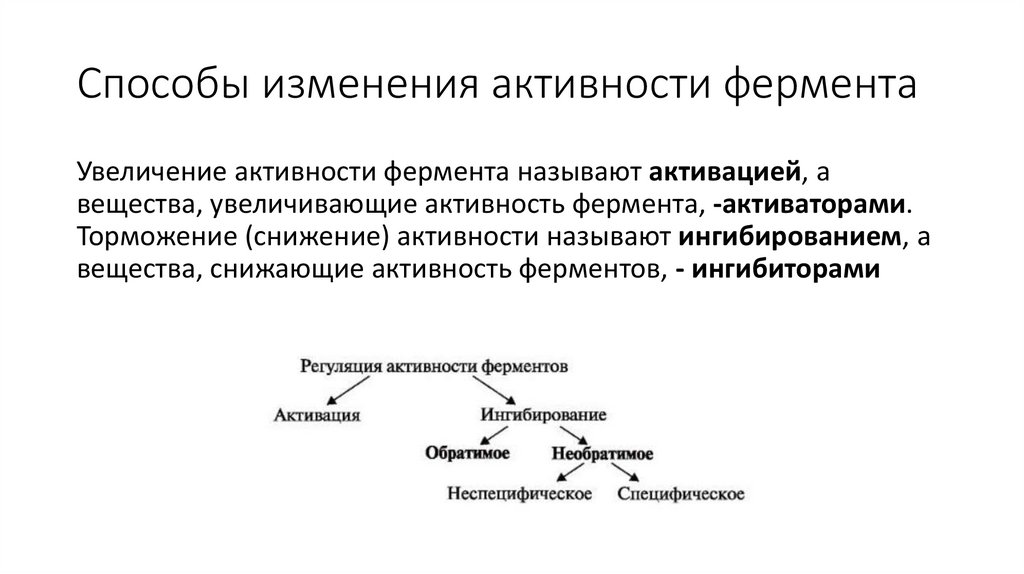
Способы изменения активности ферментаУвеличение активности фермента называют активацией, а
вещества, увеличивающие активность фермента, -активаторами.
Торможение (снижение) активности называют ингибированием, а
вещества, снижающие активность ферментов, - ингибиторами
5.
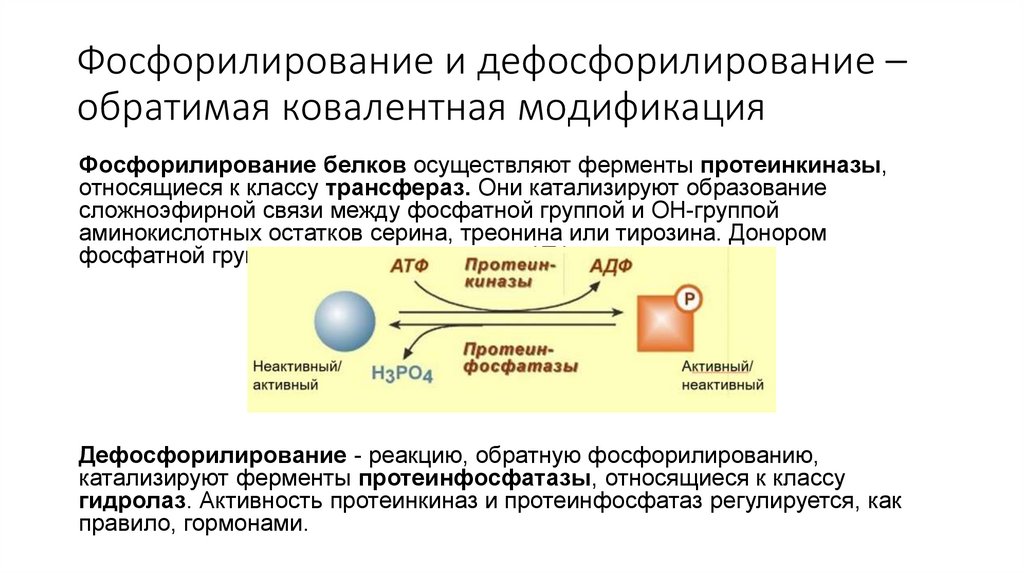
Фосфорилирование и дефосфорилирование –обратимая ковалентная модификация
Фосфорилирование белков осуществляют ферменты протеинкиназы,
относящиеся к классу трансфераз. Они катализируют образование
сложноэфирной связи между фосфатной группой и OH-группой
аминокислотных остатков серина, треонина или тирозина. Донором
фосфатной группы чаще всего является АТФ
Дефосфорилирование - реакцию, обратную фосфорилированию,
катализируют ферменты протеинфосфатазы, относящиеся к классу
гидролаз. Активность протеинкиназ и протеинфосфатаз регулируется, как
правило, гормонами.
6.
Активация ферментов фосфорилированиемТриацилглицерол-липаза (ТАГ-липаза) - внутриклеточный фермент жировой
ткани. В дефосфорилированной форме фермент неактивен.
Пол действием специфический протеинкиназы А (ПКА) фермент
фосфорилируется и переходит в активную форму.
В результате фосфорилирования происходят изменение заряда,
конформации фермента; конформации активного центра фермента.
Повышается сродство фермента к субстрату и возрастает скорость
ферментативной реакции,
7.
Активация ферментов дефосфорилированиемДля некоторых ферментов, обеспечивающих метаболизм
глюкозы, холестерола, гликогена, фосфорилированная
форма является неактивной.
Например, фермент пируваткиназа, участвующий в
катаболизме глюкозы, переходит в активную форму только
после отщепления фосфорного остатка.
Поэтому в данном случае фосфорилирование вызывает
снижение активности, а дефосфорилирование - повышение
активности фермента
8.
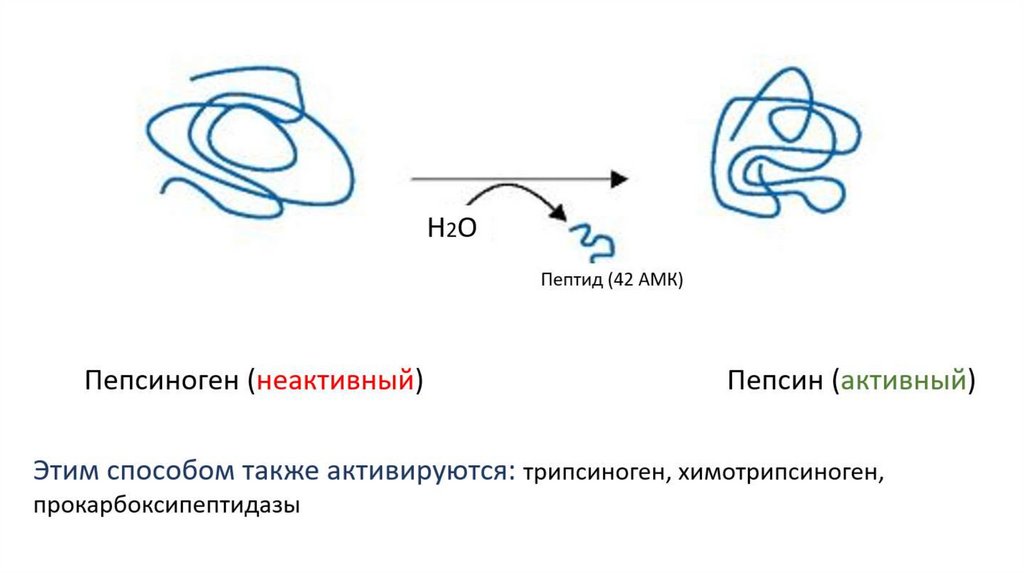
Частичный протеолизЦелый ряд ферментов вырабатывается клетками организма в
каталитически неактивной форме в виде проферментов, или
зимогенов. Активация профермента происходит путем отщепления
от него пептида - частичного протеолиза.
В результате частичного протеолиза (отщепления пептида):
изменяются первичная структура, молекулярная масса,
конформация фермента и его активного центра, повышаются
сродство к субстрату (S) и скорость ферментативной реакции.
9.
Например, трипсин в поджелудочной железе синтезируется вформе неактивного предшественника трипсиногена. В
кишечнике происходит отщепление с N-конца молекулы
трипсиногена гексапептида под действием энтеропептидазы.
Фермент из неактивной формы переходит в активную.
Синтез пептидаз в неактивной форме предотвращает их
разрушающее действие на клетки органов, в которых они
образуются. Данный процесс регуляции активности носит
необратимый характер.
10.
11.
Регуляция активности ферментов путемассоциации-диссоциации протомеров
В тканях присутствуют ферменты, которые в неактивной форме
представлены отдельными комплексами, состоящими из
нескольких протомеров. При увеличении в клетке концентрации
специфических регуляторных молекул они присоединяются к
определенным центрам протомеров. Изменение их конформации,
вызванное присоединением лигандов, повышает их сродство друг
к другу и стимулирует ассоциацию, т.е. образование активной
формы фермента
12.
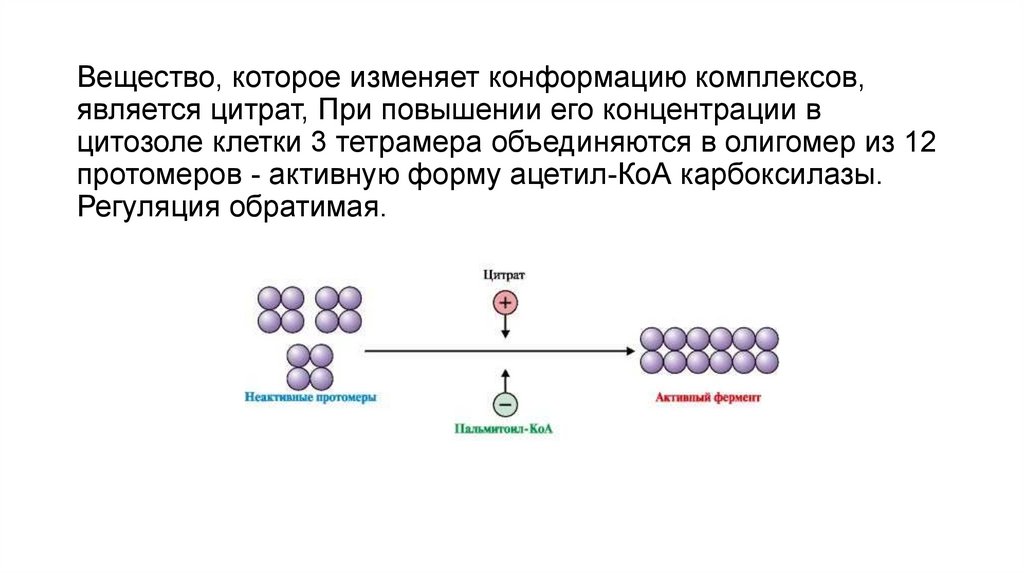
Вещество, которое изменяет конформацию комплексов,является цитрат, При повышении его концентрации в
цитозоле клетки 3 тетрамера объединяются в олигомер из 12
протомеров - активную форму ацетил-КоА карбоксилазы.
Регуляция обратимая.
13.
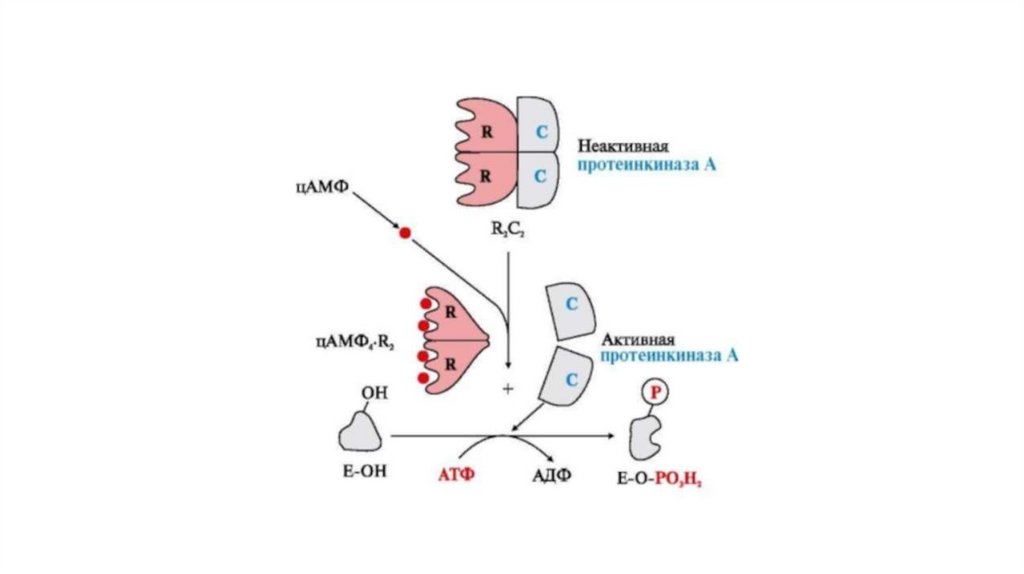
Другим примером этого типа регуляции может служитьактивация протеникиназы А.
В неактивной форме фермент состоит из 4 протомеров - 2
каталитических (С) и 2 регуляторных (R). R-протомеры имеют
по 2 центра связывания для молекул регуляторного лиганда циклического аденозинмонофосфата (цАМФ). Молекулы
цАМФ при повышении их концентрации в клетке
присоединяются к специфическим центрам R-протомеров.
Это приводит к изменению их конформации и потере
сродства к С-протомерам. Отделившиеся каталитические
протомеры (протеинкиназа А) проявляют протеинкиназную
активность и фосфорилируют белки по аминокислотным
остаткам Сер и Тре. В отсутствие цАМФ R,-протомеры
взаимодействуют с С, протомерами, образуя неактивный
комплекс R2C2
14.
15.
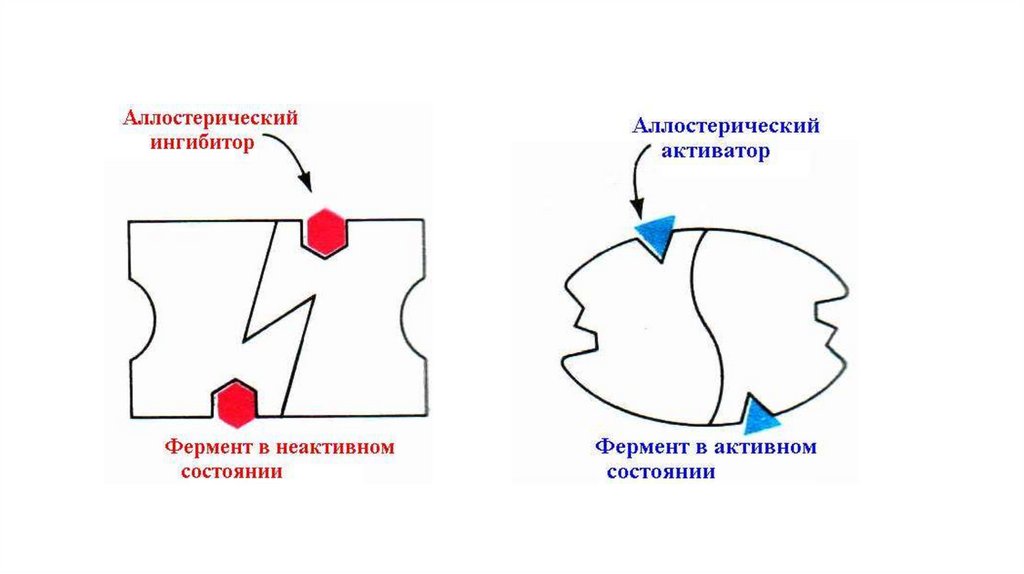
Аллостерическая регуляцияФерменты имеющие такой механизм регуляции являются, как
правило, олигомерными белками. Они состоят из нескольких
(не менее 2) субъединиц, имеют активный и аллостерический
центры, которые находятся на разных субъединицах.
Присоединение эффектора в аллостерический центр
вызывает кооперативные конформационные изменения всех
протомеров. Конформационные перестройки в активном
центре фермента повышают или понижают его сродство к
субстрату.
16.
17.
Аллостерическое ингибирование конечным продуктомметаболического пути активности первого фермента распространенный способ регуляции обмена веществ в клетке
Его еще называют механизмом отрицательной обратной связи. Он
сигнализирует клетке о том, что количество синтезируемого
вещества достигло определенного уровня, превышение которого
нежелательно.
18.
Изменение количества ферментовИзменение количества ферментов - самый медленный способ
регуляции, который обычно затрагивает изменение биосинтеза
белка или его метаболизма.
19.
20.
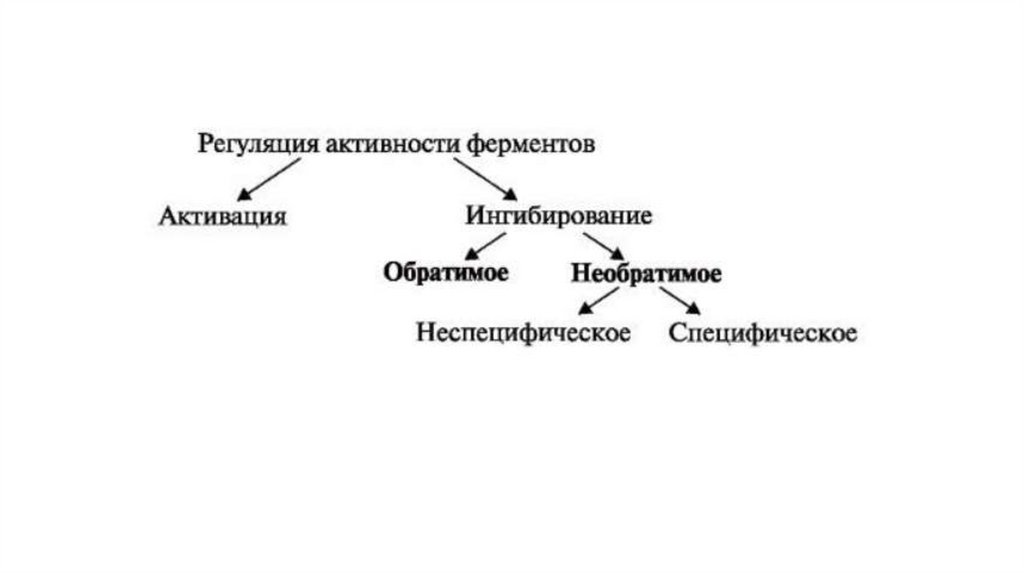
Ингибирование активности ферментовНеобратимое ингибирование приводит к потере ферментативной
активности в результате ковалентного связывания необратимого
ингибитора с ферментом. Чаще всего такой способ регуляции
активности является нефизиологическим. Он присущ разнообразным
токсичным веществам и лекарственным средствам.
Неспецифическое ингибирование вызывают вещества, ковалентно
связывающиеся с определенными аминокислотными остатками. Этим
определяется токсическое действие ионов ртути и свинца на организм.
Например, n-хлормеркурибензоат вызывает инактивацию практически
всех ферментов, в активный центр которых входят остатки цистеина
21.
При специфическом необратимом ингибировании ковалентноймодификации подвергается один фермент. Чаще всего происходит
так называемое механизм-активируемое (называемое также
суицидным) ингибирование. В таком случае ингибитор (I)
представляет собой субстрат-самоубийцу. Под действием
фермента (E) он превращается в высокореакционноспособную
молекулу (Ir*), которая не превращается в продукт (Р), а
ковалентно связывается в активном центре этого фермента,
вызывая его необратимую инактивацию. Поскольку каждый
фермент характеризуется определенной субстратной
специфичностью, такой субстрат-самоубийца будет специфически
ингибировать один определенный фермент.
22.
Обратимое ингибированиеПри обратимом ингибировании ингибитор связывается с
ферментом нековалентными связями и легко диссоциирует от
последнего. Существует несколько типов обратимого
ингибирования:
• конкурентное
• неконкурентное
• смешанное
• бесконкурентное
23.
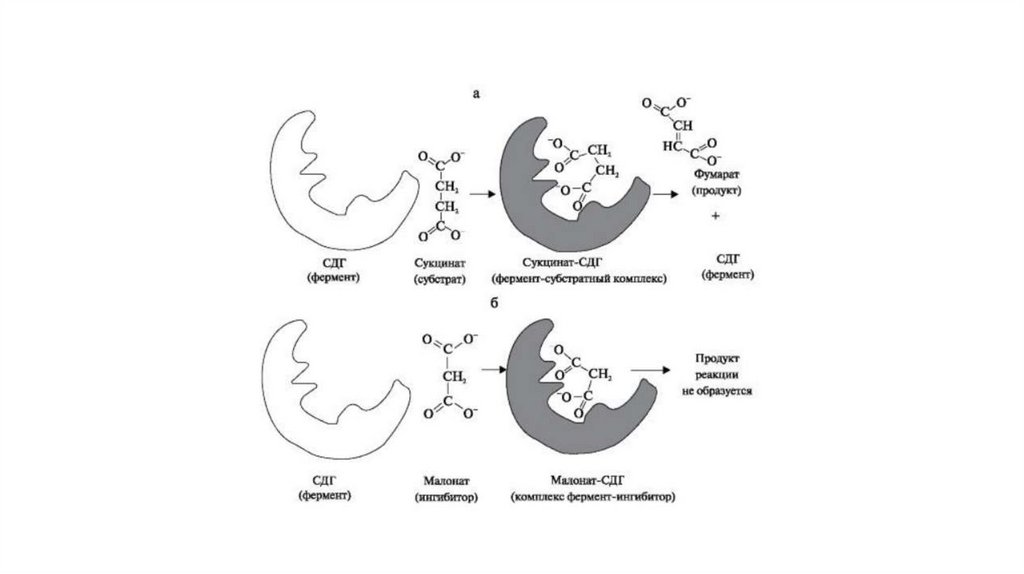
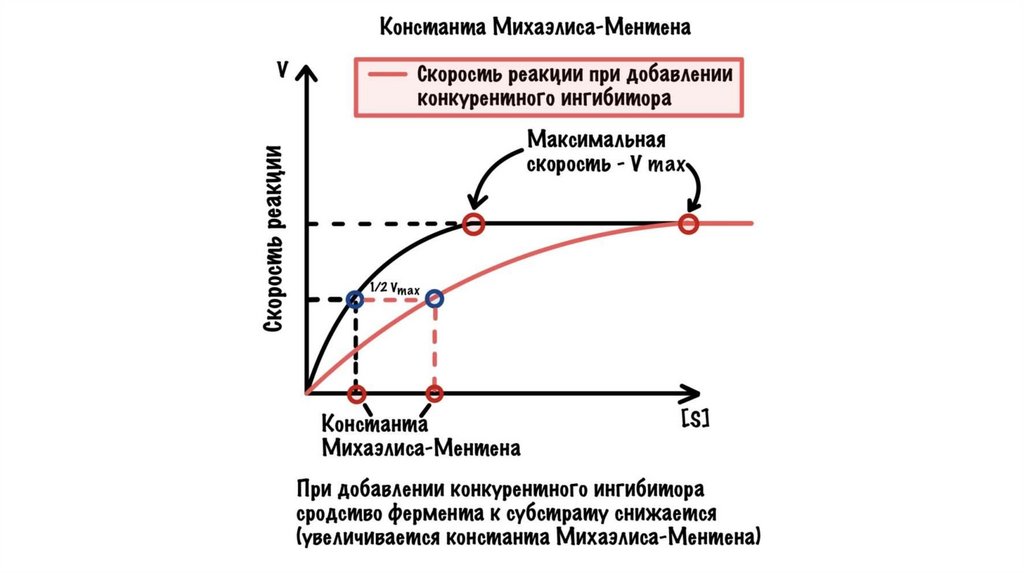
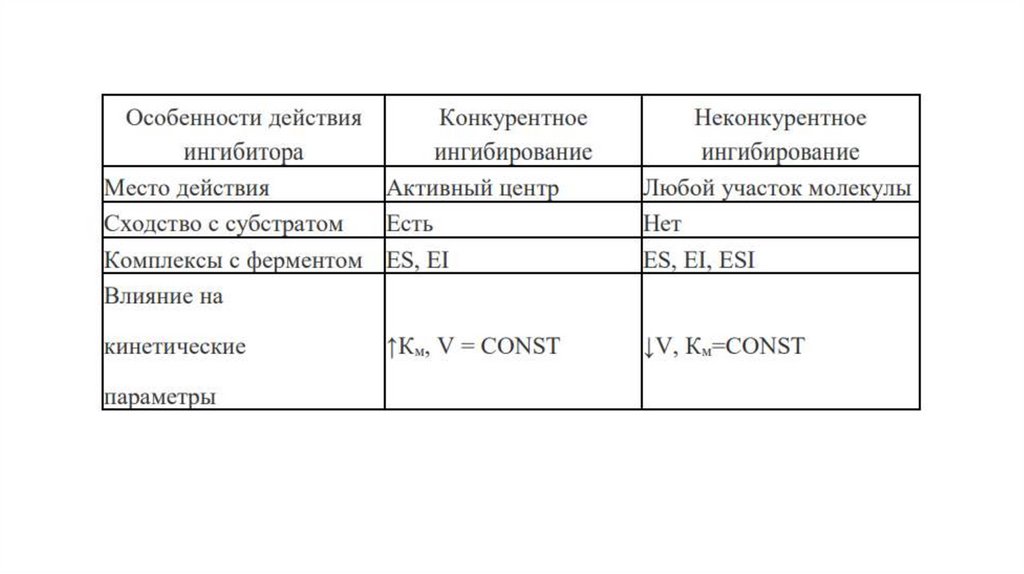
Конкурентное ингибированиеПри конкурентном ингибировании ингибитор обладает
структурным сходством с субстратом и конкурирует с ним за
активный центр фермента. Именно поэтому выраженность
конкурентного ингибирования будет определяться соотношением
концентраций ингибитора и субстрата. Чем выше будет это
соотношение, тем больше ингибирование фермента, и наоборот.
24.
25.
26.
В случае ферментов с относительной субстратной специфичностью,катализирующих превращение нескольких субстратов, один
субстрат может выступать в качестве ингибитора для другого
субстрата. Например, фермент алкогольдегидрогеназа может
катализировать реакцию дегидрирования как этилового спирта, так
и метилового
И если оба субстрата будут претендовать на активный центр
алкогольдегидрогеназы, предпочтение будет отдано тому из них,
концентрация которого будет больше. Иначе говоря, один субстрат
будет выступать в качестве конкурентного ингибитора другого.
27.
Лечение спиртомМетиловый спирт (метанол) - сильный яд, к которому особенно
чувствительна центральная нервная система. Прием даже
небольшого количества метанола (30-50 мл) может привести к
слепоте, парезам и параличам. Более высокие дозы смертельны
для человека. Одним из способов лечения отравления метанолом
считают введение (внутрь или внутривенно) большого количества
этанола, что позволяет насытить все активные центры
алкогольдегидрогеназы и, таким образом, затормозить
метаболизм метанола. В результате этанол является конкурентным
ингибитором алкогольдегидрогеназы по отношению к метанолу.
Хотя взятые по отдельности оба вещества - субстраты одного
фермента.
28.
Неконкурентное ингибированиеПри неконкурентном ингибировании вещество, тормозящее скорость
ферментативной реакции, не обладает структурным сходством с
субстратом. Поэтому конкуренции ингибитора и субстрата за активный
центр фермента не происходит, и неконкурентный ингибитор, как
правило, связывается с молекулой фермента вне активного центра.
Однако это вызывает такое изменение структуры фермента, при
котором нарушается нормальное взаимодействие активного центра с
субстратом. При этом неконкурентные ингибиторы не влияют на
связывание фермента с субстратом, а изменяют только Vмакс.
Поскольку неконкурентный ингибитор может связываться как с Е, так и с
ES, такое ингибирование нельзя уменьшить путем простого увеличения
концентрации субстрата.
29.
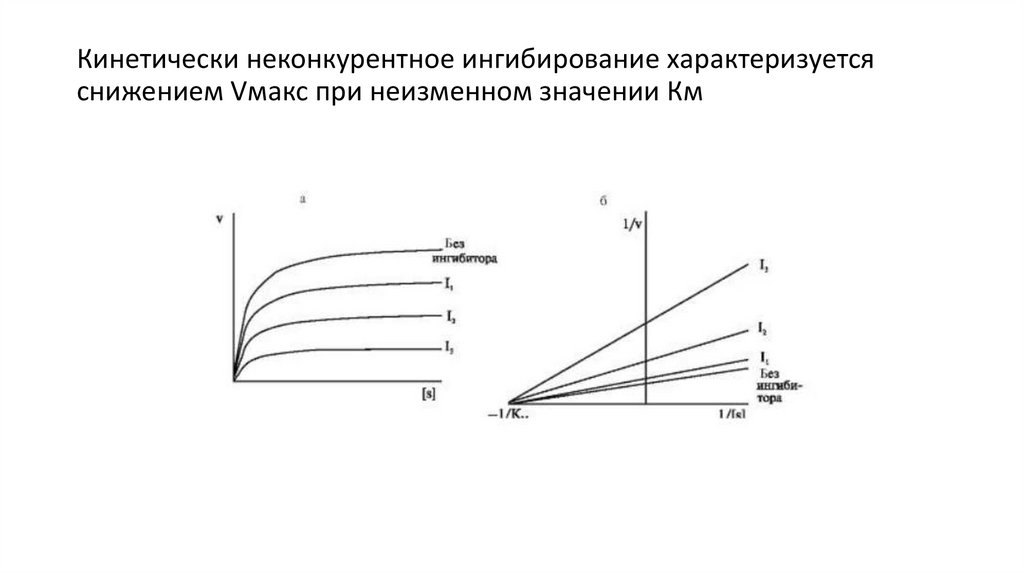
Кинетически неконкурентное ингибирование характеризуетсяснижением Vмакс при неизменном значении Км
30.
31.
Смешанное и бесконкурентноеингибирование
Неконкурентное ингибирование в чистом виде встречают очень
редко. Чаще наблюдают смешанное ингибирование, когда под
действием ингибитора происходит не только снижение Vмакс, но и
изменение Км.
Бесконкурентное ингибирование - ингибитор связывается
только с фермент-субстратным комплексом, но не со
свободным ферментом, изменяя его конформацию, что
затрудняет катализ. Это связывание происходит вне
активного центра фермента. Повышение концентрации
субстрата увеличивает ингибирование фермента.
32.
ИзоферментыИзоферменты – это множественные формы фермента,
катализирующие одинаковую реакцию, но отличающиеся по
строению. Изоферменты могут отличаться кинетическими
параметрами, условиями активации, тканевой специфичностью.
Чаще всего изоферменты являются олигомерными белками и
отличаются по составу субъединиц.
Обнаружение различных изоферментных форм позволяет
использовать их в энзиомодиагностики патологий соответствующих
органов.
33.
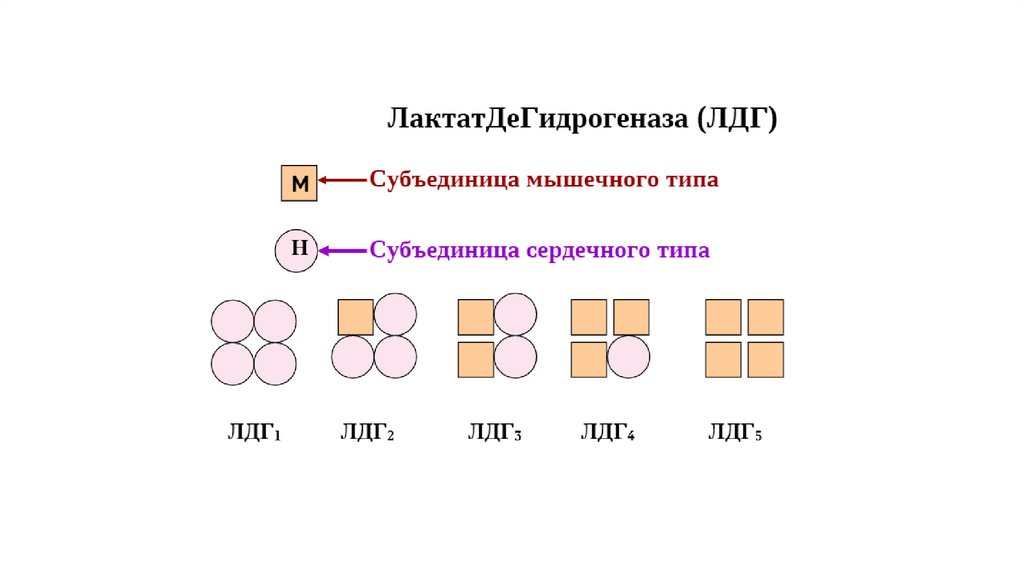
ЛактатдегидрогеназаНапример, фермент гликолиза лактатдегилрогеназа (ЛДГ),
представлен в организме человека пятью изоферментами. Данный
фермент является тетрамером, который может быть «построен» из
двух типов субъединиц H и M. Они получили свое название по
первым буквам органов, из которых они были выделены (от англ.
heart – сердце и muscle – мышца).
Например, фермент гликолиза лактатдегилрогеназа (ЛДГ),
представлен в организме человека пятью изоферментами. Данный
фермент является тетрамером, который может быть «построен» из
двух типов субъединиц H и M. Они получили свое название по
первым буквам органов, из которых они были выделены (от англ.
heart – сердце и muscle – мышца).
34.
35.
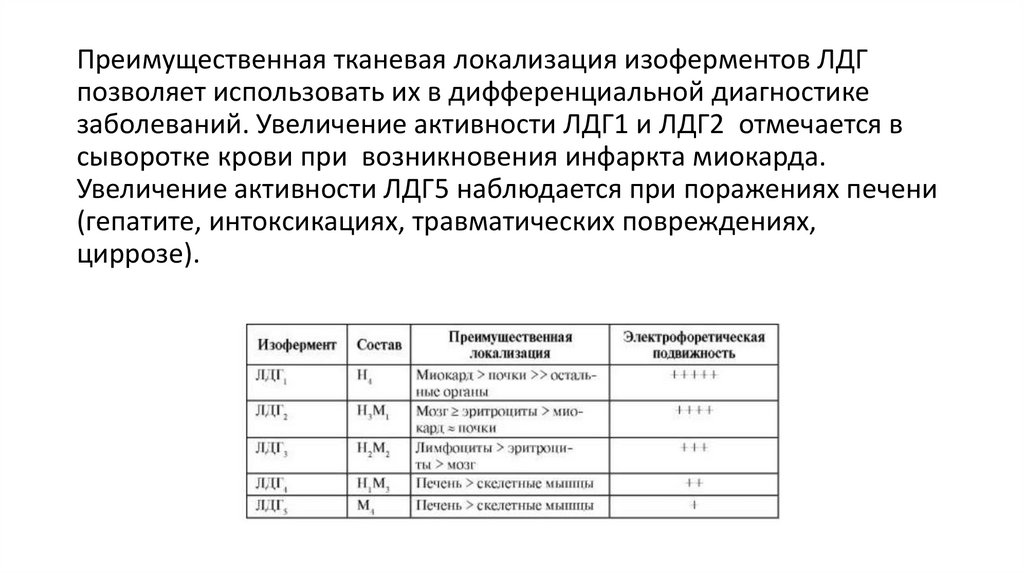
Преимущественная тканевая локализация изоферментов ЛДГпозволяет использовать их в дифференциальной диагностике
заболеваний. Увеличение активности ЛДГ1 и ЛДГ2 отмечается в
сыворотке крови при возникновения инфаркта миокарда.
Увеличение активности ЛДГ5 наблюдается при поражениях печени
(гепатите, интоксикациях, травматических повреждениях,
циррозе).
36.
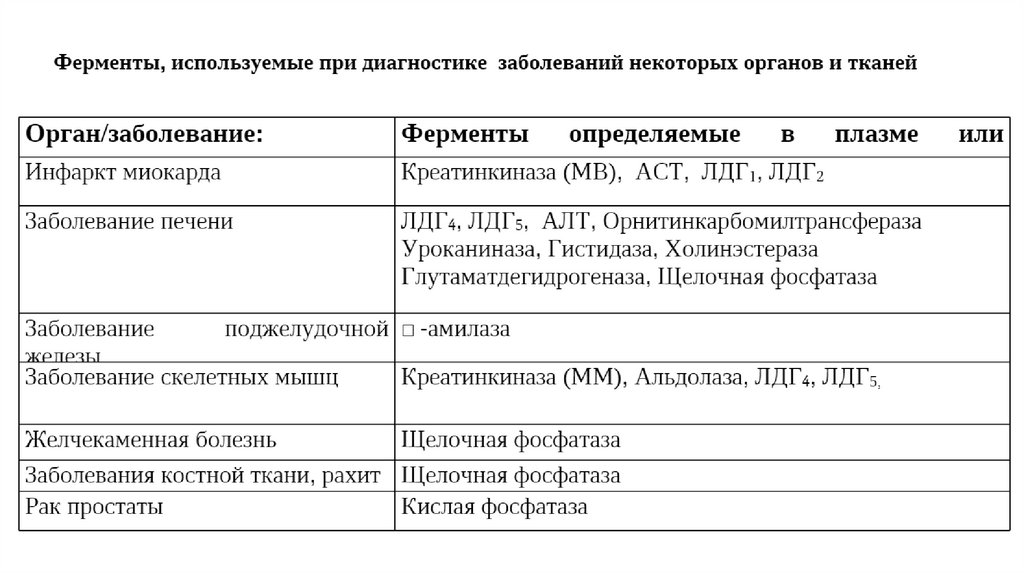
КреатинкиназаФермент креатинкиназа представлен в организме человека тремя
изоферментами, каждый из которых состоит из двух субъединиц.
Изоформа ВВ синтезируется в мозге и не имеет диагностического
значения, так как не проникает через гематоэнцефалический барьер.
Изоформы МВ преимущественно синтезируется в миокарде и ее
уровень в плазме крови возрастает при инфаркте миокарда, а изоформа
ММ преимущественно синтезируется в скелетных мышцах.
Соответственно уровень креатинкиназы ММ в крови может повышаться
при обширном поражении мышц, при мышечных дистрофиях.
37.
Измерение активности АЛТ и АСТНаиболее активны две трансаминазы – аланинаминотрансфераза
(АЛТ) и аспартатаминотрансфераза (АСТ).
Их активность определяют в сыворотке крови для диагностики
инфаркта миокарда и заболеваний печени. В норме активность
АЛТ и АСТ в сыворотке крови около 40 Е/л, а соотношение АСТ/АЛТ
(коэффициент де Ритиса) равно 1,33+0,4.
При заболеваниях печени наблюдается резкое повышение
активности АЛТ (АСТ/АЛТ<0,6), а при инфаркте миокарда
наибольшие изменения выявляются в активности АСТ (АСТ/АЛТ >
2).

























 Биология
Биология