Похожие презентации:
Газовые законы
1.
Газовые законы2. ПОВТОРЕНИЕ
1. Вывести уравнение К – М.2. Записать уравнение К – М и объяснить
смысл входящих в него букв
3. Получить уравнение перехода 1 2.
4. Записать уравнение перехода и вывести
из него р2 ,Т2 , Т1 , V1.
5.Ответы на вопросы
3. ИЗОПРОЦЕСС
– изменение состояния идеальногогаза при неизменном значении
одного из макроскопических
параметров
Преимущества:
а) упрощает расчеты
б) позволяет графически описывать
процессы
4. изопроцессы
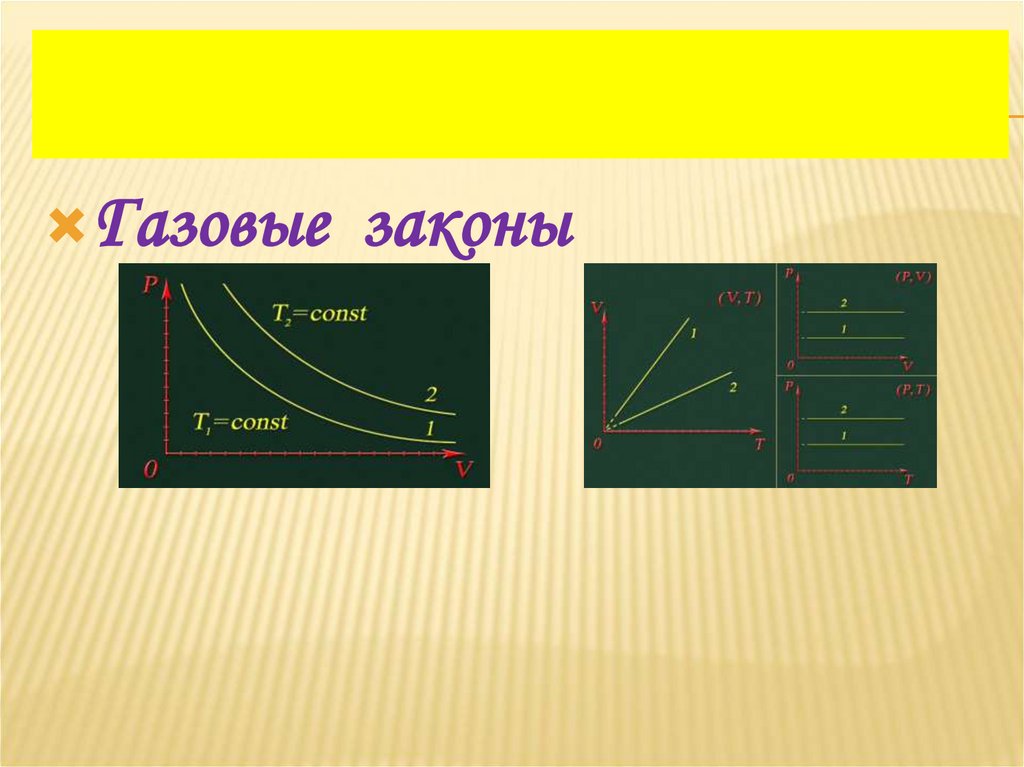
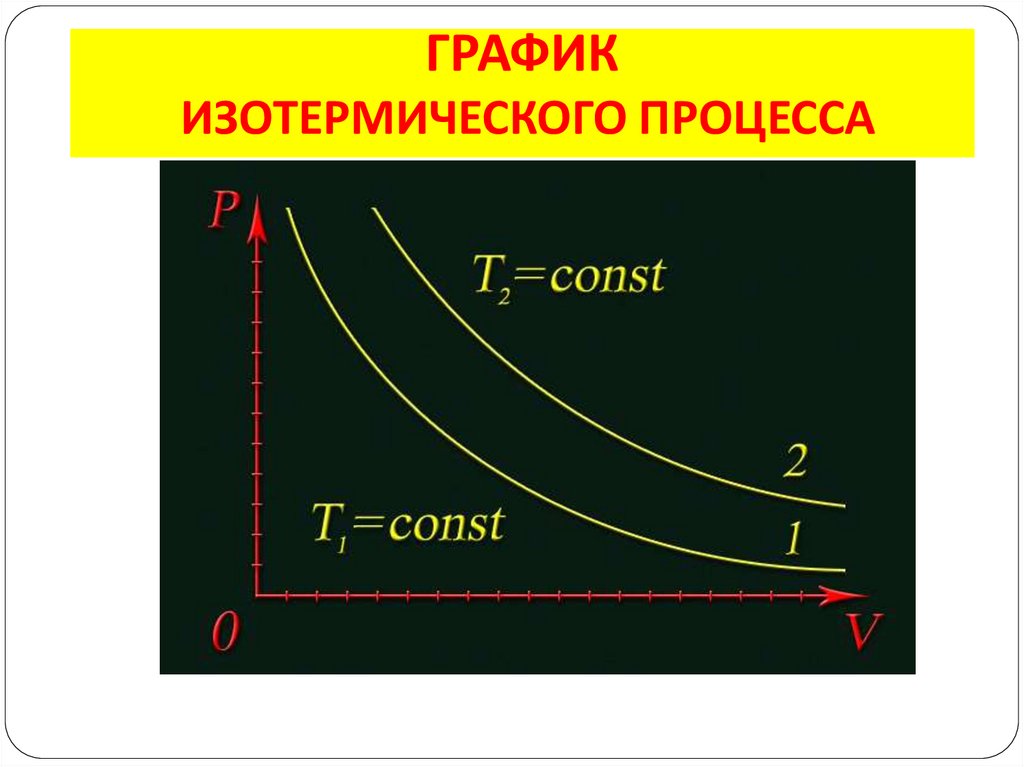
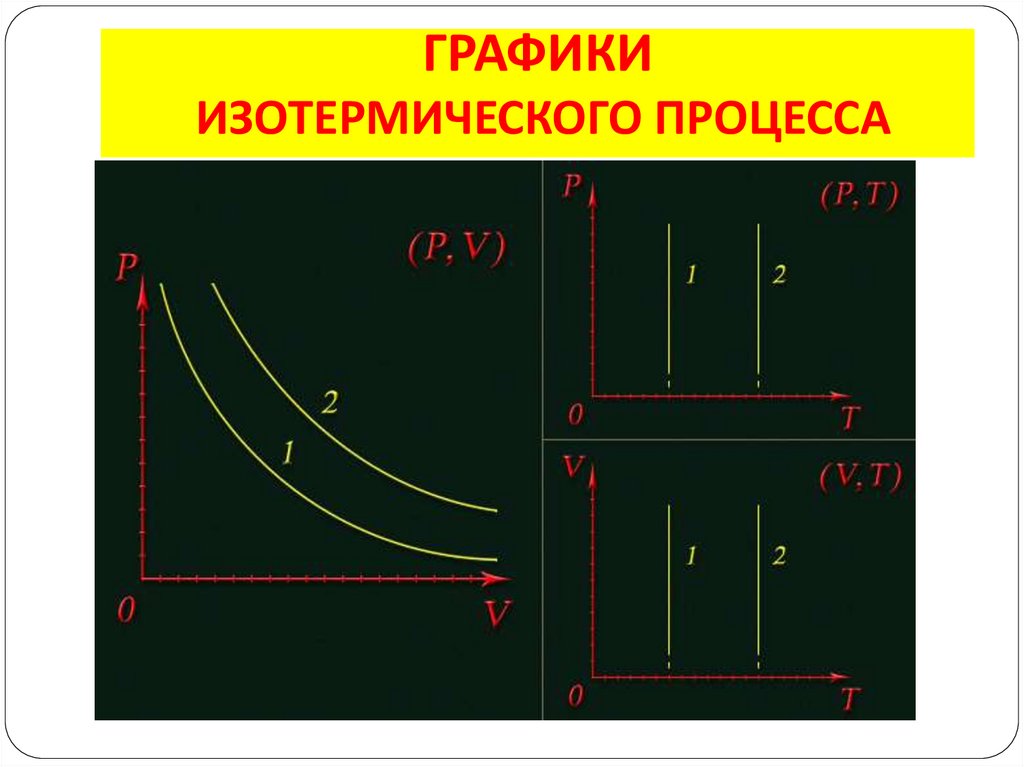
5. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
– изменения состояния газа припостоянной температуре (Т = const)
p1V1 = p2V2
Закон Бойля – Мариотта: для газа данной
массы произведение давления газа на его
объём постоянно, если температура газа
не изменяется
Примеры: дыхание человека, сжатие мяча
6. ГРАФИК ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
7. ГРАФИКИ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
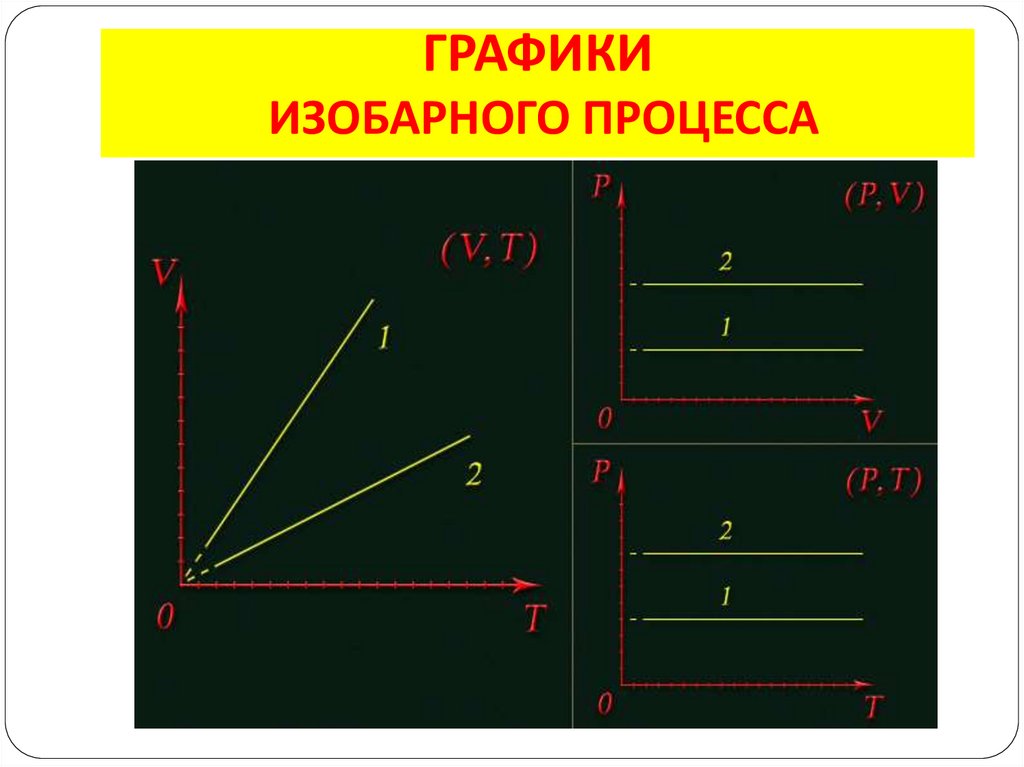
8. ИЗОБАРНЫЙ ПРОЦЕСС
– изменение состояния газа припостоянном давлении (р = const )
V1 V2
T1 T2
Закон Гей – Люссака: для газа данной массы
отношение объёма к температуре
постоянно, если давление газа не меняется
Примеры: цилиндр с поршнем, шарик
9. ГРАФИКИ ИЗОБАРНОГО ПРОЦЕССА
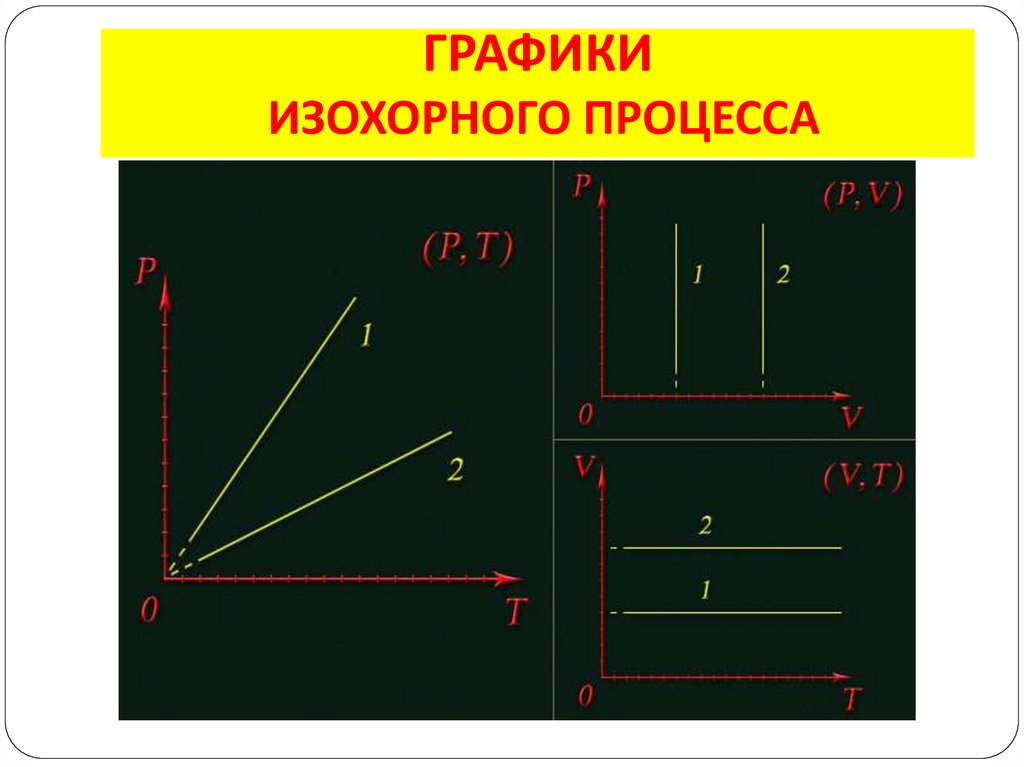
10. ИЗОХОРНЫЙ ПРОЦЕСС
– изменение состояния газа припостоянном объёме (V = const)
p1 p2
T1 T2
Закон Шарля: для газа данной массы
отношение давления к температуре
постоянно, если объём не меняется
Пример: нагревание лампы
11. ГРАФИКИ ИЗОХОРНОГО ПРОЦЕССА
12. ЗАДАЧА (образец)
р2
Какие процессы представлены
3 на графике и как изменяются
параметры газа?
1
0
Т
1 – 2 изотермический,
2 – 3 изобарный,
3 – 1 изохорный,
р↑ Т=
р= Т↑
р↓ Т↓
V↓
V↑
V=
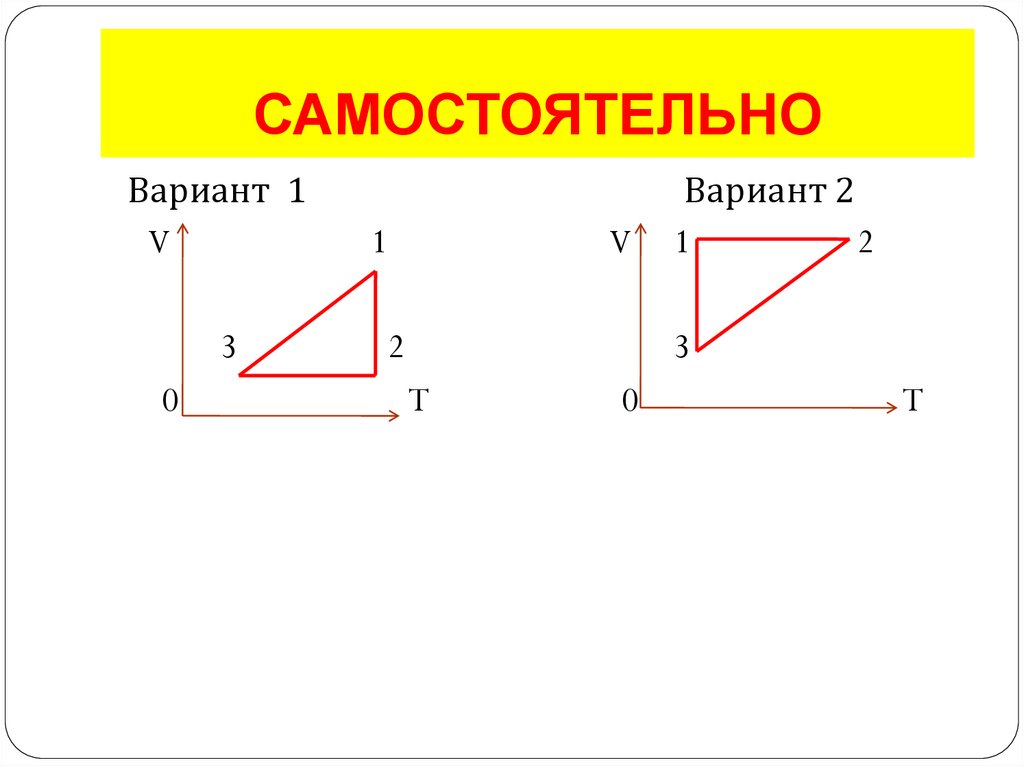
13. САМОСТОЯТЕЛЬНО
Вариант 1V
3
0
1
V
2
Вариант 2
1
2
3
T
0
T
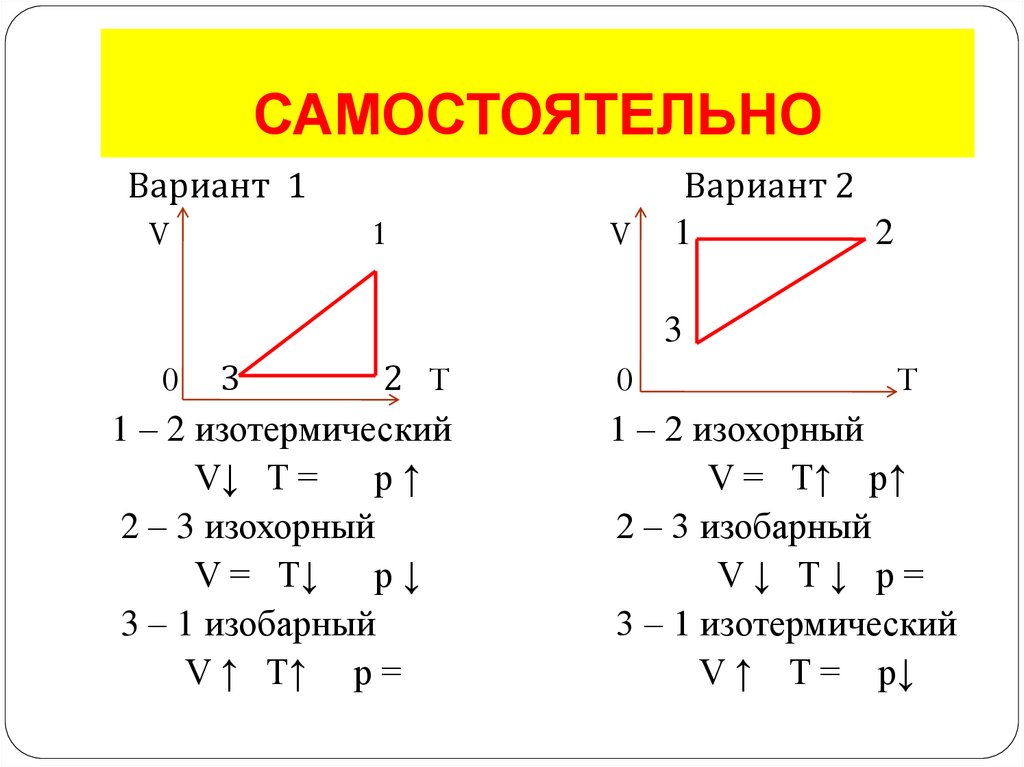
14. САМОСТОЯТЕЛЬНО
Вариант 1V
1
V
Вариант 2
1
2
3
0 3
2 T
1 – 2 изотермический
V↓ T = p ↑
2 – 3 изохорный
V = T↓ p ↓
3 – 1 изобарный
V ↑ T↑ p =
0
T
1 – 2 изохорный
V = T↑ p↑
2 – 3 изобарный
V↓ T↓ p=
3 – 1 изотермический
V ↑ T = p↓







 Физика
Физика








