Похожие презентации:
Химическая связь Метод валентных связей (метод Гайтлера и Лондона, 1927 г.)
1. Химическая связь Метод валентных связей (метод Гайтлера и Лондона, 1927 г.)
2.
Идея Льюиса (1916 г.): в химическом соединении каждый атомстремится
приобрести конфигурацию оболочки атома инертного газа, что может быть
осуществлено при помощи обобществления внешних (валентных) электронов.
ОДНА общая электронная пара соответствует единице валентности.
В 1927 г. идея разработана В.Гайтлером и Ф.Лондоном с
использованием аппарата квантовой механики. Идея расчета
энергетического состояния электронов в молекуле водорода:
1. Атомы водорода (а) и (в) в молекуле Н2 сохраняют свою
индивидуальность, т.е. каждый электрон (1) и (2) принадлежит ядру
своего атома.
2. Волновые функции 1S электрона (1) в атоме (а) – ψа (1) и электрона
(2) в атоме (в) – ψв (2) известны.
3. Электроны неразличимы, т.е. возможно ψа (2) и ψв (1).
3.
Тогда вид функций первого приближения ψ1 и ψ2 , которые описывают состояниеэлектронов в молекуле – произведение волновых функций изолированных атомов:
ψ1 = ψа (1) • ψв (2) и ψ2 = ψа (2) • ψв (1) (из-за неразличимости электронов (1) и
(2)).
Для молекулы водорода волновая функция представляет линейную комбинацию
функций ψ1 и ψ2:
ψ = ψ1 ± ψ2
ψ(+) – симметричная функция, ей соответствует случай антипараллельных спинов;
ψ(―) – антисимметричная функция, ей соответствует случай параллельных спинов.
|ψ|2 определяет плотность электронного облака
|ψ(+)|2 = |ψ(1)|2 + |ψ(2)|2 + 2|ψ(1)||ψ(2)|
межъядерном пространстве,
(б) – увеличение электронной плотности в
|ψ(―)|2 = |ψ(1)|2 + |ψ(2)|2 ― 2|ψ(1)||ψ(2)|
в межъядерном пространстве.
(а) – уменьшение электронной плотности
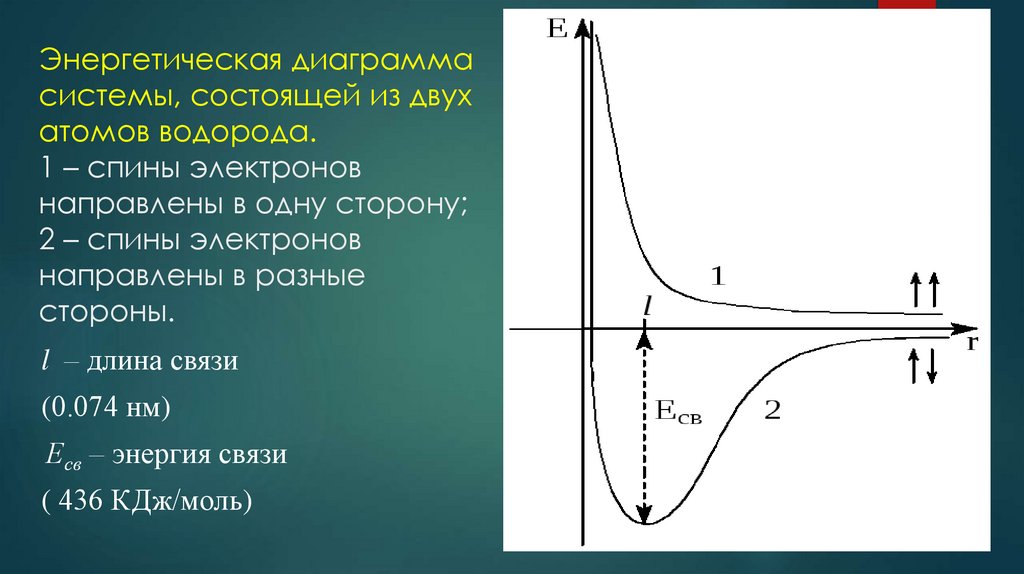
4. Энергетическая диаграмма системы, состоящей из двух атомов водорода. 1 – спины электронов направлены в одну сторону; 2 – спины
электроновнаправлены в разные
стороны.
l – длина связи
(0.074 нм)
Есв – энергия связи
( 436 КДж/моль)
5. Основные положения метода валентных связей
1. Химическая связь между атомами образуется в результате перехода их валентныхэлектронов в совместное владение, т.е. в результате образования в межъядерном
пространстве общих электронных пар.
2. Общие электронные пары образуют неспаренные электроны с
антипараллельными спинами.
3. Химическая связь обязана частичному перекрыванию электронных облаков в
межъядерном пространстве, что приводит к увеличению электронной плотности с
отрицательным зарядом, к которой притягиваются положительно заряженные ядра.
4. Чем больше перекрываются электронные облака в межъядерном пространстве,
тем выше энергия связи.
5. Существуют неполярные (гомеополярные) и полярные (гетерополярные)
ковалентные связи. В первом случае общая электронная плотность расположена
строго посередине межъядерного пространства, во втором – оттянута в сторону
элемента с повышенной электроотрицательностью.
6. Основные положения метода валентных связей
6. Ковалентная связь обладает направленностьюмаксимального перекрывания электронных облаков).
(направлена
в
сторону
7. Ковалентная связь обладает насыщаемостью. Насыщаемость определяется
механизмом образования ковалентной связи.
8. Кратность связи – количество общих электронных пар. Одна общая электронная
пара соответствует единице химической связи.
9. Длина связи – расстояние между ядрами атомов.
10. Энергия связи - работа, которую необходимо затратить для разделения молекулы
на два (в простейшем случае) атома и удаление их на бесконечно большое
расстояние. Размерность – КДж/моль (Ккал/моль).
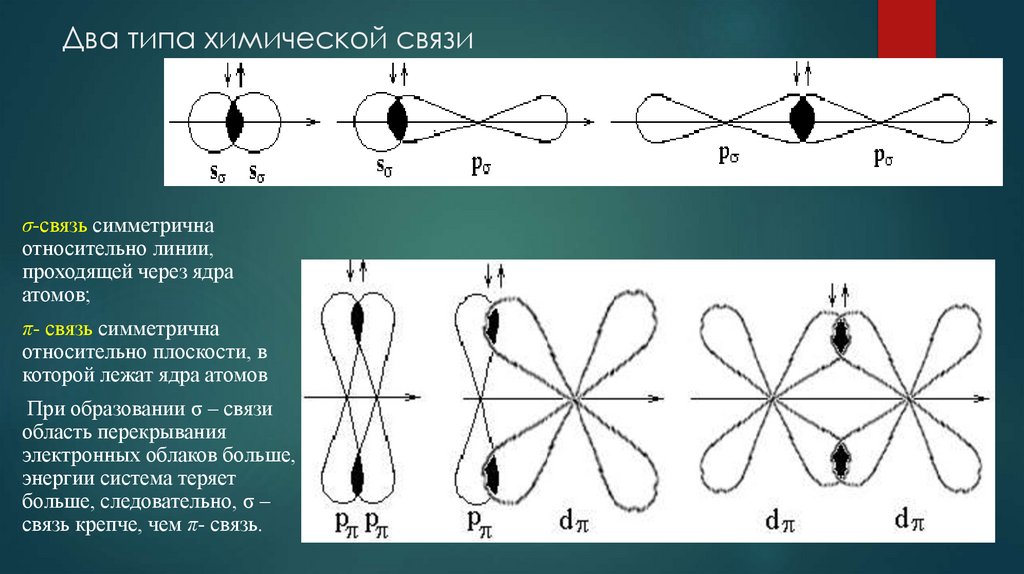
7. Два типа химической связи
σ-связь симметричнаотносительно линии,
проходящей через ядра
атомов;
π- связь симметрична
относительно плоскости, в
которой лежат ядра атомов
При образовании σ – связи
область перекрывания
электронных облаков больше,
энергии система теряет
больше, следовательно, σ –
связь крепче, чем π- связь.
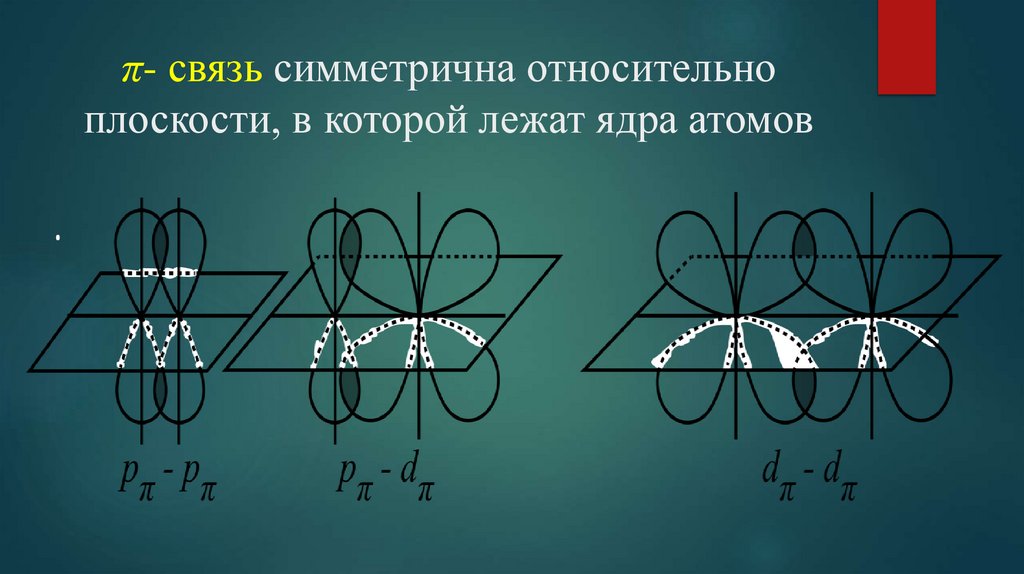
8. π- связь симметрична относительно плоскости, в которой лежат ядра атомов
9. Два механизма образования ковалентной связи
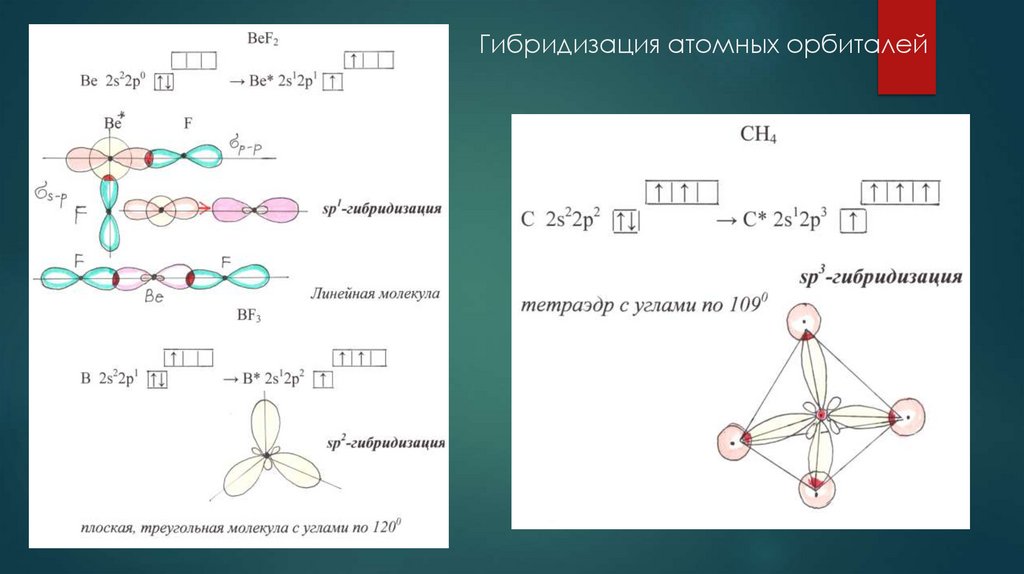
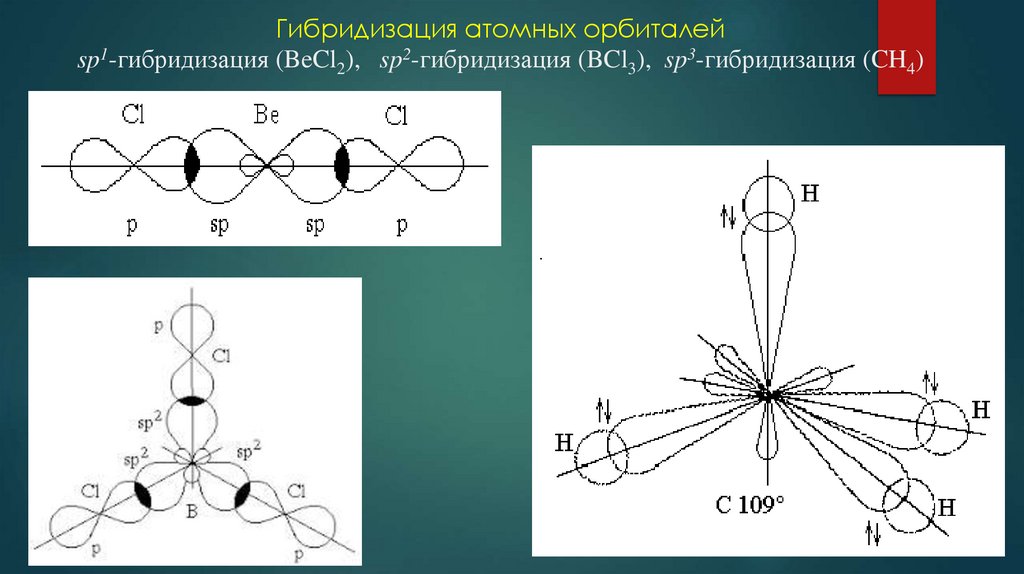
10. Гибридизация атомных орбиталей
11. Гибридизация атомных орбиталей sp1-гибридизация (BeCl2), sp2-гибридизация (BCl3), sp3-гибридизация (CH4)
12. Недостатки метода валентных связей
В целом МВС позволяет понять способность атомов к образованию определенногочисла ковалентных связей, объясняет их направленность, удовлетворительно
описывает структуру и свойства большого числа молекул.
Тем не менее,:
-
Невозможно объяснить существование устойчивых ионов H2+ и He2+
-
Согласно МВС, молекула кислорода – диамагнетик, на самом деле она обладает
парамагнитными свойствами, что указывает на наличие в ее составе
неспаренных электронов.
- Трудно объяснить, почему отрыв электронов от некоторых молекул приводит к
упрочнению химической связи (энергия связи в молекуле фтора F2 - 155
КДж/моль, в молекулярном ионе F2+ - 320 КДж/моль; в молекуле O2 Есвязи = 494
КДж/моль, а у иона O2+ - 642 КДж/моль).
13. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (МО)
В этой теории квантовомеханические зависимости для атома распространены наболее сложную систему — молекулу. Молекула рассматривается как целое, а не как
совокупность
сохранивших
индивидуальность
атомов.
В
молекуле
имеются дискретные энергетические состояния отдельных электронов с их
самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны данной молекулы (как и в атоме)
распределяются по соответствующим орбиталям. Состояние электрона в атоме
описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения
Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая
конкретный математический вид и удовлетворяющая условию нормировки и
однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной
орбиталью - АО). Каждая орбиталь характеризуется своим набором квантовых чисел,
отражающих свойства электронов в данном энергетическом состоянии. В отличие от
одноцентровых орбиталей атомов, МО многоцентровые, то есть молекулы имеют
общие орбитали для двух или более атомных ядер.
14. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (МО)
Каждая молекулярная орбиталь обладает определённой энергией, приближённохарактеризующейся соответствующим потенциалом ионизации.По аналогии с АО, МО
молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, γ-. Совокупность МО
молекулы с указанием её типа и количеством электронов на ней даёт электронную
конфигурацию молекулы. Из n исходных атомных орбиталей возникает n МО.
Существует 3 типа молекулярных орбиталей: связывающие, разрыхляющие и
несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь,
на разрыхляющих - дестабилизируют . Молекула устойчива в том случае, если число
электронов на связывающих орбиталях больше числа электронов на разрыхляющих. На
связывающей МО электроны большую часть времени пребывает между ядрами, при
этом в этом месте повышается электронная плотность, что способствует образованию
связи. На разрыхляющих же МО электроны большую часть времени находятся за
ядрами, способствуя отталкиванию ядер друг от друга. Электроны, находящиеся на
несвязывающих
МО, участия в образовании химической связи не принимают.
Распределение электронов по МО определяет порядок связи, её энергию, межъядерные
расстояния (длина связи), магнитные свойства молекул и др.
15. Метод молекулярных орбиталей как линейная комбинация атомных орбиталей (МО ЛКАО).
Метод МО ЛКАО основан на следующих правилах.1. При сближении атомов до расстояний химических связей из атомных орбиталей (АО)
образуются молекулярные (МО).
2. Число полученных МО равно числу исходных АО.
3. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания
двух АО образуются две МО. Одна из них имеет меньшую энергию по сравнению с
исходными атомными и называется связывающей, а вторая молекулярная орбиталь
обладает
большей
энергией,
чем
исходные
атомные
орбитали,
и
называется разрыхляющей.
4. При перекрывании АО возможно образование и σ-связи (перекрывание по оси
химической связи), и π-связи (перекрывание симметрично плоскости, на которой лежат
ядра).
5. Молекулярная орбиталь, не участвующая в образовании химической связи, носит
название несвязывающей. Ее энергия равна энергии исходной АО.
16. МО ЛКАО. Основные принципы
6.На одной молекулярной орбитали (как, впрочем, и атомной)
возможно нахождение не более двух электронов.
7. Электроны последовательно заполняют молекулярные орбитали с
наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей
происходит последовательно по одному электрону на каждую из них,
так, чтобы спин был максимальным (по правилу Хунда).
9. При образовании МО при перекрывании двух неэквивалентных АО
связывающая МО содержит больший вклад АО с наиболее низкой
энергией, а разрыхляющая орбиталь – вклад АО с более высокой
энергией.
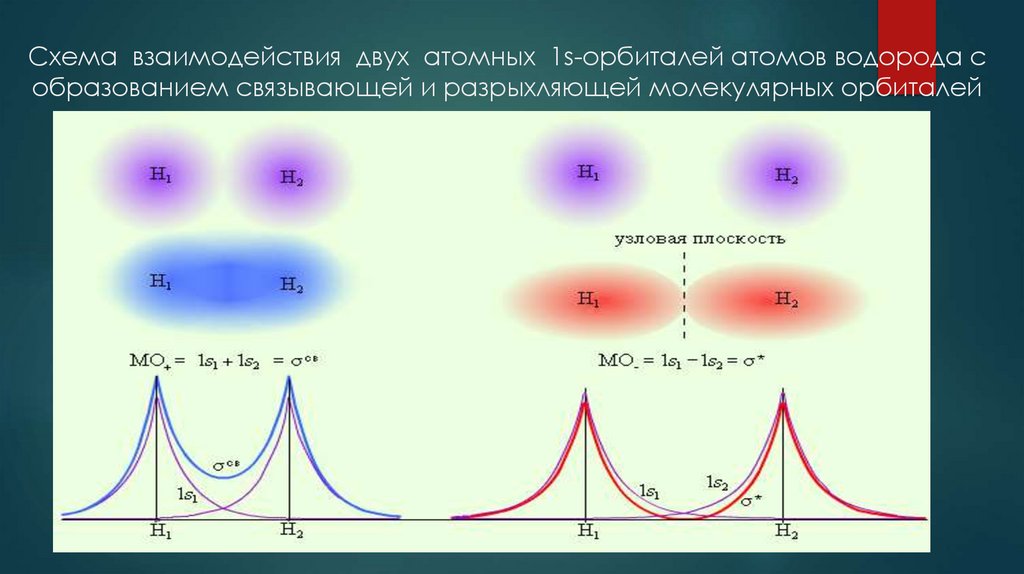
17. Взаимодействие 1s – орбиталей двух атомов водорода с образованием разрых-ляющей (сверху) и связывающей (в сере-дине)
Взаимодействие 1s – орбиталей двухатомов водорода с образованием разрыхляющей (сверху) и связывающей (в середине)
молекулярных
орбиталей.
В первом случае электронные волны первого и второго атомов не совпадают по
фазе – в результате они взаимно уничтожаются, в межъядерном пространстве происходит их интерференционное ослабление
и связь не образуется. Во втором случае
фазы совпадают, волны усиливают друг
друга, их амплитуды складываются и образуется химическая связь. При этом происходит еще и дополнительное «перетекание» электронной плотности из области
разрыхления в область связывания – в зону, к
которой притягиваются ядра. Существует и
взаимное отталкивание электронов, что
мешает образованию связи, но этот вклад
меньше
интерференции
электронных
волн и взаимодействия электронов с
ядрами.
18. Схема взаимодействия двух атомных 1s-орбиталей атомов водорода с образованием связывающей и разрыхляющей молекулярных орбиталей
19. Энергетические диаграммы молекулы водорода и иона гелия
Правила заполнения молекулярных орбиталий такие же, каки атомных орбиталей: - сначала заполняются орбитали с
меньшей энергией. потом с большей;
- соблюдается принцип запрета Паули;
- соблюдается правило Хунда.
σ – связь - симметрична относительно линии, проходя-
щей через ядра атомов;
π – связь – симметрична относительно плоскости.
Связывающие орбитали имеют энергию ниже энергии исходных атомных орбиталей (при их заполнении электронами энергия выделяется); разрыхляющие орбитали имеют энергию выше исходных АО (их заполнение требует затрат энергии).
Порядок связи – количество электронов на связывающих
орбиталях, минус количество электронов на разрыхляющих орбиталях, деленное на количество ядер.
20. Энергетические диаграммы молекул азота и кислорода
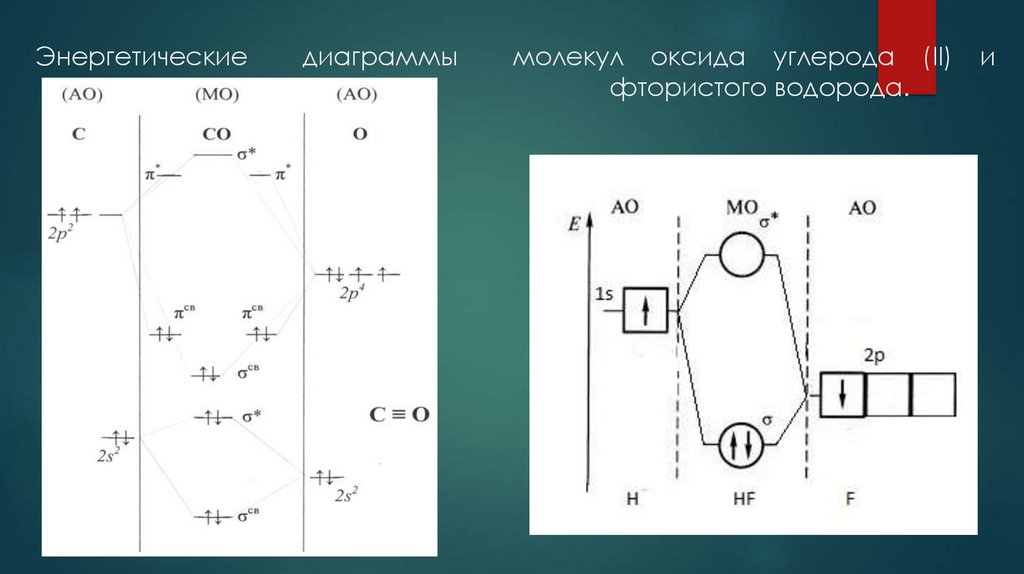
21. Энергетические диаграммы молекул оксида углерода (II) и фтористого водорода.
Энергетическиедиаграммы
молекул оксида углерода (II)
фтористого водорода.
и














 Химия
Химия








