Похожие презентации:
Азотная кислота
1.
- Это вещество было описано арабским химиком в VIIIвеке Джабиром ибн Хайяном (Гебер) в его труде
«Ямщик мудрости», а с ХV века это вещество
добывалось для производственных целей.
- Благодаря этому веществу русский учёный В.Ф.
Петрушевский в 1866 году впервые получил динамит.
- Это вещество – прародитель большинства взрывчатых
веществ (например, тротила, или тола).
- Это вещество является компонентом ракетного
топлива, его использовали для двигателя первого в
мире советского реактивного самолёта БИ – 1.
- Это вещество в смеси с соляной кислотой растворяет
платину и золото, признанное «царём» металлов. Сама
смесь, состоящая из 1-ого объёма этого вещества и 3-ёх
объёмов соляной кислоты, называется «царской
водкой».
2. НЕМНОГО ИСТОРИИ
Монах-алхимик Бонавентура в 1270 году в поискахуниверсального растворителя «алкагеста» решил нагреть
смесь железного купороса с селитрой. Сосуд, в котором
была смесь, вскоре наполнился красно-бурым «дымом».
Монах в изумлении застыл, затем убрал огонь и увидел,
как в колбу-приемник стала капать желтоватая жидкость.
Она действовала на все металлы, даже на серебро и ртуть.
Алхимики думали, что сидящий в жидкости рыжий дым
является демоном, управляющим одной из стихий
природы – водой. Поэтому желтоватую жидкость
называли «крепкой водой» или «крепкой водкой». Это
название сохранилось до времен М. В. Ломоносова. Как
сейчас называют это вещество?
3.
2 FeSO4 · 7Н2О + 4 КNO3 = Fe2О3 +2 К2SO4 + 2НNO3 +13Н2О +2NO2
4.
5. HNO3 – азотная кислота
Физические свойства1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость с резким запахом, «дымит» на
воздухе, Т кип. = 86
3. Хорошо растворима в воде (сильная одноосновная
кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
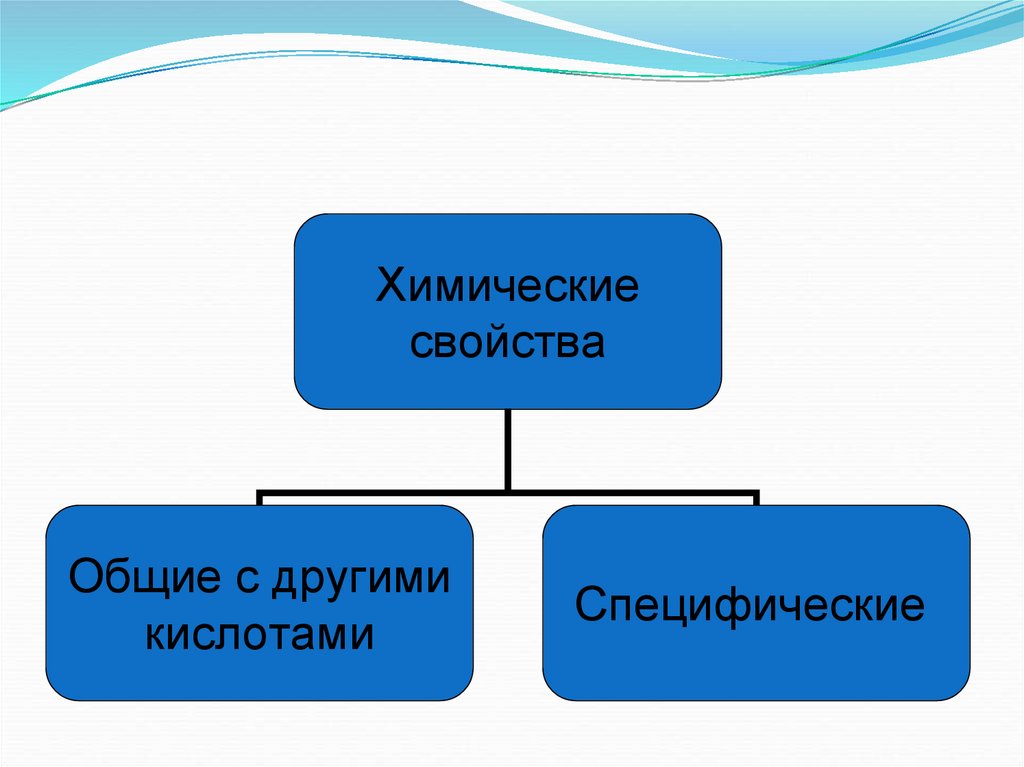
6.
Химическиесвойства
Общие с другими
кислотами
Специфические
7. Общие с другими кислотами
1) Изменяет цвет индикаторов (диссоциация)HNO3
2) Взаимодействие с основными и
амфотерными оксидами
CuO+2HNO3 Cu(NO3 ) 2 + H2O
3) Взаимодействие с основаниями и аммиаком
KOH+HNO3 KNO3 + H2O
NH3+HNO3
4) Взаимодействие с солями
Na2CO3+2HNO3
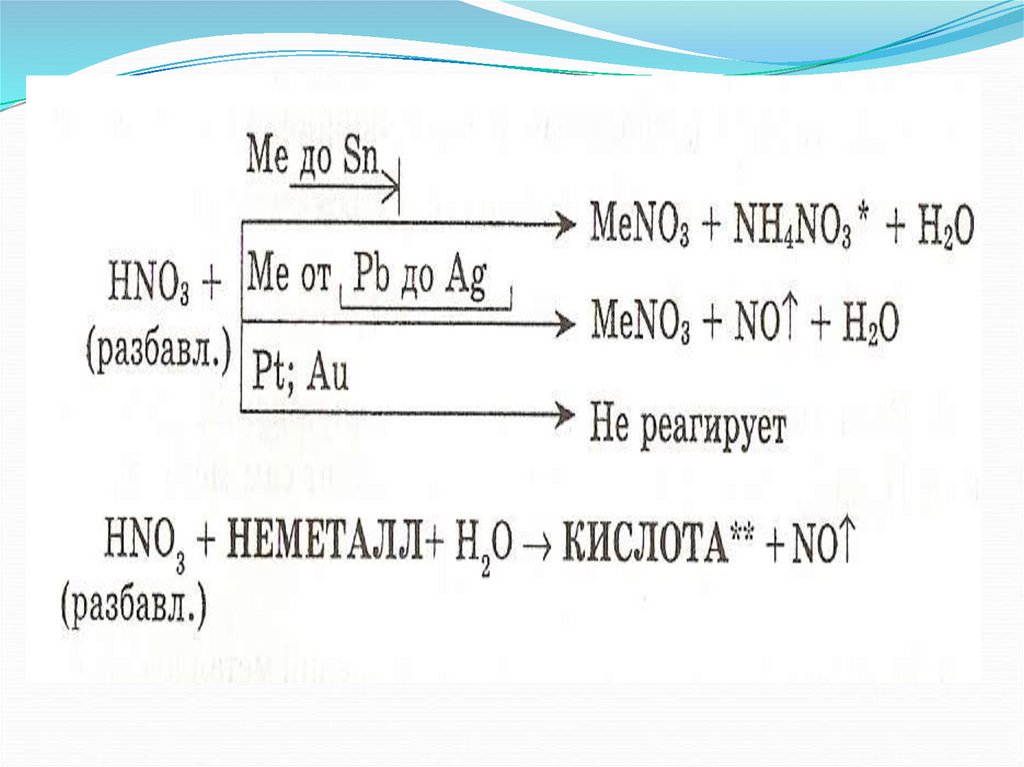
8. Специфические свойства – взаимодействие с металлами
ЗАПОМНИ!При взаимодействии азотной кислоты любой
концентрации с металлами
водород никогда не выделяется.
Продукты зависят
от металла и концентрации кислоты.
9. Разбавленная
10. Концентрированная
11.
Взаимодействие с неметалламипо схеме:
конц.
NO
неMe + HNO3
NO2
разб.
P+5HNO3(к.) H3PO4+5NO2+H2O
3P+5HNO3(р)+2H2O 3H3PO4+5NO
12. Cоли азотной кислоты – селитры разлагаются при температуре: ТЕРМОЛИЗ При термолизе нитратов всегда выделяется кислород кроме
нитрата и нитрита аммония!13. Cоли азотной кислоты – селитры разлагаются при температуре: ТЕРМОЛИЗ
левее_ Mg .Mg Cu
MeNO2 + O2
MeO + NO2 + O2
прав ее_ Cu
Me + NO2 + O2
14.
15.
16. Действие на органические вещества
Белки при взаимодействии с конц.азотнойкислотой разрушаются и приобретают жёлтую
окраску .
Под действием азотной кислоты воспламеняются
бумага, масло, древесина, уголь.
17. Разбавленная азотная кислота реагирует с каждым веществом ряда: А) SiO2, Cu(OH)2, Na2CO3 Б) Na2CO3, Al2O3, Ag В) Na2SO4, SO3,
CuOГ) Na2SO3, P2O5, Cu
18. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет даже
благородные металлы.Смесь HNO3 концентрации 100% и H2SO4
концентрации 96% при их соотношении по
объему 9:1 называют меланжем.
19.
ГЛАУБЕР Иоганн Рудольф (1604-1670),немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году.
Получение
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
NaNO3 + H2SO4(конц) = NaHSO4 + HNO3
?
(Промышленность)
?
Завод азотной кислоты
19
20.
При каталитическом окислении бесцветного,ядовитого газа А с характерным резким запахом
образуется вещество Б.
Вещество Б легко окисляется кислородом воздуха при
обычных условиях и превращается в вещество В
бурого цвета.
При растворении в воде и избытке кислорода
вещество В образует только вещество Г.
Определите вещества А, Б, В, Г.
Составьте цепочку превращений с
участием этих веществ и осуществите ее.
21.
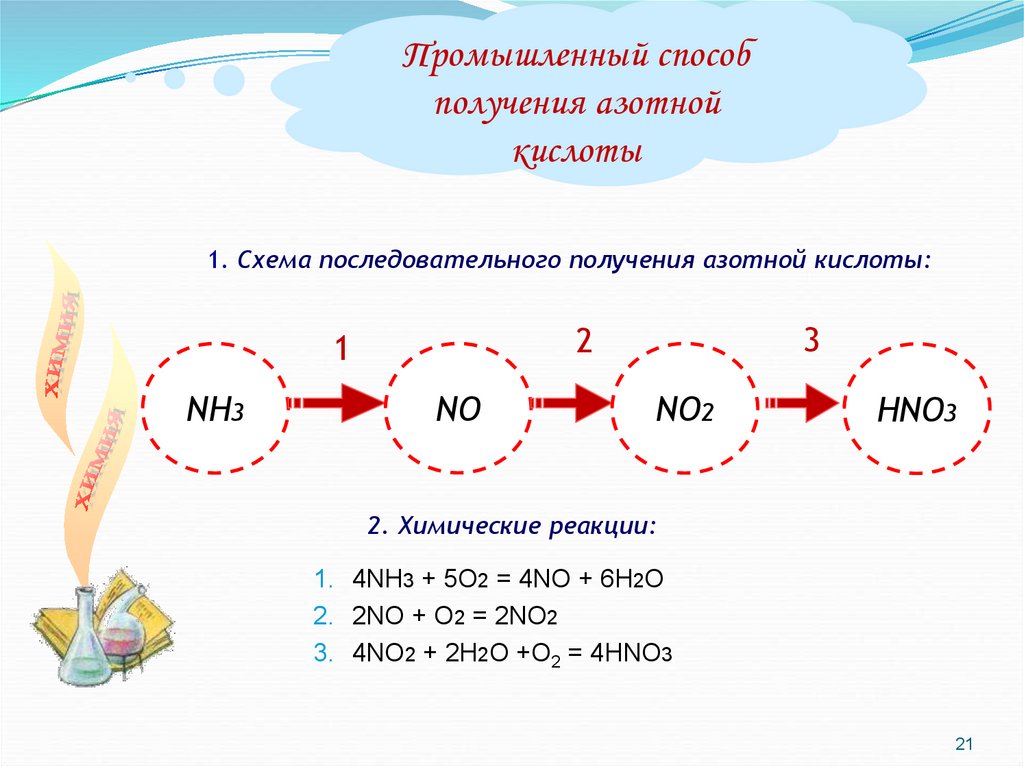
Промышленный способполучения азотной
кислоты
1. Схема последовательного получения азотной кислоты:
NH3
3
2
1
NО
NО2
НNО3
2. Химические реакции:
1. 4NH3 + 5О2 = 4NO + 6Н2О
2. 2NO + O2 = 2NO2
3. 4NO2 + 2H2O +O2 = 4HNO3
21
22. Использование
Производство:NH4NO3
минеральных удобрений
нитратов Na, К, Са и др.
в гидрометаллургии
получение ВВ, H2SO4, H3PO4,
ароматических нитросоединений,
красителей,
ракетного топлива.
травление металлов,
получение полупроводников
23.
ПрименениеМинеральные
удобрения
HNO3
Взрывчатые
вещества
Лекарства
Ракетное
топливо
Пластмассы
23
24.
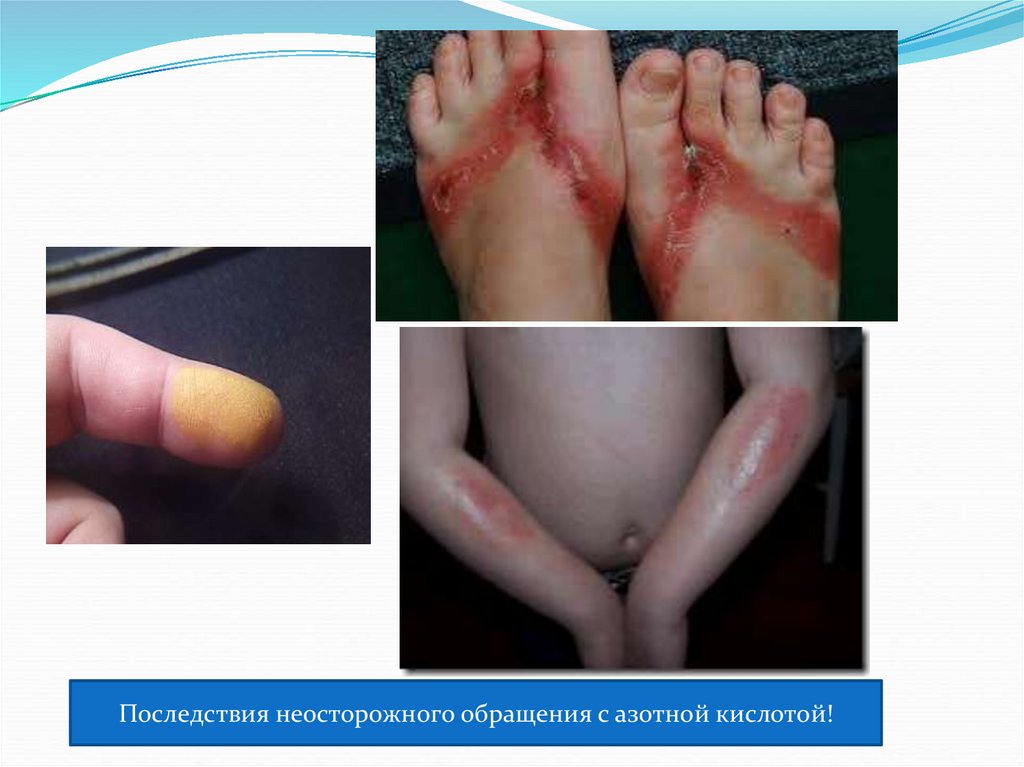
Последствия неосторожного обращения с азотной кислотой!25.
Согласны ли вы со следующимиутверждениями:
1. Азотная кислота является сильным окислителем.
2. Азотная кислота взаимодействует только с растворимыми
основаниями.
3. Азотная кислота разлагается на свету.
4. Соли азотной кислоты называются нитритами.
5. Азотная кислота взаимодействует только с металлами
стоящими в ряду активности до водорода.
6. Азотную кислоту в промышленности получают из аммиака.
7. При взаимодействии азотной кислоты с металлами водород
не выделяется.
8. При ожоге кислотой кожу обрабатывают
1) водой, раствором питьевой соды, вновь водой
2) раствором питьевой соды;
3) водой
4) раствором питьевой соды, затем водой
26.
ПРОВЕРЬ СЕБЯ !1. Да
2. Нет
3. Да
4. Нет
5. Нет
6. Да
7. Да
8. 1
26





















 Химия
Химия








