Похожие презентации:
Свойства элементов III группы Лантаноиды и актиноиды
1.
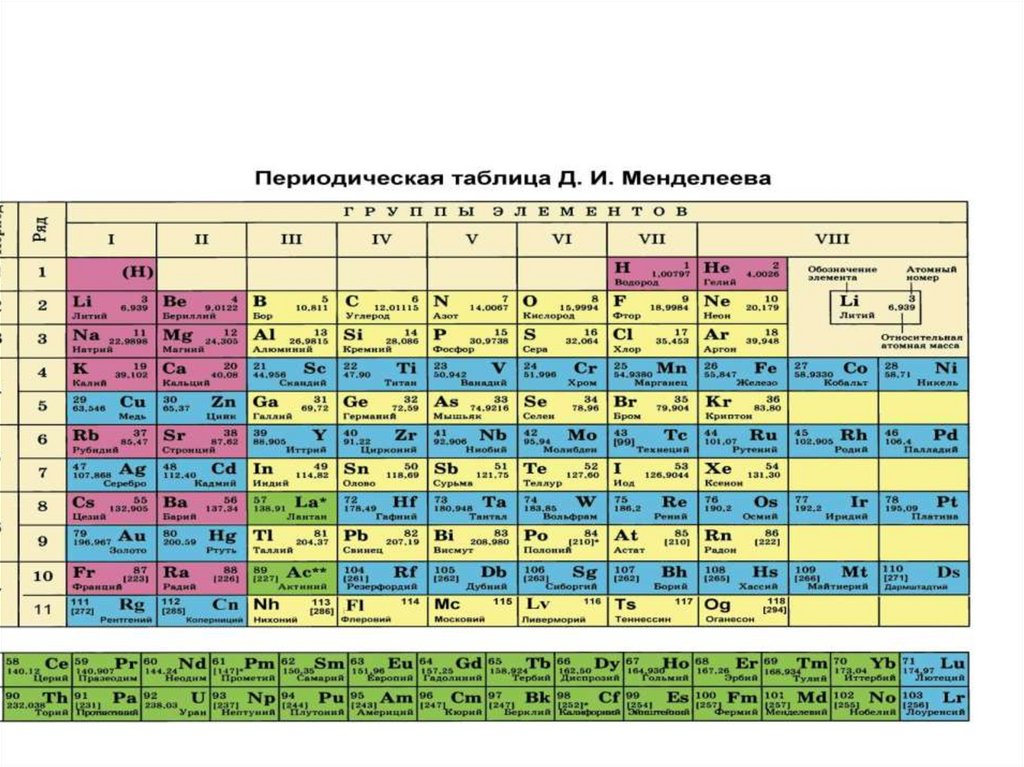
Свойства элементов III группыЛантаноиды и актиноиды
2.
3.
4.
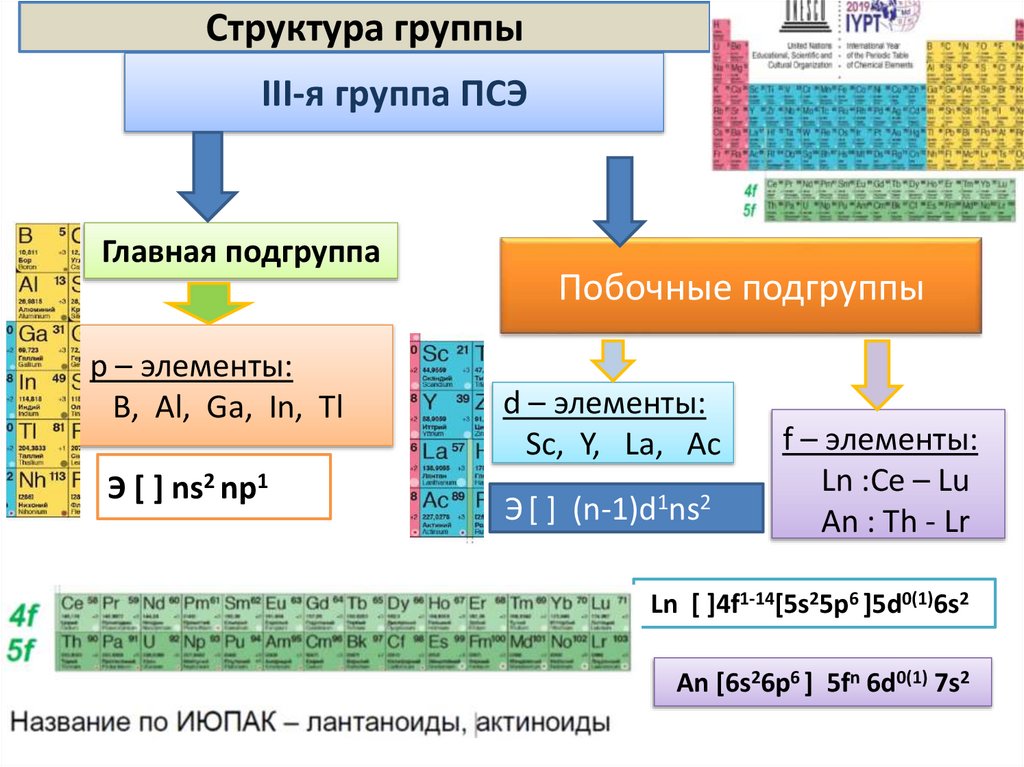
Структура группыIII-я группа ПСЭ
Главная подгруппа
p – элементы:
B, Al, Ga, In, Tl
Э [ ] ns2 np1
Побочные подгруппы
d – элементы:
Sc, Y, La, Ac
Э [ ] (n-1)d1ns2
f – элементы:
Ln :Ce – Lu
An : Th - Lr
Ln [ ]4f1-14[5s25p6 ]5d0(1)6s2
An [6s26p6 ] 5fn 6d0(1) 7s2
5.
Свойства элементов III группыОбщие свойства:
Все элементы имеют общую
валентность III и общий состав
химических соединений.
• Элементы характеризуются
металлическими свойствами, за
исключением бора.
Для оксидов и гидроксидов
наиболее характерны основные
свойства;
у Al, Ga, In, Sc проявляется
амфотерность.
• Имеют подобные растворимые и
нерастворимые в воде
соединения:
• Растворимы: ЭCl3 , Э2(SO4)3 Э(NO3)3
• Нерастворимы: Э(OH)3 , ЭF3 ,
ЭPO4 , Э2(CO3)3 , Э2(C2O4) 3
Различия в свойствах:
• Элементы главной подгруппы
имеют иное электронное
строение Э [ ] ns2 np1
p-элементы (менее активные
металлы).
• d- и f- элементы –имеют на
внешнем уровне ns- два
электрона : Э [ ] (n-1)d1ns2
поэтому являются типичными
металлами
• Различия в свойствах элементов
побочных подгрупп
определяется электронным
строением предшествующих
электронных слоев.
6.
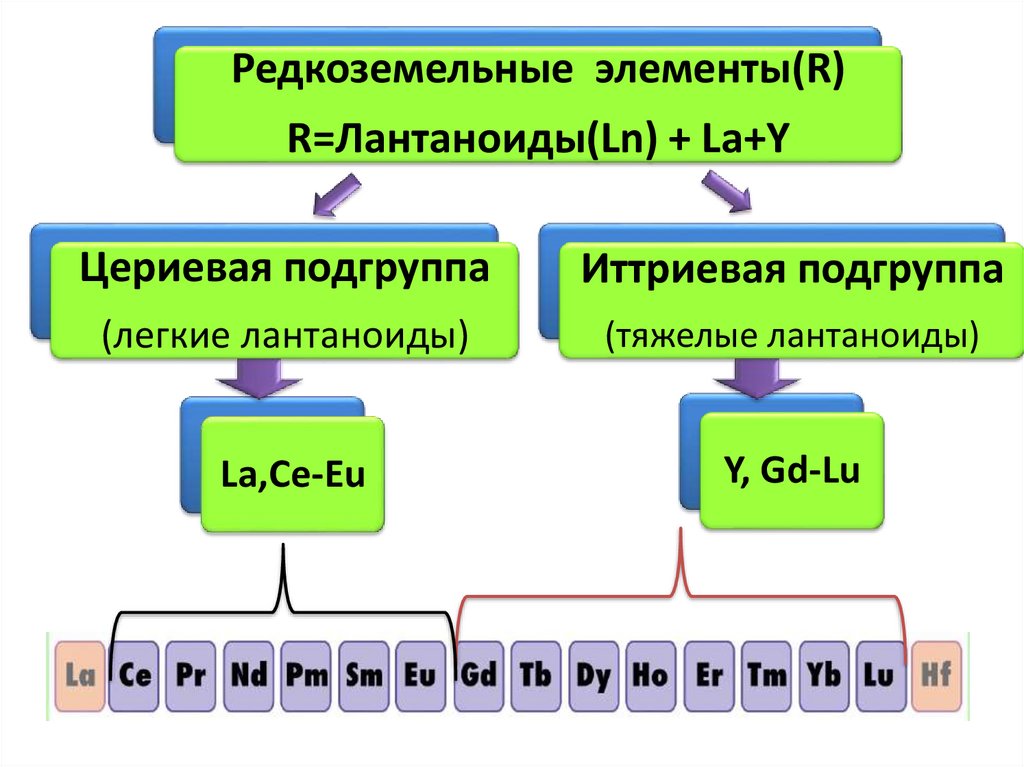
Редкоземельные элементы(R)R=Лантаноиды(Ln) + La+Y
Цериевая подгруппа
Иттриевая подгруппа
(легкие лантаноиды)
(тяжелые лантаноиды)
La,Се-Eu
Y, Gd-Lu
7.
Получение малорастворимых соединений РЗЭ(III)Нерастворимы в воде гидроксиды РЗЭ(OН)3 ,
фосфаты РЗЭ PO4 , оксалаты РЗЭ 2(C2O4)3 ,
карбонаты РЗЭ2(CO3)3 , фториды РЗЭ F3
РЗЭ2(SO4)3 +3Na2CO3 РЗЭ2(CO3)3 +3Na2 SO4
2 РЗЭ(NO3)3+3(NH4)C2O4 РЗЭ 2(C2O4)3 (бел)+6NH4NO3
РЗЭ(NO3)3+Na3PO4 РЗЭ PO4 (бел)+3NaNO3
РЗЭ(NO3)3+3NaF РЗЭ F3 (бел)+3NaNO3
РЗЭ(NO3)3+3NaOH t РЗЭ(OН)3 +3NaNO3
8.
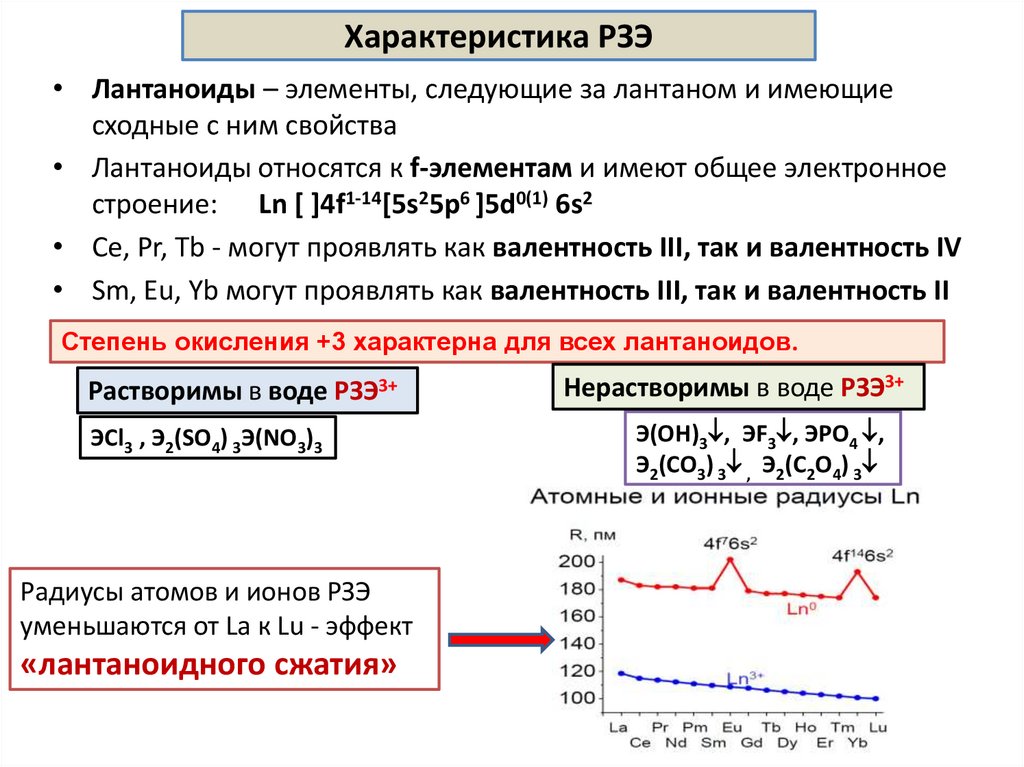
Характеристика РЗЭ• Лантаноиды – элементы, следующие за лантаном и имеющие
сходные с ним свойства
• Лантаноиды относятся к f-элементам и имеют общее электронное
строение: Ln [ ]4f1-14[5s25p6 ]5d0(1) 6s2
• Ce, Pr, Tb - могут проявлять как валентность III, так и валентность IV
• Sm, Eu, Yb могут проявлять как валентность III, так и валентность II
Степень окисления +3 характерна для всех лантаноидов.
Растворимы в воде РЗЭ3+
ЭCl3 , Э2(SO4) 3Э(NO3)3
Радиусы атомов и ионов РЗЭ
уменьшаются от La к Lu - эффект
«лантаноидного сжатия»
Нерастворимы в воде РЗЭ3+
Э(OH)3 , ЭF3 , ЭPO4 ,
Э2(CO3) 3 , Э2(C2O4) 3
9.
1.На воздухе легкие Ln окисляются при комнатной температуре,Остальные - при t = 180-200 °С:
4Ln0+3O20 t 2Ln2O3
Ln0-3е Ln+3
O02+4е 2O-2
4
3
2. Се и богатые Се сплавы пирофорны.
Се0+О20 СеО2-2
Се0- 4е Се+4
O02+ 4е 2O-2
Пирофо́рность — способность твёрдого
материала в мелкораздробленном
состоянии к самовоспламенению на воздухе
при отсутствии нагрева.
3. С галогенами взаимодействуют при невысокой температуре
2РЗЭ+3Cl2 t 2РЗЭCl3
РЗЭ0-3е РЗЭ+3
Cl02+2е 2Cl-
2
3
интенсивность взаимодействия
уменьшается от фтора к йоду.
10.
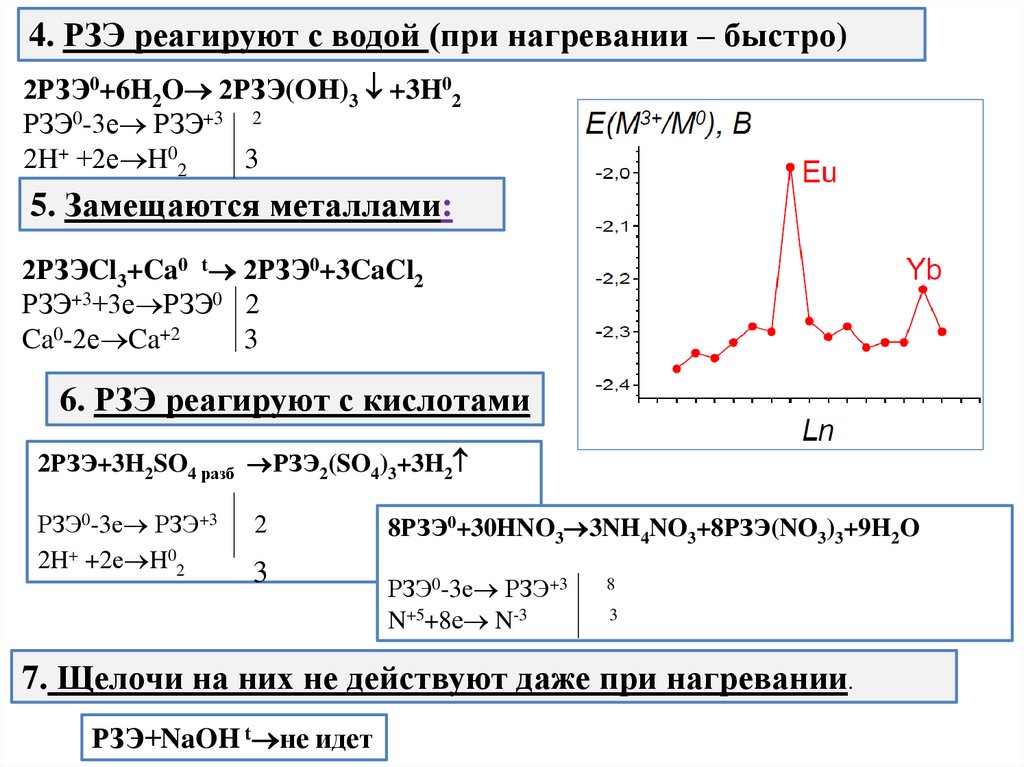
4. РЗЭ реагируют с водой (при нагревании – быстро)2РЗЭ0+6H2O 2РЗЭ(OH)3 +3H02
РЗЭ0-3е РЗЭ+3 2
2H+ +2е H02
3
5. Замещаются металлами:
2РЗЭCl3+Ca0 t 2РЗЭ0+3CaCl2
РЗЭ+3+3е РЗЭ0 2
Ca0-2е Ca+2
3
6. РЗЭ реагируют с кислотами
2РЗЭ+3H2SO4 разб РЗЭ2(SO4)3+3H2
РЗЭ0-3е РЗЭ+3
2H+ +2е H02
2
8РЗЭ0+30HNO3 3NH4NO3+8РЗЭ(NO3)3+9H2O
3
РЗЭ0-3е РЗЭ+3
N+5+8е N-3
8
3
7. Щелочи на них не действуют даже при нагревании.
РЗЭ+NaOH t не идет
11.
ГидролизПри стандартных условиях идет в основном по первой ступени.
Из-за меньшей растворимости оксосолей могут идти две
ступени
РЗЭCl3 +H2O
РЗЭCl3 + 2H2O
РЗЭ(OH) 2Cl
РЗЭOHCl2 + HCl
РЗЭ(OH) 2Cl + 2HCl
РЗЭOCl + H2O
Оксохлорид РЗЭ
РЗЭH3 +3H2O РЗЭ(OH)3 + 3H2 ( !!! при нагревании, полный)
12.
ОСОБЫЕ СВОЙСТВА НЕКОТОРЫХЛАНТАНОИДОВ
13.
Cвойства церияЭлектронная конфигурация атома церия :
2
2
6
0 2 =
1
2
6
1 2 (+3 ) Се** [ ] 4f 0[5s25p6]5d26s2 (+4 )
58Се [ ] 4f [5s 5p ]5d 6s
58Се [ ] 4f [5s 5p ]5d 6s
58
Церий активный металл.(ЕСе+3 / Се0= −2,34 В)
Церий взаимодействует при нагревании с большинством неметаллов (O2, H2, N2, Cl2, C, S,
P и т.д.) с образованием соответствующих бинарных соединений.
2Ce + N2
2CeN
Бурно взаимодействует с кислородом
Ce + O2 → CeO2
Реагирует с водой и разбавленными кислотами с выделением Н2
Се +3Н2О Ce (OН)3 +3H2
2Ce+3H2SO4 Ce2(SO4)3 + 3H2
Карбонаты церия горят на воздухе:
Ce+32(CO3)3 + O02 t Ce+4O2 + 6CO2
Ce+32(C2O4)3 + O02 t 2Ce+4O2 + 6CO2
Се+3-е Се+4 4 Eвос=1.61 В;
O02 +4е 2O-2 1 Еок=1.23 В;
E = Eок-Eвос =-0.38В
14.
Свойства соединений церия Ce3+1. Кислотно-основные свойства Ce(OH)3
Гидроксид в водных растворах проявляет основной характер.
Ce(NO3)3+3NaOH Ce(OH)3 (бел.)+3NaNO3;
2Ce(OH)3 +3H2SO4 Ce2(SO4)3 + 3H2O
Ce(OH)3 +NaOH ;
2. Получение малорастворимых солей церия Ce3+
2Ce(NO3)3+3(NH4)C2O4 Ce2(C2O4)3 (бел)+6NH4NO3
2Ce(NO3)3+3Na2CO3 Ce2(CO3)3 (бел)+6NaNO3
Ce(NO3)3+Na3PO4 CePO4 (бел)+3NaNO3
Ce(NO3)3+3NaF CeF3 (бел)+3NaNO3
15.
Окислтельно-восстановительные свойства Ce3+Ce3+ + окислитель Ce4+
ЕСе+4 / Се+3= 1.61В
(pН > 7)
3Ce(OH)3 + KMnO4 + 2H2O 3Ce(OH)4 + MnO2 + KOH
Се+3-е Се+4
3
Mn+7+3е Mn+4 1
2Ce (NO3)3+NaBiO3 +6HNO3
2Ce(NO3)4+Bi(NO3)3+NaNO3+3H2O
(pH<7)
Bi+5+2e Bi+3
Ce+3-e Ce+4
1
Eок=1.86 В
2 Eвос=1.61В
E = Eок-Eвос = 0,25В.
16.
Особые свойства Ce4+1. Кислотно - основные свойства:
Слабые амфотерные свойства Ce(OH)4
проявляет только при высоких температурах( при спекании с щелочью):
Ce(SO4)2(жёлт.)+4NaOH Ce(OH)4(бел.) +2Na2SO4
•Ce(OH)4 +NaOH водный р-р
•Ce(OH)4 +
t Na CeO + 3H O
2NaOН(тв)
2
3
2
•Ce(OH)4 +2H2SO4 Ce(SO4)2 + 4H2O
2. Ce4+ образует комплексные соединения:
Се(С2О4)2 +2(NH4)2С2O4 (NH4)4[Се(С2О4)4]
(кч=8)
17.
Окислительно-восстановительные свойстваCe(IV)2Ce(SO4)2+H2O2 Ce2(SO4)3+O2 +H2SO4
Ce+4+e Ce+3 2 окислитель Еок=1.61 В;
Ер=Еок-Евост=0. 38 В.
-1
0
2O -2e O2 1 восстановитель Евост=1.23 В;
Ионы Ce4+ сильные окислители в кислых средах
2Ce(SO4)2+2KI I2+K2SO4+Ce2(SO4)3 (pH<7)
Ce+4+e Ce+3 2 окислитель
Eок=1.61 В;
2I--2e I2
1 восстановитель Eвост= 0.54 В;
Ер=Еок-Евост=1.07 В;
2Ce+4(OH)4+8HCl-1 2Ce+3Cl3+Cl2 +8H2O
Ce+4+e Ce+3 2 ок-ль Еок=1.61 В;
2Cl-1-2e Cl20 1 в-ль Евост=1.36 В;
Ер=Еок-Евост= 0,25 В;
Ce+4Cl4
Ce+4Br4
Ce+4I4
18.
Комплексообразование Ce4+Способность Ce4+ образовывать растворимые комплексные соединения в
отличие РЗЭ3+ используют для отделения Ce от других РЗЭ
КЧ=8, лиганды: СО32-, С2О42-, SО42-
Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4] растворимая комплексная соль
РЗЭ2(C2O4)3 + (NH4)C2O4 не идёт.
Ce2(C2O4)3 + (NH4)C2O4 не идёт.
Предварительно для разделения Ce3+ окисляют до Ce4+
2H2O+CeCl3+KMnO4+8NaOH Ce(OH)4 +MnO2 +KCl+8NaCl
Гидролиз соединений Се(IV)
•Ce(NO3)4+2H2O
Ce(OH)2(NO3)2 +2HNO3
•Ce(NO3)4+ H2O
CeO(NO3)2 +2HNO3
2CeC + 4H2O 2Ce(OH)4 + CH4 ↑( при нагревании)
2CeC2 + 4H2O 2Ce(OH)4 + C2H4 ↑( при нагревании)
19.
Качественные реакции на ионы церия•Ce(NO3)3+3NH4OH Ce(OH)3 (бел.)+3NH4NO3
2Ce(OH)3+H2O2 2Ce(OH)4 (желт.) (pH > 7);
Се+3-е Се+4
восстановитель Eвос=1.61 В;
O2-2 + 2e 2O-2 окислитель Еок=1.77 В;
Ер=Еок-Евост=0.16 В.
•Ce(OH)4 +H2O2 Ce(OH)3(OOH) (оранж.)+H2O
(pH > 7)
20.
3.Отделение Ce от других РЗЭВ основе — способность церия проявлять степень окисления +4.
РЗЭ 2(C2O4)3 + (NH4)C2O4 не идёт
Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4](р-р)
Ce(OH)3 + 3HCl CeCl3 + 3H2O.
РЗЭ(OH)3 + 3HCl РЗЭCl3 + 3H2O (pH = 6,5)
2Ce+4(OH)4+8HCl-1 2Ce+3Cl3+Cl2 +8H2O
Ce+4+e Ce+3 2 ок-ль Еок=1.61 В;
2Cl-1-2e Cl20 1 в-ль Евост=1.36 В;
(pH = 1,5)
21.
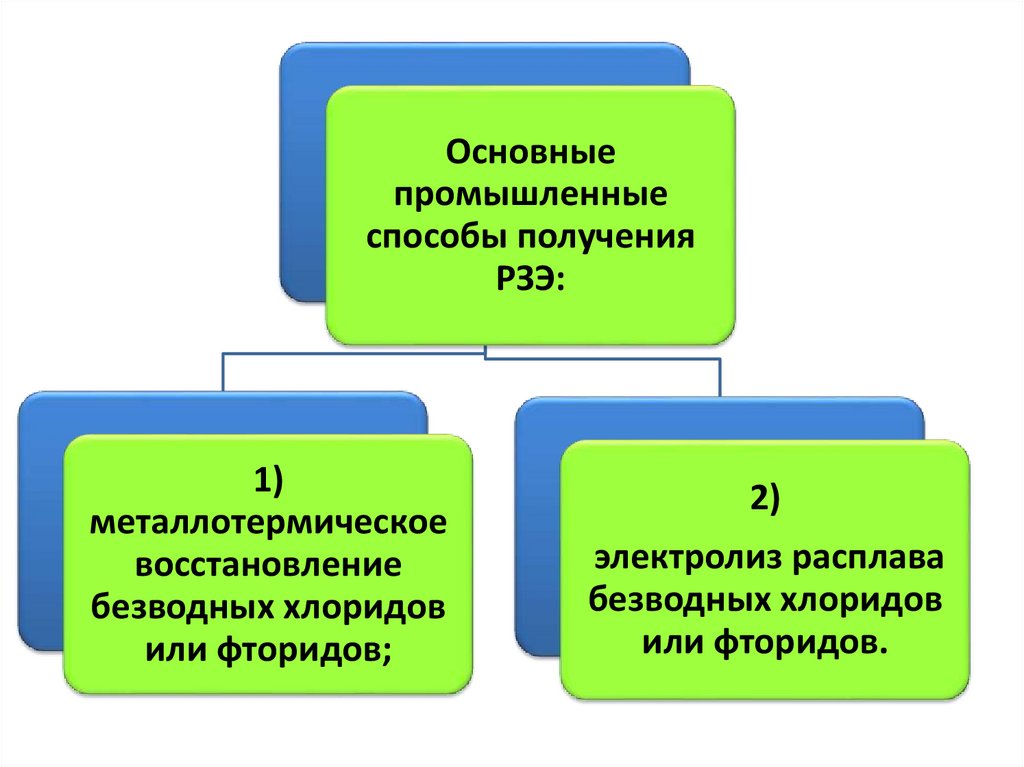
Основныепромышленные
способы получения
РЗЭ:
1)
металлотермическое
восстановление
безводных хлоридов
или фторидов;
2)
электролиз расплава
безводных хлоридов
или фторидов.
22.
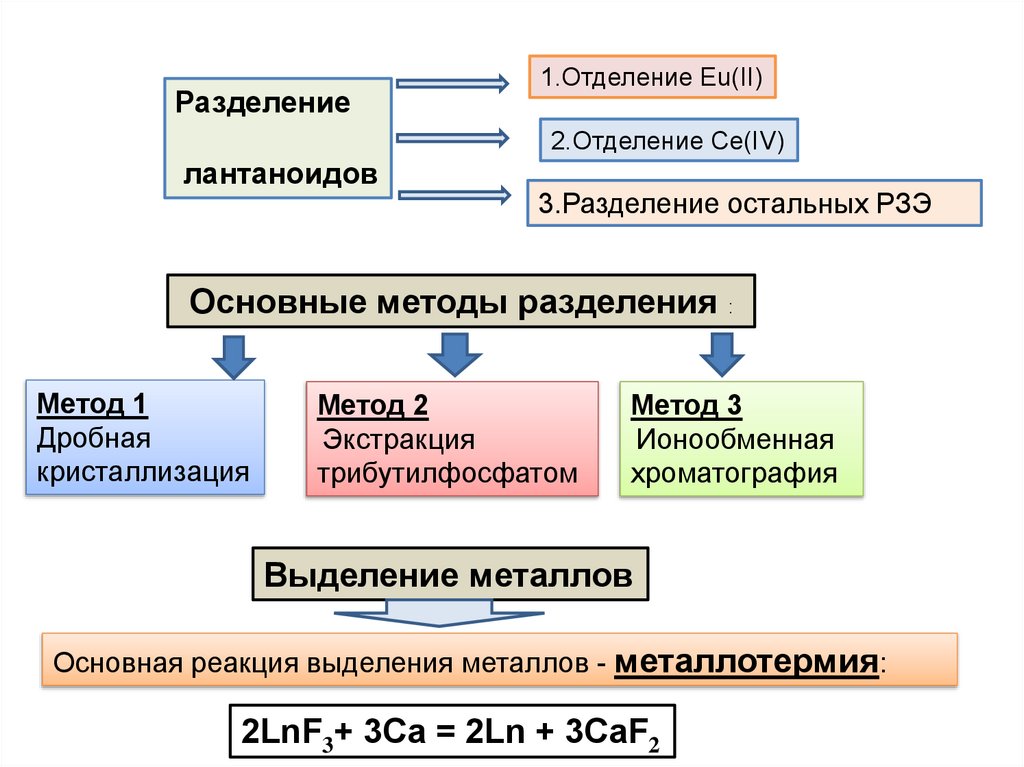
Разделение1.Отделение Eu(II)
2.Отделение Ce(IV)
лантаноидов
3.Разделение остальных РЗЭ
Основные методы разделения :
Метод 1
Дробная
кристаллизация
Метод 2
Экстракция
трибутилфосфатом
Метод 3
Ионообменная
хроматография
Выделение металлов
Основная реакция выделения металлов - металлотермия:
2LnF3+ 3Ca = 2Ln + 3CaF2
23.
63Eu1. Особенность электронного строения
Электронная конфигурация атома европия характеризуется наличием семи
электронов на 4f-подуровне (устойчивая конфигурация 4f7):
63Eu [
] 4f7[5s25p6] 5 d06s2 +2
63Eu [
] 4f6[5s25p6] 5d16s2 +3
Соединения со степенью окисления +2 и +3
Соединения европия со степенью окисления +2 по свойствам похожи на
соединения элементов II группы (кальция, бария)
2.СВОЙСТВА МЕТАЛЛИЧЕСКОГО ЕВРОПИЯ
Многие характеристики европия (радиус атома наибольший, наименьшая
плотность и т.п.) заметно отличаются от подобных характеристик остальных
лантаноидов.
Металлический европий- активный металл Е = -2,4 В,
он наименее стоек к действию окружающей среды.
4 Eu + 3 O2 → 2 Eu2O3
Еu + 2Н2О → Еu(ОН)2 ↓ + Н2↑
2Еu + 6Н2О → 2Еu(ОН)3 ↓ + 3Н2↑
Eu + 2С → EuС2
24.
Еu+
Н2О
→ Еu(ОН)2
+
Н2 ↑
Двухзарядные ионы европия, иттербия и самария могут быть получены
в водных растворах восстановлением, причем ионы Еu2+ довольно
устойчивы и по своим свойствам близки к ионам щелочноземельных
металлов.
Из соединений двухвалентного европия известен темно-красный оксид
ЕuО, который образуется при нагревании смеси Еu2О3 с графитом до
1300 °с.
2Еu2О3 + С → 4ЕuО + СО2↑
Этот оксид относительно устойчив на воздухе, но в присутствии воды
медленно реагирует с ней с выделением водорода:
2ЕuО + 4Н2О → 2Еu(ОН)3 + Н2↑
Гидроксид Еu(ОН)2 малорастворимое основание,
в присутствии воды медленно окисляется растворенным кислородом
до Еu(ОН)3
4Еu(ОН)2 + О2 + 2Н2О → 4Еu(ОН)3
25.
1.Отделение Eu от других РЗЭсвязано со способностью образовывать труднорастворимый сульфат EuSO4
2EuCl3+Zn+2H2SO4 2EuSO4 +ZnCl2+4HCl
Eu3+ +e Eu2+ 2 окислитель
Еок= -0.55 В;
Zn0-2e Zn2+ 1 восстановитель Евост.= -0.762 В;
Ер=Еок-Евост=0.212 В;
Eu2(SO4)3+Zn 2EuSO4 +Zn SO4
РЗЭ2(SO4)3+Zn
EuC2+ 2H2O Eu(OH)2 +C2H2(ацетилен)
2.Отделение Ce от других РЗЭ
В основе — способность церия проявлять степень окисления +4.
CeCl3+KMnO4+8NaOH Ce(OH)4 + MnO2 + KCl + 8NaCl + 2H2O
Се+3-е Се+4
3
Mn+7+3е Mn+4 1
РЗЭ 2(C2O4)3 + (NH4)C2O4 не идёт
Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4](р-р)
26.
Особые свойства скандияСкандий амфотерен:
8Sc0+30HNO3 3NH4NO3+8Sc (NO3)3+9H2O
Sc0-3е Sc+3 8
N+5+8е N-3
3
2Sc0+ 2NaOH +2H2O 2NaScO2+3H2
Sc0-3е Sc+3 2
2Н++2е H2 3
Отделение скандия от РЗЭ
Sc+3+3NH4F ScF3 +3NH4+
РЗЭ+3+3NH4F РЗЭ F3 +3NH4+
ScF3+3NH4F (NH4)3[ScF6]
РЗЭ F3 + NH4F
27.
28.
Особенности электронного строения актиноидовАктиноиды: элементы от 90 Th 103Lr у которых идет заполнение
внутреннего 5f- подуровня
Аn[…6s26p6 ] 5f k 6d m 7s2 m равно 0 или 1
k изменяется от 0 до 14,
Различие в энергиях 5f- и 6d-орбиталей An меньше, чем 4f- и 5d-орбиталей Ln
Близость 5f и 6dорбиталей
обеспечивает легкость перехода
электронов между ними
Наиболее долгоживущими являются изотопы Th и U
. Все актиноиды претерпевают радиоактивный распад
Периоды полураспада Th и U соответственно: 1,4∙1010 и 4∙109 лет
. В земной коре также встречаются очень небольшие количества изотопов Pa, Pu,
Np, образующиеся в результате ядерных реакций. Другие элементы в природе не
обнаружены. Их получают облучением урана и некоторых более тяжелых
элементов нейтронами в ядерных реакциях.
29.
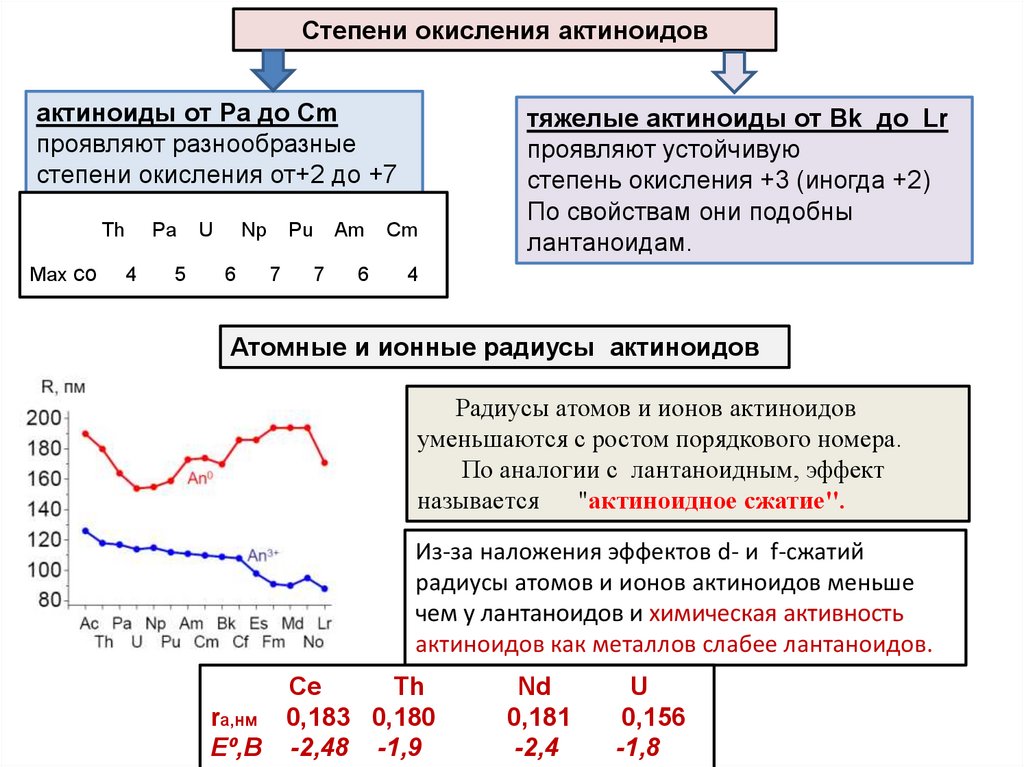
Степени окисления актиноидовактиноиды от Pa до Cm
проявляют разнообразные
степени окисления от+2 до +7
Th
Max со
Pa
4
5
U
Np
6
Pu
7
7
Am
Cm
6
4
тяжелые актиноиды от Bk до Lr
проявляют устойчивую
степень окисления +3 (иногда +2)
По свойствам они подобны
лантаноидам.
Атомные и ионные радиусы актиноидов
Радиусы атомов и ионов актиноидов
уменьшаются с ростом порядкового номера.
По аналогии с лантаноидным, эффект
называется "актиноидное сжатие".
Из-за наложения эффектов d- и f-сжатий
радиусы атомов и ионов актиноидов меньше
чем у лантаноидов и химическая активность
актиноидов как металлов слабее лантаноидов.
Ce
Th
ra,нм 0,183 0,180
Е⁰,B -2,48 -1,9
Nd
0,181
-2,4
U
0,156
-1,8
30.
Химические свойства актиноидов• 4f-орбитали не принимают участия в ковалентной связи,
5f-орбитали –принимают участие в ковалентной связи
• Легкие актиноиды похожи на d-металлы с тем же числом валентных
электронов: образуют устойчивые комплексы и проявляют высокие со.
• Обладают большой склонностью к комплексообразованию, особенно, с
кислородсодержащими лигандами ;
• В ряду легких актиноидов (от актиния до америция) свойства элементов
сильно различаются
• В ряду тяжелых актиноидов (от кюрия до лоуренсия) свойства
элементов в значительной степени аналогичны и похожи на свойства
лантаноидов;
31.
1. Обладают большой склонностью к комплексообразованию,особенно с кислородсодержащими лигандами
2. В водных растворах образуют комплексы, в которых часто
проявляют координационное число, равное 8,
Na4[U(C2O4)4] и Na4[Th(CO3)4].
Склонность к гидролизу для каждого типа ионов M3+, M4+,
MO2+ и MO22+ повышается с ростом атомного номера
элемента;
3. Для катионов склонность к комплексообразованию снижается в ряду
M4+ > MO22+ ≥ M3+ > MO2+,
а при замене лиганда - в рядах :
фторид > нитрат > хлорид > перхлорат и карбонат > оксалат > сульфат;
32.
Свойства тория• Электронная формула 90Th
5f 0 6d 2 7s2
• Природный торий содержит практически один изотоп 232 Th,
период полураспада равен 1,4·1010 лет
• Основная степень окисления +4
Торий — активный металл, по реакционной способности близкий к
лантаноидам, но отличается от них степенью окисления
1. Торий - ативный восстановитель (Е о = -1,9 В)
Торий вытесняет водород из кипящей воды
Th + 4H2O → Th(OH)4 ↓ + 2H2↑
2. медленно растворяется в разбавленных
фтористоводородной, азотной или серной кислотах
Th +2H2SO4(разб) → Th (SO4)2 + 2H2↑
Th + 4HF(разб) → ThF4 ↓ + 2H2↑
33.
При нагревании торий реагирует со многиминеметаллами:
O2 , Н2, С, Cl2, Br2, S, N2
Торий взаимодействует с кислородом (порошок пирофорен)
Th + О2 → ThО2
• Торий взаимодействует с азотом при 800 °C с
образованием нитрида тория (t 2500 °С) ,
• 3Th + 2 N2
Th3N4
• Взаимодействия тория с углеродом
• Th + C
ThC
• Th + 2C
ThC2
• карбиды разлагаются водой с образованием
углеводородов.
• ThC + 4H2O
Th(OH)4 ↓ + CH4↑
• ThC2 + 4H2O
Th(OH)4 ↓ + C2H4↑
34.
Соединения тория (IV)к растворимым в воде соединениям тория (IV)относятся:
Th(NO3)4 , ThCl4 и Th (SO4)2
к труднорастворимым в воде соединениям тория (IV)относятся: Th(OН)4
↓, ThF4 ↓ , Th (СO3)2 ↓,Th (С2O4)2 ↓ , Th 3(РO4)4 ↓ThSiO4 , Th3(PO4)4
Th(OH)4 - имеет основной характер
Th (SO4)2 + 4NH4OH → Th (OH)4↓ +2(NH4)2SO4
Th (OH)4↓
ThO2 + 2H2O
Th (OH)4↓ + 4HCl(разб)
ThCl4 + 2H2O
Th (OH)4↓ + CO2 → Th OCO3↓ + H2O
Гидролиз солей
Th(NO3)4 + H2O
ThO(NO3)2 + 2HNO3
Th(NO3)4 + 2Na2 CO3 + H2O
ThOCO3↓ + H2CO3 + 4NaNO3
комплексообразование
В водных растворах Th (IV) образует комплексные соединения с КЧ=6, 8 и реже 10 или 12.
Комплексообразование используют для растворения труднорастворимых
соединений тория (карбонатов, оксалатов).
ThOCO3↓ + 3Na2CO3 + H2O → Na4[Th(CO3)4] + 2NaOH
Th(C2O4)2 ↓ + 2(NH4)2C2O4 → (NH4)4[Th(C2O4)4]
35.
Получение тория• минерал монацит Th3(PO4)4 вскрывают сернокислотным или
щелочным способом
Th3(PO4)4+12NaOH → 3Th(OH)4↓+4Na3PO4
• оксид тория ThO2 подвергают металлотермическому
восстановлению кальцием в атмосфере инертного газа:
ThO2+2Ca
Th + 2CaO
• электролиз расплава галогенида тория
ThCl4 (илиThF4 )→ Th +Cl2
36.
получение чистого тория(иодидное рафинирование)
Th + 2I2
t
1
ThI4↑ t
2
Th + 2I2
Тетраиодид тория ThI4 (tпл. 566 °С, tкип. 837 °С) разлагается
на простые вещества при нагревании выше
900 °С.
Th + 2I2
Th + 2I2
ThI4↑
Th
примесиThO2
ThC Th3N4
ThO2 + I2
ThC
+ I2
Th3N4 + I
2
37.
УРАН И ЕГО СВОЙСТВА38.
Уран• Уран — самый тяжелый из встречающихся в природе
элементов
• Его содержание в земной коре составляет 3·10-4 % по массе
• Он имеет три изотопа: 99,28% природного урана составляет
изотоп 238U, период полураспада которого равен 4,5·109 лет;
• 0,715 % – изотоп 235U с периодом полураспада 7,1·108 лет;
• 0,005 % – изотоп 234U с периодом полураспада 2,47·105 лет.
• Изотоп 233U получен в результате ядерных реакций.
Электронное строение и СО урана
92U [… 6s 26p6] 5f 36d 17s2
Энергии орбиталей 5f-, 6d-, 7s- и 7pпримерно одинаковы.
степени окисления от +3 , +4, +5, +6,
наиболее устойчивыми среди них являются степени окисления +4 и +6
в степени окисления +6 – амфотерные свойства
Природный минерал настуран
39.
Электронное строение и СО урана• 92 U 5f 36d 17s2
• степени окисления от +3 , +4, +5, +6,
• наиболее устойчивыми среди них являются
степени окисления +4 и +6
• в степени окисления +6 – амфотерные
свойства;
• Его температура плавления равна 1132 °C
• Он химически активен и реагирует со
многими элементами периодической
системы.
40.
Свойства урана• Свойства металла: уран активный металл, активный
восстановитель (уступает по активности лантаноидам)
• Взаимодействует со многими неметаллами
• Уран имеет очень высокое сродство к кислороду
• U + O2
UO2 (U O3 U3O8 )
• 2U + N2
2UN
• U + C
UC
• U + 2C
UC2
• UC + 4H2O
U(OH)4 + CH4↑ при нагревании
• UC2 + 4H2O
U(OH)4 + C2H4↑ при нагревании
• U + 3F2
UF6
• U + 3Cl2
UCl6
41.
Взаимодействие U с водой и кислотами42.
Свойства U(IV)U(IV) -аналог Th4+
основные свойстваU (OН)4; UO2 аналогичны свойствам Th (OН)4;
ThO2
• Гидролиз:
U (NO3)4 + 2H2O →
U(OH) 2(NO3)2 + 2HNO3
• Комплексообразование
U(C2O4)2 ↓ + 2(NH4)2C2O4 → (NH4)4[U(C2O4)4]
• Безводный тетрафторид получают из диоксида урана
UO2+4HF → UF4↓+2H2O
• ОВР
• восстановлением гексафторида урана различными
восстановителями, например, водородом
UF6+H2 → UF4↓+2HF
43.
Окислительно-восстановительныу свойства U(IV)U(Ⅲ)
(+в-ль) U(IV) (+ок-ль)
U(VI)
уран (IV)– окислитель
Под действием восстановителей переходит в уран (Ⅲ)
2U(SO4)2 + Zn → U2(SO4)3 + ZnSO4
U+4+e → U+3
Zn0-2e→Zn+2
уран (IV)- восстановитель
E⁰U+6/U+4 = 0,33В
Под действием окислителей переходит в уран (VI)
• U(SO4)2 + 2Ce(SO4)2 + 2H2O → UO2SO4 + Ce2(SO4)3 + 2H2SO4
5U(SO4)2 + 2KMnO4 + 2H2O → 5UO2SO4 + 2MnSO4 + K2SO4 + 2H2SO4
Mn+7+5e = Mn+2 2
U+4-2e = U+6
3
44.
Свойства U(VI)Растворимость – хорошо растворимы соли сильных кислот
(азотной, соляной, серной), комплексные соединения и UO2F2
Гидролиз солей:
UCl6 + 2H2O → UO2Cl2 + 4HCl
Амфотерность:
• при растворении в кислотах образуются соли диоксоурана
(ПР = 10-22 ) UO2(OH)2 + H2SO4 → UO2SO4 + 2H2O
при растворении в концентрированных щелочах образуются
соли – уранаты
• UO2(OH)2 +2NaOH → Na2UO4 ↓ + 2H2O
↓
• или диуранаты
2UO2(OH)2 +2NaOH → Na2U2O7 ↓ + 3H2O
Окислительно-восстановительные свойства U6+ окислитель
UO2SO4 + Zn + 2H2SO4 → U(SO4)2 + ZnSO4 + 2H2O
U+6+2e = U+4
Zn0-2e = Zn+2
45.
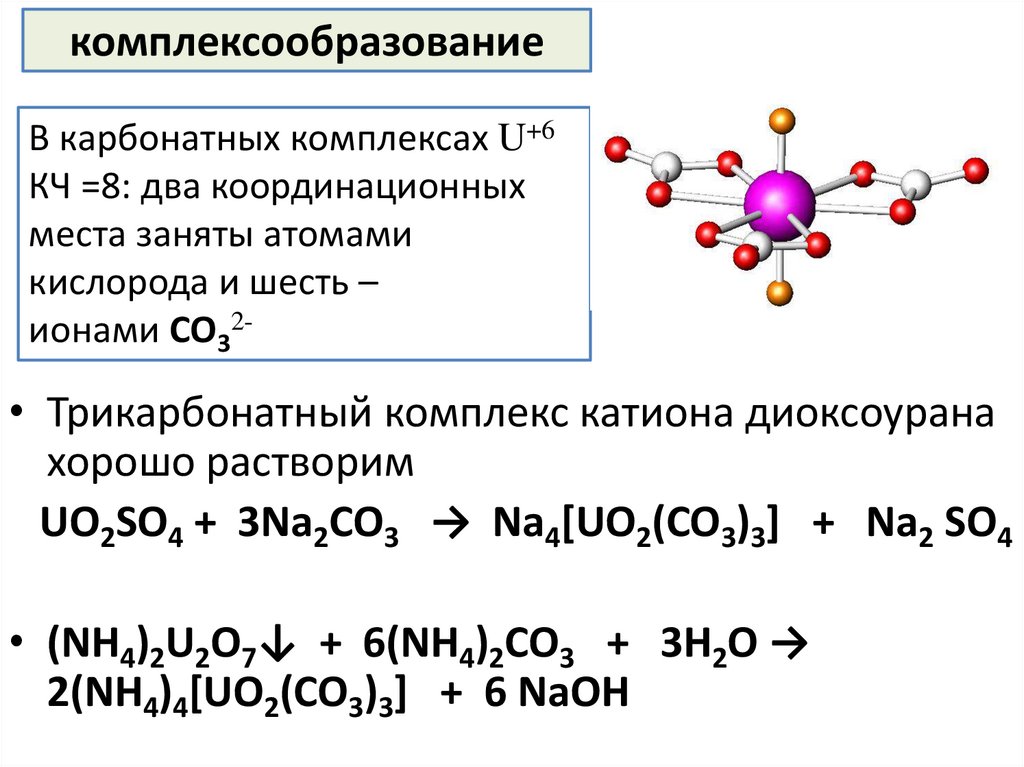
комплексообразованиеВ карбонатных комплексах U+6
КЧ =8: два координационных
места заняты атомами
кислорода и шесть –
ионами CO32-
• Трикарбонатный комплекс катиона диоксоурана
хорошо растворим
UO2SO4 + 3Na2CO3 → Na4[UO2(CO3)3] + Na2 SO4
• (NH4)2U2O7↓ + 6(NH4)2CO3 + 3H2O →
2(NH4)4[UO2(CO3)3] + 6 NaOH
46.
Получение урана• Для урана известно около 200 минералов
• промышленное значение имеет минерал
настуран (урановая смолка) U3O8
Только Th и U получают химическими методами
47.
Получение и очистка уранаурановую смоляную руду U3O8 обрабатывают
минеральными кислотами, например азотной или
серной кислотой, в присутствии MnO2 для
окисления урана(IV):
U3O8 + MnO2 + 4H2SO4 → MnSO4 + 3UO2SO4 + 4H2O
• Металлический уран получают
восстановлением тетрафторида урана UF4
кальцием или магнием в инертной
атмосфере:
• UF4+2Ca
U+2CaF2
48.
Метод карбонатной очисткивыщелачивание
U O
MnO
4
H
SO
3 UO SO MnSO 4 H О
3 8
2 4
2
2 4
4
2
примеси
примеси
Способность U(VI) легко образовывать растворимые
комплексные соединения с CO32- используется для
отделения урана от сопутствующих ему в природе примесей,
методом очистки карбонатом натрия.
комплексообразование
UO SO 3Na CO Na4[UO2 (CO3)3] р р Na2 SO4
2 4
2 3
([Th])
полный
смешанный
гидролиз
2CuSO 2 Na CO H O (CuOH ) CO 2 Na SO CO
4
2 3
2
2 3
2 4
2
полный
смешанный
гидролиз
Fe2 (SO 4 )3 3Na 2CO3 3H 2O 2Fe(OH)3 3Na 2SO 4 3CO2
РЗЭ 2 (SO 4 )3 3Na 2 CO3 обмен
РЗЭ 2 (CO3 ) 3 3Na 2SO 4
Получили: U(+6), Th(+4) в растворе; примеси в осадке
49.
Получение металлического урана1.Разрушение комплекса:
Na4[UO2(CO3)3] + 3H2 SO4 → UO2SO4 + 3H2 CO3 + 2 Na2SO4
2.Осаждение термически нестойкого UO2(OH)2
UO2(NO3)2 + 2NaOH UO2(OH)2 + Na2SO4
мало
3.Термическое разложение UO2(OH)2
UO2(OH)2 → UO3 + H2O
4. Восстановление
UO3 + H2 → UO2 + H2O
5. Синтез фторида ( для снижения Тпл.)
UO2 + 4 НF4 → UF4 + 2 H2O
6. восстановление тетрафторида урана UF4 кальцием или
магнием в инертной атмосфере(металлотермия):
UF4+2Ca → U +2CaF2
50.
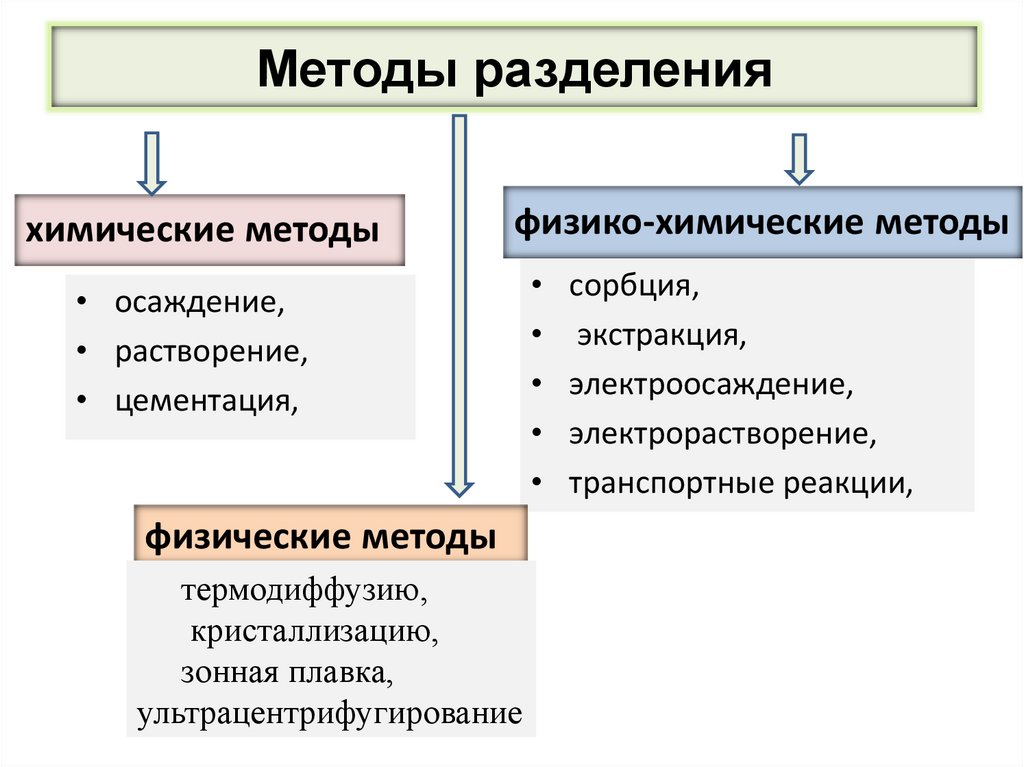
Методы разделенияхимические методы
физико-химические методы
• осаждение,
• растворение,
• цементация,
физические методы
термодиффузию,
кристаллизацию,
зонная плавка,
ультрацентрифугирование
сорбция,
экстракция,
электроосаждение,
электрорастворение,
транспортные реакции,
51.
химические методыВ основе лежит применение
специфических
реагентов, которые по-разному взаимодействуют с
основным и примесными компонентами, позволяя
перевести один из них в газовую или твердую фазы.
В качестве специфических реагентов могут служить
• минеральные кислоты,
• щелочи,
• окислители,
• комплексообразователи
52.
ОсаждениеОснован на различной растворимости
компонентов растворов.
Для отделения от примесей используют
селективные осадители и промывку полученных
осадков на фильтре
.
Ag++Cl- = AgCl↓,
Ba2++SO42- = BaSO4↓
Коэффициент разделения для процессов осаждения
β = ПРi/ПРj
отделение скандия от
РЗЭ и тория
ScF3 ↓+3NH4F → (NH4)3[ScF6]
РЗЭF3↓
ThF4↓
растворим
+ NH4F
→
53.
цементацияв качестве осадителей могут применяться чистые
металлы, которые вытесняют из растворов более
электроположительные металлы.
получение меди из ее разбавленных р-ров:
CuSO4+Fe = Cu↓+FeSO4
очистка сульфатно-цинковых растворов от примеси меди
и кадмия:
CuSO4+Zn = Cu↓+ZnSO4
CdSO4+Zn = Cd↓+ZnSO4
54.
ОВР применяют для выделения из смеси техэлементов, которые могут существовать в
растворах в различных степенях окисления
выделение ионов марганца из сульфатных р-ров
3MnSO4+2KMnO4+2H2O = 5MnO2↓+K2SO4+2H2SO4
Mn+7+3e = Mn+4
Mn+2-2e = Mn+4
2
3
Отделение европия от сульфатов трехвалентных РЗЭ
2EuCl3+Zn+2H2SO4 = 2EuSO4↓+ZnCl2+4HCl
55.
применение• расщепляющие материалы, к которым
относятся изотопы урана 235U, 233U,
плутония 239Pu и 241Pu
• в природе встречается только 235U
• за один акт деления урана в расчете на 1 г
ядерного топлива выделяется около 180
МэВ, что соответствует 7,4·107 кДж.
56.
• ТолькоTh и U получают химическими методами• Остальные элементы получают в результате ядерного
синтеза















































 Химия
Химия








