Похожие презентации:
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
Тема: «Периодический закон и
периодическая система химических
элементов Д.И. Менделеева.
Строение атома»
Преподаватель химии: Агафонова Н.В.
2.
План лекции:1. Периодический закон и периодическая система
Д. И. Менделеева.
2. Строение атома.
3. Состояние электронов в атоме. Электронные
конфигурации атомов.
4. Квантовые числа.
5. Зависимость свойств элементов от строения их
атомов.
2
3.
Дмитрий Иванович Менделеев (1834 – 1907)Великий русский ученый энциклопедист, один
из основоположников современной химии
В1869 г. Д.И. Менделеев открыл
один из важнейших законов
химии – периодический закон.
3
4.
*Первая формулировка закона:
Свойства элементов, а также формы и
свойства соединений элементов находятся в
периодической зависимости от величины
атомной массы элементов.
*
Современная формулировка закона:
Свойства элементов и их соединений находятся
в периодической зависимости от заряда ядра
атома.
4
5.
Графическим изображением периодического законаявляется периодическая система Д.И. Менделеева.
7 периодов
10 рядов
8 групп
5
6.
Период – горизонтальный ряд –последовательность элементов, которая
начинается щелочным металлом и заканчивается
благородным газом. Периоды бывают малые
(состоят из одного горизонтального ряда) и
большие (состоят из двух горизонтальных
рядов).
6
7.
Группа – вертикальный ряд – совокупность элементов,которые имеют одинаковую высшую валентность в
оксидах и других соединениях. Эта валентность равна
номеру группы.
Исключения:
I группе: Cu (II), Аg (III), Au (III),
VI группе: O (II), в VII группе: Н, F (II).
7
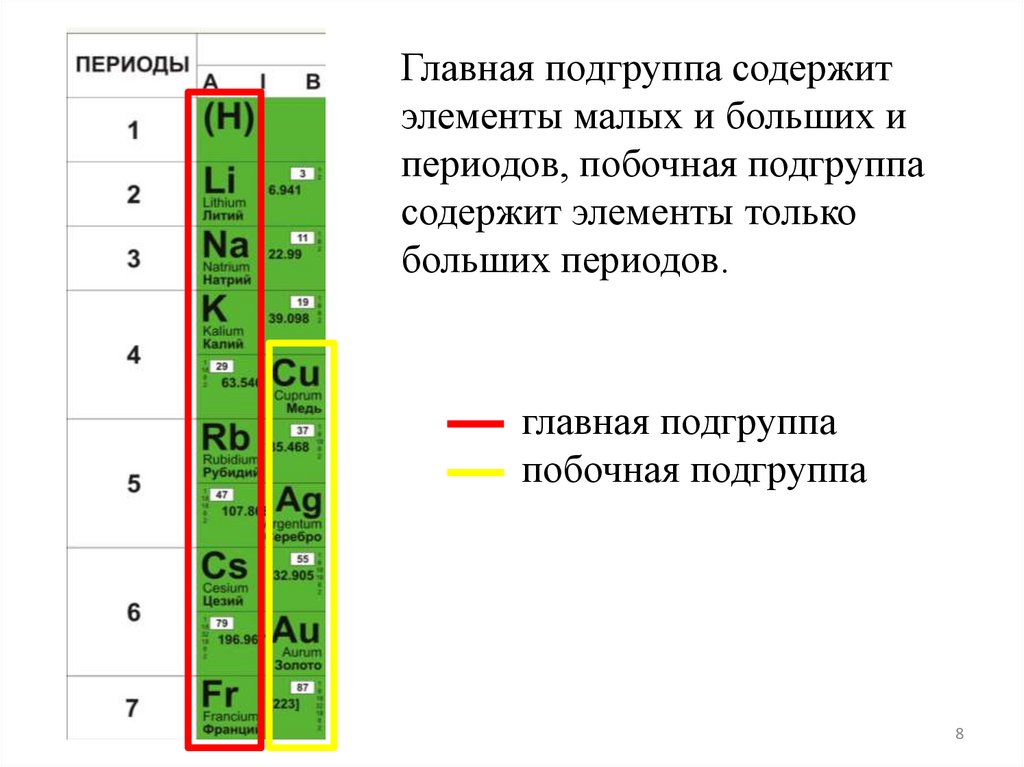
8.
Главная подгруппа содержитэлементы малых и больших и
периодов, побочная подгруппа
содержит элементы только
больших периодов.
главная подгруппа
побочная подгруппа
8
9.
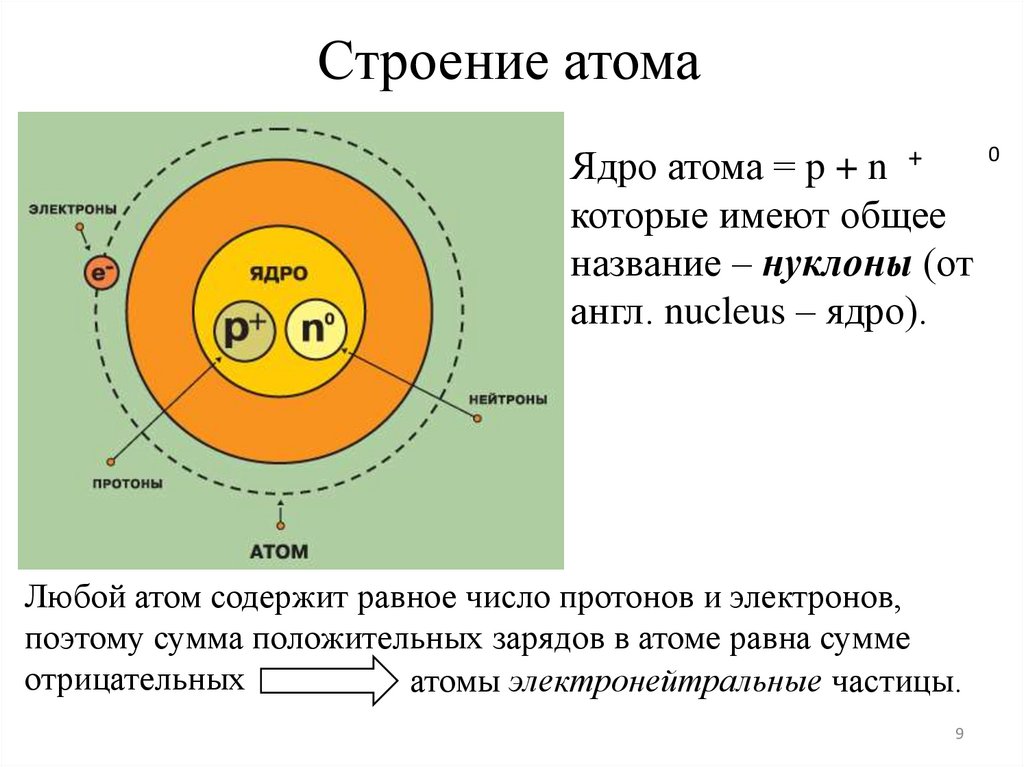
Строение атома0
Ядро атома = p + n +
которые имеют общее
название – нуклоны (от
англ. nucleus – ядро).
Любой атом содержит равное число протонов и электронов,
поэтому сумма положительных зарядов в атоме равна сумме
отрицательных
атомы электронейтральные частицы.
9
10.
1011.
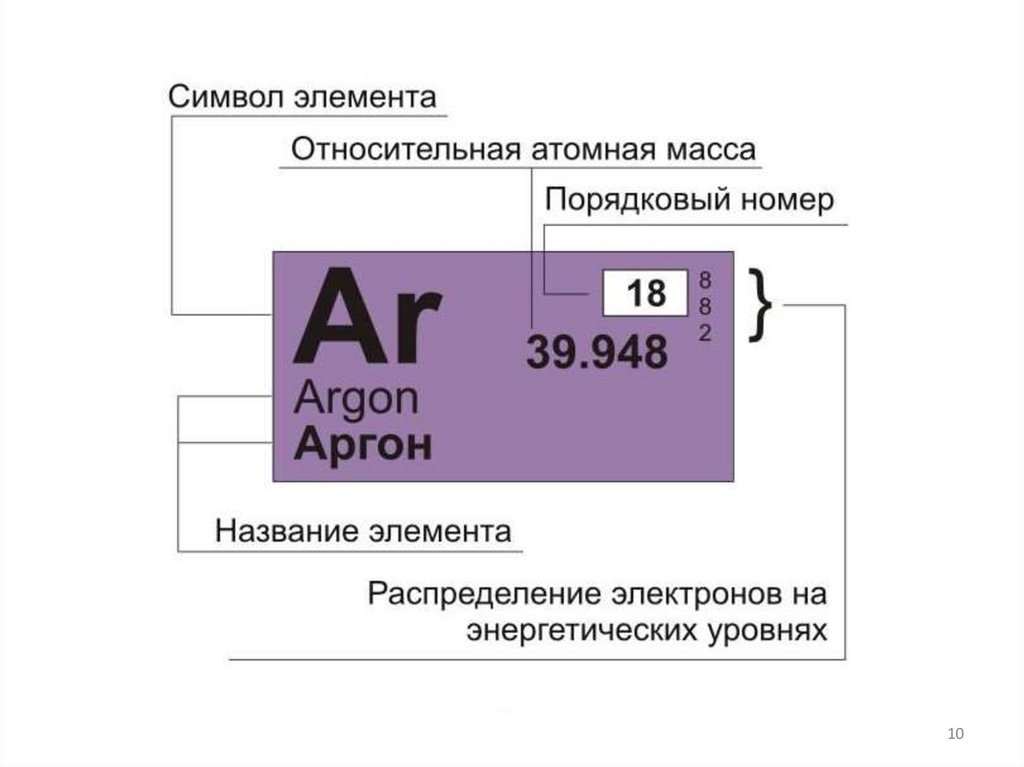
Каждое цифровое обозначение в периодической системеД. И. Менделеева отражает какую-либо особенность в
строении атомов:
Порядковый
номер
элемента
Массовое
число
атома (А)
=
=
Заряд
ядра
атома
Число
протонов
(Z)
=
Число
протонов
в ядре
+
Число
нейтронов
(N)
=
Число
электронов
в атоме
Номер периода численно равен числу энергетических уровней в
атоме электрона.
Номер группы численно равен числу электронов на внешнем
энергетическом уровне (валентные электроны) для элементов
главных подгрупп и максимальному числу валентных электронов
для побочных подгрупп.
11
12.
Модели строения атомаКвантовая теория
1. Электрон имеет двойственную
(корпускулярно – волновую) природу.
12
13.
2. Для электрона невозможно одновременно точноизмерить скорость координату
Принцип неопределенности (В. Гейзенберг)- чем точнее
мы измеряем скорость, более неопределенность в
координате и наоборот.
13
14.
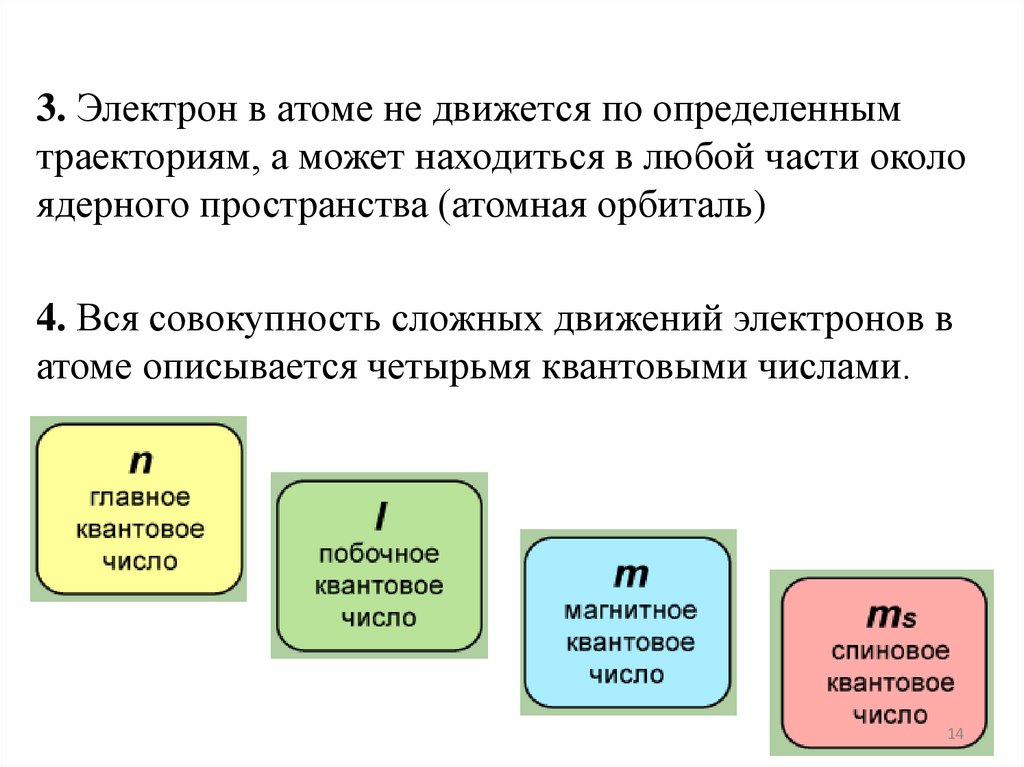
3. Электрон в атоме не движется по определеннымтраекториям, а может находиться в любой части около
ядерного пространства (атомная орбиталь)
4. Вся совокупность сложных движений электронов в
атоме описывается четырьмя квантовыми числами.
14
15.
Состояние электронов в атомеЧасть атомного пространства, в котором вероятность
нахождения данного электрона наибольшая (равна ≈
90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную
орбиталь и образует электронное облако, которое
является совокупностью различных положений быстро
движущегося электрона.
Электроны в атоме распределяются по энергетическим
уровням и подуровням.
15
16.
Чтобы правильно изображать электронныеконфигурации различных атомов, нужно знать:
1. Число электронов в атоме (равно
порядковому номеру элемента)
2. Число энергетических уровней (равно номеру
периода)
3.Число энергетических уровней в атоме равно
числу подуровней.
16
17.
Заполнение уровней и подуровней17
18.
4. Число электронов на уровнях и подуровнях.Максимальное число электронов в пределах уровня
определяется по формуле 2n2,
где n– энергетический уровень.
Предельное заполнение подуровней
s2, р6, d10, f 14
5. Порядок заполнения уровней и подуровней
1s2s2p3s3p4s3d4p5s4d5p6s5d4f6p7s
18
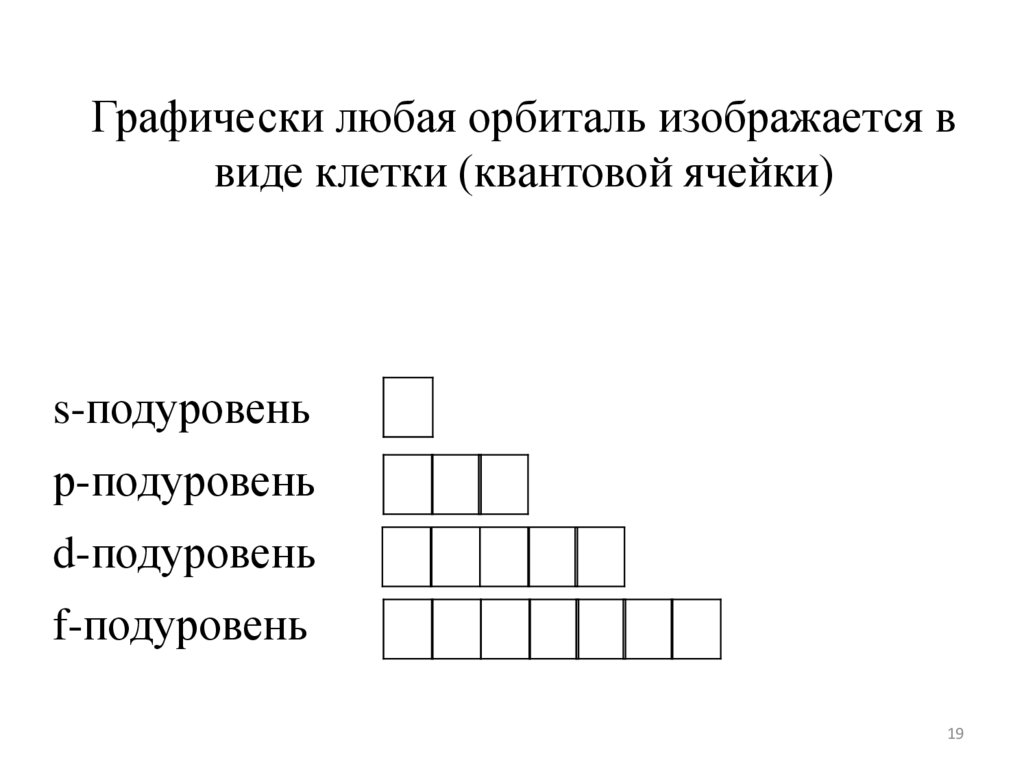
19.
Графически любая орбиталь изображается ввиде клетки (квантовой ячейки)
При составлении электроно-графических
формул следует помнить, что
s-подуровень
р-подуровень
d-подуровень
f-подуровень
19
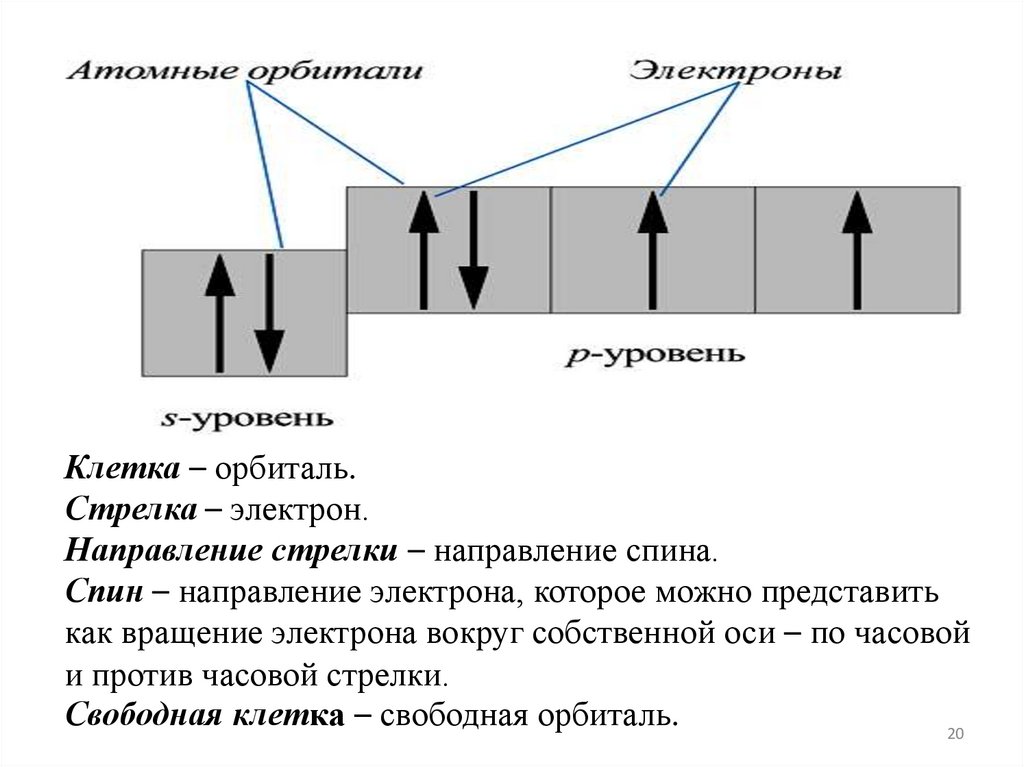
20.
Клетка – орбиталь.Стрелка – электрон.
Направление стрелки – направление спина.
Спин – направление электрона, которое можно представить
как вращение электрона вокруг собственной оси – по часовой
и против часовой стрелки.
Свободная клетка – свободная орбиталь.
20
21.
На каждой орбитали может быть не более двухэлектронов, они должны иметь
противоположные спины:
допускается заполнение
↑↓
не допускается заполнение
↑↑
(принцип запрета Паули)
21
22.
Заполнение одного подуровня в основном состоянииатома начинается одиночными электронами с
одинаковыми спинами. После того, как одиночные
электроны займут все орбитали в данном подуровне,
заполняются орбитали вторыми электронами с
противоположными спинами.
(правило Гунда)
22
23.
Электронно-графическая формулаатома углерода
Возбужденное состояние атома
1
3
23
24.
Возбужденное состояние атома – этосостояние с более высокой энергией, чем
основное. При этом происходит разъединение
спаренных электронов и переход одного из
них с данного подуровня на свободную
орбиталь другого подуровня.
24
25.
Составьте электронную иэлектронно-графическую
формулу атома серы в
основном и возбужденном
состоянии
26.
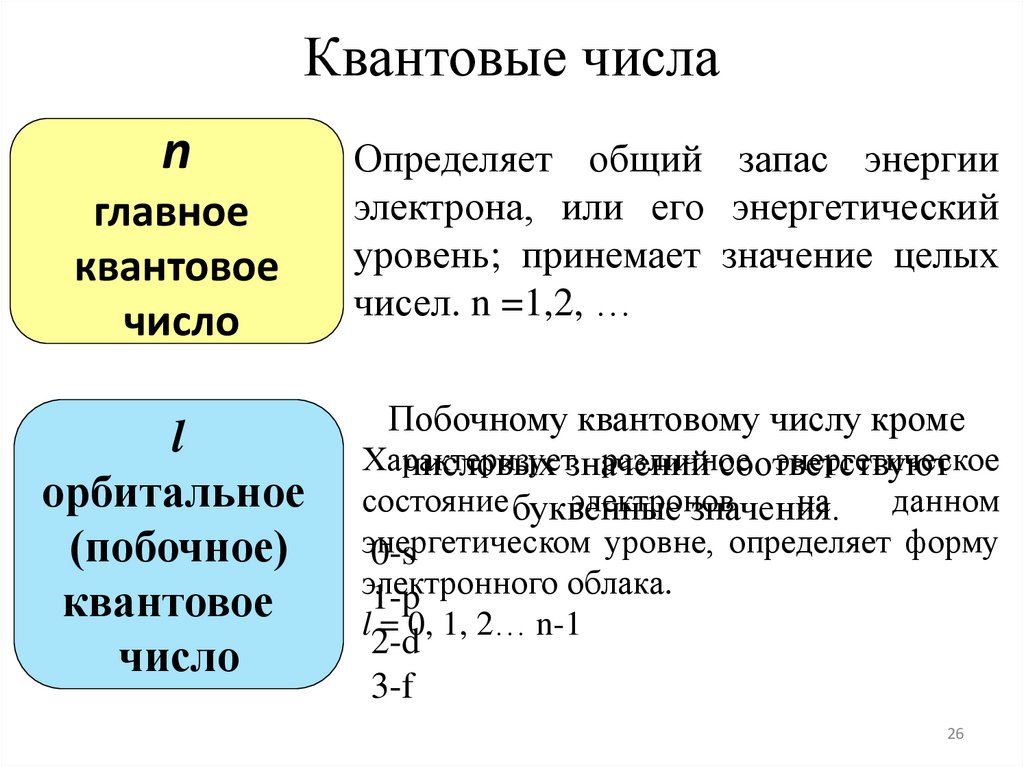
Квантовые числаn
главное
квантовое
число
l
орбитальное
(побочное)
квантовое
число
Определяет общий запас энергии
электрона, или его энергетический
уровень; принемает значение целых
чисел. n =1,2, …
Побочному квантовому числу кроме
Характеризует
различное
энергетическое
числовых значений
соответствуют
состояние буквенные
электронов
на
данном
значения.
энергетическом
уровне, определяет форму
0-s
электронного
облака.
1-p
l = 0, 1, 2… n-1
2-d
3-f
26
27.
Квантовые числаml
магнитное
квантовое
число
Характеризует ориентацию орбиталей
в пространстве.
ms
спиновое
квантовое
число
Характеризует вращение электрона
вокруг своей оси и принимает только
два значения +1/2 и -1/2
Электрон со спином +1/2 изображают ↑,
со спином -1/2 - ↓
Магнитное квантовое число принимает
значения целых чисел от –l через 0 до +l
ml=-l….0…+l
Всего (2l+1)
27
28.
Зависимость свойств элементов отстроения их атомов
Металличность – это способность атомов элемента
отдавать электроны.
Неметалличность – это способность атомов элемента
присоединять электроны.
Электроотрицательность элемента характеризует
способность его атомов притягивать к себе электроны,
которые участвуют в образовании химических связей с
другими атомам в молекуле.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
28
29.
В периодической системе Д.И. Менделеева с увеличениемпорядкового номера элемента свойства атомов химических
элементов изменяются следующим образом
В периоде с увеличением заряда
порядкового номера металлические
свойства ослабевают, а
неметаллические усиливаются, т.к.
В группах (главная подгруппа) с
порядкового номера металлические
свойства усиливаются, а
неметаллические ослабевают, т.к.
- возрастает число электронов
на внешнем уровне атома,
- число энергетических уровней
в атомах остается постоянным,
- радиус атомов уменьшается,
- ЭО увеличивается
- число электронов на внешнем
уровне атомов остается
одинаковым,
- число энергетических уровней
в атомах увеличивается,
- радиус атомов увеличивается,
- ЭО уменьшается.
29
30.
Закрепление материала1. Дайте характеристику 15 элементта периодической
системы химических элементов.
2. Составьте электронно-графическую формулу
кислорода, определите валентность кислорода.
3. Определите значения всех квантовых чисел для
электрона
4f
30
31.
Значение периодического закона ипериодической системы химических
элементов Д.И.Менделеева.
Д/З
законспектировать
самостоятельно
31
32.
ЛитератураОсновная литература:
1. Габриелян, О. С. Химия. 10 класс. Базовый уровень : учебник / О. С.
Габриелян. - 4-е изд., стер. - М. : Дрофа, 2016. - 192 с.
Дополнительная литература:
1. Грандберг, И. И. Органическая химия : учеб. для бакалавров / И. И.
Грандберг, Н. Л. Нам. - 8-е изд. - М. : Юрайт , 2013. - 608 с
Электронные ресурсы:
1. ЭБС КрасГМУ «Colibris»
2. ЭБС Консультант студента ВУЗ
3. ЭБС Консультант студента Колледж
4. ЭМБ Консультант врача
5. ЭБС Айбукс
6. ЭБС Букап
7. ЭБС Лань
8. ЭБС Юрайт
9. СПС КонсультантПлюс
10. НЭБ eLibrary
32
33.
Спасибо за внимание33


























 Химия
Химия








