Похожие презентации:
Энтропия және оның әртүрлі процесстерде өзгеруі. Термодинамиканың екінші заңының бастамасы
1.
ҚЕАҚ С. Ж. Асфендияров атындағы Қазақ Ұлттықмедицина университеті
ЭНТРОПИЯ ЖӘНЕ ОНЫҢ ӘРТҮРЛІ
ПРОЦЕССТЕРДЕ ӨЗГЕРУІ.
ТЕРМОДИНАМИКАНЫҢ ЕКІНШІ
ЗАҢЫНЫҢ БАСТАМАСЫ.
Алматы , 2024
2.
Жоспар:Энтропия
Әртүрлі процестер
үшін энтропия
өзгерістерін
есептеу
III. Термодинамиканың
екінші заңының
бастамасы.
I.
II.
3.
Қайтымды және қайтымсыз процесстерПроцесстер
Қайтымды
Қайтымсыз
Жүйе мен оны
қоршаған ортада
процесс тура және
кері бағытта жүріп,
бастапқы күйіне
келетін процесстер.
Процесс бастапқы
күйіне келе
алмайтын, келтіру
үшін сырттан
энергия
жұмсалатын
процесстер
⮚ Тұздардың гидролизі
⮚ Карно машинасы
⮚ Тас құлаған кезде
механикалық энергияның
ішкі энергияға айналуы;
⮚ Тұз немесе қант өздігінен
суда ериді, бірақ олар
өздігінен ерітіндіден
бөліне алмайды және су
тұщы бола алмайды;
⮚ Тұнба түсу, газ бөліну
реакциялары
4.
ЭнтропияНеміс физигі 1854ж. Р. Клаузиус қайтымды
изотермиялық
процесс
үшін
процестің
келтірілген жылуы оның күй функциясы екенін
көрсетті. Бұл шаманы энтропия (S) дейді, ол
жұмысқа айналдыруға болмайтын, яғни
байланысқан энергияның мөлшері болып келеді:
ал қайтымды ауысудың
мөлшері (dq) үшін
шексіз
аз
жылу
Осы екі теңдеуді қайтымды процестер үшін термодинамиканың II
заңының математикалық теңдеулері дейді.
5.
Энтропия (гр. еntropіa – бұрылыс, айналу) – тұйықтермодинамикалық жүйедегі өздігінен жүретін процестің өту
бағытын сипаттайтын күй функциясы. Энтропия ұғымын
термодинамикаға 1865 ж. Р.Клаузиус енгізген.
Энтропия(S) – жүйенің ретсіздігінің сандық өлшемі ретінде
термодинамикалық функция болып табылады, ретсіздік артқан
сайын жоғарылайды.
Энтропия мен термодинамикалық мүмкіндік арасындағы байланыс
(Больцман теңдеуі): S=k*InWi , мұндағы
Wi- термодинамикалық мүмкіндік;
k- Больцман тұрақтысы.
Термодинамикалық мүмкіндік (Wi) – берілген макрокүй жүзеге
асыруға мүмкіндік беретін түрлі әдістер санын (микрокүй)
көрсететін шама .
6.
Әртүрлі процестер үшін энтропия өзгерістерінесептеу.
✔ Қайтымды изотермиялық процестер үшін.
(P = const)
мұнда: DН – өзгерістің жылуы
Т – өзгерістің температурасы.
Келтірілген теңдеу арқылы фазалық өзгерістердің
(қайнау, балқу, айдау) энтропиясының өзгерісін (DS)
есептейді.
Р=const жай жүретін, қайтымды процеске жуық
температураның өзгеруі үшін:
7.
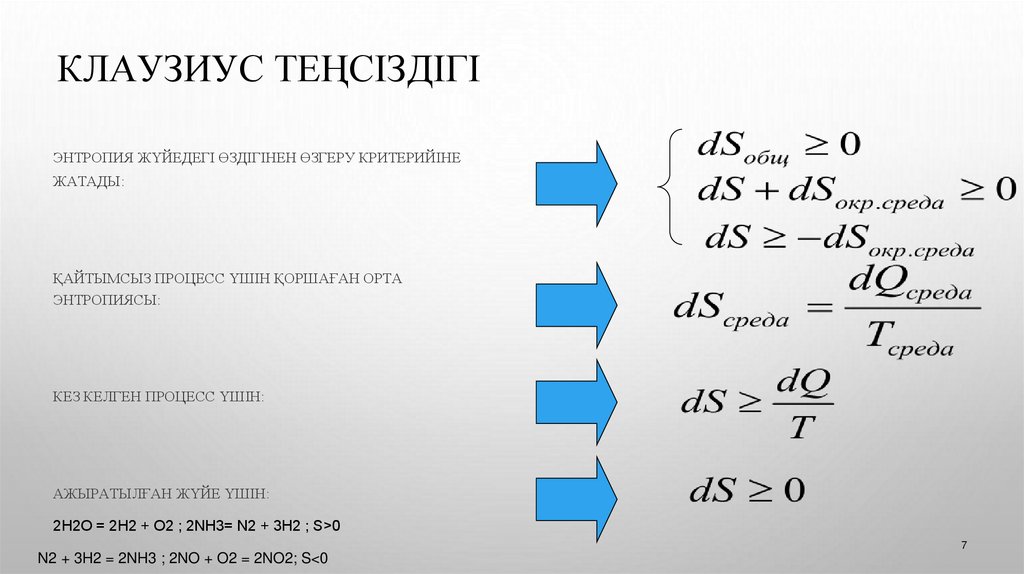
КЛАУЗИУС ТЕҢСІЗДІГІЭНТРОПИЯ ЖҮЙЕДЕГІ ӨЗДІГІНЕН ӨЗГЕРУ КРИТЕРИЙІНЕ
ЖАТАДЫ:
ҚАЙТЫМСЫЗ ПРОЦЕСС ҮШІН ҚОРШАҒАН ОРТА
ЭНТРОПИЯСЫ:
КЕЗ КЕЛГЕН ПРОЦЕСС ҮШІН:
АЖЫРАТЫЛҒАН ЖҮЙЕ ҮШІН:
2Н2О = 2H2 + O2 ; 2NH3= N2 + 3H2 ; S>0
7
N2 + 3H2 = 2NH3 ; 2NO + O2 = 2NO2; S<0
8.
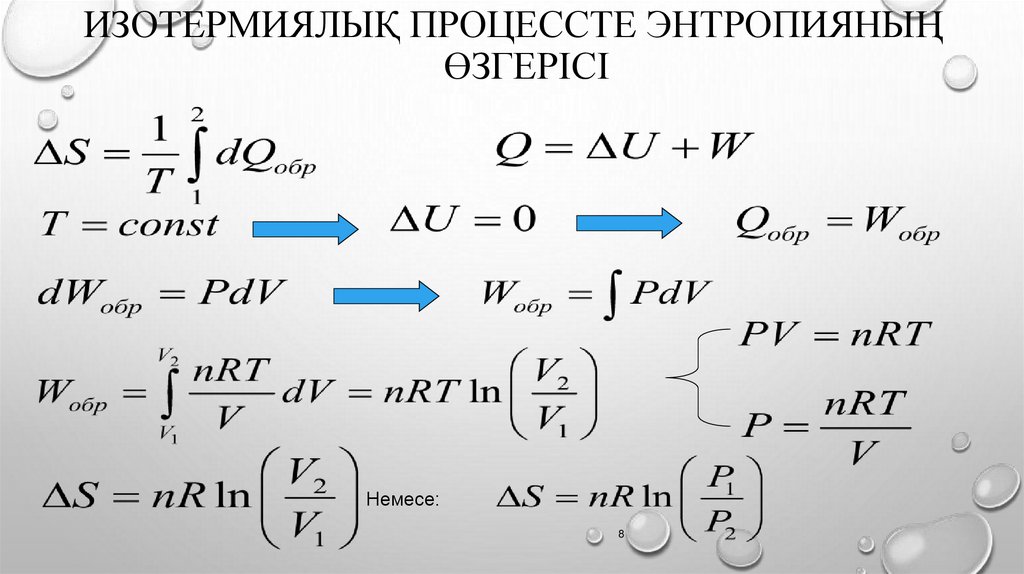
ИЗОТЕРМИЯЛЫҚ ПРОЦЕССТЕ ЭНТРОПИЯНЫҢӨЗГЕРІСІ
Немесе:
8
9.
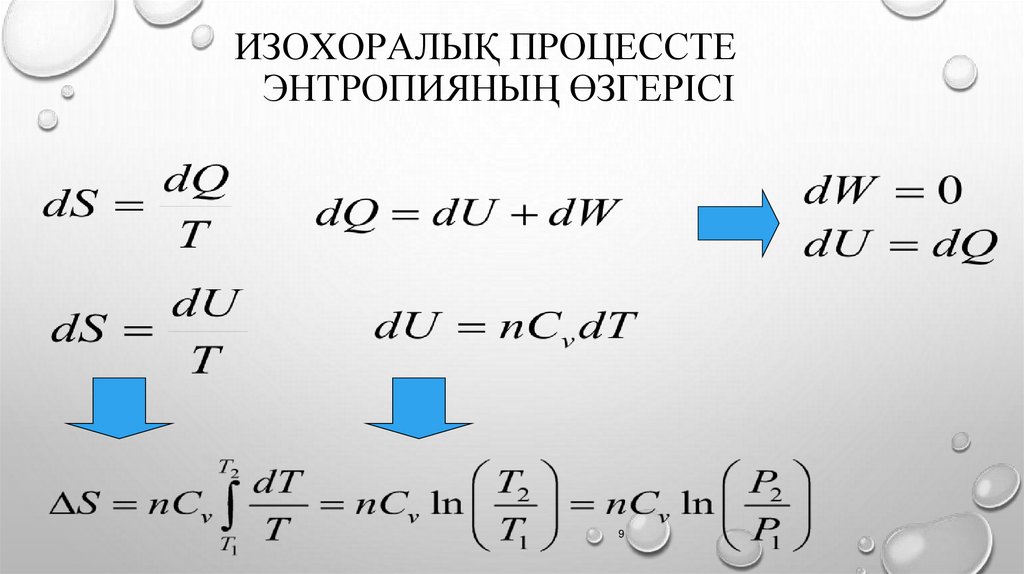
ИЗОХОРАЛЫҚ ПРОЦЕССТЕЭНТРОПИЯНЫҢ ӨЗГЕРІСІ
9
10.
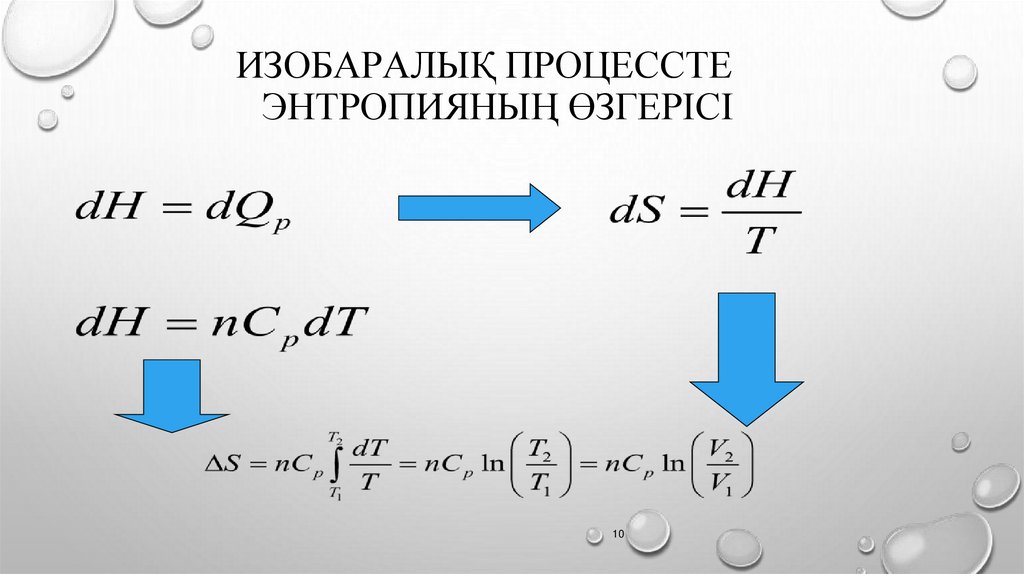
ИЗОБАРАЛЫҚ ПРОЦЕССТЕЭНТРОПИЯНЫҢ ӨЗГЕРІСІ
10
11.
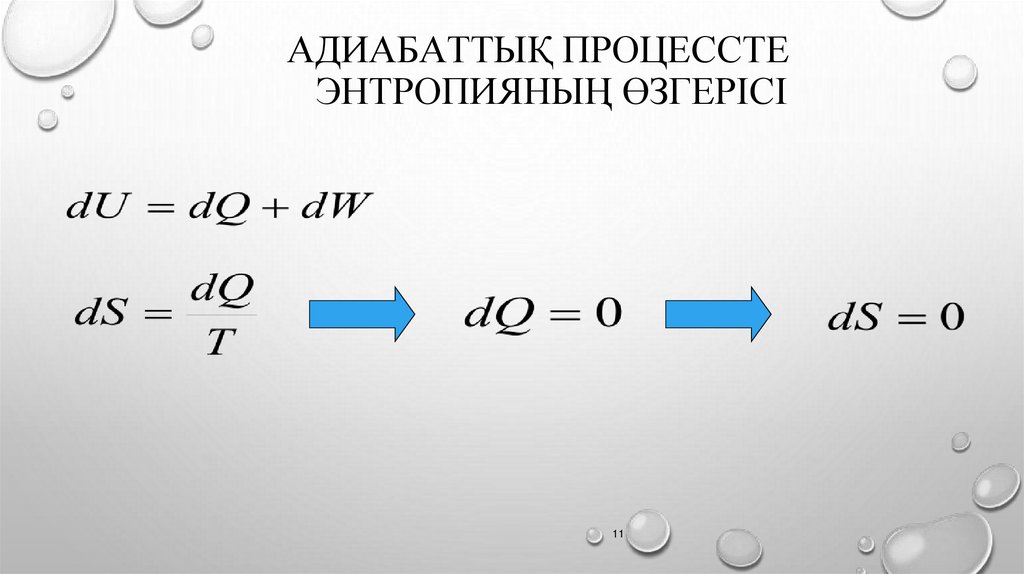
АДИАБАТТЫҚ ПРОЦЕССТЕЭНТРОПИЯНЫҢ ӨЗГЕРІСІ
11
12.
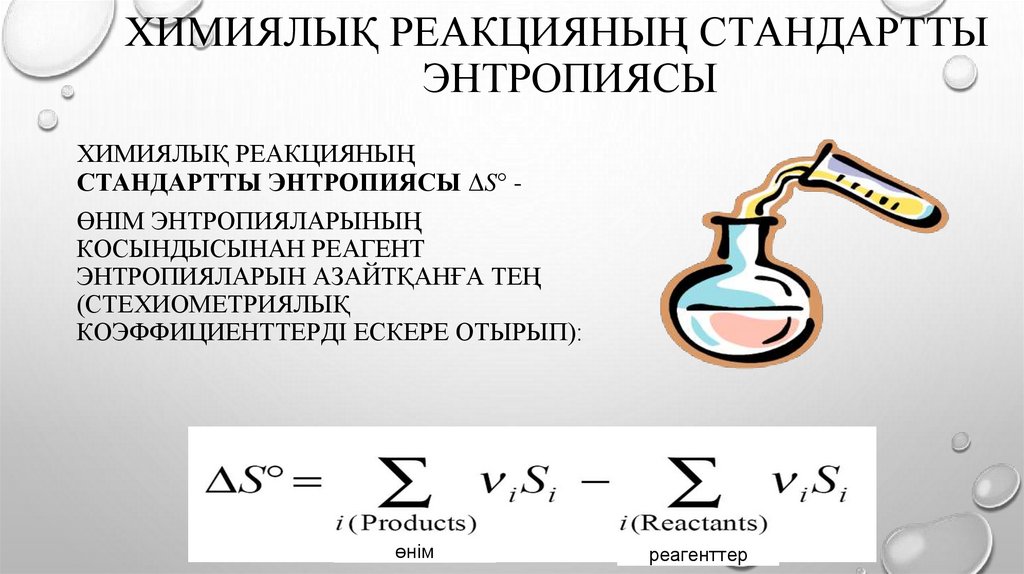
ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ СТАНДАРТТЫЭНТРОПИЯСЫ
ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ
СТАНДАРТТЫ ЭНТРОПИЯСЫ ΔS° ӨНІМ ЭНТРОПИЯЛАРЫНЫҢ
КОСЫНДЫСЫНАН РЕАГЕНТ
ЭНТРОПИЯЛАРЫН АЗАЙТҚАНҒА ТЕҢ
(СТЕХИОМЕТРИЯЛЫҚ
КОЭФФИЦИЕНТТЕРДІ ЕСКЕРЕ ОТЫРЫП):
12
өнім
реагенттер
13.
2 теңдеуді біріктіретін болсақ, кез-келген процестер үшінтермодинамиканың II заңының теңдеуін аламыз:
немес
е
Оқшауланған жүйеде қоршаған орта мен жылу алмасу жоқ,
демек
dq = 0, онда d S≥0
Демек, егер оқшауланған жүйеде өздігінен (қайтымсыз)
процесс жүргенде, жүйенің энтропиясы жоғарылайды және
тепе-теңдік орныққанда өзінің максималды шамасына келеді.
14.
Термодинамиканың II заңының анықтамалары:❑Ешқандай сыртқы әсерлердің көмегінсіз жүретін
процестерді өздігімен жүретін процестер деп айтады. Энергия
жұмсалғанда ғана жүретін процестерді өздігінен жүрмейтін процестер
деп айтады. Процестер қайтымды және қамтымсыз болуы мүмкін.
Термодинамиканың II заңы процесс өздігінен жүре алатынын
көрсетеді:
1.жылу өздігінен суық денеден ыстық денеге
ауыспайды
2. процестің нәтижесі тек жылудың жұмысқа
айналуы болса, ол іске аспайды
3. II-ші текті мәңгілі қозғалтқыш болуы мүмкін
емес (яғни, ол қоршаған ортаның салқындауы
арқылы жұмыс атқаратын қолғалтқыш болып
табылады).
15.
16.
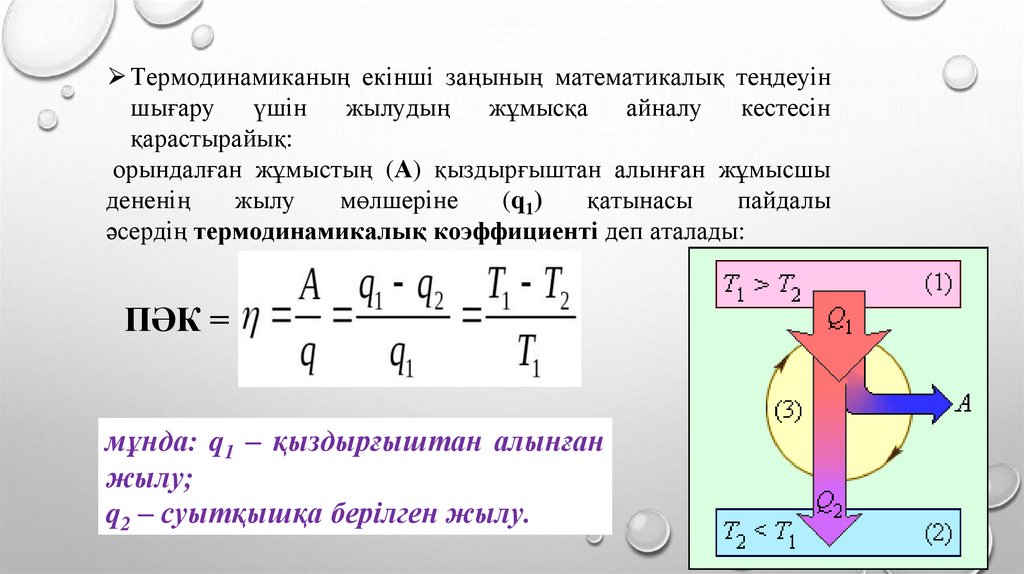
⮚Термодинамиканың екінші заңының математикалық теңдеуіншығару
үшін жылудың жұмысқа айналу
кестесін
қарастырайық:
орындалған жұмыстың (А) қыздырғыштан алынған жұмысшы
дененің
жылу
мөлшеріне
(q1)
қатынасы
пайдалы
әсердің термодинамикалық коэффициенті деп аталады:
ПӘК =
мұнда: q1 – қыздырғыштан алынған
жылу;
q2 – суытқышқа берілген жылу.
17.
❑ ПӘК қыздырғыш (Т1) және суытқыштың (Т2)температураларына тәуелді теңдеуді келесі
түрде жазамыз:
немесе
шаманы процестің келтірілген жылу дейді.
18.
19.
Термодинамика 0 - заңыЕгер температуралары әр түрлі екі денені бір біріне жанастырсақ, онда
бір дене ысиды, екіншісі суиды. Бұл жағдайда екі дене бір бірімен
термодинамикалық тепе- теңдікте болып, температуралары бірдей
болады. Термодинамикалық тепе-теңдік екі немесе, оданда көп
денелер жанасқанда орнайды.
1931 жылы Р.Фаулер термодинамикалық тепе- теңдік заңын
тұжырымдаған: егер А және В жүйелерінің әр қайсысы Д жүйесімен
жылулық тепе-теңдікте болса, онда А және В жүйелері де бір
бірімен жылулық тепе-теңдікте деп айтуға болады.
Бұдан температураны анықтау тек қана тепе-теңдікте тұрған жүйелер
үшін анықтауға болатынын көруге болады.
20.
Пайдаланылған әдебиеттер:1)Негізгі: Евстратова К.И. и др. Физическая и коллоидная химия. - М.: ВШ, 1990. 487б. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. - М.:
ВШ, 2001. -254б. Кругляков П.М., Хаскова Т.Н. Физическая и коллоидная химия. М.: ВШ, 2005. -319б.
2)Бугреева Е.В. и др. Практикум по физической и коллоидной химии.-М.:ВШ,
1990. -255б. Х.М. Рубина и др. Практикум по физической и коллоидной химии.М.:ВШ, 2001. -152б. Қоқанбаев Ә.Қ. Физикалық химияның қысқаша курсы. –
Алматы.: Баспа, 1999. – 164б. Патсаев Ә.К., Шитыбаев С.А., Дәуренбеков Қ.Н.
Бейорганикалық, физикалық және коллоидтық химия. – Шымкент. 2004
3)Қосымша: Мушкамбаров Н.Н. Физическая и коллоидная химия. –М: ГЭОТАРМЕД, 2001.-384б. Зимон А.Д. Физическая химия. – М.: Агар, 2003.-320 б. Белик
В.В. Физическая и коллоидная химия. –М: «Академия», 2005. -288б. Слесарев В.И.
Химия. Основы химии живого.-СПб.: Химиздат, 2001.-784б. Гельфман М.И.
Практикум по физической химии.-СПб.: Лань 2003.-256б.













 Химия
Химия








