Похожие презентации:
Алканы
1.
АЛКАНЫ2.
ПЛАН РАССМОТРЕНИЯ КЛАССАОРГАНИЧЕСКИХ ВЕЩЕСТВ
1. Строение
2. Номенклатура
3. Изомерия
4. Получение
5. Физические свойства
6. Химические свойства
7. Применение
3.
АЛКАНЫэто предельные углеводороды, содержащие
только одинарные связи между атомами С–С в
молекуле, т.е. содержащие максимальное
количество водорода. Общая формула алканов
CnH2n+2
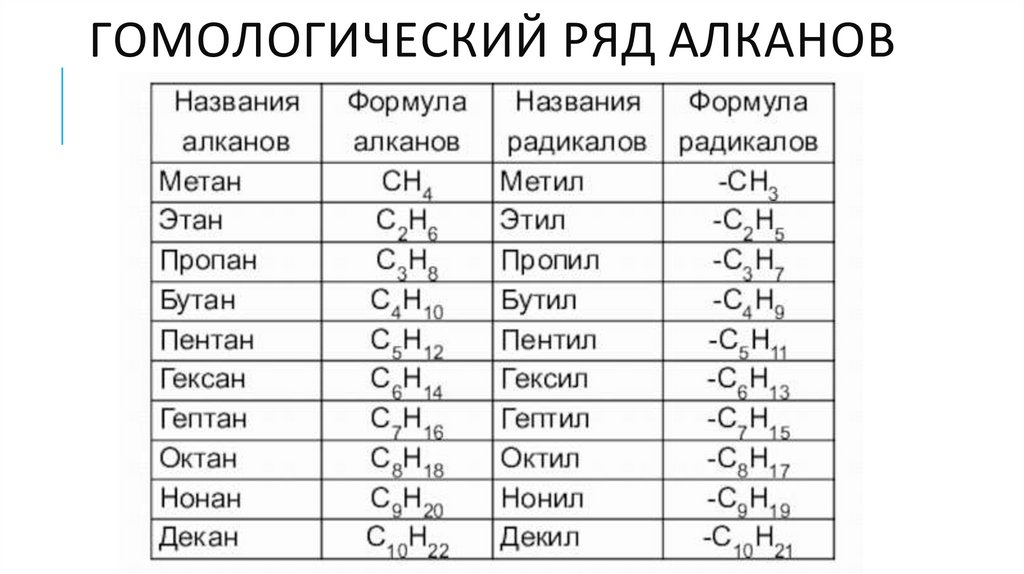
Гомологи - вещества, схожие по физическим и
химическим свойствам, и отличающиеся на одну или
несколько групп –СН2– друг от друга.
4.
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ5.
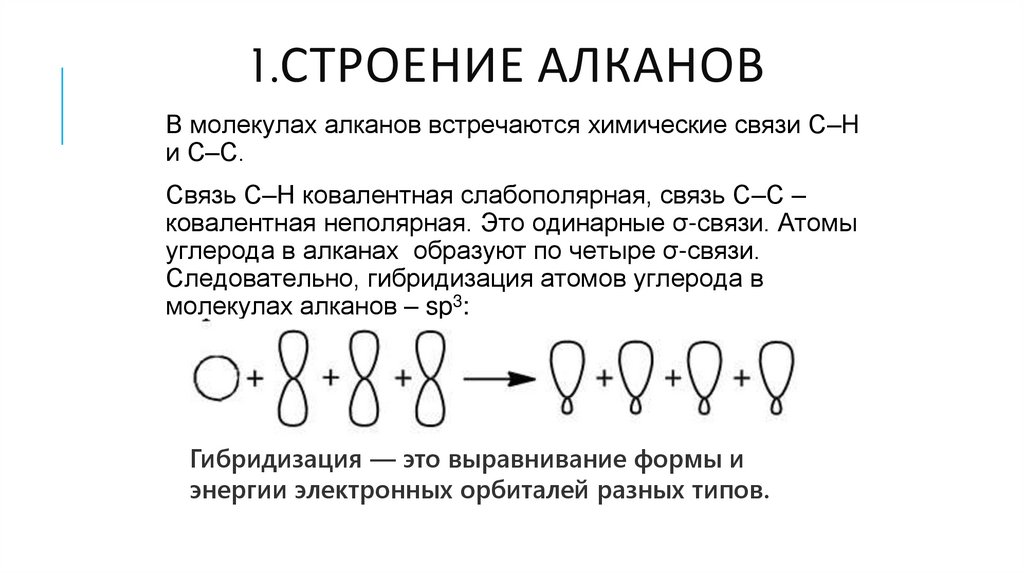
1.СТРОЕНИЕ АЛКАНОВВ молекулах алканов встречаются химические связи C–H
и С–С.
Связь C–H ковалентная слабополярная, связь С–С –
ковалентная неполярная. Это одинарные σ-связи. Атомы
углерода в алканах образуют по четыре σ-связи.
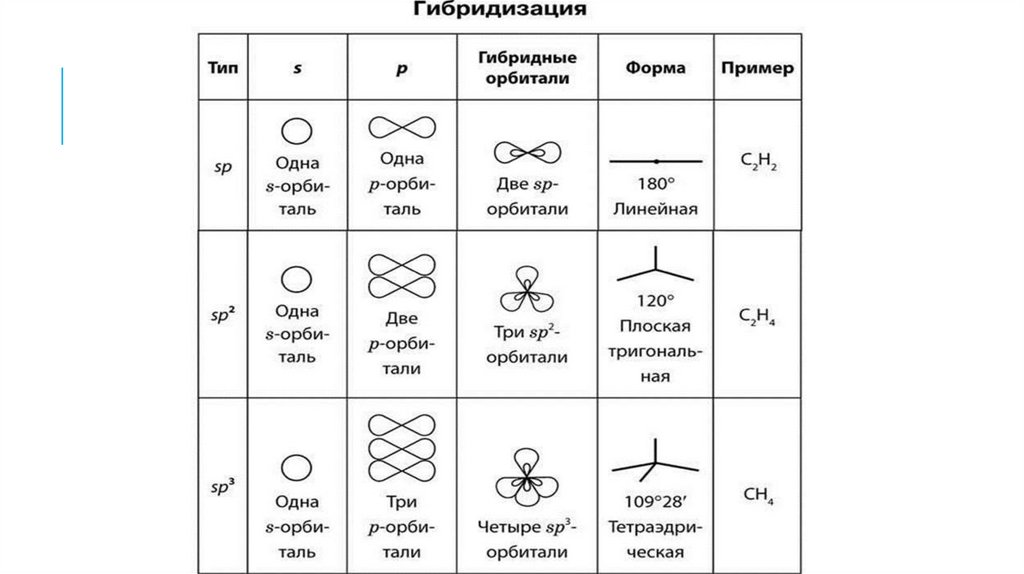
Следовательно, гибридизация атомов углерода в
молекулах алканов – sp3:
Гибридизация — это выравнивание формы и
энергии электронных орбиталей разных типов.
6.
7.
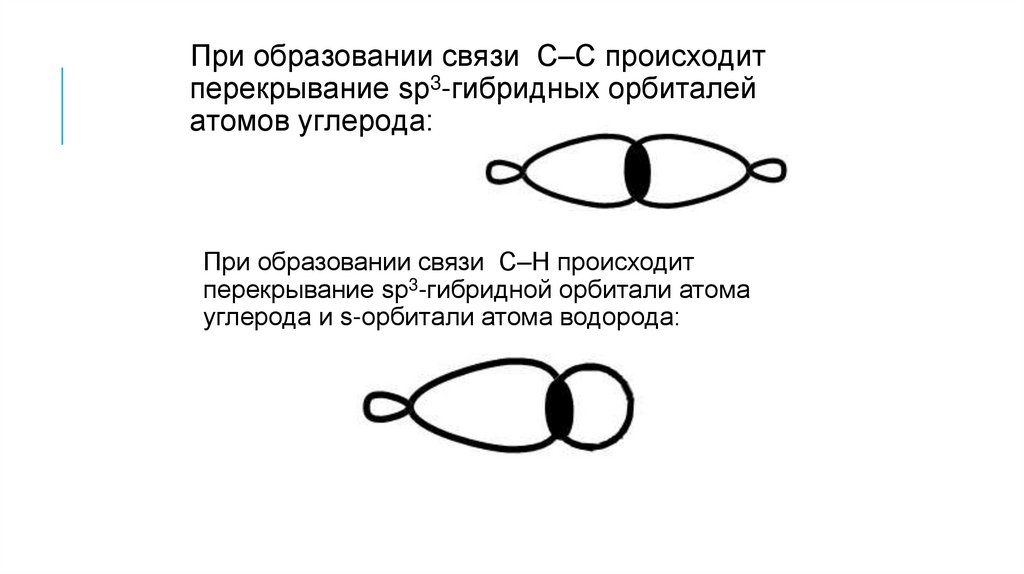
При образовании связи С–С происходитперекрывание sp3-гибридных орбиталей
атомов углерода:
При образовании связи С–H происходит
перекрывание sp3-гибридной орбитали атома
углерода и s-орбитали атома водорода:
8.
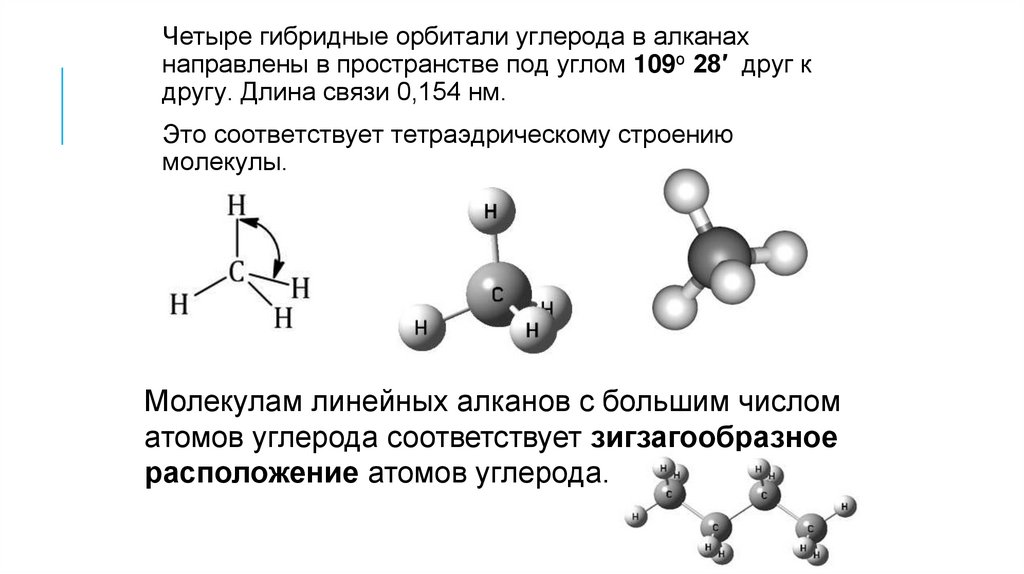
Четыре гибридные орбитали углерода в алканахнаправлены в пространстве под углом 109о 28′ друг к
другу. Длина связи 0,154 нм.
Это соответствует тетраэдрическому строению
молекулы.
Молекулам линейных алканов с большим числом
атомов углерода соответствует зигзагообразное
расположение атомов углерода.
9.
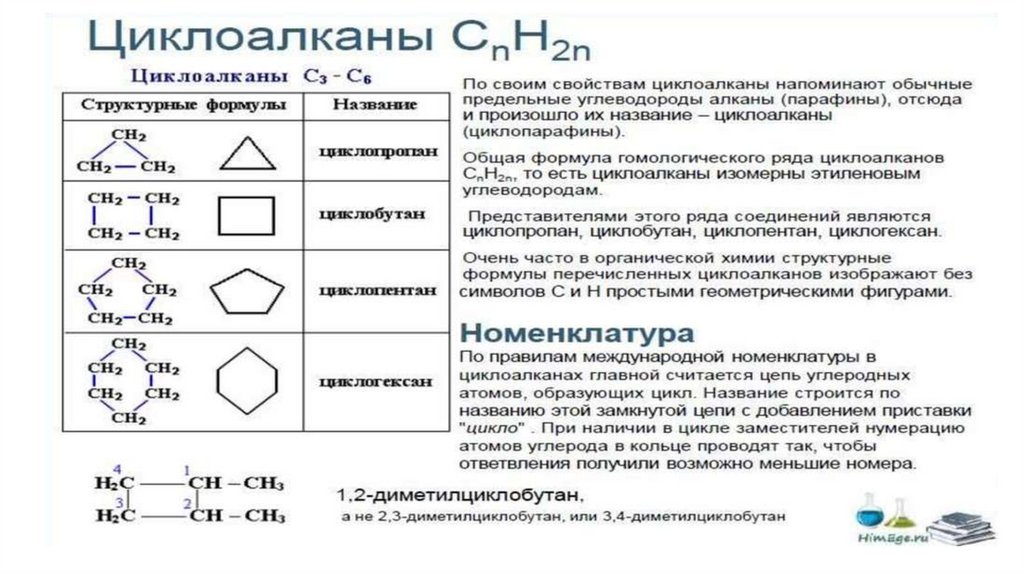
2. НОМЕНКЛАТУРААЛКАНОВ
Для простейших алканов (метан, этан, пропан,
бутан и изобутан) используют тривиальные
названия. Начиная с пятиатомного
углероводорода, в названии неразветвленных
(нормальных) алканов используют корень,
который показывает число атомов углерода в
молекуле, и добавляют соответствующий
суффикс (для алканов – ан, для алкенов – ен, и
т.д.).
10.
11.
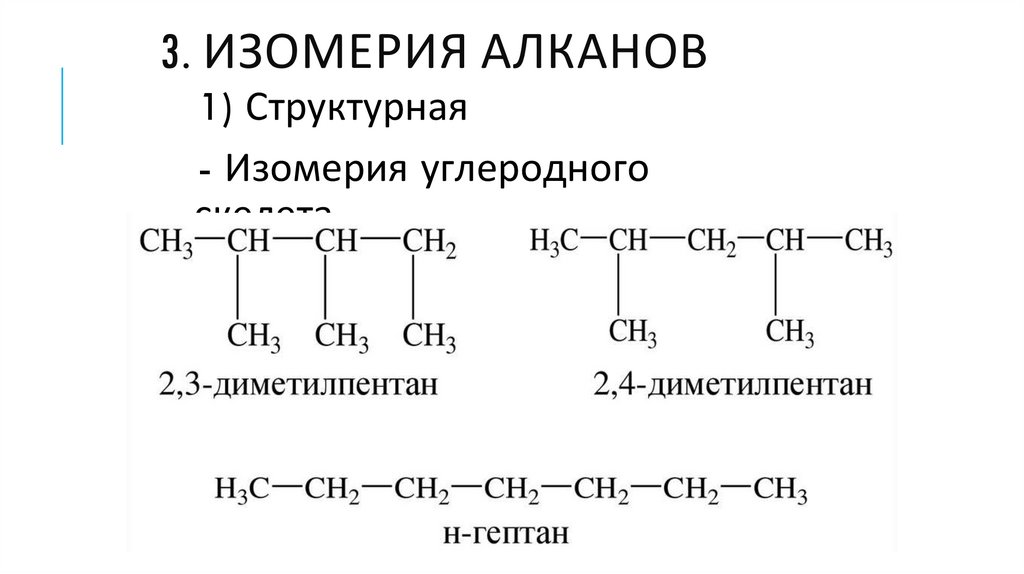
3. ИЗОМЕРИЯ АЛКАНОВ1) Структурная
- Изомерия углеродного
скелета
12.
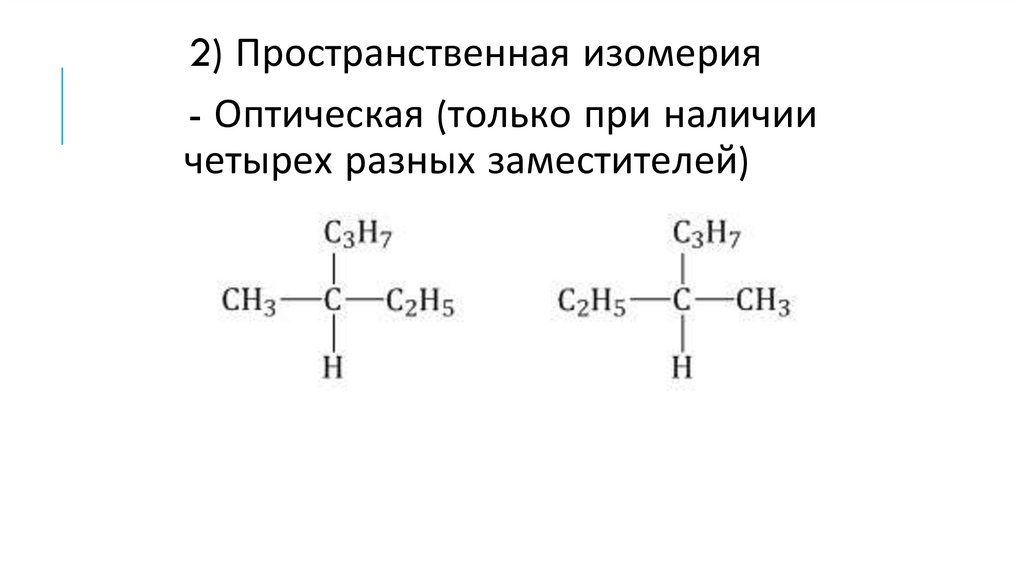
2) Пространственная изомерия- Оптическая (только при наличии
четырех разных заместителей)
13.
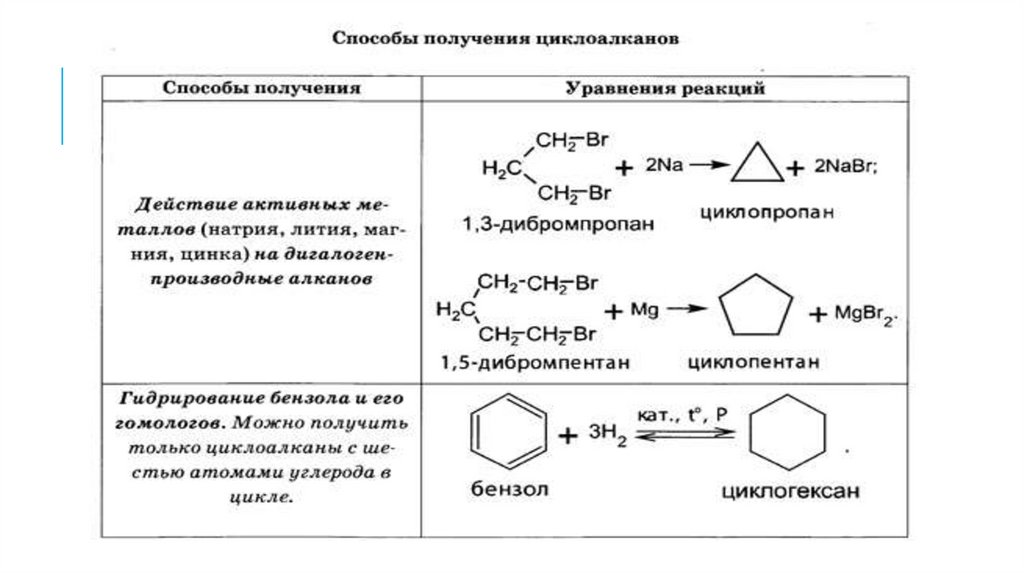
4. ПОЛУЧЕНИЕ АЛКАНОВ14.
5. Физические свойстваалканов
15.
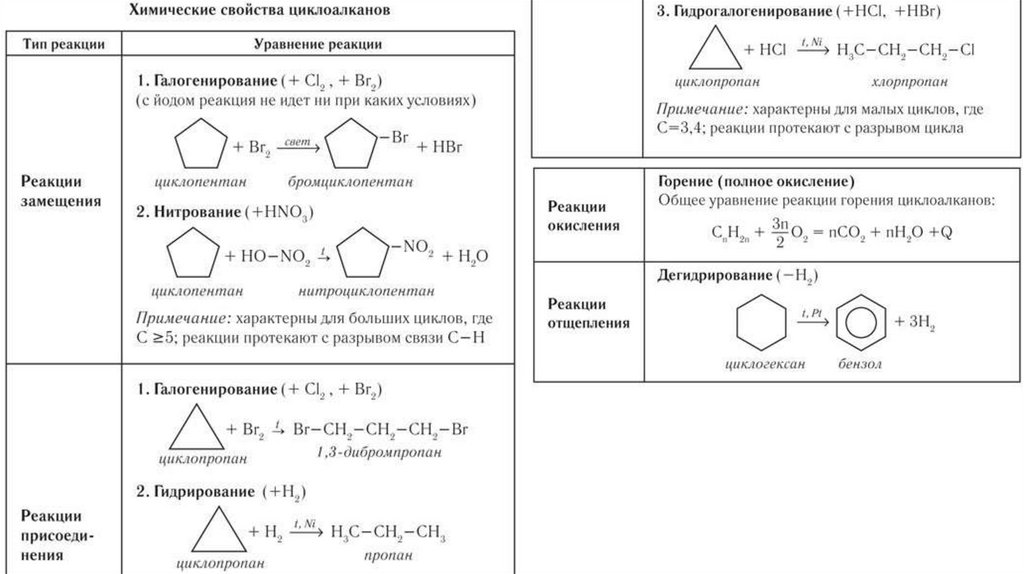
6. ХИМИЧЕСКИЕСВОЙСТВА АЛКАНОВ
I. РЕАКЦИИ ЗАМЕЩЕНИЯ
1. Галогенирование (на свету) +Br, Cl
16.
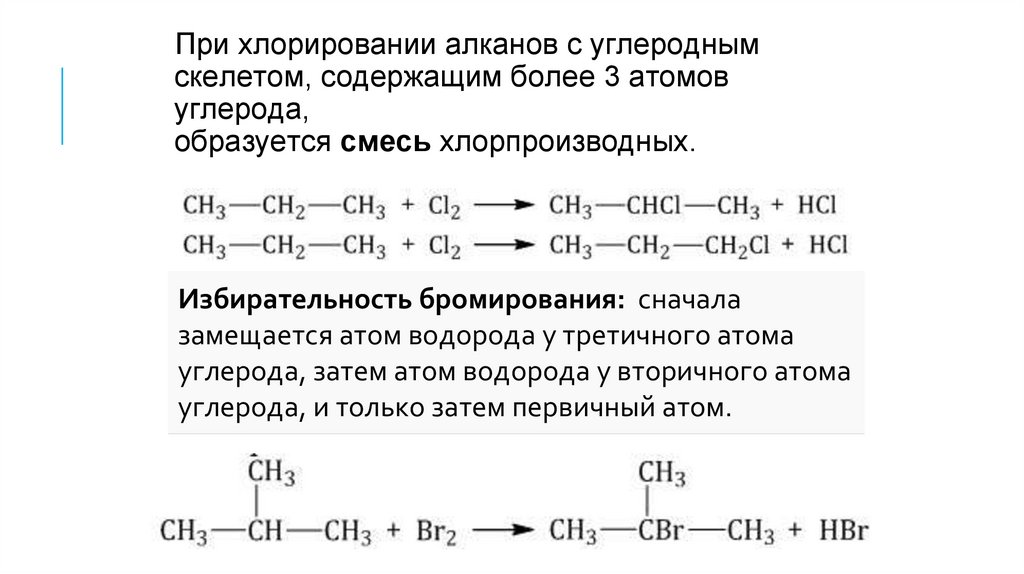
При хлорировании алканов с углероднымскелетом, содержащим более 3 атомов
углерода,
образуется смесь хлорпроизводных.
Избирательность бромирования: сначала
замещается атом водорода у третичного атома
углерода, затем атом водорода у вторичного атома
углерода, и только затем первичный атом.
17.
2. НитрованиеАлканы взаимодействуют с
разбавленной азотной кислотой при
нагревании до 140оС и под
давлением.
С третичный–Н > С вторичный–Н >
С первичный–Н
18.
II.Реакции разложения1. Дегидрирование
Дегидрирование – это реакция отщепления
атомов водорода.
В качестве катализаторов дегидрирования
используют никель Ni, платину Pt, палладий Pd,
оксиды хрома (III), железа (III), цинка и др.
19.
2. Пиролиз (дегидрирование) метанаПри медленном и длительном нагревании до
1500оС метан разлагается до простых веществ
3.Крекинг – это реакция разложения алкана с
длинной углеродной цепью на алканы с более
короткой углеродной цепью и алкены.
20.
III. Окисление алкановАлканы горят с образованием углекислого газа и воды.
Реакция горения алканов сопровождается выделением
большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Например, горение пропана в недостатке
кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция
окисления метана кислородом до простого
вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
21.
IV. ИЗОМЕРИЗАЦИЯ АЛКАНОВПод действием катализатора и при
нагревании неразветвленные
алканы, содержащие не менее
четырех атомов углерода в основной
цепи, могут превращаться в более
разветвленные алканы.
22.
7. ПРИМЕНЕНИЕАЛКАНОВ
Предельные углеводороды алканы применяются в
пищевой и химической промышленности, в энергетике,
косметологии и медицине.
Алканы служат растворителями и сырьем для производства
лаков, красок, мазей.
Их используют в качестве топлива.
Химическое производство пластика, синтетических тканей
использует в качестве сырья алканы.
С развитием технологий сферы применения алканов
расширяется.















 Химия
Химия








