Похожие презентации:
Ферменты как биокатализаторы. Краткая история развития энзимологии. Связь энзимологии с другими науками
1.
План лекции:Ферменты как биокатализаторы.
Краткая история развития
энзимологии. Связь энзимологии с
другими науками
2.
METABOLISMAnabolism:
Биосинтез
Мономеры → полимеры
Энергия затрачивается
Энтропия понижается
Catabolism:
Распад
Полимеры
→ Мономеры
В большей степени
восстановительные процессы
Энергия высвобождается
Энтропия возастает
В большей степени
окислительные процессы
Глюконеогенез. Синтез белков и
жиров
Гликолиз, липолиз,
протеолиз
Скорость метаболических процессов обусловлена
активностью ферментов
3.
Термин лат. «fermentum» — дрожжиВ литературе используется греческий эквивалент
«Энзимология» - раздел биохимии,
изучающий ферменты
4. Большая часть ранней истории биохимии - история исследований ферментов Биологические катализаторы были впервые обнаружены при
Большая часть ранней истории биохимии история исследований ферментовБиологические катализаторы были впервые
обнаружены при изучении пищеварения животных
и ферментации сахара дрожжами
(пивоварение и виноделие)
5.
6.
• Луи Пастер (XIX век) - ферменты (что означает«у дрожжей») считались (ошибочно)
неотделимыми от живых дрожжевых клеток.
• В. Кюне (1876) - ввел термин энзим (от греч.
Ἐν - in - ζύμη - дрожжи, закваска), который был
предложен для «неорганизованных
ферментов», секретируемых клетками.
• Более ста лет назад термины «фермент» и
«энзим» отражали различные точки зрения в
теоретическом споре Луи Пастера, с одной
стороны, и Бертло и М. Ю. Либиха, с другой, о
природе спиртового брожения
7.
• E. Buchner (1897). Было обнаружено, что дрожжевые экстрактыспособны сбраживать сахар в спирт, в 1907 году получил
Нобелевскую премию по химии за это открытие
• Джон. Самнер (1926) - первым получил высокоочищенный
кристаллический фермент (уреаза)
• Было обнаружено, что ферменты являются белками (1920-1930-е
годы, Дж.Самнером на уреазе и каталазе, «все ферменты являются
белками», Джон Нортроп на пепсине и трипсине, оба получили
Нобелевскую премию 1946 года по химии).
• В течение следующих 10 лет было выделено несколько ферментов,
белковая природа ферментов была окончательно доказана.
8.
В 1926 году американец Джеймс Самнер впервые выделил вкристаллической форме фермент (который катализирует гидролиз
мочевины до NH3 и CO2) из семян канавалии.
9.
Некоторые виды молекул РНК, известные как рибозимы, такжеобладают ферментативной активностью. Они включают
рибосомальную РНК, которая катализирует образование
пептидных связей между аминокислотами
10.
Энзимология является основой познания на молекулярномуровне важнейших проблем физиологии и патологии
организмов
Новое направление энзимологии - медицинская
энзимология
Достижения Энзимология находит широкое применение в
медицине, особенно в профилактике, диагностике и
лечении заболеваний
11.
MAIN DIRECTIONS OF MEDICAL ENZYMOLOGY• Enzymopathology – the study of the molecular basis of
development the pathological process due to a violation of the
activity of enzymes
• Enzymodiagnostics- diagnosis of diseases by determine the
activity of enzymes and by the use of enzymes for the major
components of the metabolism in blood and urine
• Enzymotherapy – application of enzymes as drugs
Engineering Enzymology - is the use of enzymes for getting
medicines as a technical and pharmaceuticals)
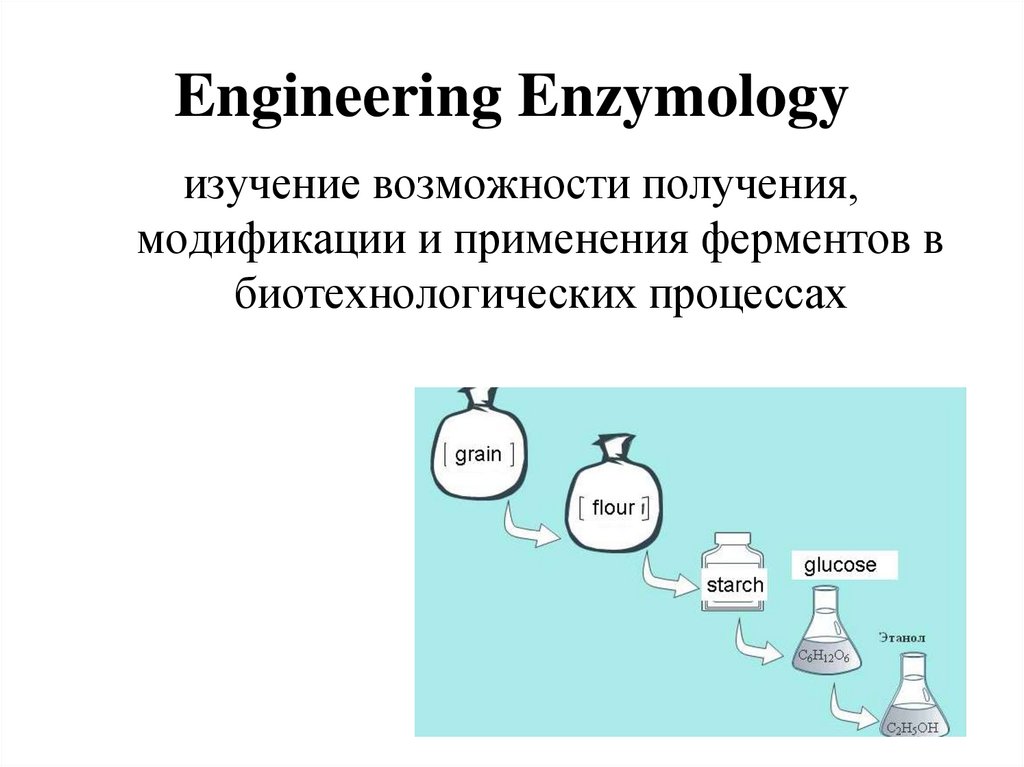
12. Engineering Enzymology
изучение возможности получения,модификации и применения ферментов в
биотехнологических процессах
13.
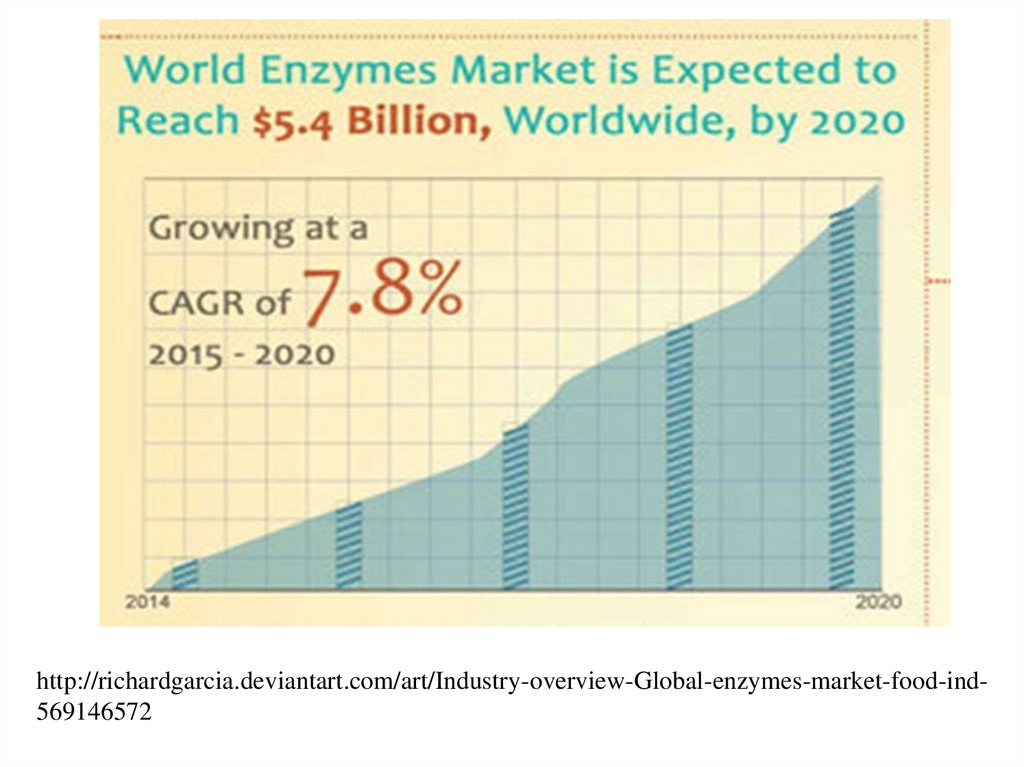
http://richardgarcia.deviantart.com/art/Industry-overview-Global-enzymes-market-food-ind56914657214.
Катализатор - «вещество, котороеувеличивает скорость химической
реакции без его изменения в
процессе»
15. МЕХАНИЗМЫ ДЕЙСТВИЯ ЭНЗИМОВ Энергетические изменения в химических реакциях
Возникают любые химические реакции, подчиняющиесядвум основным законам термодинамики:
• закон сохранения энергии
• и закон энтропии
16.
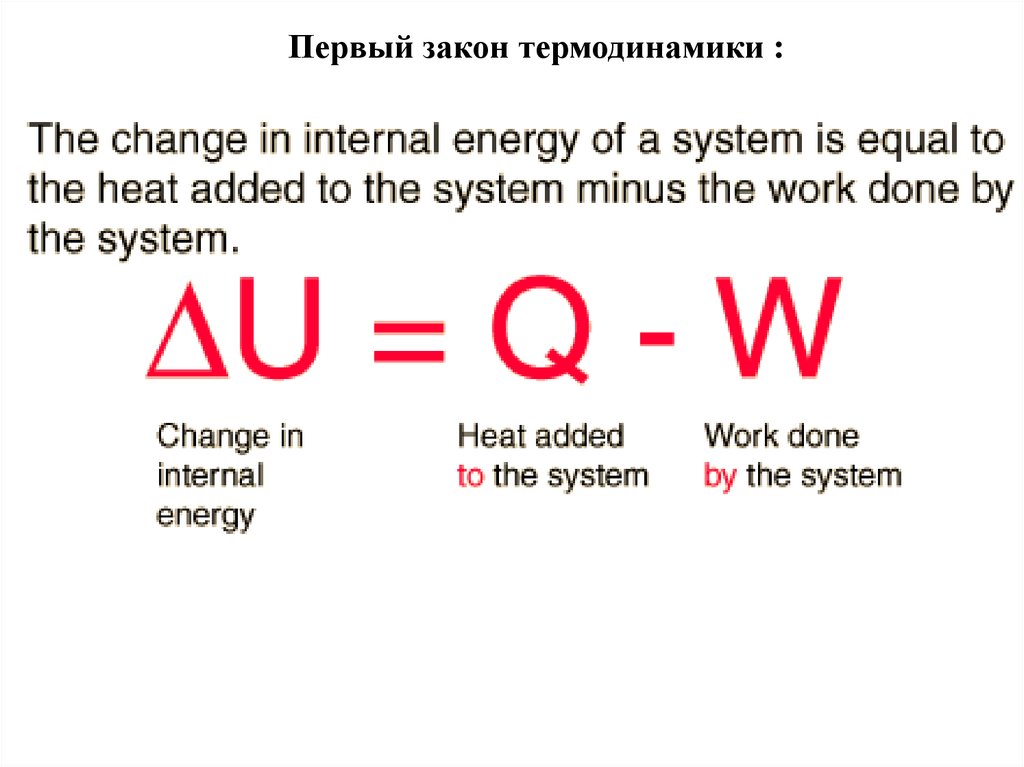
Первый закон термодинамики :17.
Второй закон термодинамики :В естественном термодинамическом процессе сумма
энтропий взаимодействующих термодинамических
систем возрастает
18.
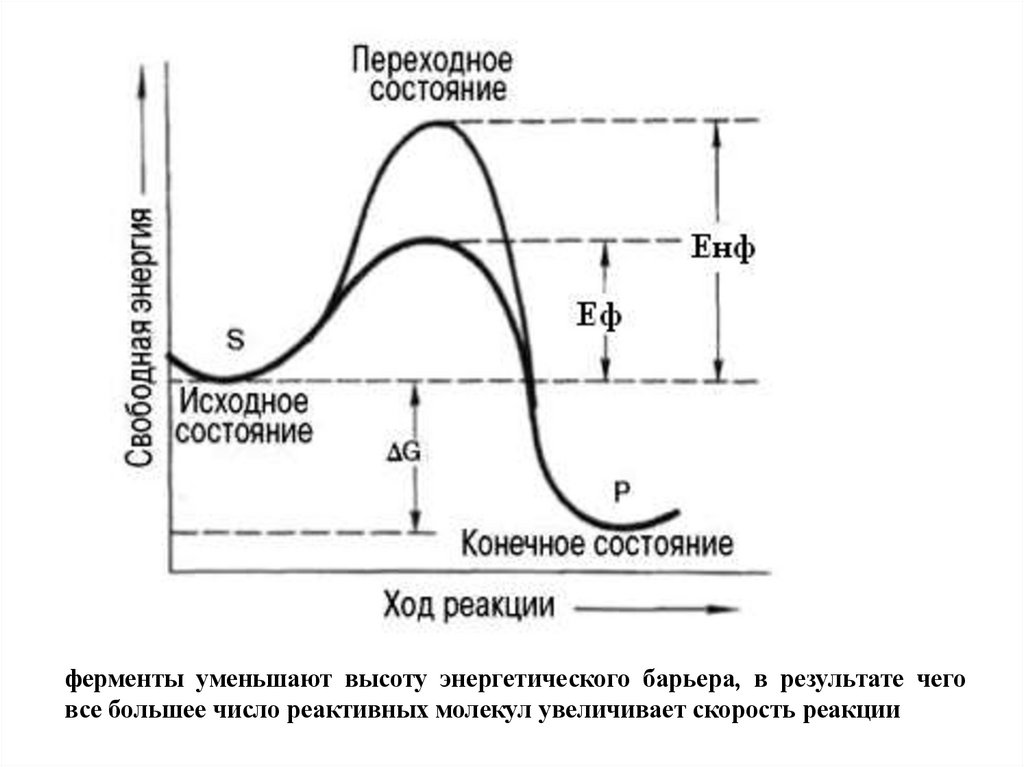
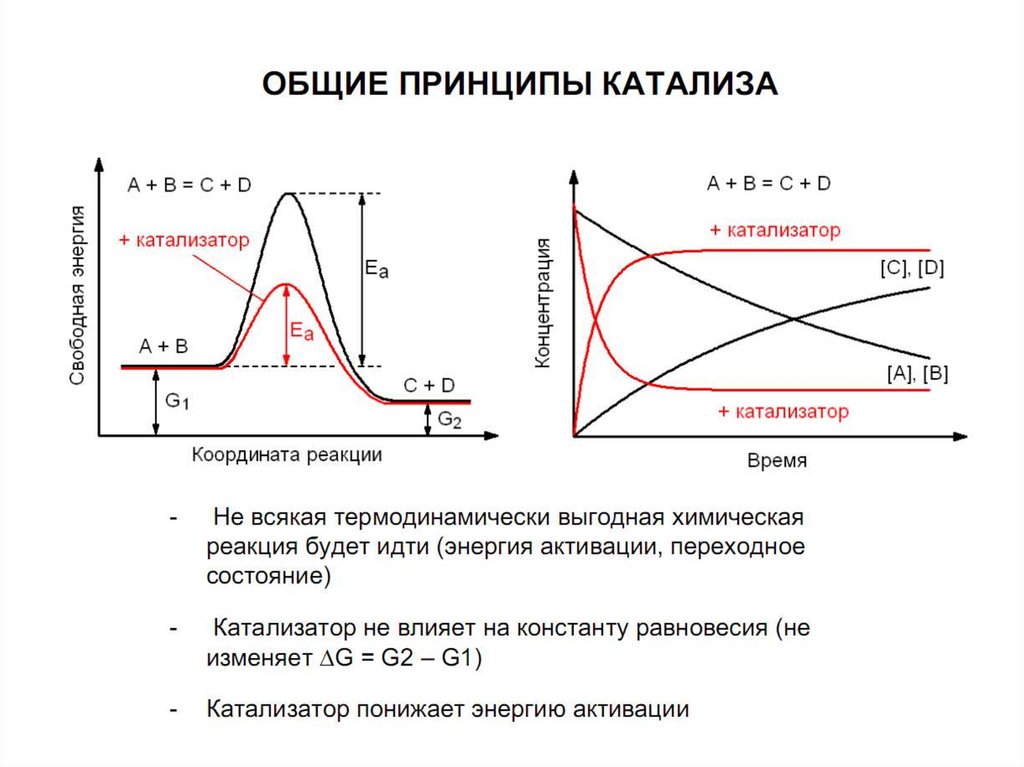
Ферменты ускоряют химические реакции.Как?
- понижают энергию активации реакции
Если Ea будет ниже, больше молекул реагентов
будет проходить через «энергетический холм»,
поэтому в секунду получается больше
продуктов
19.
• Энергия активации - дополнительноеколичество кинетической энергии,
необходимое для реагирования молекулам
вещества
• Энергетический барьер (энергетический
холм) в молекуле изменяется, что приводит к
перераспределению химических связей и
образованию новых соединений
20.
ферменты уменьшают высоту энергетического барьера, в результате чеговсе большее число реактивных молекул увеличивает скорость реакции
21.
22.
Сходство ферментов с небиологическимикатализаторами заключается в следующем:
• E * катализирует энергетически возможные
реакции;
• энергия химической системы остается постоянной;
• в процессе катализа направление реакции не
изменяется;
• E * не потребляются во время реакции
23.
Отличия ферментов (E *) от небиологическихкатализаторов:
•Фермент катализирует химическую реакцию в спец.
структурированном активном центре;
•E * имеют исключительную каталитическую мощность,
намного превышающую небиологические катализаторы;
•E * высокоспецифичны;
•E * обычно работают в очень мягких условиях
температуры и рН.
•E * часто являются регуляторными молекулами.
•Вещество, на которое воздействует фермент, называется
субстратом, комплементарно связывается с активным
центром фермента
24.
• В чем разница между ферментом и белком?• Все ферменты являются белками, за
исключением некоторых РНК
• не все белки являются ферментами
25.
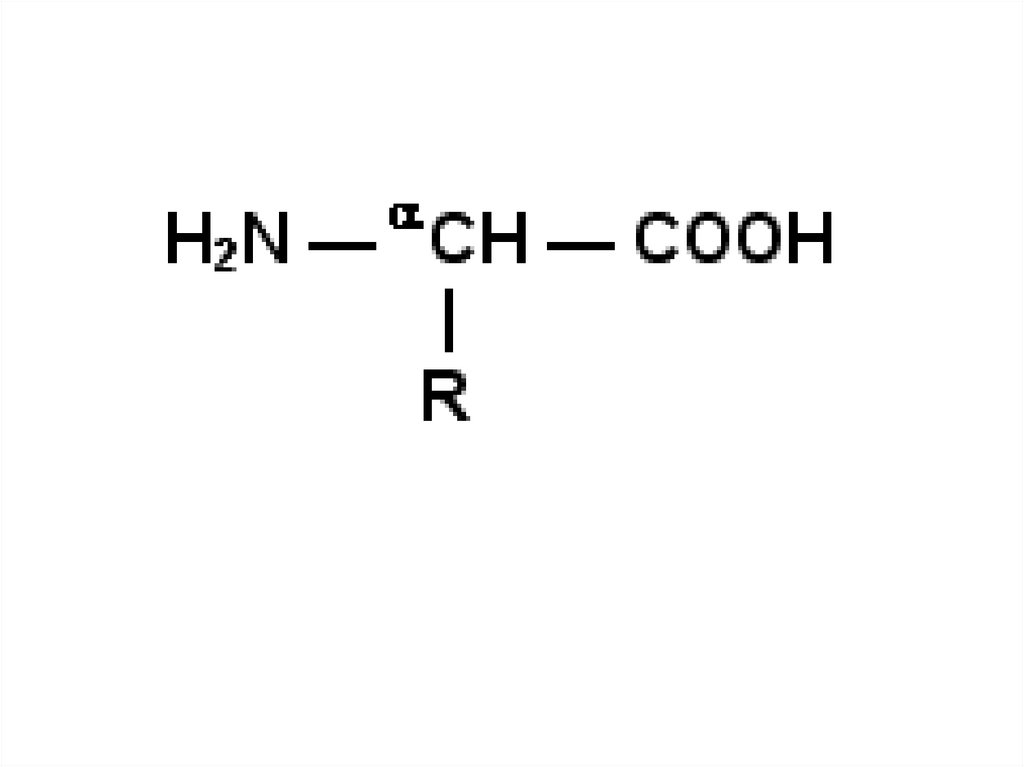
Как и другие функциональные белки, ферменты делятся напростые и сложные.
Простые ферменты - простые белки, они состоят из
аминокислот и распада гидролиза только в аминокислоты.
Комплексные ферменты представляют собой сложные белки, они
состоят из простого белкового и небелкового компонента. Во
время их гидролиза, помимо свободных аминокислот, выделяется
небелковая часть или продукты ее распада
26.
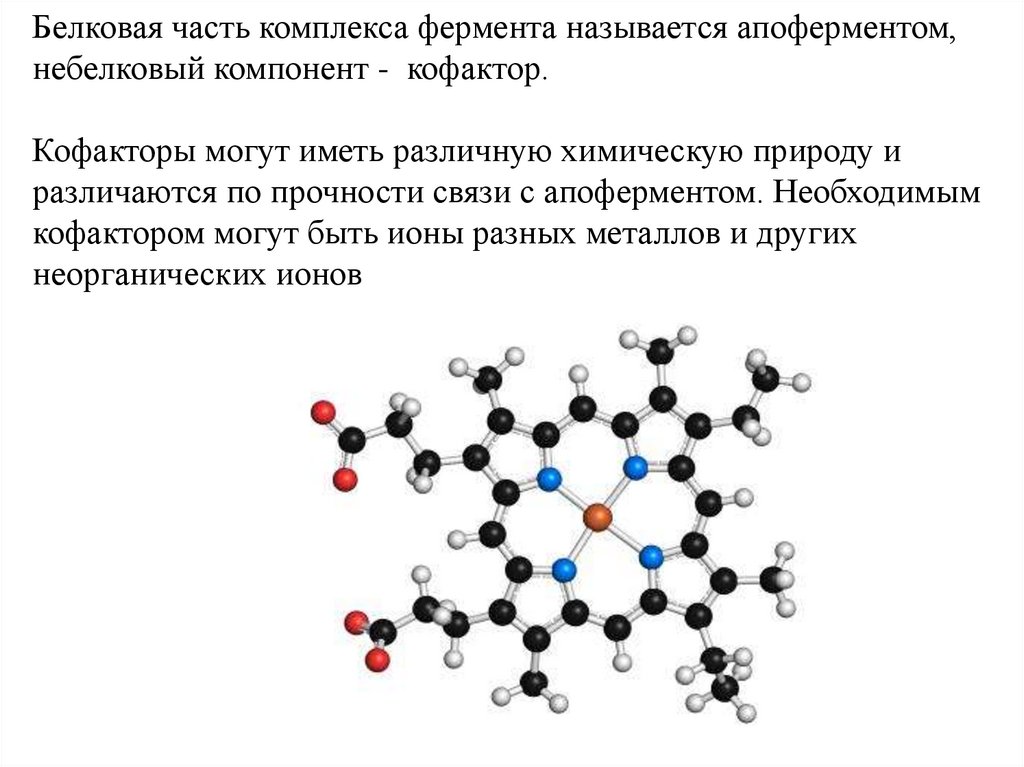
Белковая часть комплекса фермента называется апоферментом,небелковый компонент - кофактор.
Кофакторы могут иметь различную химическую природу и
различаются по прочности связи с апоферментом. Необходимым
кофактором могут быть ионы разных металлов и других
неорганических ионов
27.
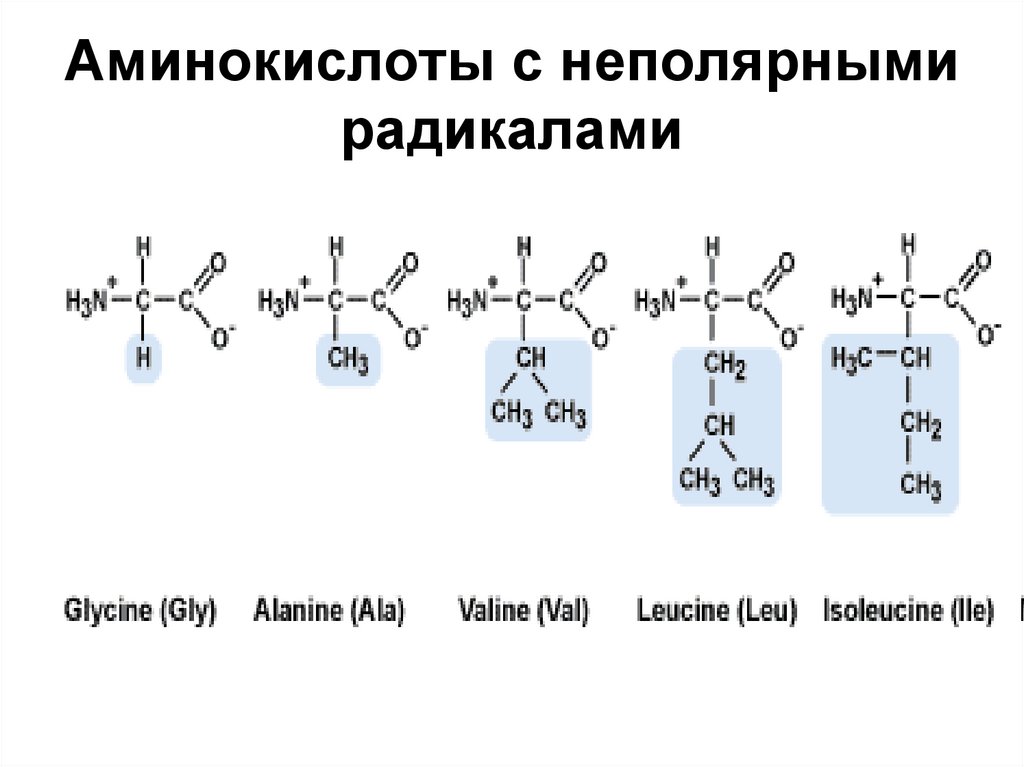
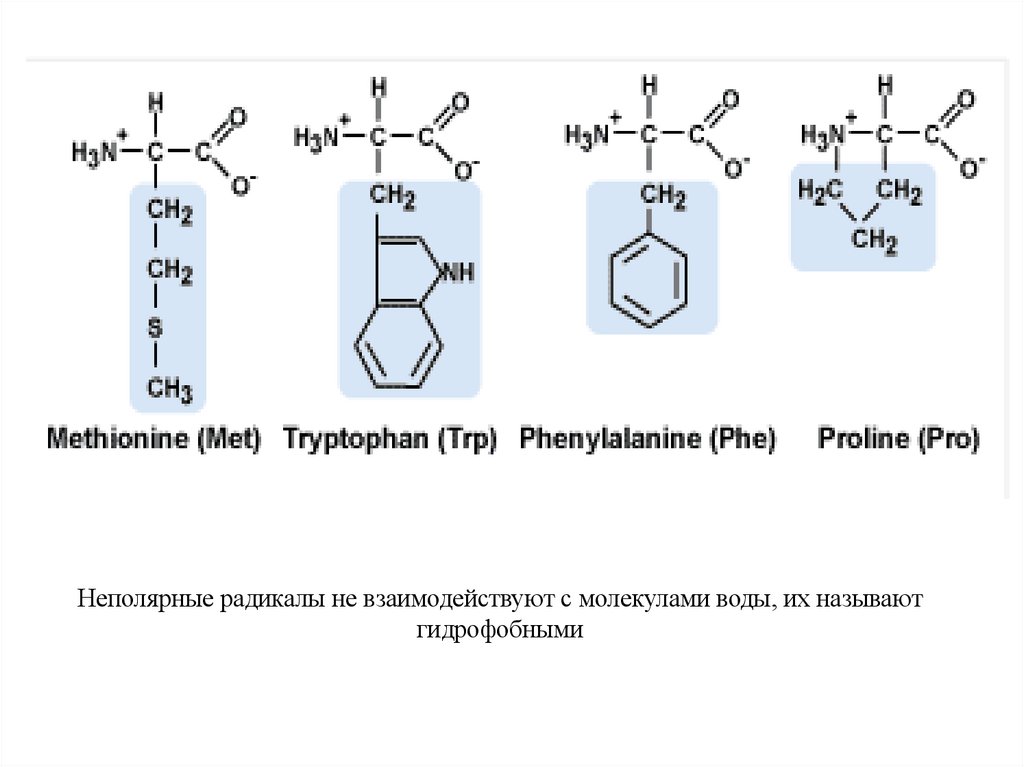
28. Аминокислоты с неполярными радикалами
29.
Неполярные радикалы не взаимодействуют с молекулами воды, их называютгидрофобными
30.
Non-polar radicals do not interact with water molecules, they are called hydrophobic.31.
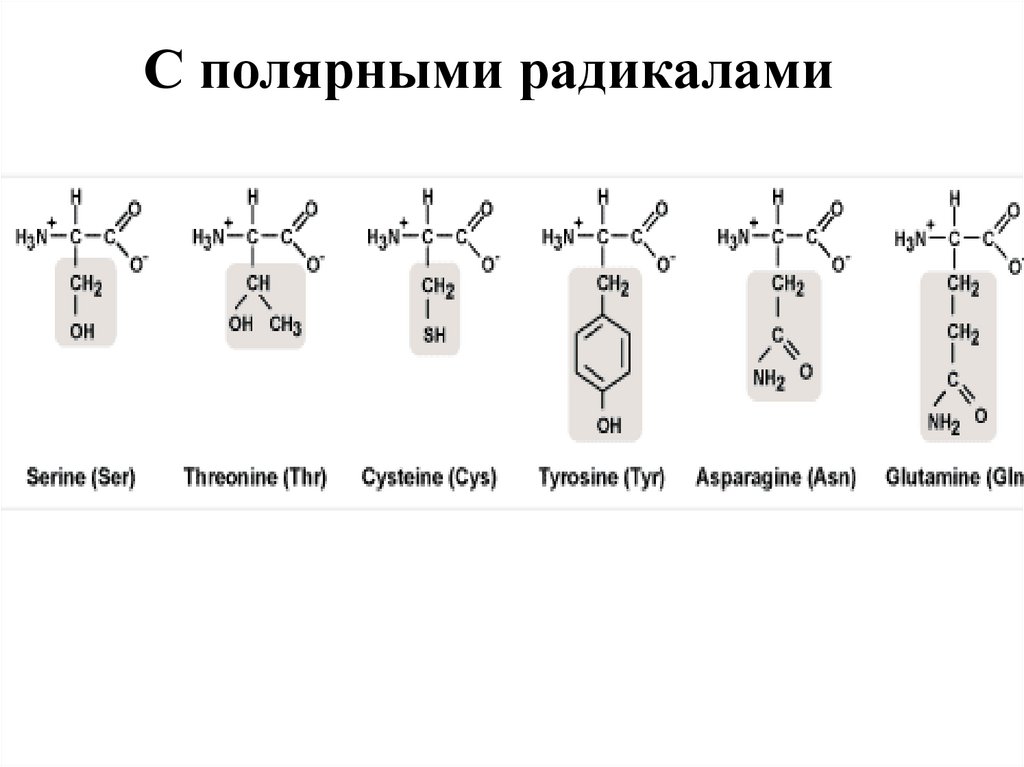
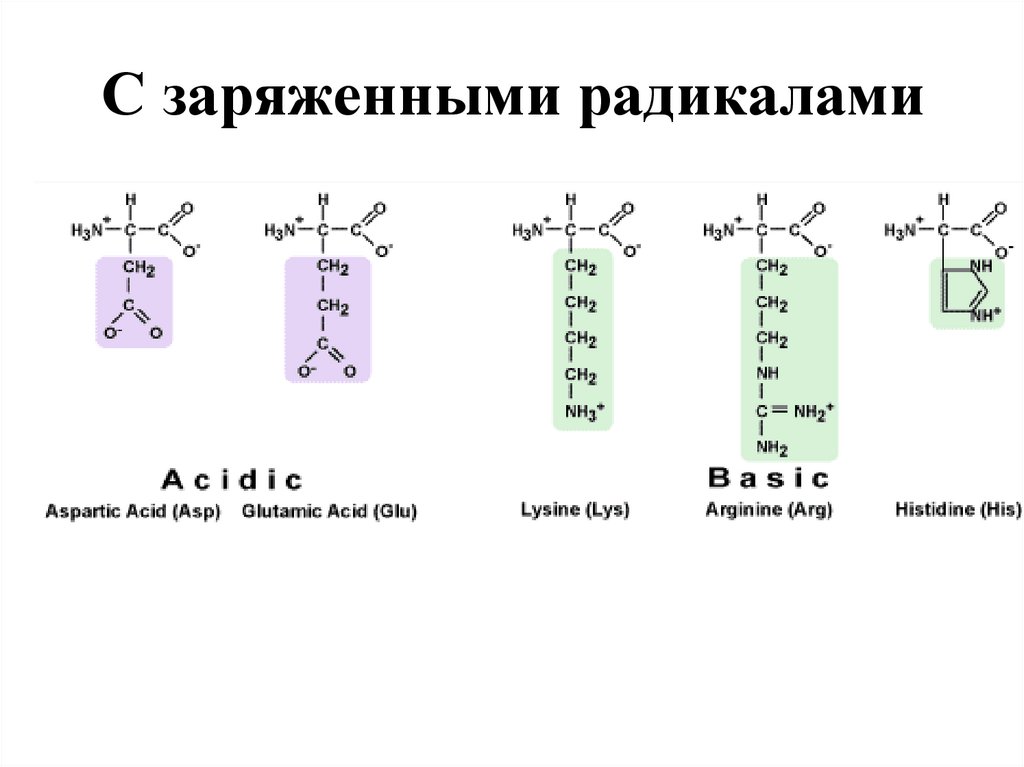
С полярными радикалами32. С заряженными радикалами
33.
В то же время неполярные радикалы аминокислот имеют большеесродство к органическим растворителям (гексан, хлороформ и т.
Д.), А аминокислоты с полярными радикалами растворяются в
таких растворителях хуже
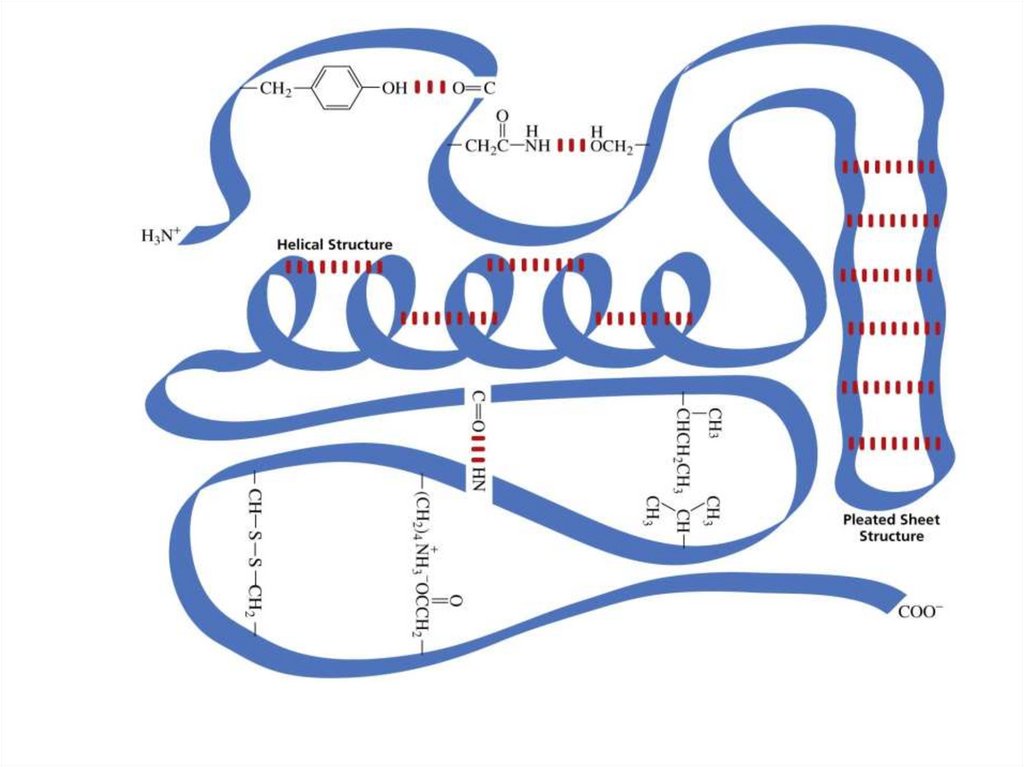
34. Структурная организация белка
Как и другие белки, ферменты имеют первичную структуру порядок аминокислот в их полипептидных цепях)вторичная структура – альфа спираль или бета слой)
третичная структура - трехмерная форма, образованная
пространственными отношениями вторичных компонентов
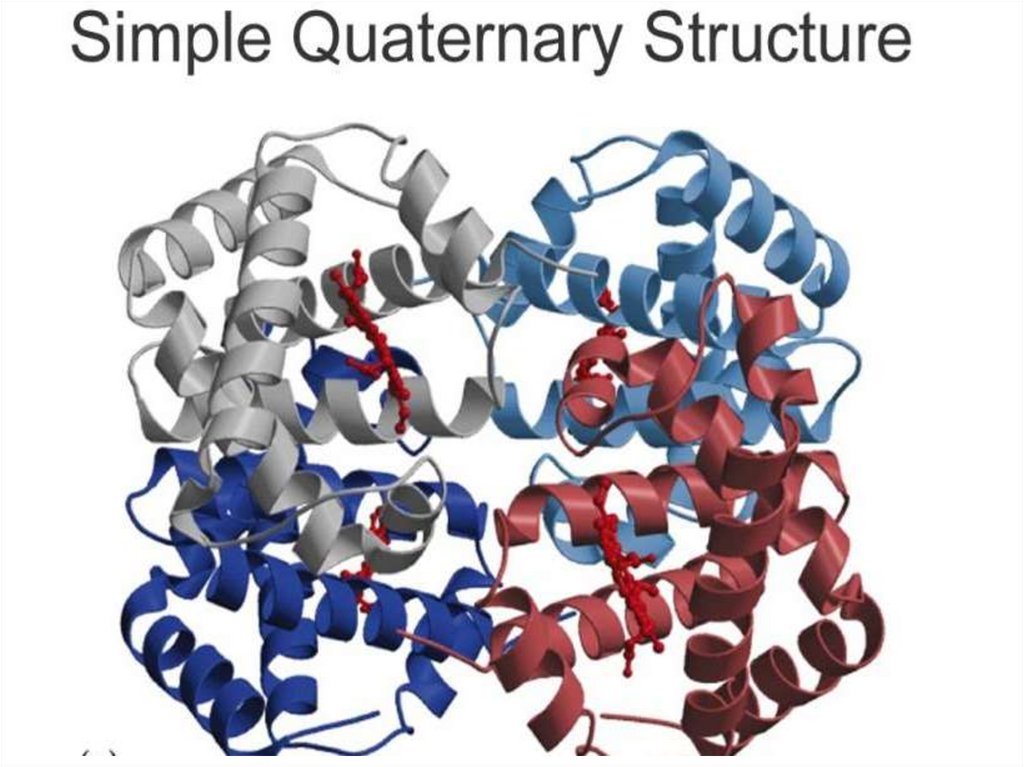
четвертичная структура - форма, образованная комбинацией
нескольких белковых субъединиц, соединенных с образованием
единого функционального фермента.
Вторичные белковые структуры (спирали, листы, ленты и т. д.)
Часто содержат различные домены белка, каждый из которых имеет
определенную функцию. Сочетание и взаимодействие между его
доменами определяют, как функционирует конкретный фермент.
35.
36.
К. Линдерштрем-ЛангУровни организации белковой структуры: первичная структура
(аминокислотная последовательность), вторичная структура (aспираль и один тяж b-структуры), третичная структура глобулы,
сложенной одной цепью, и четвертичная структура олигомерного (в
данном случае - димерного) белка.
37.
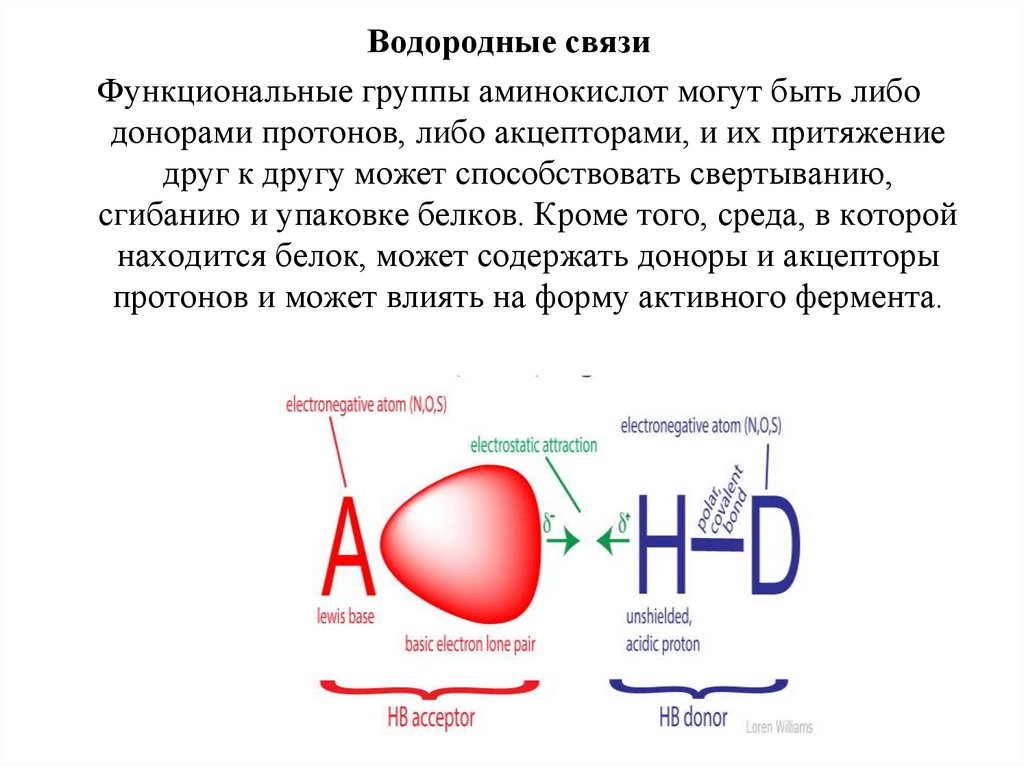
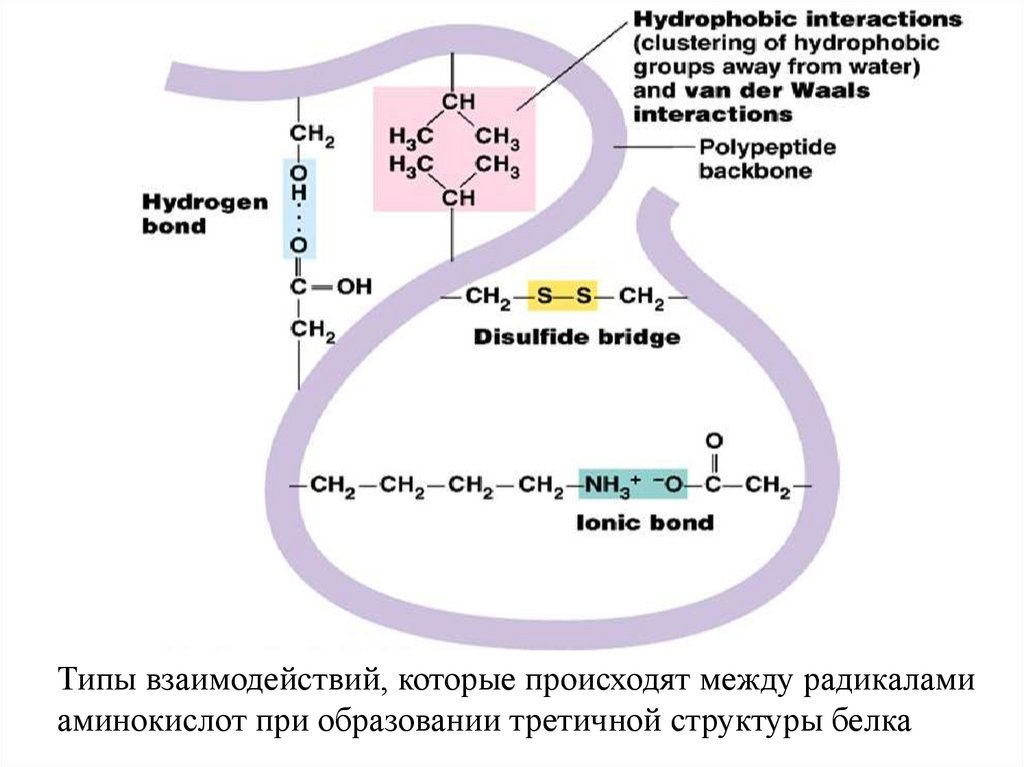
Водородные связиФункциональные группы аминокислот могут быть либо
донорами протонов, либо акцепторами, и их притяжение
друг к другу может способствовать свертыванию,
сгибанию и упаковке белков. Кроме того, среда, в которой
находится белок, может содержать доноры и акцепторы
протонов и может влиять на форму активного фермента.
38. Гидрофобные силы
Функциональные группы белка могут бытьполярными (гидрофильными) или неполярными
(гидрофобными). Поскольку белки чаще всего
встречаются в водном растворе, неполярные
области молекулы отталкиваются от
окружающей среды и могут складываться
внутрь, оставляя полярные области на
поверхности молекулы.
39. Ионное взаимодействие
•. Функциональные группы белка могут образовывать диполь(т. е. иметь одинаковые и противоположные заряды на каждом
конце) или ионные (имеющие либо общий отрицательный,
либо положительный заряд). Взаимодействия между
противоположными зарядами диполей и заряженных областей
функциональных групп могут оказывать сильное влияние на
конфигурацию белка. Заряженные области функциональных
групп аминокислот, взаимодействующих с заряженными
областями среды белка, также могут влиять на белковые
формы и функции
40.
•4. Ван-дер-Ваальсовы силы. Эти слабые силы отталкиванияили притяжения между противоположными концами диполей
вносят вклад в свертывание белка не из-за их силы, а из-за их
численности. Дипольные взаимодействия с белками являются
основным источником сил Ван-дер-Ваальса в этих больших
молекулах. Из-за их структуры и сил, определяющих их форму,
конформация ферментов может легко измениться.
41.
Типы взаимодействий, которые происходят между радикаламиаминокислот при образовании третичной структуры белка




























 Биология
Биология








